昆明市腹泻人群肠致病性大肠杆菌流行特征研究
杨春利, 张顺先,艾 琳,蔡玉春,卢 艳, 陈韶红,徐 闻,古文鹏,胡 薇, 3,陈军虎,李石柱,陈家旭,周晓农
昆明市腹泻人群肠致病性大肠杆菌流行特征研究
杨春利1, 张顺先1,艾 琳1,蔡玉春1,卢 艳1, 陈韶红1,徐 闻2,古文鹏2,胡 薇1, 3,陈军虎1,李石柱1,陈家旭1,周晓农1
目的 了解云南省昆明市肠致病性大肠杆菌(enteropathogenicEscherichiacoli,EPEC)的流行特征,为我国EPEC感染引起的腹泻提供科学依据。方法 在云南省昆明市4家哨点医院收集腹泻病例粪便样本1 121份,非腹泻人群粪便样本319份,进行细菌培养,选择单个菌落,提取DNA,并采用荧光定量PCR检测EPEC,同时使用结构化问卷收集研究对象基本信息。结果 EPEC在腹泻病例中的检出率高于非腹泻研究对象中的检出率(5.53%,1.88%,χ2=7.36,P<0.05)。EPEC的检出率在不同年龄组腹泻病例中有统计学差异(χ2=17.27,P<0.05),其中在2—5岁腹泻病例最高(12.12%,16/132);EPEC的检出率在腹泻病例中有明显的季节分布趋势(χ2=12.82,P<0.05),其中EPEC在夏季最高(9.00%,18/200),冬季最低(3.05%,12/394)。EPEC阳性的腹泻病例水样便占61.3%(38/62),出现脱水症状占12.9%(8/62)。结论 EPEC是昆明市人群腹泻的重要细菌性病原体之一,且EPEC感染以5岁以下儿童为主,EPEC感染容易造成脱水。
腹泻病例;非腹泻研究对象;肠致病性大肠杆菌;流行病学特征
腹泻是全球重要的公共卫生问题之一,每年可引起全球70万5岁以下儿童死亡[1],全球每个5岁以下儿童每年平均发生腹泻2.7次[1]。腹泻报告发病率在我国39种法定传染病中位居第三[2],在我国每年引起1万名5岁以下儿童死亡[3]。细菌性病原体及代谢产物是引起急性传染性腹泻的重要原因,其中肠致病性大肠杆菌(enteropathogenicEscherichiacoli, EPEC) 是很多发展中国家(包括我国)儿童腹泻的主要细菌性病原体之一[4]。我国5岁以下腹泻住院儿童中EPEC的检出率为1.6%[5],上海地区全年龄组腹泻病例中EPEC检出率为1.18%[6],北京地区全年龄组腹泻病例中EPEC的检出率为0.9%[2]。为此本研究尝试了解我国云南省昆明市肠致病性大肠杆菌的感染情况,描述其流行特征,为肠致病性大肠杆菌的防治提供科学参考。
1 材料与方法
1.1 研究现场 本研究选取云南省昆明市4家医院作为哨点医院,即:云南省第一人民医院、昆明医科大学第一附属医院、昆明市儿童医院和昆明市普善社区医院。从上述4家哨点医院的门诊病例中选择腹泻病例和非腹泻研究对象。
1.2 研究对象 腹泻病例:于2014年7月1日到2015年6月30日期间,在上述4家哨点医院门诊就诊的患者中,选择按就诊当天计算在过去24 h内腹泻次数≥3次且粪便形态异常(水样便、血样便、黏液样便或蛋花样便等)的就诊者作为腹泻病例。非腹泻研究对象:于2014年7月1日到2015年6月30日期间,在上述4家哨点医院门诊就诊的患者中,过去2周内无腹泻症状且未患其他消化道疾病的就诊者作为非腹泻病例,且要求非腹泻病例在就诊日期上和对应的腹泻病例相差不超过15 d。排除粪便样品量不足、问卷不完整或拒绝参加的研究对象。
1.3 粪便样品的采集和信息收集 于2014年7月1日到2015年6月30日期间,在上述4家哨点医院无菌采集腹泻病例和非腹泻研究对象的粪便样品(要求粪便样品量大于3 g或3 mL)。在12 h内将其运到云南省疾病预防控制中心实验室,同时使用结构化问卷收集研究对象的信息。
1.4 肠致病性大肠杆菌检测 当每份粪便样品送到实验室后,立刻接种在麦康凯培养基上生长18~24 h。挑选10~12个单个菌落,加入含100 μL灭菌去离子水的1.5 mL EP管中并混匀,同时把每单个菌落接种在营养琼脂平板上培养18~24 h。将混合液通过热提取法提取DNA(100 ℃,10 min),并采用荧光定量PCR检测EPEC。根据文献[7-8],针对eaeA基因,选择引物,并在生工生物工程(上海)股份有限公司合成前引物(5′-CCGATTCCTCTGGTGACGA-3′)和后引物(5′-CCACGGTTTATCAAACTGATAACG-3′),使用之前将其配成10 μmol的浓度,-20 ℃储存备用。PCR反应体系共20 μL:10 μL PCR mix (SYBR○RPremix Ex TaqTMII,宝生物,大连)、前后引物各0.5 μL(10 μmol)、1 μL模板和8 μL ddH2O。扩增条件为:预变性95 ℃、30 s;变性95 ℃、5 s,退火60 ℃、30 s,循环40次。在退火阶段检测荧光。当检测出现疑似阳性时,将对应样本的每个单个菌落分别挑选出来,加入含100 μL去离子水的1.5 mL EP管中,通过热提取法提取核酸并检测单个菌落是否为EPEC(与上述方法相同),对确定的阳性菌株进行保存。
1.5 数据处理和分析 使用SPSS 19.0软件(SPSS 19.0,IBM)进行数据分析,分类资料的计算用χ2检验或者Fisher确切概率法;连续性资料根据数据特征选择t检验、方差分析或秩和检验,检验水准取α=0.05。
1.6 伦理学 本研究已通过中国疾病预防控制中心寄生虫病预防控制所伦理审查委员会伦理学评审。
2 结 果
2.1 研究对象基本特征 2014年7月1日到2015年6月30日期间,本研究共招募1 121例腹泻病例和319名非腹泻研究对象。所有研究对象的性别比(男∶女)为1.0(724/716),腹泻病例为1.0(559/562),而非腹泻研究对象为1.07(165/154),两组研究对象性别比差异无统计学意义(χ2=0.343,P=0.558)。所有研究对象中位年龄为12.7月(四分位间距(Q):0.7-24.5),腹泻病例为1.2岁(Q:0.7-4.8),非腹泻研究对象为4.7岁(Q:0.8-40.0),腹泻病例年龄低于非腹泻研究对象(χ2=6.58,P<0.05)。所有研究对象中69.7%来自由城地区(n=976),其中来自城市地区的腹泻人群占整个腹泻人群的67.2%(n=753),来自城市地区的非腹泻人群占整个非腹泻人群的69.9%(n=223)(χ2=17.291,P<0.05)。 在1 121名腹泻病例中冬季腹泻病例所占比例最高(35.1%,n=394),其次是春季23.8%(n=267)、秋季23.2% (n=260) 和夏季17.8% (n=200);在非腹泻人群中冬季的非腹泻样本所占比例最高(31.0%,n=99),其次是秋季27.9%(n=89),春季20.7%(n=66)和夏季20.4%(n=65)(χ2=0.541,P=0.144)。
2.2 EPEC在腹泻病例和非腹泻研究对象中的比较 腹泻病例中EPEC的检出率为5.53%(62/1 121),非腹泻研究对象中EPEC检出率为1.88%(6/319),EPEC的检出率在腹泻病例中高于非腹泻研究对象(χ2=7.36,P<0.05,OR=3.504,95%CI:1.307-7.127)。其中,在5岁以下腹泻病例人群中EPEC的检出率为5.53%(47/850),5岁以下非腹泻病例中EPEC的检出率为1.76%(3/170),其中EPEC的检出率在5岁以下腹泻病例中高于5岁以下非腹泻研究对象(χ2=4.307,P<0.05,OR=3.258,95%CI:1.002-10.593)。在5岁以上人群中,EPEC在5以上腹泻病例中的检出率为5.54%(15/271),在5岁以上非腹泻人群中的检出率为2.01(3/149),EPEC的检出率在5岁以上腹泻病例和5岁以上非腹泻研究对象中没有统计学差异(χ2=2.907,P=0.088,OR=2.852,95%CI:0.812-10.014)。
2.3 EPEC在腹泻病例中的流行病学特征
2.3.1 性别分布 EPEC在女性腹泻病例中检出率为5.52%(31/562),在男性腹泻人群中为5.54%(31/559),这表明EPEC的检出率在女性腹泻病例和男性腹泻病例中没有统计学差异(χ2=0.001,P=0.999,OR=1.006,95%CI=0.603-1.678)。
2.3.2 年龄分布 EPEC的检出率在不同年龄组腹泻病例中有统计学差异(χ2=17.272,P=0.004)。在2—5岁腹泻病例中检出率最高(12.12%,16/132),其次是5—65岁(6.15%,15/244)、1—2岁(5.58%,15/269)、6—12月龄(4.56%,12/263)和6月龄以下(2.15%,4/186),而65岁以上人群没有检出(0/27)。
2.3.3 季节分布 EPEC的检出率在腹泻病例中有明显的季节分布趋势(χ2=12.819,P=0.005),如图1所示,EPEC在夏季腹泻病例中检出率最高(18/200),其次是春季(21/267)和秋季(11/260),在冬季时最低(12/394)。
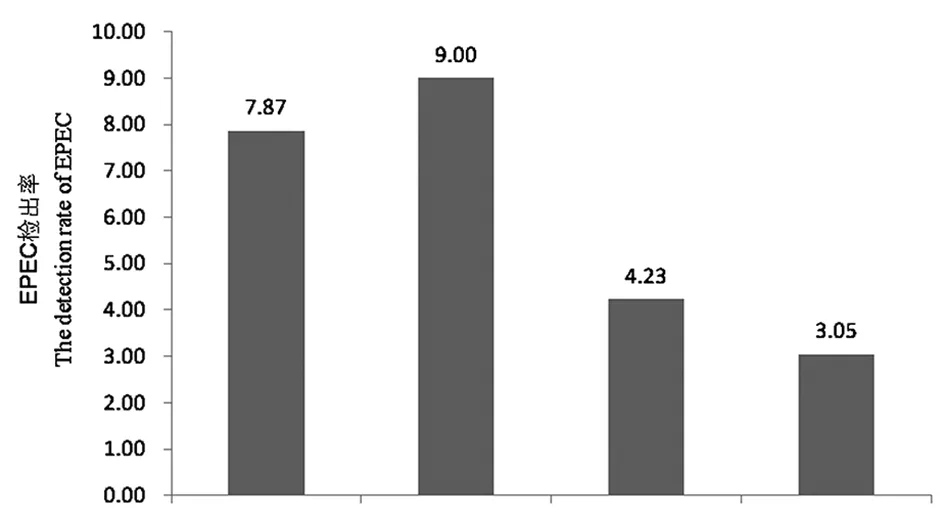
图1 EPEC在腹泻人群的季节分布Fig.1 Seasonal distribution of EPEC in diarrhea patients
2.4 腹泻病例中EPEC感染者的基本特征 如表1所示: EPEC阳性的腹泻病例的年龄低于EPEC阴性的腹泻病例的年龄。EPEC阳性的腹泻病例和EPEC阴性的腹泻病例的腹泻次数无差异。发热和呕吐在EPEC阳性和阴性的腹泻病例中没有差异,但脱水更容易出现在EPEC阳性的腹泻病例中。同时,水样便更容易出现在EPEC阳性的腹泻病例中。
3 讨 论
EPEC是一种能导致人体多系统感染的粪-口途径传播的肠道致病菌,也是引起婴幼儿腹泻的重要细菌性病原体[4, 9-10]。及时了解 EPEC的分子流行特征是传染病预防控制的重要内容,但是目前国内EPEC常用的检测方法是细菌培养和血清鉴定(金标准),其鉴定方法存在实验过程繁琐、耗时长、诊断血清因子不全、灵敏度和特异性都低等弊端,使得EPEC的流行程度一直被低估[2, 5]。而大肠埃希菌的致泻性主要取决于是否携有相应的毒力因子,因而血清学鉴定不是EPEC感染诊断和流行调查的理想方法。灵敏度高和特异度高的细菌培养和荧光定量PCR联合使用的检测方法急需在全国推进和应用,以准确评估EPEC相关的疾病负担[2, 4]。
表1 腹泻病例中EPEC感染者的基本特征
Tab.1 Essential characteristic of diarrhea patients infected with EPEC

指标变量VariablesEPEC阳性ThepositiveofEPECn=62N(%)EPEC阴性ThenegativeofEPECn=1059N(%)统计量StatisticP居住地(城区)Residence(urbanareas)42(67.74)711(67.14)1.214a0.545年龄(年,中位数)Age(years,median)1.17 1.962.158b0.031腹泻次数(≥3/天)Diarrheafrequency(≥3/day)6 60.105b0.269发热(>37.3℃)Fever(>37.3℃)8(12.90)130(12.28)0.021a0.884呕吐Vomiting17(27.42)246(23.23)0.573a0.449脱水Dehydration8(12.90)56(5.29)6.310a0.021水样便Waterystool38(61.29)472(44.57)6.603a0.010黏液样便Mucusstool24(38.71)516(48.73)2.353a0.125其他类型粪便Theotherstools0(0.00)63(5.95)2.867a0.090
a卡方检验,b秩和检验
aChi-square test,bWilcoxon rank test
本研究表明EPEC是5岁以下儿童的腹泻相关病原体,且检出率较高(5.53%),这与其他研究的结果相似(6.64%)[11],EPEC是中低收入国家或地区5岁以下儿童发生急性腹泻的主要病原体[12],但也有研究发现EPEC不是儿童腹泻相关的病原体[11, 13]。这可能与EPEC的血清型有关,有研究发现经典O群血清型EPEC是5岁以内尤其是2岁以内儿童腹泻的确定病原体,但其他血清型(如A/EECX血清型)的EPEC并不能引起腹泻[14-15]。需要进一步进行血清分型来深入阐述不同血清型EPEC的致病力,但本研究并未对EPEC进行血清分型,这是本研究的一个限制。
本研究中EPEC 的检出率在2—5岁腹泻人群中远高于2岁以下腹泻人群,但JOHN等研究者发现EPEC的易感人群主要集中在2岁以内[14],这种差别可能于本研究的现场选择有关。本研究现场在城区,研究对象家庭经济条件普遍较好,2岁以下儿童人工奶粉喂养比例很高,而人工奶粉中包含很多能提高儿童免疫力的物质,从而减低儿童对病原体菌的易感性;同时,儿童在前6个月,从母体获得的非特异性抗体可以部分防止细菌感染[16]。2—5岁儿童饮食结构逐步发生变化,混合食物占主要部分,EPEC作为重要的食源性病原体,感染儿童的机会增多。社会经济、卫生条件等差异在一定程度上解释了本研究中EPEC的流行特征与欠发达地区不同[15, 17]。
本研究发现云南昆明城市地区腹泻病例主要集中在春季和夏季,而贵阳地区主要集中在秋季和夏季[18],这种差异可能与昆明独特的气候因素有关。同时,提示昆明地区EPEC相关腹泻防控的关键时期在夏季。
本研究为62例EPEC腹泻病例提供病原学依据的同时,揭示了昆明市EPEC的流行病学特征,其结果将为昆明地区EPEC相关腹泻的预防和控制提供科学参考依据。另外,由于EPEC可以通过食物、水源等方式传播从而暴发疫情,故在进行腹泻病例病原监测的同时,采用荧光定量PCR方法,快速检测食品中的EPEC,对保障食品安全及腹泻防控都具有重要意义。
[1] Walker CL, Rudan I, Liu L, et al. Global burden of childhood pneumonia and diarrhoea[J]. Lancet, 2013, 381(9875): 1405-1416. DOI: 10.1016/S0140-6736(13)60222-6
[2] Qu M, Deng Y, Zhang X, et al. Etiology of acute diarrhea due to enteropathogenic bacteria in Beijing, China[J]. J Infect, 2012, 65(3): 214-222. DOI: 10.1016/j.jinf.2012.04.010
[3] Liu L, Johnson HL, Cousens S, et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000[J]. Lancet, 2012, 379(9832): 2151-2161. DOI: 10.1016/S0140-6736(12)60560-1
[4] Liu J, Kabir F, Manneh J, et al. Development and assessment of molecular diagnostic tests for 15 enteropathogens causing childhood diarrhoea: a multicentre study[J]. Lancet Infect Dis, 2014, 14(8): 716-724. DIO: 10.1016/S1473-3099(14)70808-4
[5] Yu J, Jing H, Lai S, et al. Etiology of diarrhea among children under the age five in China: Results from a five-year surveillance[J]. J Infect, 2015, 71(1): 19-27. DOI: 10.1016/j.jinf.2015.03.001
[6] Li J, Hu JY, Wu HY,et al. Etiological surveillance for diarrhea in Shanghai from August 2013 to July 2014[J]. Chin J Epidemiol, 2015, 36(10): 1099-1103.DOI:10.3760/cma.j.issn.0254-6450.2015.10.014 (in Chinese)
黎健, 胡家瑜, 吴寰宇,等.上海市2013年8月至2014年7月腹泻病例病原学监测研究[J]. 中华流行病学杂志,2015, 36(10):1099-1103.
[7] Deer DM, Lampel KA. Development of a multiplex real-time PCR assay with internal amplification control for the detection of Shigella species and enteroinvasiveEscherichiacoli[J]. J Food Prot 2010, 73(9): 1618-1625.
[8] Hidaka A, Hokyo T, Arikawa K, et al. Multiplex real-time PCR for exhaustive detection of diarrhoeagenicEscherichiacoli[J]. J Appl Microbil, 2009, 106(2): 410-420. DOI: 10.1111/j.1365-2672.2008.04043.x
[9] Croxen MA, Law RJ, Scholz R, et al. Recent advances in understanding enteric pathogenicEscherichiacoli[J]. Clin Microbil Rev, 2013, 26(4): 822-880. DOI: 10.1128/CMR.00022-13
[10] Pang H, Zhao AL, Bai XN, et al. Detection and analysis of diarrheagenicEscherichiacolifrom stool specimens of patients with infectious diarrhea in Changzhi area [J]. Chin J Zoonoses, 2013,(5): 520-522.DOI:10.3969/cjz.j.issn.1002-2694.2013.05.021(in Chinese)
庞慧, 赵爱兰, 白向宁,等.长治地区腹泻患者致泻性大肠杆菌的检测与分析[J]. 中国人兽共患病学报,2013(5):520-522.
[11] Vu NT, Le Van P, Le Huy C, et al. Etiology and epidemiology of diarrhea in children in Hanoi, Vietnam[J]. Int J Infect Dis, 2006, 10(4): 298-308.
[12] Albert MJ, Faruque AS, Faruque SM, et al. Case-control study of enteropathogens associated with childhood diarrhea in Dhaka, Bangladesh[J]. J Clin Microbiol, 1999, 37(11): 3458-3464.
[13] Hien BT, Scheutz F, Cam PD, et al. DiarrheagenicEscherichiacoliandShigellastrains isolated from children in a hospital case-control study in Hanoi, Vietnam[J]. J Clin Microbiol, 2008, 46(3): 996-1004. DOI: 10.1128/JCM.01219-07
[14] Gerner-Smidt P, Jensen C, Olsen KE, et al. Diarrheagenic potential ofEscherichiacoliin children in a developed country[J]. J Clin Microbil, 2003, 41(12): 5836, 5836-5837.
[15] Gomes TA, Elias WP, Scaletsky IC, et al. DiarrheagenicEscherichiacoli[J]. Braz J Microbiol, 2016, 47 Suppl 1: 3-30. DOI: 10.1016/j.bjm.2016.10.015
[16] Levine MM, Robins-Browne RM. Factors that explain excretion of enteric pathogens by persons without diarrhea[J]. Clin Infect Dis, 2012, 55(Suppl 4): S303-S311. DOI: 10.1093/cid/cis789
[17] Wang X, Wang J, Sun H, et al. Etiology of childhood infectious diarrhea in a developed region of China: cmpared to childhood diarrhea in a developing region and adult diarrhea in a developed region[J]. PLoS One, 2015, 10(11). DOI: 10.1371/journal.pone.0142136
[18] Wei XY, You L, Tian KC, et al. Etiological surveillance of diarrheagenicEscherichiacolifrom infectious diarrheal patients in Guiyang, China, 2013[J]. Chin J Zoonoses, 2015, 31(9): 881-885.DOI:10.3969/j.issn.1002-2694.2015.09.020 (in Chinese)
韦小瑜, 游旅, 田克诚, 等.贵阳地区2013年腹泻病例中致泻性大肠杆菌的病原监测分析[J]. 中国人兽共患病学报,2015, 31(9):881-885.
s: Zhou Xiao-nong, Email: ipdzhouxn@sh163.net
Epidemiological characteristics investigation of enteropathogenicEscherichiacoliin diarrhea patients from Kunming City, China
YANG Chun-li1, ZHANG Shun-xian1, AI Lin1, CAI Yu-chun1, LU Yan1, CHEN Shao-hong1, XU Wen2, GU Wen-peng2, HU Wei1,3, CHEN Jun-hu1, LI Shi-Zhu1, CHEN Jia-xu1, ZHOU Xiao-nong1
(1.NationalInstituteofParasiticDiseases,ChineseCenterforDiseaseControlandPrevention,KeyLaboratoryforParasitologyandVectorBiology,MOHofChina,WHOCollaboratingCenterforTropicalDiseases,NationalCenterforInternationalResearchonTropicalDiseases,Shanghai200025,China; 2.YunnanProvincialCenterforDiseaseControlandPrevention,Kunming650022,China; 3.DepartmentofMicrobiologyandMicrobialEngineering,SchoolofLifeSciences,FudanUniversity,Shanghai200433,China)
In order to provide scientific reference for the prevention and treatment of EPEC infection, the epidemiological characteristics of enteropathogenicEscherichiacoli(EPEC) was investigated in Kunming City, Yunnan. A total of 1 121 diarrhea patients and 319 healthy controls were recruited from four sentinel hospitals in Kunming City from June 2014 to July 2015. The stool samples were cultured and the total DNA was extracted to detect EPEC with real-time polymerase chain reaction (PCR). A structured questionnaire was applied to each case for the clinical manifestation and the basic information. Results showed that the detection rate of EPEC in diarrhea patients was more than the controls (5.53%, 1.88%, χ2=7.36,P<0.05). The prevalence of EPEC was no significant difference between male and female in diarrhea patients (5.54%, 5.53%, χ2=0.001,P=0.999). However, the detection rate of EPEC had significant difference in different age groups (χ2=17.27,P<0.05), among which the detection rate was the highest in 2—5 years group (12.12%, 16/132). And the prevalence of EPEC showed remarkable seasonal trend in diarrhea cases (χ2=12.82,P<0.05), and the detection rate was the highest in summer (9.00%, 18/200) and the lowest in winner (3.05%, 12/394). Watery stool was found in 61.29% (38/62) in diarrhea cases with EPEC infection, and dehydration was found in 12.9% (8/62) in diarrhea cases associated with EPEC infection. Results showed EPEC is one of the mainly pathogens causing diarrhea in Kunming City, and EPEC infection occurred mainly in children under 5 years, and it is prone to dehydration.
diarrhea patient; healthy control cases; EPEC; epidemiological characteristics
10.3969/j.issn.1002-2694.2017.04.006
国家科技重大专项(No.2008ZX10004-011;No.2012ZX10004-220)、国家卫生行业科研专项(No.201502021)和上海市公共卫生第四轮三年行动计划(GWIV-29)联合资助
周晓农,ipdzhouxn@sh163.net
1.中国疾病预防控制中心寄生虫病预防控制所,卫生部寄生虫病原与媒介生物学重点实验室,世界卫生组织热带病合作中心,国家级热带病国际联合研究中心,上海 200025; 2.云南省疾病预防控制中心,昆明 650022; 3.复旦大学生命科学学院微生物学与微生物工程系,上海 200433
Supported by the National Science and Technology Major Project (Nos. 2008ZX10004-011 and 2012ZX10004-220), the Chinese Special Program for Scientific Research of Public Health (No. 201502021), and the Fourth Round Three Year Action Plan Public Health of Shanghai, China (No. GWIV-29)
R382
A
1002-2694(2017)04-0321-05
2016-07-25 编辑:梁小洁

