解理面粉碎分选法制备新型碳纳米材料的研究
郭留希,武艳强,杨晋中
(1.郑州华晶金刚石股份有限公司,郑州 450001;2.郑州人造金刚石及制品工程技术研究中心有限公司,郑州 450001)
解理面粉碎分选法制备新型碳纳米材料的研究
郭留希1,武艳强2,杨晋中1
(1.郑州华晶金刚石股份有限公司,郑州 450001;2.郑州人造金刚石及制品工程技术研究中心有限公司,郑州 450001)
以人造金刚石为原料,通过解理面剥离粉碎分选的制备工艺成功制备出了两种新形貌的碳纳米材料——碳晶素和钻石烯。利用X射线粉末衍射(XRD)、透射电子显微镜(TEM)、激光拉曼光谱(Raman)、固体核磁(MAS NMR)等对其进行了表征分析,发现碳晶素是一种物相构成为钻石相的类球形的碳纳米颗粒,单个颗粒的粒径为2~5 nm,且含有两种不同性质的碳原子,这两种不同性质的碳原子在颗粒表面形成了一种碳原子二聚体结构,钻石烯是一种物相构成为钻石相的多层结构的碳纳米片,该碳纳米片是由金刚石解理面(111)晶面剥离粉碎而形成的,且含有不饱和sp2杂化碳,形成了sp3和sp2混合杂化的结构,粒度不同,sp3碳与sp2碳的比例也不同。
人造金刚石;解理面剥离粉碎分选;碳原子二聚体;不饱和碳
1 前言
碳元素是神奇的六号元素,它的单质有众多同素异形体,例如从最硬的金刚石到极软的石墨,由于碳材料具有优异的性能,所以始终处于科技创新的前沿领域,而作为碳材料主要的分支碳纳米材料也取得了丰硕的研究成果。碳纳米材料被誉为21世纪的重要材料,其本身所拥有的潜在优越性,以及在化学、物理及材料学相关领域具有的广阔的应用前景,使之成为全球科学界各级科研人员争相关注的焦点。碳纳米材料根据其在空间维度上纳米尺寸的不同可以分为三类,从零维到一维再到二维碳纳米材料,人们对其研究的重点主要集中在石墨烯、富勒烯、碳纳米管、纳米金刚石等方面,主要研究方向集中在制备工艺技术的改进以及对其形貌的控制和性能改进等方面。
目前常规的碳纳米材料的制备工艺方法主要是氧化还原法、燃烧法、电弧放电法以及炸药爆轰法等[1-6],这些制备工艺方法存在着反应难控制、副产物多、能耗高、对环境污染大等缺点,且无法对产物的生长过程进行有效地控制,从而无法对产物的形貌及粒度进行可控,因此研发一种绿色环保且可达到对产物形貌粒度可控的碳纳米材料新型制备工艺是十分必要的。
本实验以人造金刚石为原料,通过解理面剥离粉碎分选的方法制备出了两种新型的碳纳米材料——碳晶素和钻石烯,该制备工艺方法简单、易规模化生产。
2 实验
2.1 制备过程
具体制备工艺流程如图1所示,将粒度为35~80目的人造金刚石通过磁力进料器投入气流粉碎机进行粉碎,投料速度为0.45 kg/h,通过调节粉碎机超音速气磨流的空气压力将气流加速从而带动人造金刚石原料进行对撞粉碎从而得到D50值为4 μm的气磨料。然后将气磨料投入球磨机进行球磨,球磨采用干磨工艺,钢球大小为1 mm的不锈钢钢球,不锈钢球与原料的比例为7∶1,球磨时间为4 h,球磨机转速控制在800 r/min,最后得到了球磨料。将球磨料进行提纯处理,提纯处理分酸洗提纯和碱洗提纯,先酸洗后碱洗,酸洗主要是去除人造金刚石中的金属触媒、石墨以及气流粉碎及球磨时附着上的金属杂质。酸洗分两步进行。首先用浓度为10%的盐酸去除金属杂质,将球磨料放入反应釜中加入浓度为10%的盐酸,盐酸与球磨料的质量比为1∶3,反应时间为2 h,反应结束后,将酸洗后的物料用去离子水进行清洗,直至清洗液的pH值接近于7为止。其次用浓度分别为96%和70%的浓硫酸和高氯酸组成的混合酸去除石墨杂质,混合酸与球磨料的质量比为1∶1,反应时间为1 h,反应温度为160℃,反应结束后用去离子水进行清洗,直至清洗液的pH值接近于7为止。碱洗主要是去除叶蜡石杂质,将酸洗后的料放入反应釜中加入NaOH(物料:NaOH = 2∶1),反应温度为240℃,反应时间为2 h,碱洗完毕后,将碱洗后的物料用去离子水进行清洗,直至清洗液的pH值接近于7才结束清洗。提纯干净的料进行分选分级处理,分选分级方法分沉淀分选工艺和离心分选工艺两种。沉淀分选是在Φ220mm×300 mm的敞口烧杯中进行的,取330 g酸碱处理过的料加入浓度为0.05%的硅酸钠溶液搅拌至糊状,加入一定量的去离子水超声分散30 min,超声结束后加去离子水到烧杯上刻度位置并搅拌1 min,静置36 h后用抽液管将高度为150 mm的上层液体抽出,调节上层液体的密度为0.9~1。离心分选上层液体,离心三次,每次离心后取离心管上层2/3的液体,离心转速为8000r/min,离心时间为10 min。静置离心后的上层液体,最后在烘箱中将沉淀物烘干。
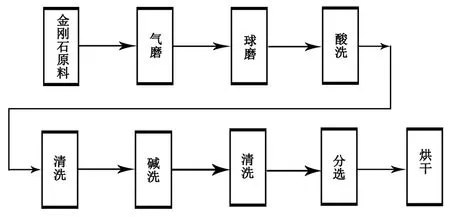
图1 制备工艺流程示意图Fig.1 Diagram of the preparation process flow表1 不同粒度的产品的分选参数表Table 1 Sorting parameters for products of different size

粒径(nm)分选时间(h)536050228100192200180250168
2.2 产物的结构表征
采用Rigaku ultima Ⅳ(Cu Kα射线,λ = 1.54056 ×10-10m)X射线衍射仪(XRD)分析了不同粒度产物的物相构成,扫描角度2θ为10°~90°,扫描速率为0.02 deg/s,其中管电压为40 kV,管电流为40 mA。产物形貌的变化分析是在JEM-2100型透射电子显微镜(TEM,加速电压为200kV)上进行的。拉曼光谱分析是在RenishawinVia型激光拉曼光谱仪上测试的,激发波长为532 nm。13C固体核磁测试是在Bruker 600MHz型固体核磁测试仪上测试的。
3 实验结果与讨论
图2为产物的XRD谱图,a图为10°~90°的广角XRD谱图,b图为40°~50°的XRD谱图。从a图我们可以看出在44°和75°左右出现两个非常明显的衍射峰,在其它位置上没有出现衍射峰,通过与XRD标准图谱比对,我们发现分别与钻石相的(111)和(220) 晶面相匹配,说明我们制备的产物的物相均是由钻石相构成的,并不存在其它的杂相,同时我们还可以看出产物a的XRD谱图在20°~40°之间存在着一个非常明显的非晶包,而产物b-e则没有明显的非晶包,这说明产物a的结晶性较弱而产物b-e的结晶性强。根据谢乐公式Scherrer:
(1)
计算出其晶粒大小,其中K为常数,取0.89;
λ:Cu的Kα射线波长,0.154056 nm;
β:(111)晶面的半高宽,FWHM;
θ:衍射角的一半。
计算结果如图3所示,从计算结果我们可以看出不同粒径大小的产物的晶粒大小是不同的,产物a的晶粒大小约为3.5 nm,远小于其它产物的晶粒大小。

图2 制备产物的XRD谱图Fig.2 The XRD spectra of the productsa:5 nm;b:50 nm;c:100 nm;d:200 nm;e:250 nm。

图3 不同粒度产物的晶粒大小谱图Fig.3 The grain size spectra of products of different sizea:5 nm;b:50 nm;c:100 nm;d:200 nm;e:250 nm
图4为不同粒径大小产物的TEM谱图,从TEM谱图上我们可以明显地看出产物a和产物b-e的形貌是完全不同的。从图a中我们可以看出产物a的形貌为规整的类球形纳米颗粒,颗粒粒径分布在2~5 nm之间,平均粒径为3.5 nm,但是分散性差,团聚现象比较严重,而产物b-e为多层状结构的纳米片,从中间局部放大图我们可以看出随着产物粒度的增大,层状结构的厚度也越来越大。当产物的粒度较小时(图b、c),其形貌为一种薄片状结构,且片状结构不规整,随着产物粒度的逐渐增大(图d、e),片状结构逐渐趋于完整同时分散性也逐渐增强,基本上没有团聚现象发生。从SAED表征分析看,产物a具有多晶结构,而产物b-e具有单晶结构,根据XRD分析结果可知产物a的晶粒大小约为3.5 nm,这与其平均粒径大小基本相同,这说明产物a单个颗粒是一种单晶结构,单晶结构的单个颗粒构成了多晶结构,HRTEM表征结果表明其晶格间距d=0.21 nm,这与钻石相的(111)的晶面间距d(111)=0.206 nm基本相同,这说明产物a是由(111)晶面构成的,而产物b-e的片状结构是由多层的(111)晶面构成的,我们知道金刚石的解理面为(111)晶面,在制备过程中由于受到外力的作用而使之沿着解理面剥离粉碎,形成了由(111)晶面构成的纳米颗粒及纳米片。

图4 制备产物的TEM谱图Fig.4 The TEM spectra of the productsa:5 nm;b:50 nm;c:100 nm;d:200 nm;e:250 nm
图5为不同粒径产物的Raman光图谱。从Raman谱图上我们可以明显地看出产物a在1320 cm-1和1580 cm-1处并没有出现碳晶体的特征拉曼峰D峰和G峰,而产物b-e在1320 cm-1和1580 cm-1处则出现了碳晶体的特征拉曼峰D峰和G峰,这说明这两种不同粒度产物的晶体结构是不同的。从图中我们可以明显地看出,随着产物粒度的逐渐增大,其特征拉曼峰D峰和G峰的峰强也是逐渐增大的,通过TEM表征我们可知,随着产物粒径的增大,产物中的层厚度也是越来越厚的,这就意味着随着产物中的层厚度越来越厚,其对应的拉曼峰强也越来越大,这说明拉曼峰强与层厚度存在一定的依赖性。我们根据公式(2)计算出了sp3碳的含量,如表2所示。

图5 制备产物的Raman谱图Fig.5 The Raman spectra of the productsa:5 nm;b:50 nm;c:100 nm;d:200 nm;e:250 nm

表2 不同粒度的产物拉曼D峰和G峰对比表
sp3contents = 0.24 - 48.9(ωG-0.1580)
(2)
其中ωG: G峰的位置(μm-1)
从表2我们可以看出,随着产物粒径的增大,sp3碳含量是逐渐在增大的,其sp3碳含量与对应的粒度存在着一个线性的关系,如图6所示, 相反,D峰的半高宽(FWHM)是随着产物粒径的增大而逐渐减小的,ID/IG由1.27快速升高到5.7,这说明随着产物粒径的增大,其产物的结晶性也是逐渐在增强的,这与XRD表征结果是相符的。与此同时,我们还可以发现随着产物粒径增大,D峰和G峰的位置发生了蓝移,蓝移幅度约为8 cm-1,这可能与产物粒度增大以及sp3:sp2杂化有关。

图6 不同粒度产物的sp3含量谱图Fig.6 sp3 content spectrum of products of different particle size
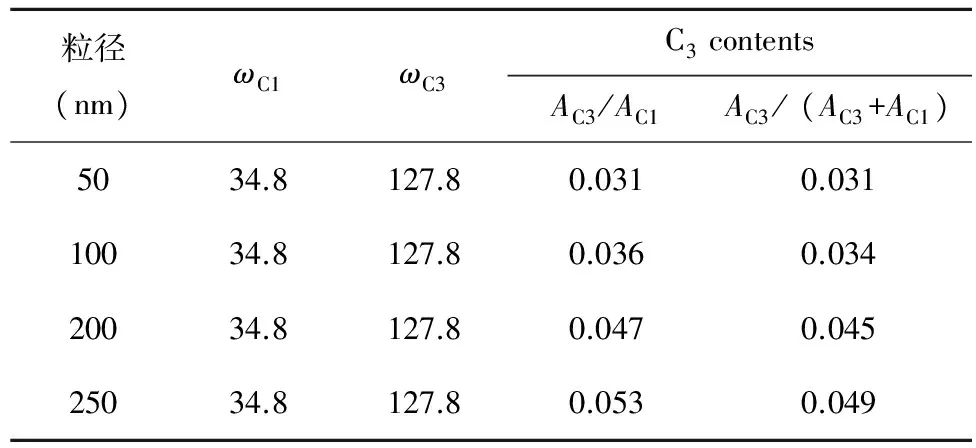
图7为不同粒度产物的13C MAS NMR图谱,从谱图上我们可以看出产物b-e在化学位移δC分别为34.8×10-6和127.8×10-6时均有两个碳峰C1和C3出现,而产物a在化学位移δC分别为34.8×10-6和30×10-6时有两个碳峰C1和C2出现,在其它位置上没有峰出现,这说明产物a和产物b-e中均含有两种性质不同的碳,且含有一个共同的碳原子C1,C2和C3在不同的化学位移位置,C1峰强,C2和C3峰弱,这意味C1的含量多,C2和C3的含量少。我们知道sp3轨道杂化碳的化学位移δC通常在0~60×10-6,sp2轨道杂化碳的化学位移δC通常在(100~220)×10-6,sp轨道杂化碳的化学位移δC通常在(60~90)×10-6,由此我们可以断定C1为sp3轨道杂化碳,C2为sp3轨道杂化碳,C3为sp2轨道杂化碳,也就是说,产物a和产物b-e是由不同性质的碳原子构成的,产物a是由两个性质不同的sp3轨道杂化碳构成的,而产物b-e是由sp3和sp2轨道杂化碳两种不同性质的碳原子构成的。从b图上我们可以看出,产物a中的两个不同性质的碳原子C1和C2的化学位移δC只相差4.8 ×10-6,说明这两个不同性质的碳原子所处的化学环境比较接近,因此C1为颗粒内部的碳原子,C2为颗粒表面的碳原子,C1和C2这两种性质不同的碳原子在颗粒表面形成了一种碳原子二聚体结构,正是由于碳原子二聚体结构的存在才导致了这种碳纳米材料具有特殊的Raman效应。由前面分析我们可知,产物b-e是由两个不同的碳原子C1和C3构成的,其中C1为sp3轨道杂化碳,C3为sp2轨道杂化碳,sp2轨道杂化碳是一种不饱和碳,也就是说,我们制备的产物中含有不饱和碳键,形成了一种sp3轨道杂化碳和sp2轨道杂化碳混合杂化的状态,我们分析了不饱和碳C3的含量随着产物粒度的增大而发生的变化,如表3所示:

图7 制备产物的MAS NMR谱图Fig.7 The MAS NMR spectra of the products.a:5 nm;b:50 nm;c:100 nm;d:200 nm;e:250 nm表3 不同粒度产物中sp2轨道杂化碳与sp3轨道杂化碳对比表Table 3 Comparison of sp2 orbital hybrid carbon and sp3orbital hybrid carbon in products of different particle size
粒径(nm)ωC1ωC3C3contentsAC3/AC1AC3/(AC3+AC1)5034.8127.80.0310.03110034.8127.80.0360.03420034.8127.80.0470.04525034.8127.80.0530.049
从表3我们可以看出,不同粒度的产物中sp2轨道杂化碳的含量是不同的,随着产物粒度的增大,sp2轨道杂化碳的含量是升高的,如图8所示,也就是说产物结构中层厚度越厚sp2轨道杂化碳的含量也就越高,这点与Raman光谱分析结果是相符的。
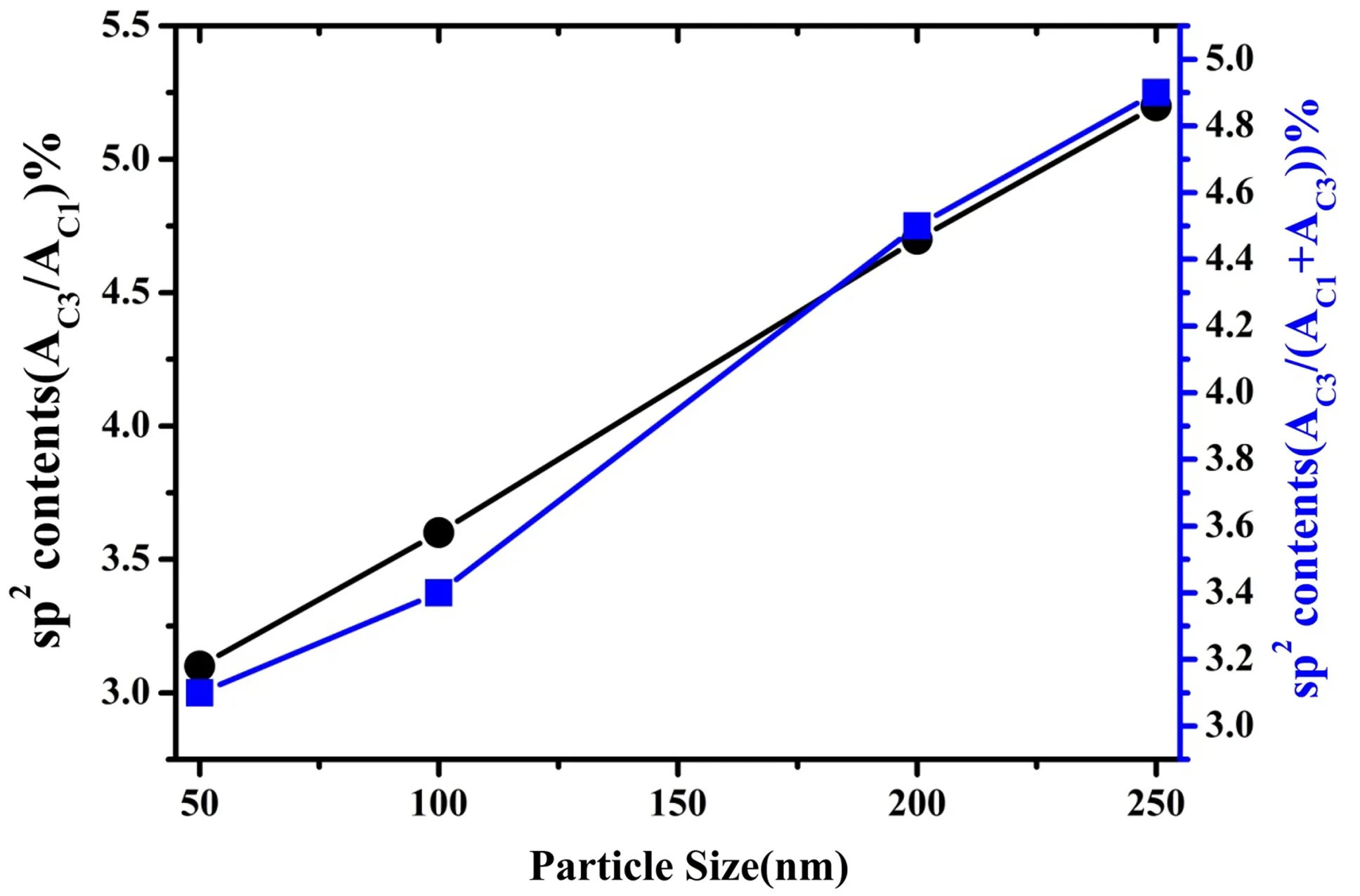
图8 不同粒度的产物的sp2轨道杂化碳含量谱图Fig.8 Content spectra of sp2 orbital hybrid carbon in products of different particle sizes.
4 总 结
我们利用人造金刚石作为原料采用解理面剥离分选的制备工艺方法制备出了两种新型的碳纳米材料,这两种新型的碳纳米材料具有不同的形貌及结构,一种是形貌规整为类球形的钻石相的碳纳米颗粒,单个颗粒粒径分布在2~5 nm之间,碳晶素颗粒表面形成了一种碳原子二聚体结构排布的结构,我们称之为碳晶素,另一种是形貌为多层片状结构的钻石相的碳纳米片,其中含有不饱和碳sp2杂化碳,形成了sp2与sp3混合杂化的状态,且粒度不同,sp2杂化碳与sp3杂化碳的比例不同,我们称之为钻石烯。该制备工艺方法简单,成本低,利于产业化,为其它材料纳米化提供了一种新的思路,这两种新形貌的碳纳米材料未来可应用于生物医药、人体仿生材料、电子、机械、超导、新能源、缓释药物、缓释农药、电子、机械等领域,应用前景广阔。
[1] Iijima S. Helical Microtubes of Graphitic Carbon[J]. Nature,1991,354(6348):56-58.
[2] Guo T,Nikolave P,Thess A,et al. Catalytic growth of single-walled nanotubes by laser vaporization[J]. Chem Phys Lett,1995,243:49-54.
[3] 曹宗良,王健农,丁冬雁,等. 化学气相沉淀法快速生长定向碳纳米管[J]. 新型碳材料,2003,18(1):48-52.
[4] 李颖,李轩科,刘朗. 不同原料气催化热解法制备碳纳米管的研究[J]. 新型碳材料,2004,19(4):298-303.
[5] Yuanzhu Mi,Yingliang Liu,Dingsheng Yuan,et al. Synthesis of carbon nanotubes via toluene-thermal reduction process at moderate temperature [J].Journal of Materials Science,2005,40(14):3635-3638.
[6] 朱永春,钱逸泰.溶剂热法制备碳纳米材料[J].无机化学学报,2008,24(4):499-504.
Study of The Preparation of New Carbon Nanomaterials byThe Cleavage Plane Crush Separation Technology
GUO Liu-xi1, WU Yan-qiang2, YANG Jin-zhong1
(1.ZhengzhouSino-CrystalDiamondJoint-stockCo.,Ltd,Zhengzhou450001,China;2.ZhengzhouSyntheticDiamond﹠ProductsEngineeringTechnologyResearchCenterCo.,Ltd,Zhengzhou450001,China)
Two types of carbon nanomaterials with new morphology, carbon crystal-ingredient and diamond alkene, have been successfully prepared by using synthetic diamond as raw material through cleavage plane crush separation technology. Characterization analysis by X-ray powder diffraction (XRD), transmission electron microscope (TEM), laser raman spectroscopy (Raman) and solid nuclear magnetic (MAS NMR) shows that the carbon crystal-ingredient is a type of near-spherical carbon nanocrystalline particle with a diamond phase composition, and the diameter of the single particle is 2~5 nm which contains two types of carbon atoms of different nature. These two types of carbon atoms form a carbon atom dimer structure on the particle surface. Diamond alkene is a tpye of multilayered carbon nanosheet with a diamond phase composition formed by the stripping and crushing of the diamond cleavage plane(111) and contains unsaturated carbon sp2 hybridization which as a result forms a hybrid structure of sp3and sp2. The ratio between sp3 and sp2 will differ as the particle size varies.
synthetic diamond;the cleavage plane crush separation technology;carbon atom dimer;unsaturated carbon
2016-12-14
郭留希(1963-),男,大学学历,教授级高级工程师,现任郑州华晶金刚石股份有限公司董事长,主要从事超硬材料的开发与管理工作。
武艳强,E-mail:wlsiyan@163.com
郭留希,武艳强,杨晋中,等.解理面粉碎分选法制备新型碳纳米材料的研究[J].超硬材料工程,2017,29(2):28-34.
TQ164
A
1673-1433(2017)02-0028-07

