PP1γ基因DNA甲基化在学习记忆中的作用
侯林,许晟迪,张柱霞,田小莉,姜树原,刘友,巴德仁贵,黄丽华*,邵国,3*
(1. 包头医学院中心实验室生物医学研究中心,基础学院,包头医学院神经科学研究所,内蒙古 包头 014010;2.内蒙古自治区低氧转化医学重点实验室,内蒙古 包头 014010;3.首都医科大学 宣武医院 低氧适应转化医学北京重点实验室,北京 100053)
研究报告
PP1γ基因DNA甲基化在学习记忆中的作用
侯林1,2#,许晟迪1,2#,张柱霞1,2,田小莉1,2,姜树原1,2,刘友1,2,巴德仁贵1,2,黄丽华1,2*,邵国1,2,3*
(1. 包头医学院中心实验室生物医学研究中心,基础学院,包头医学院神经科学研究所,内蒙古 包头 014010;2.内蒙古自治区低氧转化医学重点实验室,内蒙古 包头 014010;3.首都医科大学 宣武医院 低氧适应转化医学北京重点实验室,北京 100053)
目的 研究蛋白磷酸酶1γ(protein serine/threonine phosphatase, PP1γ)和DNA甲基化在学习记忆中的作用。方法 通过DNA甲基化转移酶(DNA methytransferases,DNMTs)抑制剂5-aza-cdR处理小鼠,观察小鼠学习记忆情况及其PP1γ表达变化,通过水迷宫测定小鼠的学习记忆能力,Real-time PCR 检测小鼠海马区DNMTs和PP1γmRNA转录水平以及Western-Blot测定PP1γ的蛋白质表达水平。为了进一步探讨5-aza-cdR对小鼠学习记忆的影响是否与细胞增殖和凋亡有关,用5-aza-cdR 处理NG108-15神经细胞,流式细胞仪、xCelligence系统和荧光素酶报告基因分别检测5-aza-cdR对细胞增殖、凋亡和PP1γ的转录活性的影响。结果 侧脑室注射了5-aza-cdR的小鼠空间学习记忆能力增加,同时小鼠海马区的DNMTs和PP1γ的表达降低;10 μmol/L 5-aza-cdR抑制细胞增殖,降低PP1γ的转录活性,但是没有诱导细胞凋亡。结论 5-aza-cdR对PP1γ的表达抑制与小鼠学习记忆有关。
蛋白磷酸酶1γ;5-aza-cdR;海马;学习记忆
神经元的基因转录在学习和记忆的形成中是必须的[1]。而控制该转录的分子机制非常复杂,其中包括蛋白激酶和蛋白磷酸酶的转录调控[2]。蛋白磷酸酶1γ(protein serine/threonine phosphatase, PP1)在调节染色体重塑过程中控制转录依赖性记忆调节行为发挥着至关重要的作用[3]。它是大脑中的第二丰富的酶,包含4个表达不同的亚基(α, β, γ和δ)。其中PP1α主要表达在细胞质中,PP1β和PP1δ在胞质和胞核中均有表达,PP1γ显著表达于细胞核中[4]。这4种亚基依赖它们的亚细胞定位和相互作用基团,而定位作用于不同底物。PP1γ的研究最为广泛,不仅在大脑中对神经元信号和突触强度发挥负向调节作用[5-7],同时被认为是学习和记忆抑制性分子[8]。但是,PP1γ在调节学习记忆中的表达调控的分子机制到目前为止还没有完全明确。
学习记忆的形成涉及一系列细胞和分子的改变[9],包括基因转录、蛋白质合成和突触可塑性。DNA甲基化是表观遗传学中主要形式之一,在基因转录中发挥重要调节作用。Day等[10]的研究发现DNA甲基化显著促进学习记忆的形成。催化DNA甲基化的形成的酶称为DNA甲基转移酶(DNA methyltransferase, DNMT),主要包括DNMT1、DNMT3A、DNMT3B,与非催化亚基DNMT3L在配子、胚胎和体细胞组织的形成与发展中建立特定的DNA甲基化模型。同时,富含GC的PP1γ启动子区的甲基化水平影响其表达[11]。
5-aza-cdR是一种核苷酸类的甲基化抑制剂,它主要通过抑制DNA甲基化的转录表达而影响DNA的表达水平,而被广泛的应用于研究DNA甲基化[12-14]。DNA甲基化在神经发育和分化、学习记忆中的突触可塑性都扮演重要角色[15-18],因此本研究通过5-aza-cdR处理小鼠和细胞来探讨PP1γ的甲基化和学习记忆之间的关系。
1 材料与方法
1.1 实验动物
6~8周龄SPF级雄性ICR小鼠,体重(18~22) g,86只,购自北京维通利华实验动物技术有限公司[SCXK(京)2011-0012]。无菌手术在包头医学院低氧转化医学内蒙古重点实验室进行[19][SYXK (蒙) 2016-1017]。
1.2 试剂仪器
5-aza-cdR (美国Sigma-Aldrich公司),牛血清白蛋白(中国上海晨达医药科技有限公司),巴比妥钠(中国重庆化学试剂厂),Trizol (日本Takara公司),Superscript III试剂盒(美国Invitrogen公司),RIPA(中国上海碧云天生物技术有限公司),BCA试剂盒(美国Thermo Fisher公司),DMEM完全培养基(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),青链霉素(美国Gibco公司),FITC annexin V Apoptosis Detection Kit II(美国BD公司),pGL-3载体(美国Promega公司),Dual-Glo荧光素酶报告基因检测系统(美国Promega公司),大脑立体定位注射仪(中国瑞沃德生命科学技术有限公司),水迷宫装置(中国北京众实迪创科技发展有限责任公司),核酸蛋白分析仪NanoDrop 2000(美国Thermo Fisher公司),实时荧光定量Real-time PCR仪(美国Thermo Fisher公司),酶标仪(美国Thermo Fisher公司),凝胶成像系统(美国Bio-Rad公司),荧光倒置显微镜TE2000-U(日本Nikon公司),细胞培养箱(美国Thermo Fisher公司),xCELLigence系统(中国杭州艾森生物公司),流式细胞仪BD FA CSCantoTM II(美国BD公司)
1.3 实验方法
1.3.1 小鼠侧脑室注射
小鼠侧脑室注射方法改进于Haley和McCormick的方法[20]。5-aza-cdR溶解在无菌的磷酸盐缓冲液(PBS)中,使用前稀释至10 μmol/L。1%戊巴比妥钠麻醉小鼠,固定于大脑立体定位注射仪上,头顶部去毛,消毒皮肤,在头顶部正中切口,暴露前囟。依据小鼠立位解剖图谱,于前囟后0.5 mm,中线右侧1 mm,垂直进针,深度2.5 mm。实验组向右侧脑室缓慢注入5 μL 10 μmol/L 5-aza-cdR,每次注射时间为5 min,留针2 min,保证药物充分被吸收,缓慢退针。对照组注射等体积的0.1%的牛血清白蛋白[21]。皮肤切口处用青霉素抗菌,缝合伤口。
1.3.2 水迷宫测试
水迷宫实验方法模仿其他课题组的操作[22],连续训练5 d。训练完成后,小鼠随机分成2组,每组43只,分别侧脑室注射5-aza-cdR和BSA,休息1 d后,再次进行水迷宫测试,水下平台移至前一阶段放置位置的对面象限,连续训练5 d,每天4个象限,记录每只小鼠找到平台的时间,检测小鼠的学习记忆能力。
1.3.3 Real-time PCR检测小鼠海马中DNMTs和PP1γ的mRNA表达水平
Trizol法分离小鼠海马中的总RNA并利用逆转录试剂盒逆转录成为cDNA,于-20 ℃保存。引物由Invitrogen公司合成,引物序列参见Zhang[23]的文章。Q-PCR结果利用ΔΔCT法进行分析,ΔCT=CT目标基因- CTbeta-actin,mRNA相对丰度值F=ΔΔCT=2-ΔCT。
1.3.4 蛋白印迹
RIPA法提取小鼠海马中的总蛋白。BCA试剂盒检测总蛋白质的浓度,上样量为20 μg。Western-blot检测PP1γ和beta-actin在小鼠海马中的含量,方法如同本课题组Zhang[23]等。最后通过蛋白质凝胶成像系统扫描图像并分析其灰度值。
1.3.5 细胞培养和5-aza-cdR处理
0.6%青链霉素和10%胎牛血清的 DMEM完全培养基培养小鼠神经细胞NG108-15,培养箱培养条件为37℃、95%湿度和5% CO2。细胞融合度达到60%左右时,去掉旧培养基,重新补加含有5-aza-cdR或BSA的新培养基,孵育24 h。
1.3.6 xCELLigence系统(RTCA)实时监测细胞增殖
NG108-15细胞株在进行细胞增殖实验前一天进行细胞传代,当细胞融合度在60%~80%之间,从培养箱中取出细胞,悬浮细胞,调整细胞浓度达每孔8000个,接种在16孔板中。E-plate置于仪器检测台上测试培养基的基线。上室孔中加入细胞悬液,室温放置30 min。测定24 h内细胞贴壁生长情况。0、5、10、20 μmol/L的5-aza-CdR药物分别处理细胞,每15 min记录一次细胞的增殖指数(CI),连续监测5 d。
1.3.7 流式细胞仪监测细胞凋亡
收集6孔板中的细胞,冰冷的PBS洗2遍,1 mL的1× binding缓冲液悬浮细胞,转移100 μL细胞悬液至BD管中,然后每个BD管中加入2 μL的FITC annexin V和2 μL PI严格按照说明书的方法进行操作,最后使用流式细胞仪监测细胞的凋亡变化情况。
1.3.8 荧光素酶报告基因检测
PP1γ启动子区(-1 bp至-420 bp)插入pGL-3载体,然后转染细胞。通过Dual-Glo荧光素酶报告基因检测系统检测其活性表达,Renilla标准化其活性。
1.3.9 统计学处理
所有数据结果以均值±标准差表示,用SPSS 10.0数据统计软件ANOVA和Tukey对组间数据进行处理和分析。P<0.05为差异有显著性。
2 结果
2.1 5-aza-cdR增加小鼠空间学习记忆能力
通过水迷宫方法检测5-aza-cdR对小鼠学习记忆能力的影响。记录小鼠在2 min内找到水下1 cm隐藏平台的时间,我们发现:与对照组相比,大脑立体定位注射了5-aza-cdR的小鼠找到平台的时间明显缩短,尤其是在第2、3、4天,差异有显著性(P<0.05)(如图1),而其游泳的速度没有变化,表明5-aza-cdR明显提高了小鼠学习记忆能力。
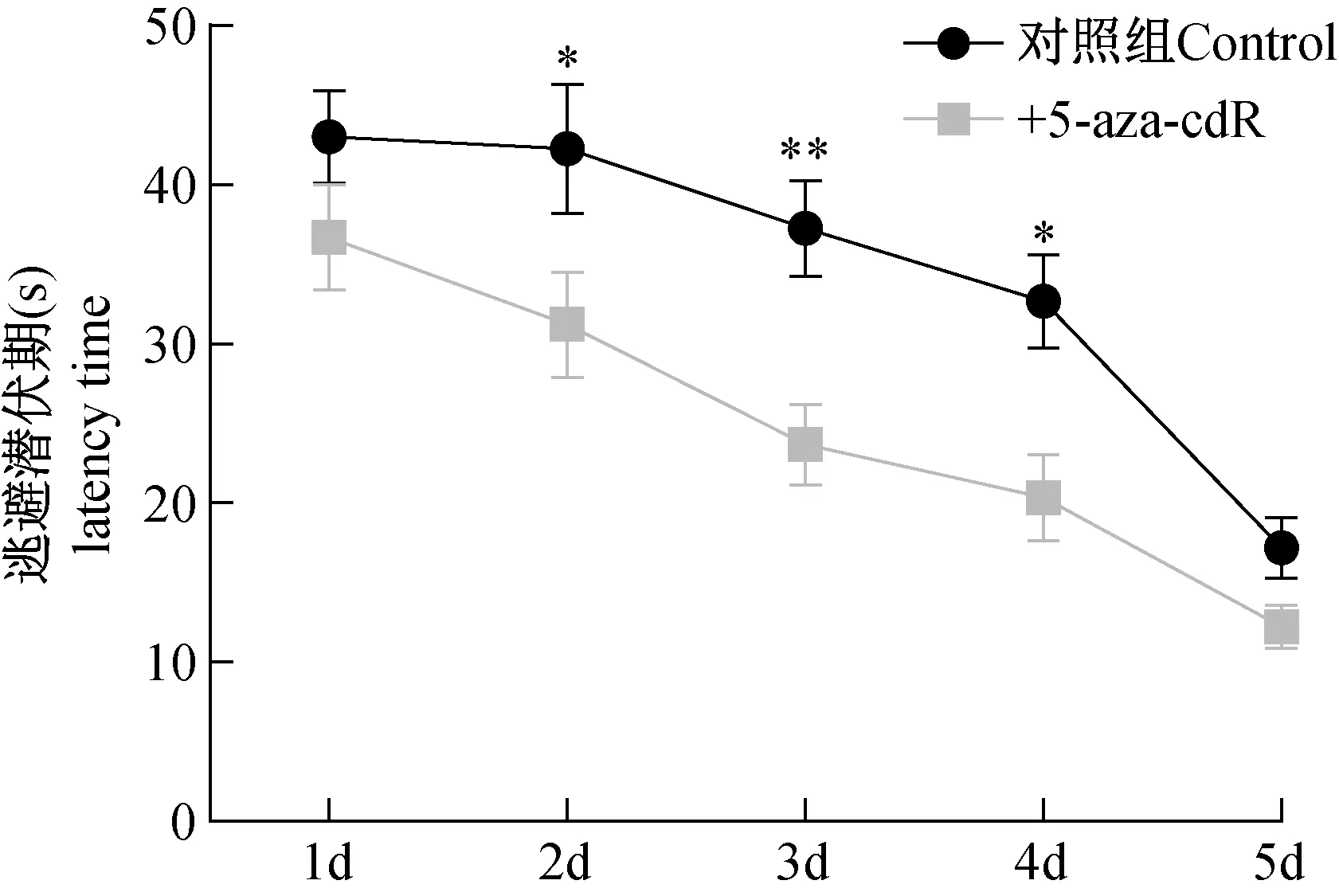
注:*P<0.05,n =43。图1 水迷宫测定小鼠空间学习记忆能力Note. *P<0.05, n=43 for each group.Fig.1 The results of Morris water maze tests show that 5-aza-cdR decreased the escape latency for mice, as a criterion for spatial memory
2.2 5-aza-cdR下调小鼠海马中DNMTs的mRNA转录水平
DNMT1、DNMT3A、DNMT3B的mRNA转录水平变现情况如图2所示。与对照组相比,5-aza-cdR处理的小鼠海马中DNMTs的转录水平明显降低(P<0.05)。

注:A:DNMT1(*P=8.0E-4<0.05);B:DNMT3A(*P=1.5E-2<0.05);C:DNMT3C (*P=2.9E-2<0.05);n=4。图2 Real-time PCR 分析小鼠海马中DNMTs的表达变化情况Note. A: DNMT1; B: DNMT3A; C: DNMT3C; n=4.Fig.2 Real-time PCR analysis for the expression of DNMTs in the mouse hippocampus
2.3 5-aza-cdR下调小鼠海马中PP1γ的转录和表达水平

注:A:*P=5.0E-4<0.05,n=3;B:*P=3.1E-2<0.05,n=3。图3 PP1γ mRNA表达变化情况和小鼠海马区PP1γ蛋白质表达变化Note. A: *P=5.0E-4<0.05, n=3; B: *P=3.1E-2<0.05, n=3.Fig.3 Expression of PP1γ mRNA and Western blot analysis of PP1γ expression in the mouse hippocampus
小鼠大脑立体定位注射了5-aza-cdR后,检测海马中PP1γ的mRNA和蛋白质表达水平,结果如图3所示。图3A显示:5-aza-cdR 明显下调PP1γ的mRNA转录水平,差异有显著性(P<0.05);图3B显示:5-aza-cdR明显降低PP1γ的蛋白质表达水平,差异有显著性(P<0.05)。
2.4 RTCA检测细胞增殖
xCELLigence RTCA检测5、10和20 μmol/L浓度的5-aza-cdR对NG108-15细胞增殖的抑制作用。我们发现5-aza-cdR对细胞增殖有明显的抑制作用,且表现为浓度依赖性,如图4A所示。当5-aza-cdR的浓度达到10 μmol/L时,NG108-15细胞增殖基本完全被抑制,因此此浓度作为该实验的最佳选择浓度。与对照组相比,5-aza-cdR明显抑制NG108-15细胞增殖,差异有显著性(P<0.05),如图4B所示。
2.5 5-aza-cdR促进NG108-15细胞的凋亡
为了进一步验证5-aza-cdR对细胞增殖的影响,我们通过流式细胞仪检测5-aza-cdR对细胞凋亡影响,结果显示10 μmol/L的5-aza-cdR对早期和晚期凋亡的影响没有显著性(图5,P>0.05)。

图4 RTCA 分析5-aza-cdR对神经细胞NG108-15细胞增殖的抑制作用Fig.4 RTCA analysis for the proliferation of NG108-15 cells treated with different concentrations of 5-aza-cdR

注:A:表示对照组细胞的凋亡变化情况;B:表示的5-aza-cdR处理后细胞的凋亡变化情况;C:表示的是两组处理情况下细胞的早期和晚期凋亡的柱状图。图5 流式细胞仪检测细胞的凋亡变化情况Note. The upper panels show the apoptosis in NG108-15 cells in the control group (A) and test group (B); C: Apoptosis in NG108-15 cells.Fig.5 FCM analysis for the apoptosis in 5-aza-cdR-treated NG108-15 cells
2.6 5-aza-cdR抑制NG018-15细胞中PP1γ的转录活性
研究5-aza-cdR对PP1γ启动子区(-1 bp到-420 bp)转录活性的影响,PP1γ启动子区和pGL-3质粒转入到pRL-TK。海肾荧光素酶活性作为对照来检测PP1γ启动子区 荧光素酶活性。如图6所示,与对照组相比,5-aza-cdR可以明显的降低PP1γ启动子区的活性(P<0.05)。
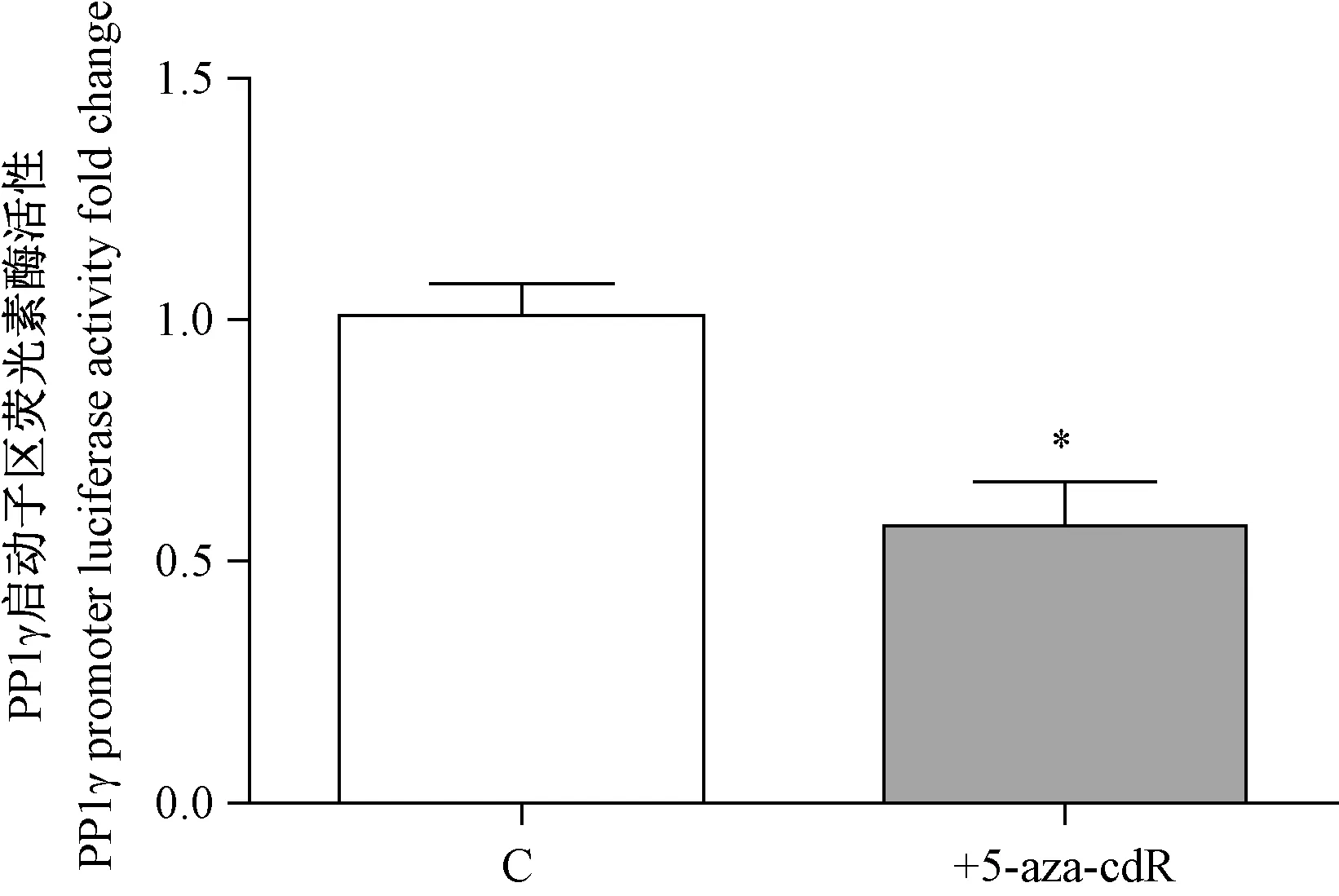
注:* P=5.0E-2<0.05,n=3。图6 5-aza-cdR 下调PP1γ启动子区活性Note. * P=5.0E-2<0.05, n=3.Fig.6 5-aza-cdR down-regulates PP1γ promoter activity
3 讨论
表观遗传学修饰是影响大脑突触可塑性形成的关键因素,其中DNA甲基化的研究最为广泛。DNA甲基化在学习记忆的形成中发挥着重要的作用[24]。Sweatt[25]和他的同事已经证明DNA甲基化的动态改变在长时程记忆形成中是必须的。研究显示DNA甲基化在调节突触可塑性和学习记忆中发挥着举足轻重的作用[26]。DNA甲基化影响神经元的可塑性,注射了甲基化抑制剂后动物恐惧水平降低[11]。随着研究的不断进展,发现DNA甲基化在大脑发育和神经元功能中发挥着关键的作用[23,27]。这些研究进一步证明了DNA甲基化在学习记忆中的关键作用。本研究发现DNA甲基化抑制剂5-aza-cdR明显抑制DNA甲基化转移酶的mRNA转录水平,同时它对小鼠的空间学习记忆能力明显提高。结果显示了DNA甲基化可能是与学习记忆能力关系密切。
本研究发现小鼠侧脑室注射10 μmol/L的5-aza-cdR可以增加小鼠空间学习记忆能力,显示这种变化可能与某些分子甲基化的改变有关。前期的研究中我们发现,DNMTs的降低伴随着PP1γ的表达降低[28]。PP1与学习记忆的形成有关,可能涉及与学习记忆相关的靶基因启动子区的转录或调节,被认为是海马中突触强度和突触可塑性负性调节因子和成年鼠中潜在的记忆抑制剂[8,26]。我们的研究结果发现,在成年小鼠海马和细胞模型中,DNA甲基化抑制剂5-aza-cdR抑制PP1γ的表达和转录活性。另一方面,PP1γ可能通过其磷酸化作用影响某些高级特殊行为的突触传输。虽然PP1γ的DNA甲基化的机制还没有完全阐述明白,但是我们已经明确PP1γ表达降低可能与提高学习记忆能力有关。
为了进一步明确5-aza-cdR对学习记忆的影响与细胞的增殖和凋亡的关系。我们进一步选择了NG108-15细胞作为体外模型进行研究。通过增殖曲线,我们发现当5-aza-cdR的浓度达到10 μmol/L时,细胞增殖基本完全被抑制。由于5-aza-cdR没有明显促进细胞的早期和晚期凋亡。因此我们推断5-aza-cdR促进小鼠学习记忆与新神经元的形成无关和凋亡无关。荧光素酶报告基因结果显示,5-aza-cdR明显降低了NG108-15细胞中PP1γ的转录活性。结合体外细胞实验和小鼠体内实验,5-aza-cdR促进小鼠学习记忆可能与PP1γ的改变有关。5-aza-cdR作为DNMTs抑制剂,能够降低DNA的甲基化程度。有研究发现低甲基化是保持大脑内基因表达稳定的需要[22]。但是我们发现5-aza-cdR降低了小鼠海马区PP1γ的表达和神经细胞的转录活性,其中可能涉及一些分子机制的改变。通过该研究,我们还不能确定5-aza-cdR对PP1γ的影响是否是与DNMTs有关。
PP1γ甲基化变化和学习记忆的关系还未见到相关的报道。我们的研究首次报道了成年小鼠海马PP1γ在5-aza-cdR对学习记忆和突触可塑性的形成中扮演着重要的角色。因此PP1γ低表达对学习记忆的影响可能与DNA甲基化有很大关系。
[1] Capitano F, Gargiuli C, Angerilli A, et al. RNA polymerase I transcription is modulated by spatial learning in different brain regions [J]. J Neurochem, 2016,136(4): 706-716.
[2] Chagniel L, Bergeron Y, Bureau G, et al. Regulation of tyrosine phosphatase STEP61 by protein kinase A during motor skill learning in mice [J]. Plos One, 2014, 9(1): e86988.
[3] Day JJ, Sweatt JD. DNA methylation and memory formation [J]. Nature Neurosci, 2010, 13(11): 1319-1323.
[4] Desjobert C, El Mai M, Gérard-Hirne T, et al. Combined analysis of DNA methylation and cell cycle in cancer cells [J]. Epigenetics, 2015, 10(1): 82-91.
[5] Einstein F, Thompson R F, Bhagat T D, et al. Cytosine methylation dysregulation in neonates following intrauterine growth restriction [J]. Plos One, 2010, 5(1): e8887.
[6] Frühwald MC, Plass C. Global and gene-specific methylation patterns in cancer: aspects of tumor biology and clinical potential [J]. Mol Genet Metab, 2002, 75(1): 1-16.
[7] Genoux D, Haditsch U, Knobloch M, et al. Protein phosphatase 1 is a molecular constraint on learning and memory [J]. Nature, 2002, 418(6901): 970-975.
[8] Gräff J, Koshibu K, Jouvenceau A, et al. Protein phosphatase 1-dependent transcriptional programs for long-term memory and plasticity [J]. Learn Mem, 2010, 17(7): 355-363.
[9] Gros A, Veyrac A, Laroche S. [Brain and memory: new neurons to remember] [J]. Biologie Aujourdhui, 2015, 209(3): 229-248.
[10] Hédou GF, Koshibu K, Farinelli M, et al. Protein phosphatase 1-dependent bidirectional synaptic plasticity controls ischemic recovery in the adult brain [J]. J Neurosci, 2008, 28(1): 154-162.
[11] Isaac J. Protein phosphatase 1 and LTD: synapses are the architects of depression [J]. Neuron, 2002, 32(6): 963-966.
[12] Kennedy A J, Sweatt J D. Drugging the methylome: DNA methylation and memory.[J]. Crit Rev Biochem Mol Biol, 2016: 51(3): 185-194
[13] Li S, Goorha S, Ballou LR, et al. Intracerebroventricular interleukin-6, macrophage inflammatory protein-1beta and IL-18: pyrogenic and PGE(2)-mediated? [J]. Brain Res, 2003, 992(1): 76-84.
[14] Miller CA, Campbell SL, Sweatt JD. DNA methylation and histone acetylation work in concert to regulate memory formation and synaptic plasticity [J]. Neurobiol Learn Mem, 2008, 89(4): 599-603.
[15] Miller CA, Sweatt JD. Covalent modification of DNA regulates memory formation [J]. Neuron, 2007, 53(6): 857-869.
[16] Morishita W, Connor JH, Xia H, et al. Regulation of synaptic strength by protein phosphatase 1[J]. Neuron, 2002, 32(6): 1133-1148.
[17] Nelson ED, Kavalali ET, Monteggia LM. Activity-dependent suppression of miniature neurotransmission through the regulation of DNA methylation [J]. J Neurosci, 2008, 28(2): 395-406.
[18] Nguyen S, Konstantinos Meletis, Fu D, et al. Ablation of de novo DNA methyltransferase Dnmt3a in the nervous system leads to neuromuscular defects and shortened lifespan [J]. Dev Dyn, 2007, 236(6): 1663-1676.
[19] 张建军, 隋欣, 吕国蔚, 等. 化学预处理对低氧预适应模型小鼠的影响 [J]. 中国组织工程研究, 2012, 46: 8698-8702.
[20] Noguchi H, Kimura A, Murao N, et al. Expression of DNMT1 in neural stem/precursor cells is critical for survival of newly generated neurons in the adult hippocampus[J]. Neurosci Res, 2015, 95: 1-11.
[21] Nugent BM, Wright CL, Shetty AC, et al. Brain feminization requires active repression of masculinization via DNA methylation [J]. Nature Neurosc, 2015, 18(5): 1823-1824.
[22] Rajendran G, Shanmuganandam K, Bendre A, et al. Epigenetic regulation of DNA methyltransferases: DNMT1 and DNMT3B in gliomas [J]. J Neurooncol, 2011, 104(2): 483-494.
[23] Zhang S, Zhang Y, Jiang S, et al. The effect of hypoxia preconditioning on DNA methyltransferase and PP1γ in hippocampus of hypoxia preconditioned mice [J]. High Altitude Med Biol, 2014, 15(4): 483-490.
[24] 姚志刚, 秦川. 表观遗传修饰在学习和记忆中的调节作用 [J]. 中国实验动物学报, 2011, 19(5): 441-445.
[25] Strack S, Kini S, Ebner FF, et al. Differential cellular and subcellular localization of protein phosphatase 1 isoforms in brain [J]. J Comp Neurol, 1999, 413(3): 373-384.
[26] Ulke-Lemée A, Trinkle-Mulcahy L, Chaulk S, et al. The nuclear PP1 interacting protein ZAP3 (ZAP) is a putative nucleoside kinase that complexes with SAM68, CIA, NF110/45, and HNRNP-G J]. Biochim Biophys Acta, 2007, 1774(10): 1339-1350.
[27] Zhang D, Li Q, Rao L, et al. Effect of 5-Aza-2′-deoxycytidine on odontogenic differentiation of human dental pulp cells [J]. J Endodont, 2015, 41(5): 640-645.
[28] Zhou R, Chen F, Chang F, et al. Persistent overexpression of DNA methyltransferase 1 attenuating GABAergic inhibition in basolateral amygdala accounts for anxiety in rat offspring exposed perinatally to low-dose bisphenol A [J]. J Psychiat Res, 2013, 47(10): 1535-1544.
Effect of expression ofPP1γand DNA methylation on learning and memory in mice
HOU Lin1,2#, XU Sheng-di1,2#, ZHANG Zhu-xia1,2, TIAN Xiao-li1,2, JIANG Shu-yuan1,2, LIU You1,2, BADE Rengui1,2, HUANG Li-hua1,2*, SHAO Guo1,2,3*
(1.Biomedicine Research Center, Basic Medical College and Neuroscience Institute, Baotou Medical College, Baotou, Inner Mongolia 014010, China; 2.Inner Mongolia Key Laboratory of Hypoxic Translational Medicine, Baotou Medical College, Baotou, Inner Mongolia 014010; 3. Beijing Key Laboratory of Hypoxia AdaptationTranslational Medicine, Xuanwu Hospital, Capital Medical University, Beijing 100053)
Objectives To study the role of protein serine/threonine phosphatase1γ (PP1γ) and DNA methylation in learning and memory. Methods The mice and cells were treated with 5-aza-cdR, a DNA methyltransferase (DNMT) inhibitor, and to observe the changes of ability of learning and memory and expression levels ofPP1γin mice. The ability of learning and memory in mice was assessed by Morris Water maze test. The mRNA expression levels ofDNMTsandPP1γin the mouse hippocampus were determined by real-time PCR and the protein level of PP1γ was measured by Western blot. To further investigate their role, NG108-15 cell line was treated with 5-aza-cdR. Flow cytometry, xCelligence and luciferase were used to detect the effects of 5-aza-cdR on the proliferation, apoptosis andPP1γtranscription in the NG108-15 cells. Results The ability of learning and memory was enhanced in the mice after administration of 5-aza-cdR injection. The expressions of DNMTs and PP1γ were decreased in the mouse hippocampus after injection of 5-aza-cdR. On the other side, 10 μmol/L 5-aza-cdR inhibited cell proliferation and decreasedPP1γtranscription without inducing apoptosis. Conclusions Our data demonstrate that 5-aza-cdR inhibits the expression of PP1γ which is related to learning and memory in mice.
PP1γ; 5-aza-cdR; Hippocampus; Learning and memory
SHAO Guo, E-mail: shao_guo_china@163.com;HUANG Li-hua,E-mail: huanglihua858@163.com
国家自然科学基金(Nos: 81460283, 81660307);内蒙古自然科学基金 (No: 2014MS0810)。
侯林(1992-),男,硕士研究生,专业:公共卫生与预防医学, E-mail: holy.lin@foxmail.com;许晟迪(1992-),女,硕士研究生,专业:神经生物学, E-mail: 2219984188@qq.com。共同第一作者
邵国,男,教授,研究方向:神经生物学, E-mail: shao_guo_china@163.com; 黄丽华,女,副教授,研究方向:神经毒理学,E-mail: huanglihua858@163.com
Q95-33
A
1005-4847(2017) 02-0146-07
10.3969/j.issn.1005-4847.2017.02.006
2016-08-30

