利用ISSR分子标记检测空间诱导罗汉果DNA突变
向巧彦 黄夕洋 李虹 甘金佳 梁勇诗 蒋水元
摘要: 为探究太空环境对罗汉果造成的诱变效应,筛选罗汉果新品种培育优异种质,该研究运用ISSR分子标记技术,对28个航天诱变罗汉果及主栽品种进行了全基因组多态性检测和聚类分析。结果表明:从100个ISSR引物中筛选得到17个引物,共扩增出157个条带,其中83条具有多态性,多态条带百分率为52.87%,遗传相似系数范围为0.707~0.987。根据UPGMA聚类图,28个罗汉果样本可以分为3类:聚类Ⅰ为航天种质B6和B3♀;聚类Ⅱ为航天种质A1♀、A14、A18与主栽品种;聚类Ⅲ中都为航天罗汉果种质。上述结果暗示A1♀、A14、A18与其他航天种质已经产生了一定的遗传分化,具有与主栽品种相似的遗传背景,可能获得了有益突变。该研究结果为罗汉果新品种培育和杂交亲本选配提供了科学依据。
关键词: 罗汉果, 空间诱变育种, ISSR, 分子标记辅助选择
中图分类号: Q949.9
文献标识码: A
文章编号: 10003142(2017)05058107
Abstract: In order to investigate genetic variation of Siraitia grosvenorii after space flight, and to create elite germplasms, ISSR (intersimple sequence repeats) molecular markers were used to detect the genomewide DNA polymorphism and to make cluster analysis of 28 S. grosvenorii samples including spaceflight accessions and main cultivars. Seventeen primers which had clear polymorphic bands were selected from 100 primers. A total of 157 bands were detected, of which 83 bands were polymorphic with a polymorphic rate of 52.87%. Genetic similarity coefficient ranged from 0.707 to 0.987. UPGMA cluster analysis revealed that 28 samples formed three primary distinct clusters: Cluster I included two space mutation germplasms B6 and B3♀; Cluster Ⅱ contained space mutation germplasm A1♀, A14, A18 and all the main cultivars; The remaining space mutation germplasm belonged to cluster Ⅲ. These results were as follows: (1) Space mutation could result in genetic variation of S. grosvenorii. (2) A1♀, A14 and A18 might gain positive mutation because their genetic backgrounds were similar with the main cultivars, which could provide useful information for creating new elite germplasms in S. grosvenorii.
Key words: Siraitia grosvenorii, space mutation breeding, ISSR, molecular markerassisted selection
罗汉果(Siraitia grosvenorii )是我国特有的葫芦科多年生草质藤本植物,以果实入药,为我国常用大宗中药材之一,具有止咳祛痰、润肠通便等功效(中华人民共和国国家药典委员会,2015)。羅汉果果实中的甜苷Ⅴ为世界上最强的非糖甜味物质之一(李典鹏和张厚瑞,2000),在天然药物和甜味剂开发方面受到广泛关注。罗汉果分布于一个相对狭小的区域,资源匮乏已成为不争的事实。罗汉果药用和甜苷提取需求量的增加,推动了罗汉果种植业的空前发展,原产地被大量开垦发展罗汉果种植,导致野生资源储备锐减;而人工栽培组培苗的推广,使栽培方式由多年生变为一年生,提高产量的同时,却导致栽培品种单一,品种退化严重。罗汉果在种植方面最突出的是品种问题,农学和生物学工作者在罗汉果的高产栽培技术(陈继富等,2012)、组织培养(付长亮等,2005)、多倍体育种(蒋水元等,2009)、新品种选育(马小军等,2008)、遗传转化研究(朱英芝,2012;邢爱佳等,2013;曾雯雯,2015)等方面已开展大量工作,并且选育出一系列优良高产的新品种。到目前为止,利用杂交育种、诱变育种与优良品种选育等常规方法还没有取得突破性进展(闫海锋等,2011)。当前所采用的栽培品种依然为20世纪70年代形成的青皮果、红毛果等农家品种。
航天育种具有诱变效率高、育种周期短、变异方向不定、可出现常规育种不易出现的变异等特点,近年来已经受到广泛关注,并取得了令人瞩目的研究成果(刘录祥等,2007;梁剑平,2010)。运用航天育种,可以提高罗汉果变异率,扩大种质资源库,创造更多供选择的优异种质。2011年,一批罗汉果种子搭载“神舟八号”进行太空育种;2012年,这批种子在广西桂林永福县进行试种。ISSR分子标记技术,具有多态性高、操作简单、价格低廉的优点,具有较高的稳定性和重复性(Zietkiewicz et al,1994)。本研究运用ISSR分子标记技术,首次在DNA层面,对航天罗汉果种质进行遗传变异检测,探究太空环境对罗汉果造成的诱变效应,为罗汉果新品种的培育提供理论指导。
1材料与方法
1.1 材料
2014年春,将航天罗汉果种质与主栽品种种植于广西植物研究所本课题组试验地,当年秋天采集叶片,共计28个样本(表1),硅胶干燥保存。航天罗汉果标号以A和B开头。主栽品种都为青皮果,航天种质品种为冬瓜果。
1.2 方法
1.2.1 DNA提取采用改良CTAB法(Doyle JJ & Doyle JL,1987),提取干燥葉片总DNA。提取步骤:称取干燥叶片0.1 g,放入研钵中,加适量液氮,快速研磨成粉;在研钵中加入2 mL 预热65 ℃ 2% CTAB(含2% β-巯基乙醇),研磨混合均匀;将溶液从研钵转入2 mL 离心管中,65 ℃ 水浴1 h,期间每隔15 min上下颠倒混匀一次;12 000 r·min1离心10 min,上清液倒入新离心管;加入等体积氯仿∶异戊醇(24∶1),上下颠倒混匀7 min。12 000 r·min1离心10 min,上清吸入新离心管;重复氯仿抽提一次; 加入1/10体积NaAc (pH 5.2), 等体积异丙醇 (-20 ℃预冷),混匀,-20 ℃冰箱中静置20 min;5 000 r·min1,5 min,倒上清液;加入1 mL 70%乙醇洗涤一次;5 000 r·min1,5 min,倒上清液,1 mL 无水乙醇洗涤2次;自然风干,加50 μL 1 × TE溶解;-20 ℃冰箱保存。
1.2.2 DNA检测运用琼脂糖凝胶电泳法检测DNA完整性,用NanoDropTM/ND2000C检测DNA浓度和纯度。
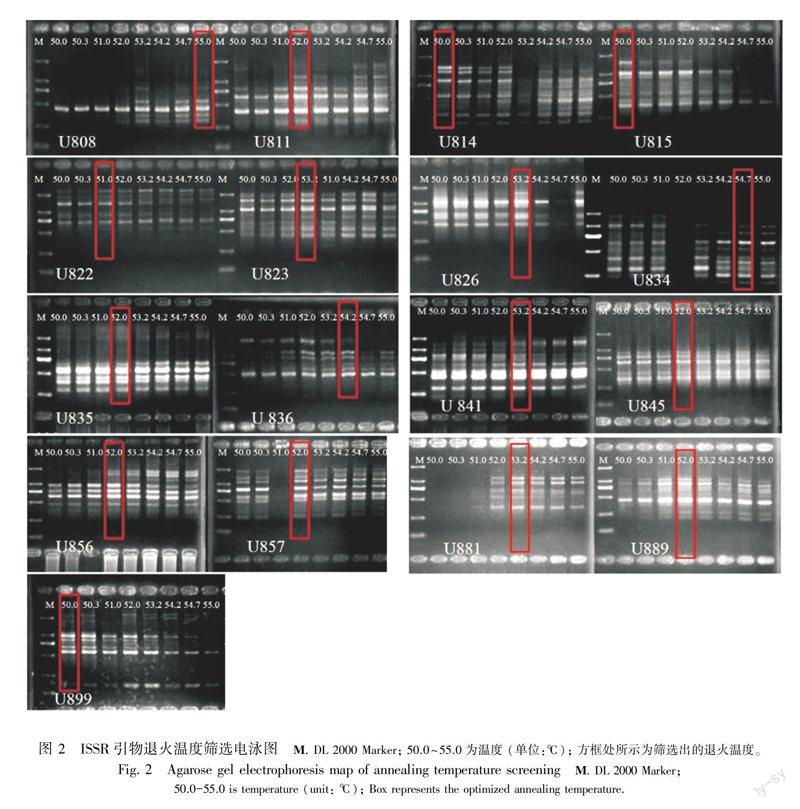
1.2.3 ISSR引物及退火温度筛选随机选取8个样本,对100个引物进行筛选。PCR试剂为TaKaRa Ex Taq DNA Polymerase (Mg2+ free buffer)。25 μL PCR反应体系中含DNA模板50 ng,其余成分终浓度:1×buffer(不含Mg2+),MgCl2 2.0 mmol·L1,4种dNTPs 各0.2 mmol·L1,引物0.5 μmmol·L1,Tag酶1 U。反应程序为94 ℃预变性3 min,94 ℃变性1 min,52 ℃退火50 s,72 ℃延伸2 min,40个循环,72 ℃延伸7 min(周俊亚等,2004)。产物用琼脂糖凝胶电泳检测,EB染色,凝胶成像系统显影、拍照。选择条带多、清晰、亮度强的引物进行引物退火温度筛选。设置50~55 ℃温度梯度,筛选退火温度,用于28个样本的ISSR分析。
1.2.4 ISSR数据分析ISSR扩增产物以0、1统计建立数据库。在相同的迁移位置上,有带存在赋值为“1”,无此带赋值为“0”,用GenAlEx 6.5软件(Peakall
& Smouse,2006;PE,2012)计算Neis (Nei & Li,1979)遗传相似系数,采用NTSYSpc Version 2.10 e 软件构建UPGMA聚类图。
2结果与分析
2.1 DNA检测
从图1可以看出,DNA条带亮度高、集中、清晰、无降解。DNA的浓度值在1 765.3~5 186.4 ng·μL1之间,λ260/280 在2.05~2.16之间,λ260/230在1.80~2.21之间。纯DNA 的λ260/280 比值约为1.8,该比值受测量时空白样品和DNA样品所用溶剂的pH和例子强度影响:酸性溶剂的比值会低0.2~0.3,而碱性溶液比值会高0.2~0.3。如果偏差太大,则是蛋白、酚或其他污染在280 nm区域附近具有吸收峰;纯DNA的λ260/230 比值为1.8~2.2。比值太低说明DNA提取技术需要优化(Desjardins & Conklin,2010)。本研究中,溶解DNA所用试剂TE(pH8.0)为碱性,λ260/280值在正常范围。因此,本研究所获得的罗汉果DNA浓度高、质量好,可以满足ISSR分析的需要。
2.2 ISSR引物筛选及引物退火温度筛选
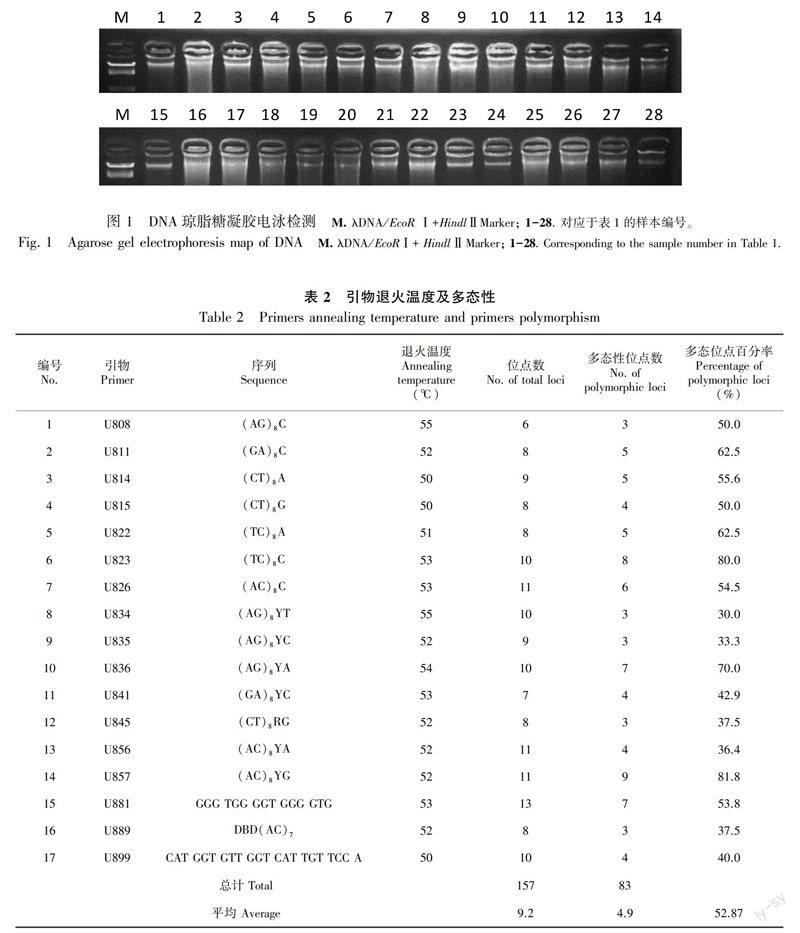
从100个ISSR引物中筛选出17个引物,筛选的退火温度见表2和图2。
2.3 遗传多样性分析
17条引物在28个样本中共扩增得到157条条带,其中83条具有多态性,多态条带百分率为52.87%;各引物扩增的条带数最多为13条(U881),最少为6条(U808),平均为9.2条;各引物扩增的多态条带最多为9条(U857),最少为3条(U808,U834,U835,U845,U889),平均为4.9条(表2)。
Neis遗传相似系数范围0.987~0.707,最大的为A1♀和BL2(0.987),最小的为B6和LG2。根据UPGMA聚类图,28个罗汉果样本可以分为3类,聚类Ⅰ为航天种质B6和B3♀;聚类Ⅱ为航天种质A1♀,A14,A18与主栽品种;聚类Ⅲ中都为航天罗汉果种质(图3)。
3讨论与结论
我国通过航天育种已培育出一批具有高产、优质、抗病新品种(系),但相应的基础理论研究较薄弱,需要加强航天诱变的分子基础研究,解析诱变的分子机制,提高诱变的预见性和诱变后代选择效率。本研究运用ISSR分子标记技术,从DNA层面,对航天罗汉果的变异进行解析。从100个ISSR引物中筛选得到17个引物,对28个罗汉果样本进行扩增,共扩增出157个条带,其中83条具有多态性,多态条带百分率为52.87%;各引物扩增的条带数最多为13条(U881),最少为6条(U808),平均为9.2条;各引物扩增的多态条带最多为9条(U857),最少为
3条(U808,U834,U835,U845,U889),平均为4.9条;Neis遗传相似系数范围0.987~0.707,最大的为A1♀和BL2(0.987),最小的为B6和LG2;根据UPGMA聚类图,28个罗汉果样本可以分为3类,聚类Ⅰ为航天种质B6和B3♀;聚类Ⅱ为航天种质A1♀,A14,A18与主栽品种;聚类Ⅲ中都为航天罗汉果种质。
航天诱变育种产生的变异率一般为5%~10%,往往从这些突变体中可以筛选到2%~3%的有益突变体材料(潘光辉等,2005)。本研究中,航天种质品种为冬瓜果,主栽品种属于青皮果,运用ISSR分子标记技术,可以从DNA层面区分这两个品种,与周俊亚等(2005)的研究结果一致。青皮果是目前栽培面积最大的罗汉果品种(周俊亚和唐绍清,2006),具有甜苷含量高,大、中果占比高、產量高、适应性强等优点(孙宗喜等,2006;白隆华等,2007)。本研究中,根据Neis遗传相似系数构建的UPMG聚类图表明,所有主栽品种聚为一类,与其品种分类一致,大多数航天罗汉果聚为一类,也与其品种来源一致;航天罗汉果A1♀,A14,A18与主栽品种聚为一类,暗示这3个种质与其他航天种质已产生了一定的遗传分化,而具有与主栽品种更为相似的遗传背景,可能获得了有益突变。本研究结果可以指导航天育种后代的筛选,重点关注A1♀,A14,A18,结合农艺性状和化学成分方面的研究,从中筛选出优良品系。
在杂交育种中,亲本选择的原则之一是亲缘关系上存在一定差异,亲本间差异越大,后代的杂交优势可能越明显。根据Nei遗传相似系数,可以获得两两品种间的最大及最小相似度,指导后续的杂交育种工作,充分利用航天种质,为罗汉果的遗传改良引入新的优良种质。
参考文献:
BAI LH, MA XJ, MO CM, et al, 2007. Study on quantitative assessment of Siraitia grosvenorii germplasms by general index [J]. Chin J Chin Mat Med, 32(23):2482-2484. [白隆华, 马小军, 莫长明, 等, 2007. 罗汉果种质资源综合指数定量评价研究 [J]. 中国中药杂志, 32(23):2482-2484.]
CHEN JF, TIAN QJ, LIU SB, 2012. Effects of different cultivation modes on growth, fructification and fruit quality of Siraitia grosvenorii [J]. Chin J Trop Crops, 33(12):2185-2189. [陈继富, 田启建, 刘世彪, 2012. 不同栽培方式对罗汉果生长、结果及品质的影响 [J]. 热带作物学报, 33(12):2185-2189.]
Chinese Pharmacopoeia Commission, 2015. Pharmacopoeia of the Peoples Republic of China(Vol. I) [M]. Beijing:China Medical Science Press:324. [中华人民共和国国家药典委员会, 2015. 中华人民共和国药典(一部) [M]. 北京:中国医药科技出版社:324.]
DESJARDINS P, CONKLIN D, 2010. NanoDrop microvolume quantitation of nucleic acids [J]. J Vis Exp, (45):e2565.
DOYLE JJ, DOYLE JL, 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue [J]. Phytochem Bull, 19:11-15.
FU CL, MA XJ, BAI LH, et al, 2005. Progress on research of tissue culture of Siraitia grosvenorii [J]. Chin J Chin Mat Med, 30(5):325-328. [付长亮, 马小军, 白隆华, 等, 2005. 罗汉果组织培养研究进展 [J]. 中国中药杂志, 30(5):325-328.]
JIANG SY, JIANG XJ, QIN JS, et al, 2009. Preliminary study on selection of seedless Siraitia grosvenorii [J]. Guihaia, 29(4):506-509. [蒋水元, 蒋向军, 覃吉胜, 等, 2009. 无籽罗汉果选育的初步研究 [J]. 广西植物, 29(4):506-509.]
LI DP, ZHANG HR, 2000. Studies and uses of Chinese medicine Luohanguo——a special local product of Guangxi [J]. Guihaia, 20(3):270-276. [李典鹏, 张厚瑞, 2000. 广西特产植物罗汉果的研究与应用 [J]. 广西植物, 2000, 20(3):270-276.]
LIANG JP, LI XH, LU XH, et al, 2010. Application of nuclear irradiation to traditional Chinese medicine [J]. Nucl Physic Rev, 21(3):284-290. [梁剑平, 李雪虎, 陆锡宏, 等, 2010. 核辐照技术在中药领域中的应用 [J]. 原子核物理评论, 21(3):284-290.]
LIU LX, GUO HJ, ZHAO LS, et al, 2007. Achievements in the past twenty years and perspective outlook of crop space breeding in China [J]. J Nucl Agric Sci, 21(6):589-592, 601. [刘录祥, 郭会君, 赵林姝, 等, 2007. 我国作物航天育种20年的基本成就与展望 [J]. 核农学报, 21(6):589-592, 601.]
MA XJ, MO CM, BAI LH, et al, 2008. A new Siraitia grosvenorii cultivar ‘Yongqing 1 [J]. Acta Hortic Sin, 35(12):1855. [马小军, 莫长明, 白隆华, 等, 2008. 罗汉果新品种‘永青1号 [J]. 园艺学报, 35(12):1855.]
NEI M, LI WH, 1979. Mathematical model for studying genetic variation in terms of restriction endonucleases [J]. Proc Nat Acad Sci USA, 76(10):5269-5273.
PAN GH, YIN XG, YANG QF, et al, 2005. Research progress on spaceflight breeding of crops [J]. SW Hortic, 33(4):34-36. [潘光辉, 尹贤贵, 杨琦凤, 等, 2005. 农作物太空育种研究进展 [J]. 西南园艺, 33(4):34-36.]
PEAKALL R, SMOUSE PE, 2006. GENALEX 6:genetic analysis in Excel. Population genetic software for teaching and research [J]. Mol Ecol Notes, 6(1):288-295.
PEAKALL R, SMOUSE PE, 2012. GenAlEx 6.5:genetic analysis in Excel. Population genetic software for teaching and research—an update [J]. Bioinformatics, 28(19):2537-2539.
SUN ZX, WANG YW, YOU M, et al, 2006. Comparison study on yield and quality in tissuecultured seedling of different Momordica grosvenori breed [J]. Biotechnol Bull, S1:521-524. [孙宗喜, 王有为, 尤敏, 等, 2006. 不同罗汉果品种组培苗产量与质量性状的比较研究 [J]. 生物技术通报, S1:521-524.]
XING AJ, MA XJ, MO CM, et al, 2013. Cloning and prokaryotic expression of UDPglycosyltransferase in Siraitia grosvenorii [J]. Acta Hortic Sin, 40(6):1195-1204. [邢愛佳, 马小军, 莫长明, 等, 2013. 罗汉果葡萄糖基转移酶基因的克隆及原核表达 [J]. 园艺学报, 40(6):1195-1204.]
YAN HF, HUANG XY, LIANG P, et al, 2011. Comparative study on biological characteristics between diploid and polyploid Siraitia grosvenorii [J]. Guangxi Sci, 18(2):177-180. [闫海锋, 黄夕洋, 梁萍, 等, 2011. 二倍体与多倍体罗汉果生物学性状的比较研究 [J]. 广西科学, 18(2):177-180.]
ZENG WW, 2015. Establishment of genetic transformation system for Siraitia grosvenorii and transformation research of CS gene [D]. Nanning:Guangxi University:15-53. [曾雯雯, 2015. 罗汉果遗传转化体系的建立与CS基因的转化研究 [D]. 南宁:广西大学:15-53.]
ZHOU JY, BING XY, PENG YT, et al, 2004. Establishment of ISSRPCR system in Luo Han Guo (Siraitia grosvenorii) [J]. J Guangxi Norm Univ (Nat Sci Ed), 22(3):81-84. [周俊亚, 宾晓芸, 彭云滔, 等, 2004. 罗汉果 ISSRPCR 反应体系的建立 [J]. 广西师范大学学报:自然科学版, 22(3):81-84.]
ZHOU JY, TANG SQ, 2006. Genetic diversity of cultivated Luohanguo (Siraitia grosvenorii) revealed by RAPD markers [J]. Mol Plant Breed, 4(1):71-78. [周俊亚, 唐绍清, 2006. 栽培罗汉果遗传多样性的 RAPD 分析 [J]. 分子植物育种, 4(1):71-78.]
ZHOU JY, TANG SQ, XIANG WS, et al, 2005. Genetic diversity of cultivated Luohanguo (Siraitia grosvenorii) based on ISSR marker [J]. Guihaia, 25(5):431-436. [周俊亚, 唐绍清, 向悟生, 等, 2005. 栽培罗汉果遗传多样性的 ISSR 分析 [J]. 广西植物, 25(5):431-436.]
ZHU YZ, 2012. Studies on Luohanguoinfecting Zucchihi yellow mosaic virus and genetic transformation system for Luohanguo [D]. Nanning:Guangxi University:71-92. [朱英芝, 2012. 小西葫芦黄化花叶病毒罗汉果分离株及转基因罗汉果的研究 [D]. 南宁:广西大学:71-92.]
ZIETKIEWICZ E, RAFALSKI A, LABUDA D, 1994. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification [J]. Genomics, 20(2):176-183.

