结肠腺瘤癌变过程中MTA1、RECK的表达及意义
陈现亮,吴义娟,吕 卓,赵慧敏,韩宝娟
·短篇论著·
结肠腺瘤癌变过程中MTA1、RECK的表达及意义
陈现亮,吴义娟,吕 卓,赵慧敏,韩宝娟
目的 分析MTA1、RECK在结肠腺瘤及结肠癌组织中的表达,探讨MTA1、RECK在结肠腺瘤癌变过程中的作用。方法 应用免疫组化SABC法检测104例结肠癌组织、114例结肠腺瘤组织、30例正常结肠组织中MTA1、RECK蛋白表达,并复习相关文献。结果 正常结肠组织、管状腺瘤、绒毛状腺瘤至结肠癌组织中MTA1的阳性率呈逐渐增高趋势(P<0.05);结肠腺瘤(中重度异型增生)组中MTA1的阳性率高于结肠腺瘤(轻度异型增生)组(P<0.05);MTA1在结肠癌中的阳性率随肿瘤临床Dukes分期的提高、淋巴结转移及肿瘤分化程度的降低而升高(P<0.05)。RECK在正常结肠组织、管状腺瘤、绒毛状腺瘤、结肠癌组中的阳性率分别为100%、78.57%、77.27%、53.85%;正常结肠组织、管状腺瘤、绒毛状腺瘤至结肠癌组中RECK的阳性率呈逐渐降低趋势;中重度异型增生结肠腺瘤组中RECK的阳性率明显低于轻度异型增生结肠腺瘤组,差异有统计学意义(P<0.05);RECK在结肠癌中的阳性率随肿瘤临床Dukes分期的提高、淋巴结转移及肿瘤分化程度的降低而降低(P<0.05)。结论 结肠癌组织中MTA1呈高表达,RECK表达缺失。MTA1、RECK参与正常组织、癌前病变、癌组织的发生、发展,在结肠腺瘤的癌变过程中起着重要作用。
结肠肿瘤;结肠癌;结肠腺瘤;MTA1;RECK
结肠腺瘤是一种结肠良性肿瘤,被认为是结肠癌的癌前病变,腺瘤的病理类型与腺瘤恶变密切相关,积极诊断和治疗结肠腺瘤是控制、减少结肠癌发病的重要途径。但目前有关结肠腺瘤癌变的机制研究较少,且其具体机制尚不明确[1-2]。近年来许多研究结果显示MTA1、RECK与多种恶性肿瘤的发生、发展、浸润和转移密切相关[3-5]。因此研究结肠癌的早期肿瘤标志物成为热点,这些研究将有助于对结肠癌的早期临床诊断、预后评价并且为进一步探讨结肠癌的发病机制提供依据。本实验采用免疫组化法对不同病理类型结肠腺瘤及结肠癌中MTA1、RECK的表达进行检测,探讨其在结肠腺瘤癌变过程中的作用,对预测结肠腺瘤的癌变可能性及化学干预有重要意义。
1 材料与方法
1.1 临床资料 收集2010~2015年邢台市人民医院肿瘤外科手术切除的104例结肠腺癌标本,由两位高年资病理科医师严格按WHO(2000)消化系统肿瘤标准明确诊断,并根据其制定的病理标准进行分级。全部病例术前均未行化疗或放疗。患者年龄31~83岁,男性79例,女性25例,有淋巴结转移者60例,无淋巴结转移者44例,按Dukes分期中国改良法分期标准:A+B期44例,C+D期60例;并按WHO(2000)结直肠癌组织学分类标准:高+中分化80例,低分化24例。肠镜活检及切除结肠腺瘤标本114例,年龄28~74岁,其中男性82例,女性32例,结直肠腺瘤组依据其伴上皮内病变的程度分为轻度异型增生组82例、中重度异型增生组32例,根据其组织学类型分为管状腺瘤70例、绒毛状腺瘤44例。正常结肠组织30例,年龄24~70岁,男性18例,女性12例。
1.2 方法 免疫组化染色按SABC试剂盒操作说明书进行。鼠抗人MTA1单克隆抗体(1C3)购自美国Santa Cruz公司,工作浓度为1 ∶100。羊抗鼠辣根过氧化物酶标记二抗;兔抗人RECK单克隆抗体(D8C7)购自福州迈新公司,工作浓度为即用型;防脱片剂APES及DAB显色剂均购自北京中杉金桥公司;以PBS代替一抗作为阴性对照,用已知阳性切片作为阳性对照。
1.3 结果判断 MTA1蛋白定位于细胞核,呈棕黄色颗粒为阳性;RECK蛋白定位于胞质或胞核呈棕黄色着色为阳性。结果判定:所有病理染色标本均由两名病理医师判断,判断标准:染色强度按棕色深浅可分为0分、1分、2分及3分,按阳性细胞比例范围分为(0)0分、(0~30%)1分、(30%~60%)2分和(>60%)3分;最后将两项得分结果相加:0~2分为阴性,3~6分为阳性。
1.4 统计学处理 采用SPSS 13.0软件进行统计学分析,数据应用χ2检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 MTA1、RECK在不同结肠组织中的表达 MTA1在正常结肠组织、管状腺瘤、绒毛状腺瘤、结肠癌组织中的阳性率分别为6.67%、42.85%、63.64%、84.61%(图1)。MTA1在结肠癌与绒毛状腺瘤间的阳性率差异有统计学意义(P<0.05),在绒毛状腺瘤与管状腺瘤间的阳性率差异有统计学意义(P<0.05),在管状腺瘤与正常结肠组织间的阳性率差异有统计学意义(P<0.05),由此可见MTA1在正常结肠组织、管状腺瘤、绒毛状腺瘤至结肠癌中的阳性率呈逐渐增高趋势(表1)。RECK在正常结肠组织、管状腺瘤、绒毛状腺瘤、结肠癌组中的阳性率分别为100%、78.57%、77.27%、53.85%(图2)。RECK在结肠癌与绒毛状腺瘤间的阳性率差异有统计学意义(P<0.05),在绒毛状腺瘤与管状腺瘤间的阳性率差异有统计学意义(P<0.05),在管状腺瘤与正常结肠组织间的阳性率差异有统计学意义(P<0.05),由此可见RECK在正常结肠组织、管状腺瘤、绒毛状腺瘤至结肠癌中的阳性率呈逐渐降低趋势(表1)。
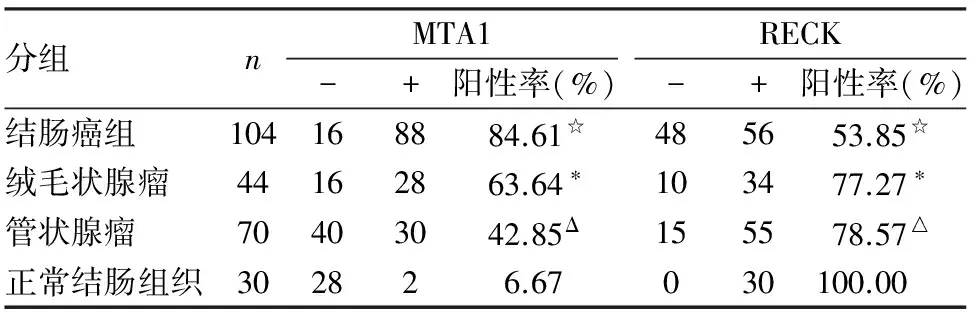
表1 MTA1、RECK在不同结肠组织中的表达
结肠癌与绒毛状腺瘤、管状腺瘤及正常结肠组相比,☆P<0.05;绒毛状腺瘤与管状腺瘤、正常结肠组织相比,*P<0.05;管状腺瘤与正常结肠组织相比,△P<0.05
2.2 MTA1、RECK在结肠腺瘤癌变过程中的表达 在结肠腺瘤中MTA1的阳性率分别为39.02%(轻度异型增生)、81.25%(中重度异型增生),差异有统计学意义(P<0.05)。RECK在轻度异型增生结肠腺瘤、中重度异型增生结肠腺瘤中的阳性率分别为90.24%、46.88%,中重度异型增生结肠腺瘤中RECK阳性率明显低于轻度异型增生结肠腺瘤,差异有统计学意义(P<0.05,表2)。

表2 MTA1、RECK在结肠腺瘤癌变过程中的表达
与轻度异型增生相比,*P<0.05
2.3 MTA1、RECK表达与结肠癌临床病理特征的关系 MTA1在结肠癌中的阳性率随肿瘤临床Dukes分期的提高及肿瘤分化程度的降低而升高(P<0.05)。有淋巴结转移组(Dukes C+D组)明显高于无淋巴结转移组(Dukes A+B组),差异有统计学意义(P<0.05)。MTA1表达与结肠癌患者年龄、性别无关(P>0.05)。RECK在结肠癌中的阳性率随肿瘤临床Dukes分期的提高、淋巴结转移及肿瘤分化程度的降低而降低(P<0.05)。在有淋巴结转移组(Dukes C+D组)明显低于无淋巴结转移组(Dukes A+B组),差异有统计学意义(P<0.05)。RECK表达与结肠癌患者年龄、性别无关(P>0.05,表3)。
3 讨论
MTA1是1993年Pencil等[6]应用差异杂交技术从具有转移潜能的鼠乳腺癌细胞株13762NF中筛选克隆出来的基因,其通过影响染色质的状态来调节转录,调控组蛋白脱乙酰基从而发挥其生物学作用。MTA1是MTA家族的一员,其与肿瘤的侵袭和转移密切相关[7]。MTA1是一种关键的癌蛋白,有研究显示MTA1在人类肿瘤中表达上调,其高表达与肿瘤的高侵袭特征如高病理分级、血管形成和预后不良等相关。MTA1可能通过以下机制在肿瘤发展进程中发挥作用:(1)MTA1基因与组蛋白去乙酰化酶结合重塑染色质的结构,实现转录相关蛋白的下调[8];(2)MTA1基因能够改变细胞角蛋白纤维系统,使细胞获得更强的侵袭及转移特征[9]。张金龙等[10]采用免疫组化法检测结肠癌中MTA1的表达,结果显示结肠癌组织及转移组织中MTA1细胞质染色强度均显著高于正常组织,MTA1在细胞质的表达强度与临床分期呈正相关,生存时间<5年的结直肠癌患者的肿瘤组织细胞质内MTA1的表达强度显著高于生存时间≥5年的患者组织,提示结肠癌中MTA1细胞质过表达者预后不良。本实验结果显示正常结肠组织、管状腺瘤、绒毛状腺瘤至结肠癌中MTA1阳性率呈逐渐上升趋势,且中重度异型增生结肠腺瘤中MTA1阳性率明显高于轻度异型增生结肠腺瘤,MTA1在结肠癌中的阳性率随肿瘤临床Dukes分期的提高、淋巴结转移及肿瘤分化程度的降低而升高,与张金龙等的研究结果一致。提示MTA1高表达是结肠癌发生的早期事件,MTA1在结肠腺瘤癌变过程中发挥一定的作用。

①A①B①C②A②B②C
图1 MTA1的表达:A.正常结肠黏膜中阴性;B.结肠癌中阳性;C.结肠腺瘤中阳性,SABC法 图2 RECK的表达:A.正常结肠黏膜中阳性;B.结肠癌中阴性;C.结肠腺瘤中阳性;SABC法
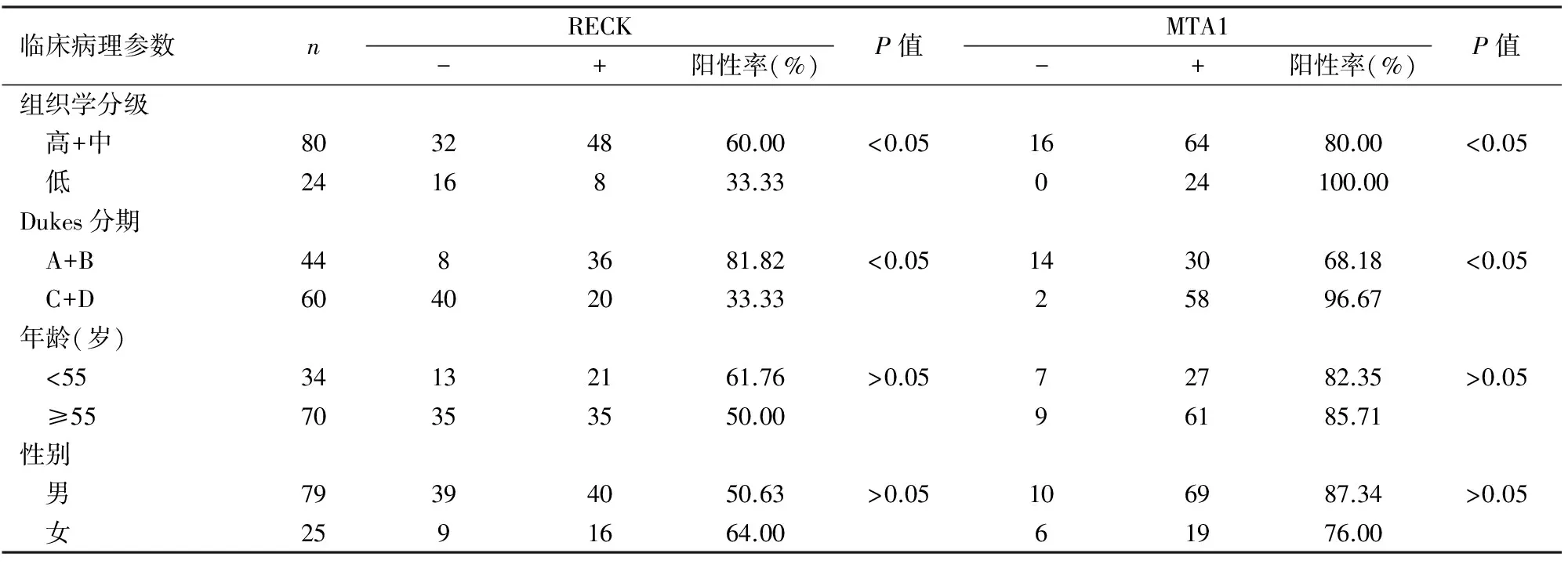
表3 MTA1、RECK表达与结肠癌临床病理特征的关系
RECK基因是1998年日本学者Takahashi等[11]在v-Kiras转染的NIH3T3细胞中发现的一种新的肿瘤抑制基因,其具有抑制基质金属蛋白酶表达与活性的功能。Morioka等[12]研究表明,RECK基因表达缺失的细胞周围黏连斑不能形成,细胞间连接遭受破坏;而对稳定细胞微管系统有显著作用的谷氨酸微管蛋白水平显著降低,明胶溶解功能增加,纤维粘连蛋白减少;同时,RECK基因表达降低的成纤维细胞在迁移过程中,其细胞极性消失,细胞定向迁移的稳定性显著减弱而迁移速度却明显增加。这说明RECK对于细胞形成和维持合适的细胞-细胞基质间粘连以及细胞的定向迁移具有调节作用;而在恶性肿瘤中,由于RECK基因表达缺失,这一功能被弱化。同时,RECK能在转录后水平抑制至少3种MMPs,即MMP-2、MMP-9及MTI-MMP,进而抑制肿瘤的血管形成及转移。近年来,研究显示RECK基因参与许多肿瘤的发生、发展,这些肿瘤包括肺癌、肝癌、头颈部鳞状细胞癌、乳腺癌及膀胱异型细胞癌等[13-14]。并且该基因与恶性肿瘤的浸润、转移和预后密切相关。本组实验结果显示正常结肠组织、管状腺瘤、绒毛状腺瘤至结肠癌中RECK阳性率呈逐渐降低趋势,且中重度异型增生结肠腺瘤中RECK阳性率明显低于轻度异型增生结肠腺瘤。RECK在结肠癌中的阳性率随肿瘤临床Dukes分期的提高、淋巴结转移及肿瘤分化程度的降低而降低。在有淋巴结转移组(Dukes C+D组)明显低于无淋巴结转移组(Dukes A+B组),差异有统计学意义。韩兵等[15]研究发现,RECK在结肠癌组织中的阳性率低于正常结肠组织。RECK表达与结肠癌浸润层次、淋巴结转移、Dukes分期呈明显负相关,与本组实验结果一致。由此可见MTA1、RECK参与正常组织、癌前病变、癌组织的发生、发展,在结肠腺瘤的癌变过程中起着重要作用。MTA1、RECK可能成为结肠癌基因治疗的靶点之一,为结肠腺瘤癌变的早期预防和临床靶向治疗提供科学依据。
[1] 李 慧, 陈 吉, 崔 宏. 结肠腺瘤癌变研究进展[J]. 亚太传统医药, 2009,5(11):163-165.
[2] 吴文新, 刘惠民, 孟嫦娟, 等.WNK2及MEK-1、ERK1/2在散发性结肠管状腺瘤癌变过程中的表达及意义[J]. 肿瘤防治研究, 2013,40(2):155-158.
[3] Ohshiro K, Kumar R. MTA1 regulation of ERβ pathway in salivary gland carcinoma cells[J]. Biochem Biophys Res Commun, 2015,464(4):1016-1021.
[4] Toh Y, Nicolson G L. Properties and clinical relevance of MTA1 protein in human cancer[J]. Cancer Metastasis Rev, 2014,33(4):891-900.
[5] Leite K R, Reis S T, Viana N,etal. Controlling RECK miR21 promotes tumor cell invasion and is related to biochemical recurrence in prostate cancer[J]. J Cancer, 2015,6(3):292-301.
[6] Pencil S D, Toh Y, Nicolson G L. Candidate metastasis-associated genes of the rat 13762NF mammary adenocarcinoma[J]. Breast Cancer Res Treat, 1993,25(2):165-174.
[7] Kai L, Wang J, Ivanovic M,etal. Targeting prostate cancer angiogenesis through metastasis-associated protein 1 (MTA1)[J]. Prostate, 2011,71(3):268-280.
[8] Kumar R, Wang R A, Bagheri-Yarmand R. Emerging roles of MTA family members in human cancers[J]. Semin Oncol, 2003,30(5 Suppl 16):30-37.
[9] Hofer M D, Menke A, Genze F,etal. Expression of MTA1 promotes motility and invasiveness of PANC-1 pancreatic carcinoma cells[J]. Br J Cancer, 2004,90(2):455-462.
[10] 张金龙, 王海娟, 刘 健, 等. 结肠癌组织中MTA1的表达水平及定位与患者预后的相关性研究[J]. 癌症进展, 2012,10(3):216-220.
[11] Takahashi C, Sheng Z, Horan T P,etal. Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membraneanchored glycoprotein RECK[J]. Proc Natl Acad Sci USA, 1998,95(22):13221-13226.
[12] Morioka Y, Monypenny J, Matsuzaki T,etal. The membrane-anchored metalloproteinase regulator RECK stabilizes focal adhesions and anterior-posterior polarity in fibroblasts[J]. Oncogene, 2009,28(11):1454-1464.
[13] Lei L, Huang Y, Gong W. Inhibition of miR-92b suppresses nonsmall cell lung cancer cells growth and motility by targeting RECK[J]. Mol Cell Biochem, 2014,387(1-2):171-176.
[14] Gomes L R, Fujita A, Mott J D,etal. RECK is not an independent prognostic marker for breast cancer[J]. BMC Cancer, 2015,8(15):660.
[15] 韩 兵, 孙 威. 血管内皮生长因子C和RECK在结肠癌组织中的表达及意义[J]. 中国医学工程, 2015,23(3):14-15.
邢台市科技支撑计划项目(2014ZC157)
河北医科大学附属邢台市人民医院消化内科,邢台 054000
陈现亮,男,硕士,主治医师。Tel: (0319)3286143, E-mail: 125569317@qq.com
时间:2017-4-17 18:19
http://kns.cnki.net/kcms/detail/34.1073.R.20170417.1819.018.html
R 735.3
A
1001-7399(2017)04-0432-04
10.13315/j.cnki.cjcep.2017.04.018
接受日期:2017-01-13

