Akt和SRC在Exosomes促进同源肺癌细胞增殖中的作用
解世林,曲晶磊,范一博,车晓芳,侯科佐,曲秀娟,刘云鹏,王晓楠,康健,胡雪君
(中国医科大学附属第一医院1.呼吸疾病研究所老年病呼吸感染科;2.肿瘤内科,辽宁省抗肿瘤药物与生物治疗重点实验室;3.呼吸疾病研究所呼吸内科,沈阳110001)
·论著·
Akt和SRC在Exosomes促进同源肺癌细胞增殖中的作用
解世林1,曲晶磊2,范一博2,车晓芳2,侯科佐2,曲秀娟2,刘云鹏2,王晓楠1,康健3,胡雪君1
(中国医科大学附属第一医院1.呼吸疾病研究所老年病呼吸感染科;2.肿瘤内科,辽宁省抗肿瘤药物与生物治疗重点实验室;3.呼吸疾病研究所呼吸内科,沈阳110001)
目的探索肺癌细胞分泌的Exosomes对其分泌细胞及其同源肿瘤细胞增殖的影响,以及PI3K/Akt和SRC信号通路在其中的作用。方法采用密度梯度离心法从肺癌A549细胞的上清液中提取Exosomes,透射电子显微镜法观察Exosomes的形态,Western blotting法检测Exosomes标志蛋白的表达,MTT法检测细胞的增殖能力。结果A549细胞来源的Exosomes的直径在30~100 nm之间,由双层膜构成。Western blotting检测到Exosomes中CD9的表达,且A549细胞来源的Exosomes以剂量和时间依赖性的方式促进其自身及同源肿瘤细胞HCC827细胞的增殖,并伴随Akt和SRC的活化。结论肺癌A549细胞来源的Exosomes以时间和剂量依赖性促进其自身及同源肿瘤细胞的增殖,其机制可能与Akt和SRC的活化有关。
Exosomes;增殖;肺癌;Akt;SRC
肿瘤细胞来源的Exosomes是由肿瘤细胞分泌至胞外的小囊泡。肿瘤细胞分泌的Exosomes携带许多与其功能相关的蛋白质及核酸[1]。有研究[2]发现,肿瘤细胞分泌的Exosomes能够促进肿瘤细胞的增殖。然而,Exosomes能否影响其分泌细胞及同源肿瘤细胞的增殖能力及其机制尚不清楚。本研究探讨了人肺腺癌细胞A549分泌的Exosomes对自身及同源肿瘤细胞HCC827增殖能力的影响,以及PI3K/Akt和SRC通路在其过程中的作用。研究结果为进一步探究肺癌来源的Exosomes对肿瘤细胞调控增殖的机制提供了新方向。
1 材料与方法
1.1 材料
1.2 细胞培养
人肺腺癌细胞系A549和HCC827购自上海细胞库。A549、HCC827细胞生长于含有12 U/L庆大霉素、10%灭活胎牛血清的RPMI1640培养液中,5% CO2孵育箱内培养,每2~3 d传代1次。所有实验均采用对数生长期细胞。
1.3 Exosomes的制备
收集培养48 h后的肺癌A549细胞上清液,用于提取Exosomes。首先,收集的细胞上清液,在4℃条件下,通过300g5 min、2 000g20 min、10 000g70 min等步骤离心,去除细胞及细胞碎片。然后,将上清液移入高速离心管中,100 000g120 min。离心管中加满PBS溶液,再次4℃100 000g120 min离心。得到提纯的Exosomes沉淀。PBS 450 μL重悬,0.22 μm滤膜除菌,Bardford法测定蛋白含量,分装后,-80℃保存备用。
1.4 电镜
Exosomes超速离心成的沉淀,于4℃经固定液(2%多聚甲醛,2.5%戊二醛)固定1 h,PBS洗涤后,再经l%锇酸固定,梯度乙醇脱水,环氧树脂包埋。最后超薄切片、铅铀染色,于透射电子显微镜下观察并摄片。
1.5 Western blotting检测蛋白表达
会务组联系方式:0351-4557677;4557096;4557076;4557660;4084788(传真);(0)18636869413;(0)15935617064;quanguomhg@126.com;mhgqk@126.com;lhg66625@126.com。
提取A549细胞来源的Exosomes,经超声破碎后加入上样缓冲液,煮沸5 min。不同浓度的(0 μg/mL、5 μg/mL和20 μg/mL)Exosomes作用于对数生长期的A549细胞48 h后,同时收集各组的A549细胞,将其裂解,与3×样品缓冲液混合后,煮沸5 min。将Exosomes样品和A549细胞裂解物进行聚丙烯酰胺(SDS-PAGE)凝胶电泳,湿法转印至硝酸纤维素膜上。5%脱脂牛奶封闭1 h后,分别加入一抗,4℃过夜,以辣根过氧化物酶标记的羊抗鼠IgG作为二抗,室温孵育30 min,ECL法显色,图像分析并处理。
1.6 MTT法检测细胞的增殖能力
取对数生长期的A549或HCC827细胞胰酶消化,以0.45×104/孔或0.55×104/孔的细胞接种于96孔板,分别加入终浓度为5和20 μg/mL的A549细胞来源的Exosomes。设置空白及正常对照组(空白组不加细胞,正常对照组不加Exosomes,其余均与Exosomes实验组同样处理)。分别培养48 h和72 h后每孔加入MTT溶液(5 mg/mL)20 μL,继续培养4 h后吸弃上清,每孔加入200 μL DMSO,振荡摇匀后,于570 nm波长下记录吸光度值。按下列公式计算细胞增殖率:增殖率(%)=(处理组平均吸光度值-空白组平均吸光度值)/(对照组平均吸光度值-空白组平均吸光度值)×100%。
1.7 统计学分析
采用SPSS 16.0统计软件进行数据分析。所得数据均为3次独立实验结果,以x±s表示。2组之间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 提取A549细胞来源的Exosomes
透射电子显微镜下观察,肺癌A549细胞来源的Exosomes为双层膜的圆盘状结构,直径30~100 nm(图1A)。利用Western blotting检测Exosomes与等量的A549细胞裂解物相比,蛋白表达的差异。Western blotting结果显示,Exosomes富含外泌体标志性蛋白CD9(图1B)。

图1 肺腺癌A549细胞来源的Exosomes的验证×50 000Fig.1 Validation of Exosomes isolated from A549 lung adenocarcinoma cells×50 000
2.2 肺癌细胞A549来源的Exosomes促进其分泌细胞增殖
MTT法检测Exosomes作用于A549细胞后,细胞增殖能力的变化。结果显示,A549细胞来源的Exosomes作用于其自身48 h和72 h后,细胞的增殖能力以剂量和时间依赖的方式增强(P<0.05),提示Exosomes可促进其分泌细胞的增殖,见图2。
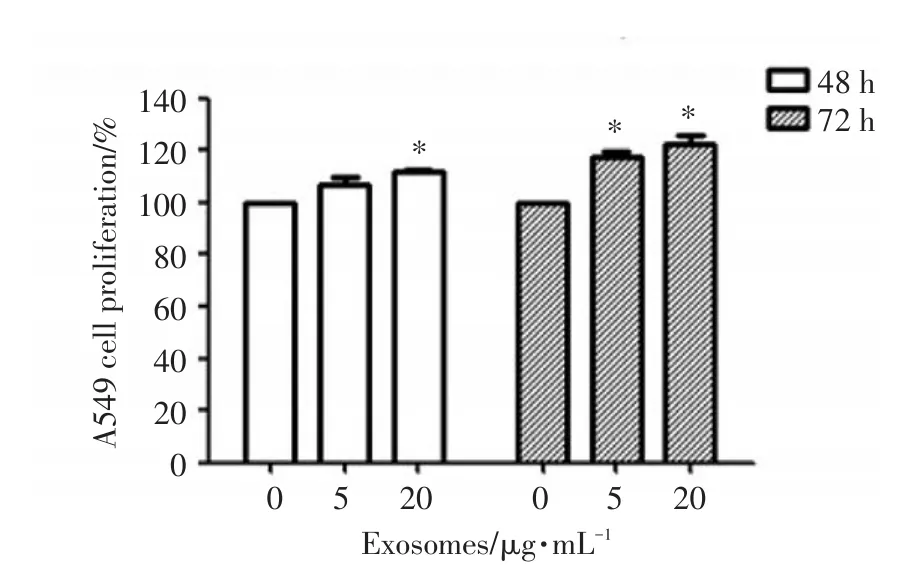
图2 A549来源的Exosomes促进A549细胞增殖Fig.2 Plot depicting the proliferation of A549 cells using varying concentrations of Exosomes
2.3 A549来源的Exosomes促进同源肺癌细胞HCC827的增殖
将5μg/mL、20μg/mL的Exosomes作用于HCC827细胞48 h及72 h后,MTT结果显示HCC827细胞增殖能力以时间和剂量依赖的方式增强(P<0.05)。结果提示,A549细胞来源的Exosomes可促进同源肿瘤细胞的增殖,见图3。

图3 A549来源的Exosomes促进HCC827细胞增殖Fig.3 Plot depicting the proliferation of HCC827 cells using varying concentrations of Exosomes
2.4 Exosomes诱导其分泌细胞中Akt和SRC的活化
Western blotting法检测5 μg/mL、20 μg/mL的Exosomes作用A549细胞24 h和48h后,Akt、SRC的表达水平的变化。结果表明,Exosomes作用于A549细胞后,phosph-Akt和phosph-SRC以时间和剂量依赖性的方式上调,见图4。

图4 Exosomes处理A549细胞后对Akt、SRC活性的影响Fig.4 Activity of Akt and SRC after treatment of the A549 cells with the Exosomes
3 讨论
Exosomes是由细胞主动分泌至胞外的囊性小泡,携带其来源细胞的蛋白和核酸,介导细胞间的信息交流,促进肿瘤的增殖及转移等多种过程[3-5]。已有研究报道,肺癌来源的Exosomes能够促进肿瘤细胞增殖。然而,其是否能促进其分泌细胞自身和同源肿瘤细胞的增殖及其机制尚不明确。
Exosomes能通过自分泌及旁分泌方式影响肿瘤微环境,从而促进多种实体瘤细胞的增殖[2]。肺癌细胞分泌的ExosomalhTERT mRNA进入纤维母细胞,促进纤维母细胞增殖、延迟其衰老,改变了肿瘤微环境[6]。肺癌细胞中YKT6可通过促进Exosomes的分泌,促进肺癌的增殖和转移[7]。另有文献[8]报道,肺癌细胞来源的Exosomal miR-302b可通过抑制TGFβRⅡ促进肺癌的增殖与迁移。然而,肺癌来源的Exosomes是否可影响其分泌细胞及其同源肿瘤细胞的增殖尚不明确。本研究结果显示,将A549细胞来源的Exosomes作用于其自身及同源肿瘤细胞HCC827后,2种细胞的增殖能力明显增强,提示肺癌细胞来源的Exosomes可以促进其分泌细胞及其同源肿瘤细胞的增殖。
近年研究[9-13]发现,Exoxomes能够通过Akt或SRC信号的活化,促进膀胱癌、胃癌、肾癌等肿瘤细胞的增殖。有研究[14]显示,肺癌细胞中GTPase促进Exosomes的释放且可激活AKT/GSK3β通路,促进肿瘤的进展。然而Akt和SRC是否促进其自身和同源肿瘤细胞的增殖尚不清楚。
在本研究中,A549细胞分泌的Exosomes通过诱导其自身细胞Akt和SRC的活化,促进其增殖能力的增强,提示Akt和SRC是Exosomes促进肿瘤细胞增殖的重要分子之一。
综上所述,肺癌细胞来源的Exosomes既能促进其分泌细胞增殖,亦能够促进同源肿瘤细胞的增殖。其机制可能与Akt和SRC信号的激活相关。本研究进一步阐明了Exosomes促进肺癌发展的机制,为治疗肺癌提出了新的方向。
[1]EITAN E,SUIRE C,ZHANG S,et al.Impact of lysosome status on extracellular vesicle content and release[J].Ageing Res Rev,2016,32:65-74.DOI:10.1016/j.arr.2016.05.001.
[2]WU L,ZHANG X,ZHANG B,et al.Exosomes derived from gastric cancer cells activate NF-κB pathway in macrophages to promote cancer progression[J].Tumour Biol,2016,37(9):12169-12180. DOI:10.1007/s13277-016-5071-5.
[3]VALLABHANENI KC,PENFORNIS P,DHULE S,et al.Extracellular vesicles from bone marrow mesenchymal stem/stromal cells transport tumor regulatory microRNA,proteins,and metabolites[J].Oncotarget,2015,6(7):4953-4967.DOI:10.18632/oncotarget.3211.
[4]RAHMAN MA,BARGER JF,LOVAT F,et al.Lung cancer exosomes as drivers of epithelial mesenchymal transition[J].Oncotarget,2016,7(34):54852-54866.DOI:10.18632/oncotarget.10243.
[5]XU W,YANG Z,LU N.From pathogenesis to clinical application:insights into exosomes as transfer vectors in cancer[J].J Exp Clin Cancer Res,2016,35(1):156.DOI:10.1186/s13046-016-0429-5.
[6]GUTKIN A,UZIEL O,BEERY E,et al.Tumor cells derived exosomes contain hTERT RNA and transform nonmalignant fibroblasts into telomerase positive cells[J].Oncotarget,2016,7(37):59173-59188.DOI:10.18632/oncotarget.10384.
[7]RUIZ-MARTINEZ M,NAVARRO A,MARRADES RM,et al. YKT6 expression,exosome release,and survival in non-small cell lung cancer[J].Oncotarget,2016,7(32):51515-51524.DOI:10.18632/oncotarget.9862.
[8]LI J,YU J,ZHANG H,et al.Exosomes-derived MiR-302b suppresses lung cancer cell proliferation and migration via TGFβRII inhibition[J].Cell Physiol Biochem,2016,38(5):1715-1726.DOI:10.1159/000443111.
[9]BECKLER MD,HIGGINBOTHAM JN,FRANKLIN JL,et al.Proteomic analysis of exosomes from mutant KRAS colon cancer cells identifies intercellular transfer of mutant KRAS[J].Mol Cell Proteomics,2013,12(2):343-355.DOI:10.1074/mcp.M112.022806.
[10]YANG L,WU XH,WANG D,et al.Bladder cancer cell-derived exosomes inhibit tumor cell apoptosis and induce cell proliferation in vitro[J].Mol Med Rep,2013,8(4):1272-1278.DOI:10.3892/ mmr.2013.1634.
[11]QU JL,QU XJ,ZHAO MF,et al.Gastric cancer exosomes promote tumour cell proliferation through PI3K/Akt and MAPK/ERK activation[J].Dig Liver Dis,2009,41(12):875-880.DOI:10.1016/j. dld.2009.04.006.
[12]杨林,吴小候,罗春丽,等.肾癌ACHN细胞exosome对自身细胞增殖和凋亡的影响[J].南方医科大学学报,2012,32(10):1498-1502.DOI:10.3969/j.issn.1673-4254.2012.10.026.
[13]DERITA RM,ZERLANKO B,SINGH A,et al.c-Src,insulin-like growth factor I receptor,G-protein-coupled receptor kinases and focal adhesion kinase are enriched into prostate cancer cell Exosomes[J].J Cell Biochem,2016,118(1):66-73.DOI:10.1002/ jcb.25611.
[14]YANG J,LIU W,LU X,et al.High expression of small GTPase Rab3D promotes cancer progression and metastasis[J].Oncotarget,2015,6(13):11125-11138.DOI:10.18632/oncotarget.3575.
(编辑 于溪)
Role of Akt and SRC Pathways in Exosome-mediated Proliferation of Homologous Lung Adenocarninoma Cells
XIE Shilin1,QU Jinglei2,FAN Yibo2,CHE Xiaofang2,HOU Kezuo2,QU Xiujuan2,LIU Yunpeng2,WANG Xiaonan1,KANG Jian3,HU Xuejun1
(1.Institute of Respiratory Disease,Department of Respiratory and Infectious Disease of Geriatrics,The First Hospital,China Medical University,Shenyang 110001,China;2.Department of Medical Oncology,Key Laboratory of Anticancer Drugs and Biotherapy of Liaoning Province,The First Hospital,China Medical University,Shenyang 110001,China;3.Institute of Respiratory Disease,Department of Respiratory Medicine,The First Hospital,China Medical University,Shenyang 110001,China)
Objective To explore the effect of Exosomes isolated from the A549 lung cancer cells on the proliferation of these cells and their homologous tumor cells,HCC827,and the role of the PI3K/Akt and SRC signaling pathways in this process.MethodsExosomes were isolated from the supernatant after density gradient centrifugation of A549 cells.The Exosomes morphology was observed by transmission electron microscopy. The expression of the Exosome-specific proteins was analyzed using Western blotting.Cell proliferation was investigated using the MTT assay.ResultsThe A549-derived Exosomes were 30-100 nm in diameter and had a bilayer membrane.Western blotting showed that CD9 was detected in these Exosomes.The isolated Exosomes promoted the proliferation of the A549 and the HCC827 cells in a dose-and time-dependent manner,accompanied by the activation of Akt and SRC.ConclusionExosomes isolated from A549 cells promote the proliferation of the secreting cells and the homologous tumor cells in a dose-and time-dependent manner.The mechanism may be related to the activation of Akt and SRC.
Exosomes;lung cancer;proliferation;Akt;SRC
R734.2
A
0258-4646(2017)06-0481-04
10.12007/j.issn.0258-4646.2017.06.001
国家自然科学基金(81372546,81472193);辽宁省科学技术计划(2014226033,2014225013,L2014296);辽宁省教育厅重点实验室基础研究项目(LZ2014037)
解世林(1987-),女,助教,硕士.
胡雪君,E-mail:huxuejun2008@hotmail.com
2016-10-25
网络出版时间:

