CDP参与凋亡过程中远程调控元件mbr对于凋亡相关基因的转录调控作用
蒋葭葭, 杨 音, 孙玉洁
(南京医科大学, 1. 江苏省人类功能基因组学重点实验室; 2. 细胞生物学系, 江苏 南京, 210029)
论 著
CDP参与凋亡过程中远程调控元件mbr对于凋亡相关基因的转录调控作用
蒋葭葭1, 2, 杨 音1, 2, 孙玉洁1, 2
(南京医科大学, 1. 江苏省人类功能基因组学重点实验室; 2. 细胞生物学系, 江苏 南京, 210029)
目的 研究凋亡过程中SATB1降解后, CDP能否代替SATB1参与BCL2和NOXA的转录。方法 在Jurkat细胞中过表达CDP, Real-time PCR检测BCL2和NOXA的转录。EMSA检测mbr元件和NOXA-SBS1上蛋白复合物的变化。结果 在Jurkat细胞中, mbr元件和NOXA-SBS1上均存在SATB1蛋白,当SATB1和CDP比例改变后, mbr元件上SATB1蛋白复合物消失,取而代之的是CDP蛋白复合物。CDP可以促进NOXA的转录,抑制BCL2的转录。结论 SATB1与其同源异型蛋白CDP的比例变化可直接改变mbr 增强子上蛋白复合物的组成。
远程调控元件mbr; BCL2; NOXA; CDP
细胞凋亡是一种受基因调控的生物学过程,可以由促凋亡和抗凋亡蛋白的比例来调节[1]。BCL2家族成员包含抗凋亡和促凋亡两类功能相反的蛋白质,是细胞中一组重要的凋亡调节蛋白, BCL2家族蛋白表达水平与比例是决定细胞命运的极为重要的因素, BCL2家族蛋白比例的改变也是决定肿瘤对凋亡刺激反应的关键因素[2]。作者的前期研究结果发现,位于BCL2基因3′非翻译区(3′-UTR)的主要断裂点区(mbr)是一个正向调控元件,能够显著增强上游200 kb处BCL2基因启动子的转录活性[3]。mbr对BCL2基因的远程调控功能依赖于SATB1蛋白介导的mbr-BCL2启动子相互作用(BCL2染色质环)以及mbr上SATB1蛋白复合物的组成。核基质附着蛋白SATB1是一个具有蛋白平台功能的转录因子, SATB1是细胞在凋亡反应中调节BCL2染色质环高级结构的动态变化的关键因素[4]。因此,细胞内SATB1蛋白水平的变化有可能是改变同一远程调控元件与不同靶基因启动子相互作用的重要因素[5]。SATB1介导的BCL2染色质环动态变化是细胞在早期凋亡反应中调节BCL2基因转录活性的关键环节。
作者还发现位于BCL2基因下游3.4Mb的NOXA促凋亡基因启动子区有SATB1结合序列。NOXA基因是mbr的另一靶基因,在人T细胞性白血病细胞(Jurkat)早期凋亡反应中, SATB1蛋白降解后从mbr、BCL2启动子区和NOXA启动子区上脱落,同时mbr与BCL2基因启动子相互作用显著减弱和BCL2基因转录活性的下调, mbr元件与NOXA基因启动子的相互作用显著增强并且NOXA基因转录活性大幅上调[6]。上述结果表明, mbr元件可选择性地调节BCL2和NOXA这两个功能相拮抗的靶基因的转录,协调两者的表达水平, mbr元件的这一功能依赖于mbr-BCL2和mbr-NOXA染色质环动态转换。
1 材料与方法
1.1 材料
anti-SATB1抗体(由美国City of Hope医学中心馈赠), anti-CDP抗体(Santa Cruz Biotechnology公司,美国), anti-β-Actin抗体(Sigma Chemical公司,美国), HRP标记的抗羊、抗兔、抗小鼠IgG(北京中杉,中国), Trizol(Invitrogen Life Technologies公司,美国),反转录试剂盒(ABI公司,美国), SYBR Green Realtime PCR Master Mix(Toyobo公司,日本), NE-PER®细胞核和细胞浆抽提试剂盒(Pierce公司,美国)。人白血病T淋巴细胞系Jurkat培养于含有10%新生牛血清、10 mmol/L HEPES、1 mmol/L丙酮酸钠、100 U/mL青霉素和100 U/mL链霉素的RPMI-1640培养液中,于37 ℃、5% CO2培养箱中培养,培养密度为(0.2~1.0)×106个/mL。
1.2 方法
1.2.1 RNA提取和RT-PCR实验:当细胞密度长至6×106个/mL时,吸取培养基,离心, PBS洗细胞1次,每孔加入1 mL Trizol裂解细胞,按照RNA提取步骤提取细胞总RNA。用逆转录试剂盒逆转录生成cDNA, 再进行real-time PCR反应。引物如下: BCL2-RTN-FTCGCCCTGTGGATGACTGAG; BCL2-RTN-RCAGAGTCTTCAGAGACAGCC
AGGA。NOXA-RTN-FGCAGAGCTGGAAGTCGAG
TGT; NOXA-RTN-RCTCTTTTGAAGGAGTCCCCTC
AT。Actin-RTN-FTCATGAAGTGTGACGTGGACAT;
Actin-RTN-RCTCAGGAGGAGCAATGATCTTG。
1.2.2 总蛋白提取及Western Blot分析:首先用预冷的三去污裂解液裂解细胞,用BCA蛋白测定试剂盒测定蛋白质浓度。制备8%~12%的SDS-PAGE凝胶,加入等量的蛋白质电泳后电转至PVDF膜,用5%的脱脂奶粉室温封闭1 h, 用TST缓冲液稀释一抗(CDP, 1∶10000; SATB1, 1∶5 000; β-Actin, 1∶5 000), 于4 ℃冰箱轻摇过夜, TST 缓冲液洗膜, 10 min×3 次,加入TST缓冲液配制的辣根过氧化物酶偶联IgG(兔抗羊, 1∶10000; 羊抗兔, 1∶4000; 羊抗鼠, 1∶5 000, 根据一抗的来源而定),室温中轻摇孵育1 h; TST缓冲液洗膜, 10 min×3 次; 在暗室中配制ECL显色液,混匀后滴加在放置平整的膜上,反应1 min, 随即将膜夹入透明膜中,上层覆盖感光胶片,置于暗盒中。根据荧光强度决定曝光时间,取出胶片后显影定影、晾干保存。
1.2.3 Jurkat细胞核抽提物提取:使用试剂盒(NE-PER)进行胞核蛋白提取,参照说明书操作。采用试剂盒(DC Protein Assay Kit), 其原理为改良Lowry法,根据说明书操作测量蛋白浓度。
1.2.4 电泳迁移率变动实验(EMSA): 合成探针。各探针序列如下: NOXA-SBS1-F: 5′-AAATT
TAATAATTTATGC -3′; NOXA-SBS1-R: 5′-GCAT
AAATTATTAAATTT -3′; 37mbr-F: 5′-TATGAAA
GGTTTACATTGTCAAAGTGATGAATATGGA -3′; 37mbr-R: 5′-TCCATATTCATCACTTTGACAATGTA
AACCTTTCATA -3′; SP1-F: 5′-ATTCGATCGGGG
CGGGGCGAGC-3′; SP1-R: 5′-GCTCGCCCCGCCCCGATCGAAT-3′。各探针上下游(F和R)序列产物加 TEN buffer(配方参见《分子克隆实验指南》)溶至10 pmol/μL, 各取50 μL分别涡旋混匀。按照一定体系将待标记探针进行标记; 使用QIAquick Nucleotide Removal kit 纯化标记探针; 所有探针置于95 ℃恒温金属浴, 10 min, 缓慢降温至室温,所获得的已标记探针稀释50倍,随后进行结合反应。配制6%非变性聚丙烯酰胺凝胶,电泳缓冲液采用0.5×TBE(配方参见《分子克隆实验指南》)。恒压250 V, 预电泳10 min。将结合反应后的各样品分别加入上样孔,两侧各加入一孔6×DNA Loading buffer作为指示剂。恒压250 V, 电泳约2 h。将非变性聚丙烯酰胺凝胶从玻璃板上剥离,用保鲜膜包裹,与胶片置于暗盒中, -80 ℃冰箱中放射自显影1~2 d, 曝光。
1.2.5 小RNA干扰及电转: SATB1特异性siRNA片段由Invotrogen公司合成后插入到Genscript公司的 pGCsi-H1/Neo/GFP/siNEGative载体中,干扰质粒可同时表达GFP, 因此可以通过绿色荧光观察转染效率。干扰片段序列如下: control-shRNA: 5′-ACGTGACACGTTCGGAGAA-3′; SATB1-shRNA: 5′-GTCCACCTTGTCTTCTCTC-3′。采用电转方法将干扰质粒和对照质粒转染Jurkat细胞。
1.3 统计学处理
实验数据以3次实验的平均值±标准误表示,组间差异用双尾Student′st检验,计算P值。P<0.05为差异有统计学意义。
2 结 果
2.1 Jurkat细胞中过表达CDP, 抗凋亡基因BCL2转录水平下降,促凋亡基因NOXA转录水平升高
作者设想早期凋亡反应中SATB1从mbr元件上解离下来,可使其同源异型蛋白在相应位点上的结合量增加。 CDP是与SATB1有着高度相似DNA结合结构域的蛋白,具有4个DNA结合结构域,两者与特异性DNA序列的结合是相互竞争关系,决定了2个蛋白能够竞争性的结合在相应区域上, SATB1蛋白与CDP蛋白的结合是相对独立的,然而他们的结合位点是重叠的[7]。有研究显示,当细胞内2个蛋白的比例改变,即SATB1从MAR上脱落后, CDP的结合量增加,反之亦然。作者利用CDP过表达质粒在Jurkat细胞中过表达CDP, 使Jurkat细胞中CDP蛋白过量表达,见图1。同时运用Real-time PCR检测BCL2基因和NOXA基因的转录, BCL2基因显著下降, NOXA基因的转录水平发现其转录水平有一定程度的上调。当干扰SATB1的表达, BCL2基因转录水平大幅度下调, NOXA基因的转录水平大幅度上升一致,说明在SATB1降解并且从mbr、NOXA和BCL2启动子上解离后, CDP很有可能代替SATB1调节两个基因BCL2和NOXA基因的转录。


A: 在Jurkat细胞中过表达CDP蛋白, Western blot验证过表达效果; B: Real-time PCR检测发现BCL2基因显著降低, NOXA基因的转录水平有一定程度的上调。**P<0.01。
图1 CDP抑制BCL2基因的转录促进NOXA基因的转录
2.2 凋亡刺激之前, mbr上和NOXA启动子区存在SATB1的结合,不存在CDP的结合
为了探讨细胞中SATB1/CDP蛋白比例是否是决定mbr元件选择性调节BCL2和NOXA基因转录活性的关键因素,即在早期凋亡过程中染色质构象发生改变, mbr元件结合的蛋白复合物发生改变,是使得其与靶基因的相互作用的亲和性改变,进而协同影响靶基因的转录活性的原因。首先作者用EMSA实验证实,在Jurkat细胞中, mbr元件和NOXA-SBS1上均有SATB1蛋白的结合,如图2所示, mbr上和NOXA启动子区均存在SATB1的结合,但是并不存在CDP的结合。而SATB1能够结合在BCL2启动子区,发挥对BCL2的调节作用在前期研究结果中已经被反复的证明[5]。
A和B凝胶电泳迁移率实验结果证实, mbr元件和Noxa启动子区上结合的蛋白复合物中有SATB1而没有CDP。泳道1:无细胞裂解物的阴性参照。泳道2: 在37mbr上形成的蛋白质复合物条带。泳道3: 100倍过量未标记37 mbr冷探针特异性竞争实验,复合物条带基本消失。泳道4: 100倍过量未标记SP1结合序列冷探针非特异性竞争实验,复合物条带不消失。泳道5、6、7: 分别在反应体系中加入2、6和10 μg抗SATB1抗体进行超迁移实验。泳道8、9、10: 分别在反应体系中加入2、6和10 μg抗CDP抗体进行超迁移实验。图中箭头指示的结合在Noxa启动子区域的三个明显的蛋白复合中complex 3中有SATB1蛋白,而结合在mbr元件的三个明显的蛋白复合中complex B中有SATB1蛋白,两段区域均没有CDP蛋白结合。


图2 凋亡刺激之前mbr和NOXA启动子区的蛋白复合物
2.3 当SATB1蛋白和CDP的比例发生改变时,mbr上和NOXA启动子区上的蛋白组分发生变化
前期的研究结果[5]已经表明,在凋亡过程中, SATB1蛋白降解,并且从mbr上解离,BCL2启动子区的蛋白组分发生改变。为了研究凋亡过程中, SATB1降解后,即SATB1蛋白和CDP的比例发生改变后,Mbr和NOXA启动子上蛋白组分的改变,以及CDP能否结合上去,作者在Jurkat细胞中干扰SATB1蛋白同时过表达CDP蛋白之后, SATB1的干扰效果和CDP的过表达效果见图3。mbr元件上的SATB1蛋白的复合物消失而含有CDP蛋白的复合物结合在mbr上,说明SATB1和CDP确实能够在mbr元件上形成竞争性结合,与此同时, NOXA-SBS1上结合的蛋白复合物也发生了相应的改变, EMSA结果显示, NOXA-SBS1上结合的蛋白复合物成分也由于SATB1和CDP的改变而改变,即CDP与SATB1蛋白在mbr和NOXA-SBS1上均形成竞争性结合,所以当细胞中SATB1蛋白与同源异型蛋白CDP的比例发生改变时, CDP取代SATB1促使mbr与NOXA之间的相互靠近,提示mbr元件染色质构象的改变影响mbr上蛋白复合物的成分,从而调节染色质空间构象,实现对靶基因的转录调控。
A: Western blot分析显示, SATB1-shRNA干扰质粒可显著下调Jurkat细胞中SATB1蛋白的表达水平的同时过表达CDP质粒增强Jurkat细胞中CDP蛋白的表达水平,从而使得Jurkat细胞中SATB1与CDP蛋白比例发生逆转。B和C: 凝胶电泳迁移率实验结果显示, Jurkat细胞中SATB1与CDP蛋白比例发生逆转后, mbr元件和Noxa启动子区上结合的蛋白复合物组分均发生了改变。泳道1: 无细胞裂解物的阴性参照。泳道2: 在Noxa-SBS上形成的蛋白质复合物条带。泳道3: 100倍过量未标记Noxa-SBS冷探针特异性竞争实验,复合物条带基本消失。泳道4: 100倍过量未标记SP1结合序列探针非特异性竞争实验,复合物条带不消失。泳道5、6、7: 分别在反应体系中加入2、6和10 μg抗SATB1抗体进行超迁移实验。泳道8、9、10: 分别在反应体系中加入2、6和10 μg抗CDP抗体进行超迁移实验。如图中箭头所示,只有加入抗CDP抗体时SBS1-蛋白质复合物随抗体量增加而逐渐消失并向上迁移。加入抗SATB1抗体时,蛋白质复合物条带无明显变化。

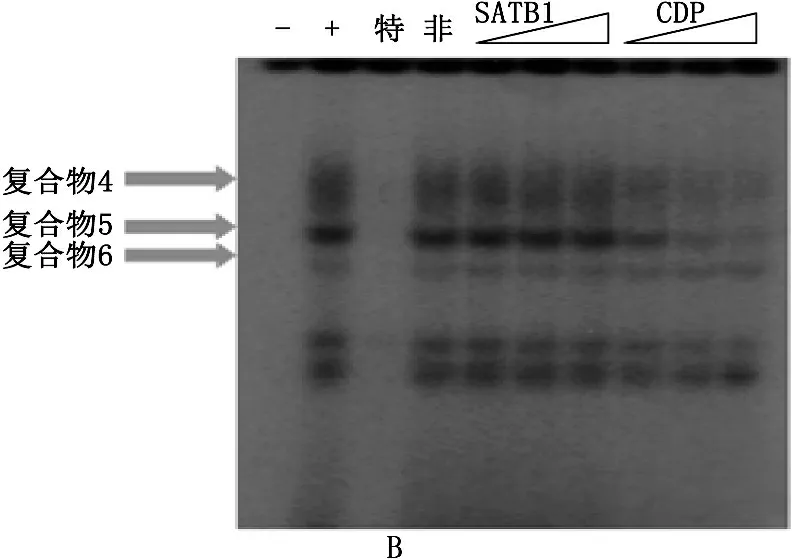
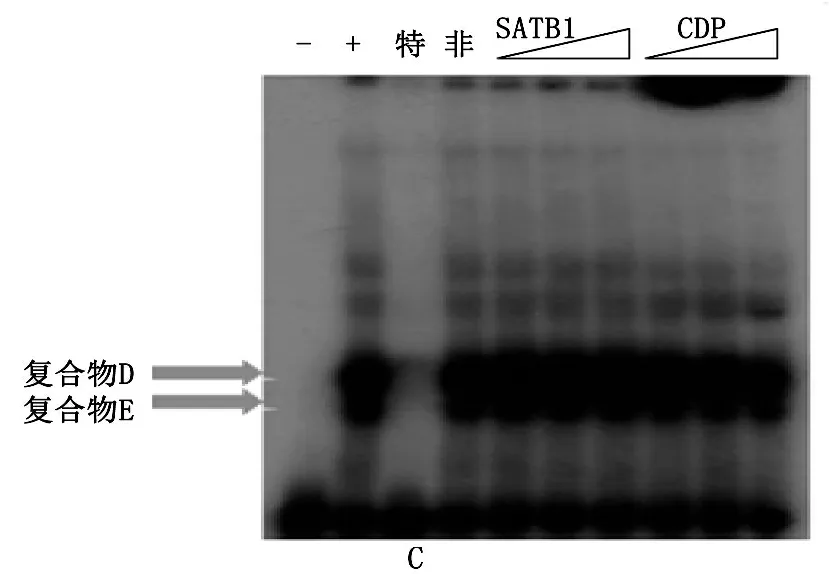
图3 当SATB1蛋白和CDP的比例改变时mbr和NOXA启动子区的蛋白复合物
3 讨 论
本研究探讨了Jurkat细胞凋亡发生后, SATB1降解并且从mbr、BCL2和NOXA启动子上解离后, CDP取代SATB1促使mbr与NOXA之间的相互靠近,促进NOXA基因转录的升高,提示mbr元件染色质构象的改变影响mbr上蛋白复合物的成分,从而调节染色质空间构象,实现对靶基因的转录调控。
CDP定位于7q22.1, 该区域在几种肿瘤中均存在丢失。其基因至少有 340 kb, 并包含33个外显子,共有 5个不同的转录本,包含 2个启动子区域, 2个多腺苷酸化位点和 7种选择性剪切位点。不同的选择性剪切方式,会产生具有不同功能的转录本。细胞中SATB1与CDP的比例也会影响SATB1对基因的调控[8]。本研究已证实, SATB1是细胞在凋亡反应中调节BCL2染色质环高级结构的动态变化的关键因素,细胞通过降解SATB1促使BCL2染色质环解聚,下调BCL2基因的转录活性。过表达抵抗caspase-6降解的SATB1突变体可逆转这一过程。可见, SATB1与特定DNA序列的结合与解离,可通过改变其结合序列上蛋白复合物的组成、相应区域染色质构象以及染色质高级结构,调控不同基因的表达。过表达CDP后,更多的SATB1与CDP结合,从而使得SATB1与DNA的结合量减少,所以过表达CDP与干扰SATB1的效果类似,使得BCL2的表达量降低, NOXA的表达量升高。有研究者[9]同样提出SATB1和CDP 都能与同一基因启动子上游的核基质结合序列结合。SATB1和CDP 通过各自的DNA 结合结构域相互作用,这种相互作用削弱了它们与启动子上游核基质结合序列的结合能力,因此影响了其转录活性。
随着染色质三维构象捕获技术的不断发展与创新[10-12], 以及ENCOD计划的完成[13], 人类解析了越来越多的DNA序列以外的遗传信息。染色质三维构象的调节也受到了越来越多的关注,其异常通过影响细胞生命活动的多个环节,影响疾病的发生和发展[14-15]。本研究探讨远程调控元件mbr在协同调节凋亡相关基因BCL2和NOXA的转录过程中涉及到的具体分子机制, SATB1与CDP的协调在凋亡过程中调控了凋亡相关基因的转录。这其中涉及到的具体分子机制要远比这些复杂,但是生物体中染色质高级结构的调控是一个复杂的网络,介导染色质高级结构的蛋白数量也很庞大,在SATB1降解以后, mbr上的蛋白组分会发生改变,涉及到新的蛋白的结合,原有蛋白的解离。CDP是其中一个,与CDP具有类似功能的蛋白还有CtBP1[16], 至于该蛋白是否参与其中或者还有其他的候选蛋白还需要后续进一步的研究证明。此外,在后续的研究过程中,作者需要结合生物信息的方法以及更高通量的研究技术对mbr上的蛋白复合物在应对凋亡刺激的过程中发生的改变做一个更系统的研究。
[1] Zhou J, Zhang S, Ong C N, et al. Critical role of pro-apoptotic Bcl-2 family members in andrographolide-induced apoptosis in human cancer cells[J]. Biochem Pharmacol, 2006, 72(2): 132-144.
[2] Giotakis A I, Kontos C K, Manolopoulos L D, et al. High BAX/BCL2 mRNA ratio predicts favorable prognosis in laryngeal squamous cell carcinoma, particularly in patients with negative lymph nodes at the time of diagnosis[J]. Clin Biochem, 2016, 49(12): 890-896.
[3] Ma C, Zhang J, Durrin L K, et al. The BCL2 major breakpoint region (mbr) regulates gene expression[J]. Oncogene, 2007, 26(18): 2649-2657.
[4] Cai S, Han H J, Kohwi-Shigematsu T. Tissue-specific nuclear architecture and gene expression regulated by SATB1[J]. Nat Genet, 2003, 34(1): 42-51.
[5] Gong F, Sun L, Wang Z, et al. The BCL2 gene is regulated by a special AT-rich sequence binding protein 1-mediated long range chromosomal interaction between the promoter and the distal element located within the 3'-UTR[J]. Nucleic Acids Res, 2011, 39(11): 4640-4652.
[6] Yang Y, Wang Z, Sun L, et al. SATB1 Mediates Long-Range Chromatin Interactions: A Dual Regulator of Anti-Apoptotic BCL2 and Pro-Apoptotic NOXA Genes[J]. PLoS One, 2015, 10(9): e0139170.
[7] Lee J, Klase Z, Gao X, et al. Cellular homeoproteins, SATB1 and CDP, bind to the unique region between the human cytomegalovirus UL127 and major immediate-early genes[J]. Virology, 2007, 366(1): 117-125.
[8] Liu J, Barnett A, Neufeld EJ, et al. Homeoproteins CDP and SATB1 interact: potential for tissue-specific regulation[J]. Mol Cell Biol, 1999, 19(7): 4918-4926.
[9] Yao X, Nie H, Rojas I C, et al. The L2a element is a mouse CD8 silencer that interacts with MAR-binding proteins SATB1 and CDP[J]. Mol Immunol, 2010, 48(1/2/3): 153-163.
[10] Leblanc B, Comet I, Bantignies F, et al. Chromosome Conformation Capture on Chip (4C): Data Processing[J]. Methods Mol Biol, 2016, 1480: 243-261.
[11] Deng W, Blobel G A. Detecting Long-Range Enhancer-Promoter Interactions by Quantitative Chromosome Conformation Capture[J]. Methods Mol Biol, 2017, 1468: 51-62.
[12] Sati S, Cavalli G. Chromosome conformation capture technologies and their impact in understanding genome function[J]. Chromosoma, 2016: 121-127.
[13] Consortium E P. An integrated encyclopedia of DNA elements in the human genome[J]. Nature, 2012, 489(7414): 57-74.
[14] Shi J, Zhang Y, Zheng W, et al. Fine-scale mapping of 8q24 locus identifies multiple independent risk variants for breast cancer[J]. Int J Cancer, 2016, 139(6): 1303-1317.
[15] Misteli T. Higher-order genome organization in human disease[J]. Cold Spring Harb Perspect Biol, 2010, 2(8): a000794.
[16] Purbey P K, Singh S, Notani D, et al. Acetylation-dependent interaction of SATB1 and CtBP1 mediates transcriptional repression by SATB1[J]. Mol Cell Biol, 2009, 29(5): 1321-1337.
Role of long-range regulatory element mbr in transcriptional regulation of apoptosis-related genes in apoptosis process participated with CDP
JIANG Jiajia1, 2, YANG Yin1, 2, SUN Yujie1, 2
(1.KeyLaboratoryofFunctionalGenomicsofJiangsuProvince; 2.DepartmentofCellBiology,NanjingMedicalUniversity,Nanjing,Jiangsu, 210029)
Objective To investigate whether CDP can replace SATB1 in BCL2 and NOXA transcription after SATB1 degradation during apoptosis. Methods CDP was over-expressed in Jurkat cells, and the transcription levels of BCL2 gene and NOXA gene were determined by real-time PCR. EMSA assay was used to detect the protein complex change in mbr and NOXA promoter. Results In the Jurkat cells, the SATB1 protein was present on the mbr element and NOXA-SBS1. When the SATB1 and CDP ratio changed, the SATB1 protein complex disappeared and replaced with the CDP protein complex on mbr element. CDP was able to promote the transcription of NOXA and inhibit the transcription of BCL2. Conclusion The ratio of SATB1 protein to its homologous protein CDP is critical for synergistic expression of BCL2 and NOXA genes mediated by the mbr long distance regulation.
long-range regulatory element mbr; BCL2; NOXA; CDP
2016-11-13
国家自然科学基金资助项目(30772490)
孙玉洁, E-mail: yujiesun@njmu.edu.cn
R 329.2
A
1672-2353(2017)09-001-05
10.7619/jcmp.201709001

