胰腺导管内乳头状黏液性肿瘤的CT及MRI表现
韩国武,龚 蓉
(湖北省宜昌市兴山县人民医院放射科,湖北 宜昌 443700)
胰腺导管内乳头状黏液性肿瘤的CT及MRI表现
韩国武,龚 蓉
(湖北省宜昌市兴山县人民医院放射科,湖北 宜昌 443700)
目的:探讨胰腺导管内乳头状黏液性肿瘤(P-IPMN)的CT及MRI特点。方法:回顾性分析15例经手术病理证实的P-IPMN患者的临床资料、CT及MRI表现。结果:15例中,腺瘤9例,交界性肿瘤2例,原位癌2例,腺癌2例。影像学分型及表现:主胰管型3例,主要表现为主胰管扩张伴胰腺实质萎缩,其中1例伴胆总管扩张,2例伴胰管内壁结节并中度强化;分支胰管型11例,其中6例位于体尾部,5例位于胰头及钩突部,病灶大小5 mm×6 mm~32 mm×40 mm,主要表现为单房或多房囊状肿瘤,似葡萄串,囊与胰管相通,其内分隔轻度强化,伴或不伴主胰管扩张;混合型1例,表现为胰腺体尾部多房性囊状肿瘤,可见病灶内多发性壁结节中度强化及分隔轻中度强化,伴主胰管明显扩张,直径22 mm。结论:P-IPMN有相对的影像学特征,CT和MRI对P-IPMN的诊断、鉴别诊断和恶性预测具有重要的临床应用价值。
胰腺肿瘤;导管内乳头状黏液性肿瘤;体层摄影术,X线计算机;磁共振成像
胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm of pancreas,P-IPMN)是一种发生于胰腺导管上皮细胞,以过量分泌黏液、肿大的乳头、主胰管和(或)分支胰管囊状扩张为特征的胰腺原发性囊性肿瘤[1],临床上相对少见。目前被认为是一种癌前病变,由于对其认识不足,以往多诊断为慢性胰腺炎或黏液性囊腺瘤。与胰腺癌相比,其预后良好,因此术前正确诊断极为重要。现回顾性分析我院自2010年1月至2016年3月收治的经病理证实的15例P-IPMN患者的临床及影像学资料,分析其影像学特征,以提高对该病的认识和术前诊断水平。
1 资料与方法
1.1 一般资料 15例中,男10例,女5例;年龄48~83岁,平均(68.8±7.4)岁。主要临床表现:顽固性反复发作性急性胰腺炎7例,腹痛及上腹部不适4例,体质量减轻2例,无明显自觉症状2例,合并黄疸2例,合并糖尿病1例。CA19-9升高2例。
1.2 仪器与方法 CT检查采用Philips 16层螺旋CT扫描仪,扫描参数:120 kV,250 mA,螺距0.938,准直宽度5 mm,矩阵512×512,采用2 mm层厚重建,重建间隔1 mm。检查前空腹4~6 h,检查前饮水500 mL,先平扫确定胰腺位置及病灶范围。增强扫描对比剂采用碘海醇注射液(350 mgI/mL),经上肢静脉由高压注射器注入,流率3.0 mL/s,剂量100 mL,分别于注入后23、60、90 s行动脉期、静脉期及延迟期扫描。
MRI扫描采用Siemens 1.5 T超导MRI扫描仪,体部相控阵线圈采集信号。T1WI:快速小角度激发梯度回波(FLASH),TR 360 ms,TE 2.51 ms,层厚4~5 mm,层距1.0 mm,FOV 350 mm×350 mm,矩阵144×256,翻转角10°,NEX 2。T2WI:刀锋伪影校正(BLADE)技术脂肪抑制快速自旋回波(TSE),TR 1500ms,TE 101ms,层厚6mm,无间隔,FOV 350mm ×350 mm,矩阵278×320,翻转角140°,NEX 1,自由呼吸触发扫描。SPACE序列3D采集MRCP:TR 2500ms,TE 710ms,层厚1mm,无间隔,FOV 380mm×380 mm,矩阵358×384,翻转角140°,NEX 2,自由呼吸触发扫描。增强扫描采用对比剂Gd-DTPA,经上肢静脉由高压注射器注入,流率2.5 mL/s,剂量15 mL,分别于注入后20、50、180 s行动脉期、静脉期及延迟期扫描。
1.3 图像分析及病理分型 由2名腹部疾病诊断经验丰富的放射科医师共同阅片,分别记录病灶的部位、大小、形态、数目、密度和(或)信号、强化方式、是否与主胰管相通、主胰管是否扩张、有无壁结节等。2000年WHO按照其细胞分化程度及生长特性将P-IPMN分为4种病理类型:腺瘤、交界性肿瘤、原位癌及腺癌。影像学分型:主胰管型、分支胰管型和混合型。
2 结果
15例中,3例病变位于主胰管(主胰管型),11例位于分支胰管(分支胰管型),1例既位于主胰管又位于分支胰管(混合型)。15例均行手术切除,并经病理诊断。
主胰管型3例,1例位于胰腺钩突部,1例位于全程胰管,1例位于体尾部。CT表现为主胰管扩张伴胰腺实质萎缩,MRCP示主胰管扩张,伴或不伴管腔内壁结节,壁结节轻中度强化。其中1例胰腺钩突部胰管扩张13 mm伴管腔内6 mm壁结节,胆总管扩张15 mm,增强扫描壁结节中度强化,其病理为腺癌(图1);1例胰腺全程主胰管扩张9 mm,管腔内壁结节直径3 mm,病理为原位癌;1例胰腺体尾部主胰管扩张7 mm,病理为交界性肿瘤。
分支胰管型11例,6例位于体尾部,5例位于胰头及钩突部。CT表现为单个或多个小囊状低密度影,似葡萄串,其内分隔轻度强化,伴或不伴主胰管扩张(图2);MRI表现为T1WI低信号、T2WI高信号单房或多房囊状肿瘤,内见分隔,大小5 mm×6 mm~32 mm×40 mm;MRCP示囊状高信号与胰管相通(图3)。其中1例胰头有大小32 mm×40 mm囊状病灶,病理为原位癌;1例胰腺体尾部多房性小囊状低密度影,病理为交界性肿瘤;其余9例病理为腺瘤。
混合型1例,MRI表现为胰腺体尾部多房性长T1、长T2信号囊性病灶,增强扫描可见多发性壁结节中度强化及分隔轻中度强化,伴主胰管明显扩张,直径22 mm,其病理为腺癌(图4)。
3 讨论
P-IPMN是一种好发于老年男性的胰腺囊性肿瘤,发病率约占胰腺囊性肿瘤的10%[2],与传统的胰腺癌相比,具有生长缓慢、低度恶性、淋巴结转移率低、复发率低和极少侵犯周围组织的特点[3]。本组均未见腹膜后淋巴结增大、周围组织侵犯及远处转移等征象。因肿瘤分泌的黏液过多阻塞正常胰液的分泌,最常见临床症状为顽固性、反复发作性、急性胰腺炎,其次为上腹部痛、黄疸、体质量减轻、厌食、脂肪痢、糖尿病等。有些患者由于肿瘤早期或较小时,症状不明显经查体偶然发现。
3.1 基本病理改变 外分泌胰腺导管的正常上皮被肿瘤性上皮所取代,肿瘤上皮为黏液性,肿瘤在胰腺导管内呈多个乳头状生长,使主胰管或分支胰管局限性或弥漫性扩张,病变可出现在导管的任何位置,55%~60%位于胰头和钩突部,可累及Vater壶腹,体尾部仅占11%~25%,33%病例呈弥漫性或多灶性。目前一种是根据肿瘤起源及受累部位不同,影像学上将P-IPMN分为:①主胰管型,肿瘤主要位于主胰管内,仅有主胰管局限性或弥漫性扩张。②分支胰管型,分支胰管明显扩张,形成胰腺内囊性病灶。③混合型,出现主胰管扩张和囊状肿瘤样改变,扩张的分支胰管与扩张或正常管径的主胰管相通。另一种是按照肿瘤分泌黏液的多少及肿瘤乳头的大小划分为:①黏液分泌型,扩张的胰管内充满凝结的黏液,肿瘤细胞呈扁平或微小乳头状,影像检查常无法显示。②乳头型,扩张的胰管内见黏液及乳头状生长的肿瘤,影像学可见到乳头状肿瘤。目前多数学者采用第一种分类方法。
3.2 影像学表现 ①主胰管型:主要表现为主胰管局限性或弥漫性扩张,胰管壁上可见乳头状和(或)扁平状软组织突起,常合并胰腺实质萎缩。MRCP可显示扩张的胰管,在胰管内可见壁结节造成充盈缺损,代表肿瘤结节或凝结的黏液。CT表现为主胰管扩张,管腔内黏液栓造成管腔内密度不均匀增高,管壁上可见等密度壁结节。CT及MRI增强扫描见肿瘤乳头轻中度强化。十二指肠乳头增大、突入肠腔是主胰管型P-IPMN的特征性改变,本组3例未见此征象。另外,主导管内乳头状肿瘤可侵犯Vater壶腹,引起胆总管扩张,也可形成胰管胆管瘘或胰管十二指肠瘘,甚至形成腹膜假性黏液瘤。②分支胰管型:大多数分支胰管型P-IPMN位于胰头和钩突部,病变呈分叶状多囊性肿块,如葡萄串,其内有厚薄不均的分隔及大小不等的壁结节,一般主胰管不扩张,但累及主胰管时可伴主胰管不同程度扩张,囊性肿块与扩张的胰管相交通是分支胰管型P-IPMN的特征性表现。CT表现为单个或多个小囊状低密度影,似葡萄串,MPR及CPR可显示小囊结构相互交通。MRI能准确地显示囊性病变、囊内分隔,以及是否与胰管相通。增强扫描壁结节及分隔呈轻中度强化。本组11例6例位于体尾部,5例位于胰头及钩突部,与文献[4]报道有差异,可能与本组例数较少有关。③混合型:最常见,病变范围相对较广,表现为主胰管合并1支或多分支胰管扩张,兼有主胰管型及分支胰管型P-IPMN的特点。
P-IPMN出现以下征象时提示恶变的可能:①胆总管扩张提示恶性可能。钟井松等[5]研究发现,胆总管扩张在恶性P-IPMN中较多,其病理基础可能是肿瘤分泌大量黏液栓在乳头部阻塞胆总管开口,也可能是肿瘤侵犯胰头部胆总管致使狭窄或梗阻,其近侧胆总管扩张相对明显。本组1例主胰管型P-IPMN,胆总管扩张15 mm,病理为腺癌。②分支胰管型相对于主胰管型和混合型恶性比例较低。本组11例中,仅1例为原位癌,与文献[6]报道一致。③病灶或壁结节越大,胰管扩张越宽,提示恶性的可能性越大[7]。Kawai等[8-9]认为肿瘤直径≥30 mm,壁结节直径≥5 mm,主胰管扩张≥7 mm,提示可能恶性。本组15例中4例为恶性,1例肿瘤直径≥30 mm,1例壁结节直径≥5 mm,3例主胰管扩张≥7 mm。④发生于胰头或钩突部的P-IPMN通常提示恶性或侵袭性,而发生于胰腺体尾部的P-IPMN通常提示良性。⑤十二指肠扩张及软组织肿块均提示恶性或侵袭性P-IPMN,此外淋巴结转移、血管侵犯及远处转移是恶性或侵袭性P-IPMN的间接征象。⑥CA19-9升高在诊断恶性P-IPMN中具有重要参考价值。本组1例CA19-9 268.8 μ/mL,病理为腺癌;1例CA19-9 101.5 μ/mL,病理为原位癌。⑦随诊过程中肿瘤突然增大也应高度警惕恶变的可能。
3.3 鉴别诊断 P-IPMN应与以下疾病鉴别:①P-IPMN可伴慢性炎症,应与慢性胰腺炎鉴别。慢性胰腺炎患者多年轻,有经常饮酒史,影像学特点为胰管呈串珠样扩张,很少伴分支胰管扩张,胰腺内出现钙化及肿块周围出现假性囊肿等有助于正确诊断,而无钙化的慢性胰腺炎与P-IPMN较难鉴别[10],若出现壁结节、十二指肠乳头增大并突入肠腔有助于P-IPMN的定性诊断。②浆液性囊腺瘤,是最常见的胰腺囊性肿瘤,50~60岁女性多见,可发生于胰腺任何部位,但以胰头区多见。微囊型由多发小囊构成,呈蜂窝或海绵状,但与胰管间无交通,胆总管及胰管可受压、移位、被包绕及梗阻,部分肿瘤中心可见星芒状瘢痕伴钙化。大囊型表现为分叶状囊性病变,囊与胰管不相通,胰管不扩张。③黏液性囊腺瘤(癌),多见于40~60岁女性,以体尾部多见。一般肿瘤较大,表现为囊性病变伴分隔和壁结节,是否与主胰管相通是其主要鉴别点。④实性假乳头状瘤,主要发生于青年女性,多为囊实相间的病灶[11],常伴出血。⑤胰腺癌坏死囊变,坏死囊变区位于病灶中央,囊变区密度(信号)不均,增强扫描不规则强化和边缘强化为主,“双管征”的出现、病灶周围侵袭、淋巴结肿大和远处转移等强烈提示胰腺癌。
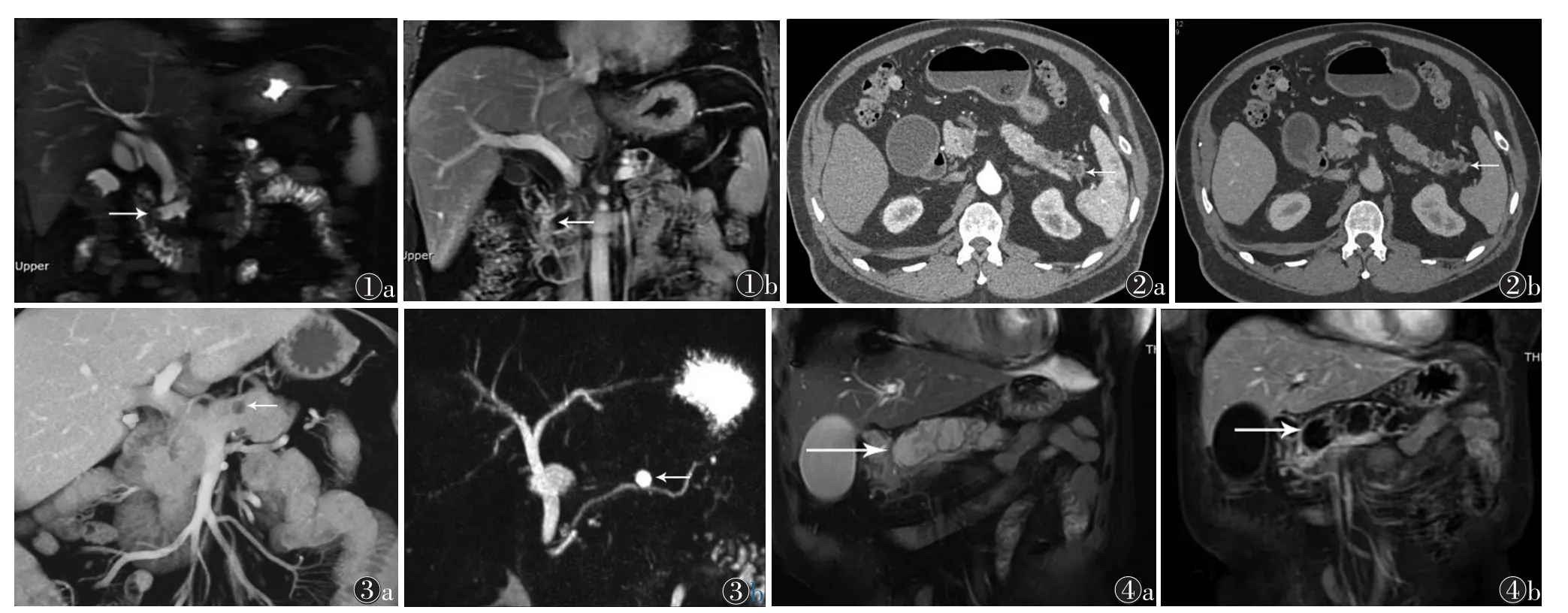
图1 女,52岁,主胰管型导管内乳头状黏液性肿瘤(P-IPMN),病理为腺癌 图1a T2WI冠状位示胰腺钩突部主胰管明显扩张,直径13 mm,其内可见直径6 mm壁结节充盈缺损(箭头),胆总管亦见扩张,直径15 mm 图1b T1WI冠状位增强扫描示主胰管内壁结节中度强化(箭头) 图2 男,71岁,分支胰管型P-IPMN,病理为交界性肿瘤 图2a,2b 增强扫描胰腺尾部多房性囊状病灶边缘轻度强化(箭头),呈串珠样改变,与主胰管相交通,伴胰腺实质萎缩 图3 男,48岁,分支胰管型P-IPMN,病理为腺瘤 图3a CT冠状位MIP示胰腺体部直径7 mm圆形边缘轻中度强化低密度结节(箭头) 图3b MRCP示胰腺体部高信号结节与主胰管交通(箭头),胆总管直径9 mm 图4 女,64岁,混合型P-IPMN,病理为腺癌 图4a T2WI冠状位示胰腺体尾部可见多房性高信号(箭头),分隔呈低信号,内部信号不均匀,主胰管明显扩张,直径22 mm 图4b T1WI冠状位增强扫描示囊性病变分隔中度强化,并见多发壁结节强化(箭头)
综上所述,胰管扩张与胰管相通的葡萄串样囊状肿块、胰管内及囊状肿块内壁结节、十二指肠乳头增大并突入肠腔是P-IPMN相对特征性影像学表现。同时,当肿瘤直径≥30 mm、壁结节直径≥5 mm、主胰管扩张≥7 mm、胆管出现梗阻、CA19-9升高,提示可能恶性。值得注意的是,P-IPMN非罕见疾病,在胰腺囊性病变的鉴别诊断中应考虑此病。
[1]Tanaka M,Kobayashi K,Mizumoto K,et al.Clinical aspects of intraductal papillary mucinous neoplasm of the pancreas[J].Gastroenterol,2005,40:669-675.
[2]陈敏,欧阳汉,全官民,等.体部磁共振诊断学[M].福州:福建科学技术出版社,2010:159-160.
[3]尚建辉,王莉,陆建平,等.胰腺导管内乳头状黏液性肿瘤的CT诊断价值[J].中国医学计算机成像杂志,2010,16(2):129-134.
[4]张惠茅,村上康二,来颖,等.胰管内乳头状黏液性肿瘤的影像学诊断[J].中华放射学杂志,2005,39(9):959-962.
[5]钟井松,胡春洪,沈海林.良、恶性胰腺导管内乳头状黏液性肿瘤CT特征与病理联系[J].临床放射学杂志,2015,34(1):66-69.
[6]Jang JY,Kim SW,Ahn YJ,et al.Multicenter analysis of clinicopathologic features of intraductal papillary mucinous tumor of the pancreas:is it possible to predict the malignancy before surgery[J].Ann Surg Oncol,2005,12:124-132.
[7]岳奎涛,刘剑羽,王智勇,等.胰腺导管内乳头状黏液性肿瘤的MSCT征象[J].中国医学影像技术,2012,28(7):1367-1370.
[8]Kawai M,Uchiyama K,Tani M,et al.Clinicopathological features of malignant inteaductal papillary mucinous tumors of the pancreas[J].Arch Surg,2004,139:188-192.
[9]Sugiyama M,Izumisato Y,Abe N,et al.Predictive factors for malignancy in intraductal papillary-mucinous tumors of the pancreas[J].Br J Surg,2003,90:1244-1249.
[10]冯娟娟,袁德全,沈雪峰,等.胰腺导管内乳头状黏液性肿瘤CT与MRI表现及鉴别诊断[J].临床放射学杂志,2012,31(2):215-216.
[11]顾浩.MSCT和MRI诊断胰腺导管内乳头状黏液性肿瘤的比较[J].中国临床医学影像杂志,2011,22(1):40-42.
2016-06-27)
10.3969/j.issn.1672-0512.2017.03.023
龚蓉,E-mail:575751949@qq.com。

