GFP-Nurr1基因修饰神经干细胞的建立及过表达Nurr1对神经干细胞向多巴胺神经元分化的影响
陈孝祥, 宋晓斌, 王向鹏, 徐蛟天, 林 海, 王 威, 杨智勇, 邓兴力
GFP-Nurr1基因修饰神经干细胞的建立及过表达Nurr1对神经干细胞向多巴胺神经元分化的影响
陈孝祥, 宋晓斌, 王向鹏, 徐蛟天, 林 海, 王 威, 杨智勇, 邓兴力
目的 利用慢病毒载体建立GFP-Nurr1基因修饰的原代神经干细胞(NSCs)模型并观察Nurr1过表达后NSCs向多巴胺神经元的分化影响。方法 利用基因重组构建pLenO-DCE-Nurr1慢病毒载体,用慢病毒转染第三代NSCs,转染72 h后荧光检测转染效果;设置空白对照组、空载体组及DCE-Nurr1组,分别用Western blot及PCR检测Nurr1的表达差异;并将转染后的NSCs分化培养7 d后分别用免疫细胞化学检测、Western blot及PCR检测酪氨酸羟化酶(TH)的表达。结果 慢病毒转染NSCs 72 h后,转染率可达90%,与对照组相比DCE-Nurr1组高表达Nurr1。经慢病毒载体感染后的NSCs仍具备分化潜能,分化培养后发现DCE-Nurr1组分化的神经细胞中TH阳性细胞分化率90.60%,对照组为21.2%。结论 慢病毒载体可高效转染NSCs过表达Nurr1;Nurr1基因过表达可以促进中脑腹侧来源NSCs向TH阳性多巴胺能神经元方向分化。
Nurr1; 基因修饰; 慢病毒; 神经干细胞
帕金森病(Parkinson’s disease,PD)的典型运动症状主要表现为运动徐缓,静止性震颤及肌强直,主要由于中脑黑质多巴胺神经元(dopaminergic neuron,DA neuron)的渐进性变性丢失引起,目前尚无治疗方法可延缓其疾病进程[1]。根据近几年的研究表明,神经干细胞(neural stem cells,NSCs)具有多分化潜能,能体外培养诱导成神经元、星形胶质细胞及少突胶质细胞,因此通过移植神经干细胞有望成为PD治疗的新希望。目前,已在PD动物模型上得到证实,通过移植体外培养的NSCs后能改善PD动物行为学症状[2,3]。但单纯神经干细胞移植治疗PD也面临诸多问题,其中如何使移植后的NSCs最大程度的分化成有功能的DA神经元是亟待解决的问题。核受体相关基因1(nuclear receptor related 1 gene,Nurr1)属于孤束核受体家族成员之一,前期大量研究表明Nurr1 对多巴胺能神经元的发育、生存和功能维持起着重要的作用,并且通过敲除小鼠Nurr1基因发现Nurr1-/-小鼠不能产生中脑多巴胺能神经元[4]。因此通过Nurr1基因修饰神经干细胞有望使移植后的NSCs最大程度分化成TH阳性的DA神经元。虽然国内曾有研究报道利用电穿孔法转染神经干细胞使其过表达Nurr1,但转染后NSCs分化成DA神经元的比例并不高。因此,本研究通过体外细胞实验,利用慢病毒载体将中脑腹侧来源原代培养的NSCs过表达Nurr1,观察其分化情况,旨在提高NSCs过表达Nurr1后向DA神经元的转化率,为进一步体内动物实验奠定基础。
1 材料和方法
1.1 材 料
1.1.1 实验动物与细胞 SD(Sprague-Dawley)雄、雌性大鼠均购于湖南斯莱克景达实验动物有限公司,许可证号:SYXK(滇)2011-0004)。将SD雌性大鼠与雄性大鼠合笼受孕,原代神经干细胞取自孕12.5~14.5 d胎鼠中脑腹侧组织培养而来。
1.1.2 主要实验试剂 DMEM/F12、DMEM/high glucose购自HyClone;L-谷氨酰胺(L-Glutamine-200 mM)、青霉素-链霉素双抗及B27(B-27 Supplement Minus Vitamin A 50X)均购自Invitrogen公司;山羊血清购自索莱宝公司;碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(Epidermal Growth Factor,EGF)均购自Peprotech 公司;D-葡萄糖购自大连美仑、多聚-D-赖氨酸购自 Sigma公司;胎牛血清(feta l bovine serum,FBS)购自BI公司;DAPI购自碧云天公司;兔巢蛋白抗体(rabbit anti-Nestin)、兔β微管蛋白Ⅲ抗体(rabbit anti-Ⅲ β-tubulin)、兔胶质纤维酸性蛋白抗体(rabbit anti-GFAP)、兔酪氨酸羟化酶抗体(rabbit anti-TH)及Alexa Fluor594标记羊抗兔IgG(Alexa Fluor594-conjugated Goat Anti-Rabbit IgG)均购自proteintech公司。RIPA裂解液购自索莱宝公司,FastQuant cDNA第一链合成试剂盒购自天根公司。
1.1.3 慢病毒载体及引物设计 pLenO-DCE-Nurr1慢病毒载体携带GFP报告基因和Nurr1目的基因,由本课题组前期构建。RT-PCR(reverse transcription-PCR)所用Nurr1及TH引物由primer5软件设计,引物购自Invitrogen公司。Nurr1(forward:5’-AAGCCACCTTGCTTGTACCAAA-3’,reverse:5’-CTTGTAGTAAACCGACCCGCTG-3’);TH(forward:5’-CAGGGCTGCTGTCTTCCTAC-3’,reverse,5’-GGGCTGTCCAGTACGTCAAT-3’);DAT(forward:5’-TTGCAGCTGGCACATCTATC-3’,reverse:5’-ATGCTGACCACGACCACATA-3’);GAPDH(forward:5’-TGCCTCCTGCACCACCAACT-3’,reverse:5’-CCCGTTCAGCTCAGGGATGA-3’)。
2.3 NSCs过表达Nurr1后的分化培养结果 将空白对照组及DCE-Nurr1组分别分化培养7 d后,经免疫荧光实验发现,与对照组相比,DCE-Nurr1组TH+的DA神经元明显增多(90.60%,而对照组为21.2%),且胞体大,突起长(P<0.001)(见图3A-C)。同时,我们发现在DCE-Nurr1组分化后的细胞仍表达GFP,但大部分表达GFP的细胞并非TH+细胞(见图3D),提示过表达的Nurr1在NSCs分化后有可能更多的位于胶质细胞。因此,我们进一步通过荧光共定位进行了确认,发现来自慢病毒载体的GFP大多表达于GFAP阳性的胶质细胞上(见图4)。另外,为进一步验证经Nurr1处理后分化得到的DA神经元是否具有成熟DA神经元特点,我们进一步检测了这两组间TH和DAT(dopamine transporter,DAT)在mRNA和蛋白水平上是否有表达差异。通过Western blot及RT-PCR发现,与对照组相比DCE-Nurr1组分化得的DA神经元TH和DAT均上调(见图5),说明经Nurr1过表达修饰后能促进NSCs向DA神经元分化,且具备成熟DA神经元功能。
1.2.1 中脑腹侧NSCs的培养及鉴定 7%水合氯醛(0.4 ml/100 g)腹腔注射麻醉孕12.5~14.5 d的SD大鼠,无菌条件下取出胎鼠后用DMEM/high glucos溶液漂洗两次,解剖显微镜下分离胎鼠取中脑腹侧组织;将组织剪碎后加入NSCs完全培养液(含20 ng/ml的EGF、20 ng/ml的bFGF、2%的B27、1%的L-谷氨酰胺),1 ml移液器枪头吹打后,经70 μm滤网过滤,1000 r/min离心5 min收集细胞后加入完全培养基重悬,按2×105个/ml细胞密度接种于培养瓶中,37 ℃、5% CO2培养箱中培养7 d,每天显微镜下观察细胞生长情况,隔天半量换液1次。原代培养7 d后机械分离神经球进行传代培养,取第三代(P3)神经球用巢蛋白(Nestin)鉴定,并用10%FBS分化培养液(撤去EGF和bFGF)分化培养后鉴定其多向分化能力。
2.1 中脑腹侧NSCs的生长特点及鉴定 原代NSCs从中脑腹侧分离后接种于25 cm2培养瓶培养,培养1~2 d,大部分细胞均贴壁并渐死亡,2~3 d后,倒置显微镜下可观察到少许神经干细胞开始聚集成簇,培养5~7 d后可形成直径150 μm~200 μm大小的神经球,经神经干细胞标志物巢蛋白(Nestin)鉴定呈阳性。将培养至7 d的神经球进一步分化培养,在分化培养液(含10%胎牛血清)作用下,神经球渐分化,球体周围生出长突起,分化培养7 d后大部分神经球均分化,经免疫荧光鉴定分别呈微管蛋白(Tuj1)、胶质纤维酸性蛋白(GFAP)阳性(见图1),说明中脑腹侧来源脑组织可经体外培养成神经干细胞,且有多向分化能力。原代培养神经球5~7 d后,可见球体中间细胞渐发暗,为营养供应不足引起,应及时传代处理。
1.2.4 Western Blot及PCR验证 仍分别设置空白对照组及DCE-Nurr1组,将P3代神经球接种于6孔板中。DCE-Nurr1组神经球转染Nurr1培养72 h后用分化培养液培养;空白对照组不予慢病毒处理,直接用分化培养液培养(与DCE-Nurr1组同一时间开始分化培养)。两组分化培养7 d后分别提取蛋白及总RNA,用western blot及PCR检测两组间TH表达情况。
1.2.3 NSCs过表达Nurr1后的分化培养及免疫荧光鉴定 设置空白对照组及DCE-Nurr1组,将P3代神经球接种于铺有细胞爬片(爬片经多聚赖氨酸处理)的24孔板中。DCE-Nurr1组神经球转染Nurr1培养72 h后用分化培养液培养;空白对照组不予慢病毒处理,直接用分化培养液培养(与DCE-Nurr1组同一时间开始分化培养)。将两组分别分化培养7 d后取出爬片,用PBS洗涤5 min×3次,4%多聚甲醛固定30 min,0.3%的Triton处理15 min,PBS洗涤5 min×3次,10%山羊血清封闭1 h后,滴加一抗兔抗TH多克隆抗体(1∶200)后4 ℃过夜;次日早上再PBS洗涤3次,滴加二抗(山羊抗兔Alexa Fluor594,1∶500)后室温孵育2 h;PBS洗涤3次后DAPI染核(DAPI为碧云天产品,使用浓度为5 μg/ml);荧光显微镜下观察荧光表达情况。
1.2.2 NSCs过表达Nurr1模型的建立及鉴定 pLenO-DCE-Nurr1慢病毒由本课题组前期构建保存,携带GFP报告基因和Nurr1目的基因。在转染前,首先收集P3代NSCs至离心管并1000 r/min×5 min离心,用完全培养基重悬,机械吹打尽量分散神经球,按2×105个/ml接种于六孔板,感染复数(MOI)按预实验取200,计算出病毒数后加入NSCs培养板,37 ℃、5% CO2培养箱中培养72 h后荧光显微镜下观察转染情况。分别设置空白对照组、空载体组及DCE-Nurr1组。空白对照组不用慢病毒感染,空载体组用携带GFP(绿色荧光蛋白)但不含目的基因Nurr1的慢病毒转染,DCE-Nurr1组用含GFP-Nurr1的慢病毒处理,将3组分化培养72 h后分别提蛋白及总RNA,进一步用Western blot及PCR检测3组Nurr1表达情况。
其二,从研究热点主题来看,近十年来研究热点主题一直在不断演变与扩展。根据关键词共现与聚类分析可知,武术文化研究主要围绕着非物质文化遗产视域下的武术文化保护与发展;中国传统武术自身的现状、困境与发展路径;中国武术文化的国际化传播与推广;武术文化的文化精神;学校武术教育中的文化反思;地域武术文化与民间武术文化的发展等几个方面的探索。
职业导游能力,是指职业导游所具备的基本的和必要的职业能力和素养,换言之,职业导游能够成功地轻松地从事导游服务工作所具备的所有能力的特征和职业素养的总和。社会实践中,职业导游,应该能够做好向导和讲解工作,能够做好游客的安全,做好旅游资源的推荐,做好游客出游活动的建议,有良好的品质和技能,语言表达、行为判断、组织协调能力,同时也要有专业的广博的知识内涵。

2 结 果
Third is viability,since Zhuang drama emerge in the folk,most of its contents were transmitted from generation to generation through folk artists’oral teaching and demonstration.
2.2 pLenO-DCE-Nurr1慢病毒对NSCs的转染 在本实验中,我们发现在P3代培养至5~7 d的神经球中加入DCE-Nurr1慢病毒感染24 h后即可在荧光显微镜下观察到绿色荧光,转染72 h后大部分神经球均表达绿光,有些神经球可渐贴壁分化(见图2A、2B),转染后培养7 d大部分神经球均分化。分别用Western bolt及PCR比较空白对照组、空载体组及DCE-Nurr1组,发现空白对照组与空载体组比较Nurr1表达无统计学意义(P>0.05),而DCE-Nurr1组较其余两组相比均高表达Nurr1,统计分析存在显著性差异(P<0.001)(见图2C、2D)。结果说明以慢病毒为载体可使NSCs高效过表达Nurr1。
1.2 方 法
加里克 · 阿瓦内齐安,捷克人。1959年生于巴库,出版商。1988年至1992年居住在哈萨克斯坦,1992年至1994年在莫斯科工作,1995年以来居住在布拉格,2012年获MFIAP荣誉,在世界30多个国家参加国际摄影沙龙和展览会300余次。

图1 NSCs鉴定及分化培养后鉴定。原代神经球培养7 d(A),经过巢蛋白(Nestin)鉴定阳性(B);将P3神经干细胞分化培养后并鉴定,分别呈GFAP及Tuj1阳性(C-D)。标尺(A-D)=20 μm

图2 pLenO-DCE-Nurr1慢病毒转染NSCs。P3代神经干细胞经pLenO-DCE-Nurr1慢病毒转染后72 h可见明显绿色荧光(A-B),并经western blot及PCR进一步得到验证(C-D):经pLenO-DCE-Nurr1慢病毒系统可成功构建NSC过表达Nurr1模型。标尺(A-B)=100 μm

图3 过表达Nurr1促进NSCs向DA神经元分化。与对照组相比,DCE-Nurr1组TH+细胞明显增多(见图A~C,***P<0.001);DCE-Nurr1组分化后的细胞仍表达GFP,但大部分未共定位于TH+细胞。标尺(A,B及D)=20 μm

图4 荧光共定位检测GFP分布。通过荧光共定位发现,慢病毒携带的GFP在NSCs分化后,大部分共定位与GFAP+细胞。标尺(A-D)=20 μm

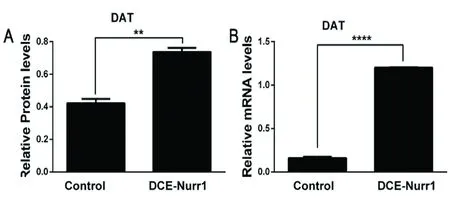

图5 与对照组相比DCE-Nurr1组分化得的DA神经元TH和DAT均上调。(**P<0.01,****P<0.0001)
3 讨 论
近年来因为老龄化诸多等原因,一些神经退行性疾病的发病逐年增加,特别是帕金森病(PD),有Meta研究分析指出截止到2014年,年龄大于40岁的女性PD患病率达到了37.55/10万,而年龄大于40岁的男性则达到了61.21/10万[5]。虽然PD的患病率正逐年增加,但现有的PD治疗均仍只能暂时缓解其临床症状,并不能延缓疾病进展,大部分患者最终仍因疾病导致生活能力丧失,甚至精神障碍。自1992年Reynolds和Weiss首次成功体外培养神经干细胞后[6],对于神经干细胞(NSCs)的研究一直不断,并渐将其用于PD治疗的研究。但在细胞移植治疗PD过程中如何把握NSCs的分化命运,将其引导分化成具有成熟功能的DA神经元的报道则较少。
核受体相关基因1,也称核受体第4A亚家族第2成员(nuclear receptor subfamily 4,group A,member 2,NR4A2),属于孤束核受体。早期的研究发现,鼠来源Nurr1在胚胎10.5 d即在中脑腹侧表达,并且持续表达于成年脑组织的中脑腹侧和黑质区[7]。此后,多项研究通过基因敲除证实,Nurr1基因的表达与DA神经元的发育合成、成熟及维持均密切相关[8]。这些研究表明,在多巴胺神经元前体细胞(如神经干细胞)向DA神经元方向分化的过程中,Nurr1基因的调控占重要作用[9]。在本实验中,为了研究过表达Nurr1基因对NSCs向多巴胺神经元的分化影响,本课题组构建了携带绿色荧光蛋白(GFP)的pLenO-DCE-Nurr1慢病毒载体,通过转染72 h后细胞的GFP荧光表达来初步确定转染效果,然后将NSCs进一步分化培养后通过Western blot、RT-PCR及免疫荧光来分析TH+多巴胺神经元的分化率。实验结果发现,与对照组相比,过表达Nurr1基因的NSCs分化培养后TH+细胞率明显升高,可达90.60%。进一步研究发现,相对于对照组,这些经Nurr1转染后分化获得的细胞高表达多巴胺转运体(Dopamine Transporter,DAT)及酪氨酸羟化酶(TH)等标志DA神经元成熟的基因。说明过表达Nurr1能促进NSCs向成熟DA神经元分化。另外,在本研究中,还发现慢病毒载体可使NSCs稳定持续过表达Nurr1,甚至在分化培养7 d后的细胞上仍能检测到较强的GFP荧光,进一步通过荧光共定位发现,这些通过慢病毒转染的GFP大多表达于GFAP阳性的胶质细胞上。Saijo等研究提出[10]Nurr1可以通过作用于小胶质细胞和星形胶质细胞来减少炎症因子的分泌从而起保护多巴胺神经元的作用。结合Saijo等研究,可以认为经Nurr1修饰后的NSCs用于移植治疗PD动物模型,不但能够促进NSCs定向分化为成熟的DA神经元,而且Nurr1还极有可能作用于分化后的星形胶质细胞来和局部移植区的小胶质细胞来减少炎症因子的分泌,从而保护经移植分化而来的DA神经元和宿主脑内残留的DA神经元的存活。但具体Nurr1通过什么机制及信号通路来发挥以上作用,还需体内动物实验进一步研究。
目前对于NSCs的基因转染,有病毒转染法和非病毒转染法,其中病毒转染法主要有慢病毒转染法和腺病毒及腺相关病毒转染法。Stephanie M等研究表明腺病毒及腺相关病毒对于神经前体细胞的转染效率不高[11]。故在本研究中,我们构建了pLenO-DCE-Nurr1慢病毒载体,除了目的基因Nurr1外,还携带绿色荧光蛋白(GFP),可在转染后直接通过荧光显微镜观察GFP的荧光表达情况来判断转染效果。在前期预实验中我们发现当MOI小于150,转染72 h后大部分神经球均只有球体周围表达绿色荧光,而将MOI提高至200时,大部分神经球均能在转染72 h后稳定表达绿色荧光,并能成功分化培养。经过Western blot及RT-PCR分析验证,通过慢病毒载体转染(MOI=200),可使NSCs转染效率大于90%,高于国内谭雪峰等利用电穿孔法转染神经干细胞的转染效率(35%)[12]。虽然本实验研究结果表明,经慢病毒载体可高效转染NSCs过表达Nurr1基因,并促进NSCs向多巴胺神经元分化,但较之电穿孔等非病毒转染法,慢病毒转染后的NSCs移植于体内后是否会增加致瘤性仍有待进一步动物实验考证。
对于B和C类型乘客,无法直观确定其下车站点,可以采用概率的方法求得在各个站点下车的概率,选取概率最高者为其下车站点,B类型乘客存在历史相似出行记录,因此其概率是站点上车次数与线路乘坐次数的比值;C类型乘客,出行链较为残缺,没有历史出行记录,因此其概率算法为类型乘客在站点i上车,则在该线路下行站点j…n下车的概率为乘客乘坐该线路在各站点的上车次数. C类型乘客在站点i上车,则在该线路下行站点j…n,下车的概率该站点上车人数,为该站点所有下游站点的上车总人数.
总之,通过本实验可以明确,慢病毒可使NSCs高效过表达Nurr1基因,且过表达Nurr1基因后能促进NSCs向成熟多巴胺神经元转化。通过实验还发现转染后的慢病毒携带的绿色荧光大部分分布于胶质细胞,这是否说明转染后Nurr1还可作用并调控胶质细胞则需进一步研究。另外,Chung S等[13,14]研究指出Nurr1是在Shh-FoxA2 和 Wnt1-Lmx1a两条信号通路共同调控下参与DA神经元的发育合成的。但通过慢病毒体外转染NSCs,促进转染后的NSCs向DA神经元转化是否通过作用于以上两条通路来发挥作用尚不清楚,需进一步研究探讨。
[1]Salat D,Noyce AJ,Schrag A,et al. Challenges of modifying disease progression in prediagnostic Parkinson’s disease[J]. Lancet Neurol,2016,15(6):637.
[2]Deng X,Liang Y,Lu H,et al. Co-transplantation of GDNF-overexpressing neural stem cells and fetal dopaminergic neurons mitigates motor symptoms in a rat model of Parkinson’s disease[J]. PLoS One,2013,8(12):e80880.
[3]王明国,李智高,杨智勇,等. 多巴胺神经元联合中脑神经干细胞移植治疗帕金森病[J]. 中国微侵袭神经外科杂志,2016,21(3):127-130.
[4]Saucedo-Cardenas O,Quintana-Hau JD,Le WD,et al. Nurr1 is essential for the induction of the dopaminergic phenotype and the survival of ventral mesencephalic late dopaminergic precursor neurons[J]. Proc Natl Acad Sci USA,1998,95(7):4013-4018.
[5]Hirsch L,Jette N,Frolkis A,et al. The Incidence of Parkinson’s Disease:A Systematic Review and Meta-Analysis[J]. Neuroepidemiology,2016,46(4):292-300.
[6]Reynolds BA,Tetzlaff W,Weiss S. A multipotent EGF-responsive striatal embryonic progenitor cell produces neurons and astrocytes[J]. J Neurosci,1992,12(11):4565-4574.
[7]Luo Y. The function and mechanisms of Nurr1 action in midbrain dopaminergic neurons,from development and maintenance to survival[J]. Int Rev Neurobiol,2012,102:1-22.
[8]Kadkhodaei B,Ito T,Joodmardi E,et al. Nurr1 is required for maintenance of maturing and adult midbrain dopamine neurons[J]. J Neurosci,2009,29(50):15923-15932.
[9]Decressac M,Volakakis N,Bjorklund A,et al. NURR1 in Parkinson disease--from pathogenesis to therapeutic potential[J]. Nat Rev Neurol,2013,9(11):629-636.
[10]Saijo K,Winner B,Carson CT,et al. A Nurr1/CoREST pathway in microglia and astrocytes protects dopaminergic neurons from inflammation-induced death[J]. Cell,2009,137(1):47-59.
[11]Hughes SM,Moussavi-Harami F,Sauter SL,et al. Viral-mediated gene transfer to mouse primary neural progenitor cells[J]. Mol Ther,2002,5(1):16-24.
[12]谭雪锋,田美玲,金国华,等. 核受体相关因子1 基因过表达诱导神经干细胞分化为多巴胺能神经元[J]. 解剖学报,2011,42(2):159-163.
[13]Chung S,Leung A,Han BS,et al. Wnt1-lmx1a forms a novel autoregulatory loop and controls midbrain dopaminergic differentiation synergistically with the SHH-FoxA2 pathway[J]. Cell Stem Cell,2009,5(6):646-658.
[14]Kim CH,Han BS,Moon J,et al. Nuclear receptor Nurr1 agonists enhance its dual functions and improve behavioral deficits in an animal model of Parkinson’s disease[J]. Proc Natl Acad Sci USA,2015,112(28):8756-8761.
Establish the GFP-Nurr1 modified NSCs and the impact on the differentiation of neural stem cells by Nurr1 Overexpression
CHENXiaoxiang,SONGXiaobing,WANGXiangpeng,etal.
(DepartmentofNeurosurgery,theFirstAffiliatedHospitalofKunmingMedicalUniversity,Kunming650032,China)
Objective To establish the GFP-Nurr1 modified NSCs model via Lentiviral vectors and observe the impact on the differentiation of neural stem cells by Overexpression of Nurr1.Methods pLenO DCE-Nurr1 lentiviral vectors was constructed by genetic recombination technology. P3 NSCs were infected with lentiviral vectors and the effect of transfection was measured by fluorescence expression after 72 hours. The expression of Nurr1 between three groups,which includes control group,empty vector group and DCE-Nurr1 group,was analyzed by Western blot/PCR respectively. The expression of TH among three groups was analyzed via immunofluorescence,Western blot and PCR after 7-days differentiation culture of the transfected NSCs. Results Approximately 90% of NSCs can be transfected by pLenO-DCE-Nurr1 after 72 hours. Nurr1 expression was upregulated in DCE-Nurr1 group,compared to control group. NSCs remains the capacity to differential after transfected by lentiviral vectors,and the TH positive cells was 90.60%,while only 21.2% in the control group. The expression of TH and DAT was also upregulated in DCE-Nurr1 group. Conclusion NSCs overexpression of Nurr1 can be mediated by lentiviral vectors with high efficiency. NSCs derived from embryonic mesencephalic can be induced to TH positive dopaminergic neurons via overexpression of Nurr1.
Nurr1; Gene modification; Lentiviral vectors; Neural stem cells
2017-03-15;
2017-04-18
国家自然科学基金地区科学基金项目(No. 81360197);国家自然科学基金项目(No. 81241126);云南省教育厅科学研究基金项目(No. 2013C227);云南省干细胞与再生医学重点实验室开放课题(No. 201401UH00160) 作者单位:(昆明医科大学第一附属医院神经外科,云南 昆明 650032)
邓兴力,E-mail:dxlkmmu@163.com
1003-2754(2017)05-0388-05
R651
A

