超声微泡造影剂携带PE38生物毒素杀伤血管内皮细胞的实验研究
纪巧,周显礼,凌耿强,王晓蕾,韦虹,杜琳瑶
超声微泡造影剂携带PE38生物毒素杀伤血管内皮细胞的实验研究
纪巧,周显礼,凌耿强,王晓蕾,韦虹,杜琳瑶
目的研究超声微泡造影剂 PLGA-COOH 联合生物毒素PE38 对内皮细胞的杀伤效应。
方法制备超声微泡造影剂 PLGA-COOH,包裹生物毒素PE38 后形成复合物,将血管内皮细胞分为空白对照组、辐照微泡组、PE38 组、复合物组、辐照复合物组,以 TUNEL实验检测凋亡指数,以 Western blot 实验检测 cleaved caspase-3,并进行组间比较。
结果TUNEL 结果显示:辐照微泡组细胞凋亡与空白对照组无显著差异(P = 0.946);PE38 组细胞凋亡较空白对照组显著增加(P < 0.001);复合物组细胞凋亡较 PE38 组显著下降(P < 0.001),较空白对照组显著增加(P < 0.001);辐照复合物组细胞凋亡较 PE38 组显著增加(P < 0.001)。蛋白检测结果与凋亡检测相符。
结论超声造影剂微泡复合物联合生物毒素杀伤血管内皮细胞具有较高的安全性、特异性及有效性,是一种具有前景的肿瘤血管杀伤方法。
超声微泡造影剂; 生物毒素; 内皮细胞
抗血管生成疗法在多种肿瘤的治疗中起着重要的作用,其主要机制之一是抑制肿瘤血供从而“饿死”肿瘤细胞[1]。抑制肿瘤血供主要有两种方式,即阻止内皮细胞构成血管和杀伤肿瘤血管结构。内皮细胞构成血管的信号通路极其复杂,阻断单一通路难以达到彻底抑制肿瘤血供的效果[2]。而杀伤肿瘤血管结构是一种直接有效的方法,目前已有研究证实应用重组免疫毒素能够抑制肿瘤血供[3]。由于重组免疫毒素造价高昂,短时间内大规模应用于治疗对患者负担巨大,因此需要探索一种造价相对低廉的特异性切断肿瘤血供的方法。
超声微泡造影剂是一种造价低廉、可大规模生产的药剂,且其具有包裹携带药物的功能。通过超声辐照,微泡造影剂可以在特定的组织器官内破裂,释放出携带的药物,使药物在局部的浓度明显增高,达到更好的治疗目的[4]。目前对于超声微泡携带生物毒素杀伤肿瘤血管的研究很少。因此,在本研究中我们首次尝试应用超声微泡造影剂包裹非特异性生物毒素形成复合物,并观察其安全性,以及在超声辐照前后其杀伤血管内皮细胞的效果。
1 材料与方法
1.1 材料
1.1.1 试剂 人脐静脉内皮细胞(HUVEC)购自中科院上海细胞库;一抗兔抗人 cleaved caspase-3抗体为上海碧云天生物技术有限公司产品;兔抗人GAPDH 抗体为 LSBio 公司产品;TUNEL 试剂盒为美国 Roche 公司产品。
1.1.2 仪器 声振仪购自爱德森电子有限公司。
1.2 方法
1.2.1 细胞培养及分组 人脐静脉内皮细胞培养于含 5 ng/ml bFGF 和 5% FBS 的 HE-SFM 培养基中,培养箱设置条件为 37 ℃、5% CO2。细胞株分 5 组分别为空白组(未处理)、辐照微泡(阴性对照)组(仅添加超声微泡造影剂,超声辐照)、PE38 组(仅含 PE38 蛋白)、复合物(微泡 + PE38)组(含微泡复合物,不辐照)、辐照复合物(辐照 +微泡 + PE38)组(含微泡复合物,超声辐照)。
1.2.2 PLGA-COOH 超声造影剂的制备 将 1 g聚乳酸-羟基乙酸共聚物(PLGA-COOH)加入 20 ml二氯甲烷中充分搅拌,加入 4 ml 双蒸水,声振仪声振 30 s 成乳化液;将乳化液倒入适量 4% 聚乙烯醇(PVA)溶液中,均质机中均质 5 min,加入 200 ml 2% 异丙醇溶液,室温下搅拌 2 ~ 5 h,使微球表面固化,二氯甲烷尽量自然挥发;多次双蒸水与正己烷洗涤、离心,收集微球、冷冻干燥后充入氟碳气体,即得 PLGA-COOH 微泡超声造影剂冻干粉。
1.2.3 制备携带 PE38 生物毒素的超声造影剂颗粒 通过将前期我们获得的重组质粒pDsRed-PE38-N1 转染 E.coli BL21 感受态细胞,化学裂解法提取包涵体,获得 PE38 表达蛋白,然后用 PBS 溶解,调整浓度为 0.2 mg/ml,有效杀伤细胞的最低毒素浓度为 0.1 mg/ml;将PLGA-COOH 造影剂冻干粉与 PBS 相混合制成造影剂微泡混悬液(浓度为 12.5 mg/ml);将两种溶液 1∶1 混合均匀,4 ℃ 保存备用。
1.2.4 超声辐照 培养瓶置于水槽内,探头距培养瓶底部约 30 mm,超声机械指数 1.4,辐照时间为 60 s。
1.2.5 TUNEL 法计算凋亡细胞数 各组细胞进行相应处理后,应用 TUNEL 试剂盒,按说明书进行试验,在光学显微镜下每组随机取 3 ~ 5 个视野,计算细胞凋亡指数。凋亡指数(%)= TUNEL 阳性细胞数/总细胞数 × 100%。实验重复 2 次。
1.2.6 Western blot 检测 cleaved caspase-3 蛋白表达水平 收集细胞加入 4 ℃ RIPA 中充分裂解。4 ℃ 下 12 000 × g 离心 15 min,上清总蛋白用BCA 法定量。每组 10 μg 总蛋白经电泳分离、转膜。室温下封闭 1 h,加入一抗(兔抗人 cleaved caspase-3 抗体,兔抗人 GAPDH 抗体体积稀释比均为 1∶1000),4 ℃ 过夜;洗膜后加入 HRP 标记的山羊抗兔 IgG(体积稀释比均为 1∶500),室温1 h,洗膜;ECL 试剂显色、采图,Image J 2x 扫描灰度值。实验重复 2 次。以(cleaved caspase-3 灰度值/GAPDH 灰度值)× 100% 表示蛋白表达水平。
1.3 统计学处理
应用 SPSS 13.0 统计软件处理数据,实验数据采用表示,多组间比较采用单因素方差分析,组间两两比较采用 LSD-t 检验,P < 0.05 为差异有统计学意义。
2 结果
2.1 超声微泡造影剂通过胞吞作用进入内皮细胞
如图 1 所示,在细胞培养基中添加微泡造影剂后,细胞将造影剂吞噬至胞内,说明超声微泡造影剂制作成功,可用于携带生物毒素进行细胞杀伤。

图 1 细胞将造影剂微泡吞噬至胞内Figure 1 The microbubbles were phagocytosed into cells
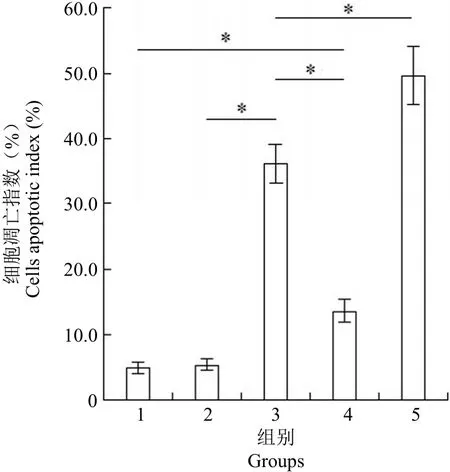
图 2 各组细胞凋亡指数比较(*P < 0.001)Figure 2 The comparison of cells apoptotic index between groups (*P < 0.001)
2.2 内皮细胞在各组条件下的凋亡数测定
如图 2 所示,TUNEL 检测结果显示,各组细胞凋亡指数平均值分别为空白对照组(5.05 ± 1.08)、辐照微泡(阴性对照)组(5.44 ± 1.13)、PE38 组(36.19 ± 3.84)、复合物(微泡 + PE38)组(13.64 ± 2.30)、辐照复合物(辐照 + 微泡 + PE38)组(49.67 ± 5.70),组间比较有统计学差异(F = 327.065,P < 0.001)。阴性对照组与空白组无显著差异(P = 0.946),表明微泡造影剂及超声辐照对细胞无毒性作用;PE38 组细胞凋亡较空白组显著增加(P < 0.001),表明 PE38 毒素对内皮细胞有明显的杀伤作用;将微泡造影剂包裹 PE38 毒素形成复合物后(微泡 + PE38),其对细胞的非特异性杀伤作用较 PE38 组显著下降(P < 0.001),表明微泡造影剂可以保护细胞免受毒素杀伤,但较空白组显著增加(P < 0.001),表明仍有少量 PE38 无法被造影剂包裹;当利用超声辐照将微泡造影剂破坏后(辐照 + 微泡 + PE38),PE38 重新得到释放,同时由于细胞形成微孔,毒素进入胞内增多,该组的细胞凋亡较 PE38 组显著增加(P < 0.001)。
2.3 细胞凋亡标志物 cleaved caspase-3 蛋白水平检测
如图 3 所示,Western blot 检测结果显示,各组 cleaved caspase-3 灰度值占 GAPDH 灰度值的百分比分别为空白组(7.90% ± 0.85%)、辐照微泡(阴性对照)组(8.23% ± 0.91%)、PE38 组(21.63% ± 1.20%)、复合物(微泡 + PE38)组(11.50% ± 0.92%)、辐照复合物(辐照 + 微泡 + PE38)组(74.10% ± 2.89%),组间比较有统计学差异(F = 976.124,P < 0.001)。阴性对照组与空白组无显著差异(P = 0.799);PE38 组表达较空白组显著增加(P < 0.001);微泡 + PE38 组表达较 PE38组显著下降(P < 0.001),但对空白组显著增加(P = 0.018 < 0.05);辐照复合物组的表达较 PE38 组(P < 0.001)及复合物组(P < 0.001)均显著增加。

图 3 各组 cleaved caspase-3 表达比较(A:各组 cleaved caspase-3 Western blot 条带图;B:各组 cleaved caspase-3 比较柱状图;*P < 0.01,**P < 0.001)Figure 3 The comparison of cleaved caspase-3 expression among groups (A: Western blot band of cleaved caspase-3 in each group; B: Histogram of comparison of cleaved caspase-3 among groups;*P < 0.01,**P < 0.001)
3 讨论
生物毒素是一类由植物或细菌产生的天然毒性蛋白,有极强的细胞毒性。绿脓杆菌外毒素(pseudomonas extoxin,PE)是目前研究和应用比较广泛的毒素之一[5]。其主要包含 3 个功能性结构域,即细胞膜结合结构域、转位结构域和核糖化酶活性结构域,既往的研究中将除去细胞膜结合结构域的 PE 毒素称为 PE38[6]。毒素分子通过细胞膜结合结构域与细胞膜表面受体结合后被细胞内吞,在吞饮泡内毒素的细胞膜结合结构域被降解从而暴露出转位结构域,在转位结构域的作用下毒素分子从吞饮小泡转位至胞浆并进入内质网,通过对真核细胞延长因子-2(EF-2)的不可逆性二磷酸核糖化修饰使其失活,从而阻断靶细胞蛋白质合成过程。此毒性过程为一种酶促反应过程,具有高效性,理论上仅一个毒素分子进入细胞就可将其杀死[7]。但是,如何能够引导毒素特异性地杀伤肿瘤血管内皮细胞是要解决的关键问题。
超声造影剂作为血池显像剂能够切实反映组织的血供情况,良好地反映组织的微循环灌注[8],目前已被成熟应用于肝脏、肾脏、胆囊等脏器局灶性病变的定性诊断[9]。近年来,研究发现超声造影剂微泡可以作为靶向治疗的载体。微泡可以以多种方式携带基因或药物,当微泡复合物在“感兴趣区”聚集时,增强该区域声压使微泡破裂、引发药物的定点定时释放,微泡破裂时产生强烈的冲击波及高速微射流在血管壁或生物屏障上形成暂时性微孔,可以增强基因转染或药物传输[10]。Nakaya等[11]在兔类风湿性关节炎模型膝关节腔内注射微泡与氨甲蝶呤混合物,证实在超声暴露下微泡能增强氨甲蝶呤对兔滑膜细胞的抗炎作用。因此,超声造影剂微泡作为向细胞内输送药物的载体为我们应用生物毒素提供了条件。聚乳酸羟基乙酸共聚物PLGA-COOH 是一种具有良好生物相容性的高分子材料,可在体内缓慢降解,最终产物是二氧化碳和水,被广泛用于药物、基因的传递与控释中,是近年来发展起来的一种新型造影剂[12]。
本次实验结果显示,应用 PLGA-COOH 制作的超声微泡造影剂对细胞几乎无毒性,当其包裹PE38 形成复合物后,复合物的生物毒性明显下降。当应用超声辐照将复合物振荡破碎后,PE38 毒素大量释放,且由于细胞受辐照后造影剂破裂影响形成许多微孔,使释放的毒素能更多地进入胞内,比单纯应用 PE38 对内皮细胞产生了更显著的杀伤作用,这表明超声微泡造影剂包裹 PE38 后,复合物安全性更高,对杀伤血管内皮细胞的特异性更明显,有效性亦有所增高。为充分验证各组细胞凋亡水平,我们进一步检测了 caspase-3 裂解产物cleaved caspase-3 的表达。Caspase-3 是细胞凋亡过程中最关键的执行分子之一,它的激活需要被剪切产生有活性的 17 kD 亚基[13]。蛋白检测结果和TUNEL 检测的结果基本相符,从分子水平验证了我们的猜想。但是,复合物在体内实验中能否达到体外实验的效果,需要后续动物实验的进一步验证。
综上,超声微泡复合物联合生物毒素杀伤血管内皮细胞具有较高的安全性、特异性及有效性,是一种具有前景的肿瘤血管杀伤药物。
[1] El-Kenawi AE, El-Remessy AB. Angiogenesis inhibitors in cancer therapy: mechanistic perspective on classification and treatment rationales. Br J Pharmacol, 2013, 170(4):712-729.
[2] Cook KM, Figg WD. Angiogenesis inhibitors: current strategies and future prospects. CA Cancer J Clin, 2010, 60(4):222-243.
[3] Alewine C, Hassan R, Pastan I. Advances in anticancer immunotoxin therapy. Oncologist, 2015, 20(2):176-185.
[4] Zhang Y, Mi CR, Wang W. Research progress of targeted microbubble contrast agent. J Ningxia Med Univ, 2016, 38(4):475-479. (in Chinese)张阳, 米成嵘, 王文. 靶向微泡超声造影剂的研究进展. 宁夏医科大学学报, 2016, 38(4):475-479.
[5] Kaloshin AA, Isakov MA, Mikhailova NA, et al. Preparation of recombinant atoxic form of exotoxin a from pseudomonas aeruginosa. Bull Exp Biol Med, 2013, 154(3):346-350.
[6] Jiang H, Xie Y, Burnette A, et al. Purification of clinical-grade disulfide stabilized antibody fragment variable--Pseudomonas exotoxin conjugate (dsFv-PE38) expressed in Escherichia coli. Appl Microbiol Biotechnol, 2013, 97(2):621-632.
[7] Lin JY, Fu MJ, Xie JM. Research advances in immunotoxin. Strait Pharm J, 2014, 26(9):4-6. (in Chinese)林接玉, 付明娟, 谢捷明. 免疫毒素的研究进展. 海峡药学, 2014, 26(9):4-6.
[8] Dindyal S, Kyriakides C. Ultrasound microbubble contrast and current clinical applications. Recent Pat Cardiovasc Drug Discov, 2011, 6(1):27-41.
[9] Claudon M, Dietrich CF, Choi BI, et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) in the liver--update 2012: a WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS. Ultraschall Med, 2013, 34(1):11-29.
[10] Wang AM, Wu XP. Clinical application and research advance of ultrasound contrast agent. Chin Foreign Med Res, 2015, 13(14):160-162. (in Chinese)汪艾曼, 吴晓萍. 超声造影剂的临床应用和研究进展. 中外医学研究, 2015, 13(14):160-162.
[11] Nakaya H, Shimizu T, Isobe K, et a1. Microbubble-enhanced ultrasound exposure promotes uptake of methotrexate into synovial cells and enhanced antiinflammatory effects in the knees of rabbits with antigen-induced arthritis. Arthritis Rheum, 2005, 52(8):2559-2566.
[12] Wang CW, Du J, Yang SP, et al. Preparation of VEGFR2-targeted PLGA ultrasound contrast agent and in vitro targeting tests. J Shanghai Jiaotong Univ (Med Sci), 2014, 34(6):772-776. (in Chinese)王翠薇, 杜晶, 杨仕平, 等. 携抗VEGFR2抗体PLGA靶向超声造影剂的制备及体外寻靶实验. 上海交通大学学报(医学版), 2014, 34(6):772-776.
[13] Zhang XT, Song TB. The study on Caspase-3 and cell apoptosis. Med Recapitulate, 2002, 8(11):621-623. (in Chinese)张晓天, 宋天保. Caspase-3与细胞凋亡的研究. 医学综述, 2002, 8(11):621-623.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):227-231
关于公布协会2015 – 2016年度分支机构评估结果的通知
为规范协会分支机构管理,促进分支机构工作,协会组织开展了 2015 – 2016 年度分支机构评估。按照《中国医药生物技术协会分支机构评估办法》规定,对协会各分支机构工作进行评分,本次评估设优秀奖 1 名、先进奖 6 名。评估结果已经协会理事长办公会审议通过,现将获奖名单公布如下:
一、优秀奖
组织生物样本库分会
二、先进奖
1.骨组织库分会
2.医药生物技术临床应用专业委员会
3.生物诊断技术分会
4.再生医学专业委员会
5.心电学技术分会
6.精准医疗分会
Experimental study on killing vascular endothelial cells of biological toxin PE38 carried by an ultrasound microbubble contrast-enhanced agent
JI Qiao, ZHOU Xian-li, LING Geng-qiang, WANG Xiao-lei, WEI Hong, DU Lin-yao
ObjectiveTo study the killing effect on endothelial cells of biological toxin PE38 carried by an ultrasound microbubble contrast-enhanced agent PLGA-COOH.
MethodsAn ultrasound contrast-enhanced agent PLGA-COOH was prepared and encapsulated biological toxin PE38. Thevascular endothelial cells were divided into control group (untreated), irradiation microbubble group (only added contrast-enhancedultrasound agent, ultrasonic irradiation), PE38 group (only contained PE38 protein), compound group (contained microbubble compound, no irradiation) and irradiation compound group (contained microbubble compound, ultrasonic irradiation). TUNEL was used to test the apoptotic rate. Western blot was used to test the cleaved caspase-3. The results of both tests were compared among groups.
ResultsThere was no significant difference between the control group and irradiation microbubble group (P = 0.946). The apoptotic rate of PE38 group was significantly higher than that of the control group (P < 0.001). The apoptotic rate of the compound group was significantly lower than that of the PE38 group (P < 0.001), while higher than that of the control group (P < 0.001). The apoptotic rate of the irradiation compound group was significantly higher than that of the PE38 group. The results from Western blot assays were similar to that from the TUNEL assays.
ConclusionThe biological toxin carried by an ultrasound microbubble contrast-enhanced agent has high safety, specificity and effectiveness in killing vascular endothelial cells, and is a promising method in killing tumor blood vessels.
Contrast-enhanced ultrasound microbubble; Biological toxin; Endothelial cells
ZHOU Xian-li, Email: zhouxianli@ems.hrbmu.edu.cn
10.3969/j.issn.1673-713X.2017.03.006
黑龙江省卫生厅科研课题资助项目(2013056)
150086 哈尔滨医科大学附属第二医院住院处超声科(纪巧、周显礼、王晓蕾、韦虹、杜琳瑶);150086 哈尔滨医科大学心肌缺血教育部重点实验室(凌耿强)
周显礼,Email:zhouxianli@ems.hrbmu.edu.cn
2017-03-16
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):227-231
Author Affiliation: In-Patient Ultrasound Department, The Second Affiliated Hospital of Harbin Medical University, Harbin 150086, China (JI Qiao, ZHOU Xian-li, WANG Xiao-lei, WEI Hong, DU Lin-yao); Key Laboratory of Myocardial Ischemia, Harbin Medical University, Ministry of Education, Harbin 150086, China (LING Geng-qiang)

