大鼠局灶性脑缺血再灌注后听觉中枢损伤的研究
吕哲 张颖 张玉波 时美娟 孟晴 路虹
河北医科大学第二医院耳鼻咽喉科(石家庄050000)
大鼠局灶性脑缺血再灌注后听觉中枢损伤的研究
吕哲 张颖 张玉波 时美娟 孟晴 路虹
河北医科大学第二医院耳鼻咽喉科(石家庄050000)
目的探讨大鼠局灶性脑缺血再灌注损伤后听觉中枢的改变及引起听力损伤的可能机制。方法选择健康白色雄性SD大鼠60只,随机分为假手术组和缺血再灌注组,每组30只。采用线栓法制备大鼠大脑中动脉栓塞模型,假手术组只分离颈部血管,不插入线栓。脑缺血60min,再灌注24h。于手术前及术后24h检测听性脑干反应,术后24h行神经功能评分,干湿重法测定脑组织含水量,TTC法检测脑梗死体积,通过Evans blue的渗出情况评估血脑屏障的完整性,末端标记法观察神经细胞凋亡状况,计算凋亡指数。Western blotting法测定MMP-9、Clau⁃din-5、Occludin、PSD-95、CX-43及Na+-α蛋白表达。结果与假手术组比较,缺血再灌注组神经功能评分及脑含水量升高,脑梗死体积增大,ABR反应阈值明显增加,凋亡指数增加,MMP-9、CX-43蛋白表达明显上升,Claudin-5、Occludin、PSD-95、Na+-α蛋白表达显著下降。两组比较差异均具有统计学意义。结论局灶性脑缺血再灌注损伤后听觉中枢的改变及听力损伤可能与MMPs激活、血脑屏障破坏、缝隙连接通道功能活化、突触功能异常及离子通道破坏有关。
缺血再灌注损伤;血脑屏障;缝隙连接;金属蛋白酶9;离子通道
听力障碍严重影响一个人的生活质量和社会交往,许多原因都可导致听力障碍,例如炎症、外伤、老龄化、遗传及脑梗塞。许多临床报告都显示脑卒中患者伴有听力损害[1-2],但是其具体机制研究尚少。
既往对缺血再灌注损伤导致听力损伤研究多集中于耳蜗,对其导致的中枢病变研究较少[3-6]。脑梗塞后可出现听觉处理异常[7]。同样有许多脑梗塞伴听力损伤患者显示有听觉感知如声音定位的障碍,用外周病变很难解释。听皮层是大脑皮质的一个亚皮质区域,也是听觉系统的最高级中枢。初级听皮层神经元的凋亡及退行性变将导致听觉中枢对传入声音信息的感知能力下降,对声音信息的处理和认知能力下降[8]。神经信号发生和传递、转导与缝隙连接、化学突触及离子通道有关,实现细胞间的信息交流。在本研究中,我们通过建立短暂性右侧大脑中动脉闭塞模型,探讨脑缺血导致听力障碍的可能机制,以及听觉皮层损伤是否与激活MMP-9、细胞凋亡,破坏缝隙连接、突触及血脑屏障,进而影响中枢听觉功能有关。
1 材料与方法
1.1实验动物
选择健康白色雄性SD大鼠60只,耳廓反射灵敏、无噪声暴露及耳毒性药物使用史,购于河北医科大学实验动物中心,体重250-280g,以标准饲料喂养,恒温20-25℃,12h光照/12h黑暗环境饲养。动物许可证号:SCXK(冀)2013-1-003。
1.2试剂和仪器
三苯氯化四氮唑(TTC)、兔抗CX43单克隆抗体(美国Sigma公司),兔抗MMP-9多克隆抗体、兔抗Na+-α单克隆抗体、兔抗PSD-95多克隆抗体(美国Abcam公司),兔抗Claudin-5多克隆抗体、兔抗Occludin多克隆抗体、兔抗β-actin多克隆抗体、Evans blue(美国Santa Cruz公司),Tunel试剂盒(Roche公司),羊抗兔IgG荧光抗体(美国Rockland公司),ICS-CHARTR-EP型ABR电位仪(北京麦德森医疗器),Synergyynergy-HT多功能酶标(美国BioTek公司)。
1.3实验方法
1.3.1动物分组和模型:将SD大鼠随机分为2组:对照组(Sham组)和缺血再灌注组(Ischemia-Re⁃ perfusion,I/R组)。每组30只。具体方法为:大鼠以10%水合氯醛麻醉后,分离右侧颈总动脉及颈外、颈内动脉,结扎颈外动脉远端,于颈外动脉上用显微手术剪剪一小口,将标记好的栓线由切口处插入颈内动脉,向上深入约为距颈总动脉分叉处18.5±0.5mm,进线有轻微阻力,堵住大脑中动脉开口。结扎固定。闭塞时间为60min,后轻柔拔出线栓[9]。Sham组只分离颈部血管,不插入线栓。缺血再灌注24h后进行检测和处死、取材。
1.3.2神经功能缺失评分:处死前采用改良的Lon⁃ga的6级5分法单盲进行行为学评分[9]。0分:无神经损伤症状;1分:提尾时不能伸展对侧前肢;2分:提尾时对侧前肢屈曲;3分:行走时轻度向对侧转圈;4分:行走时严重向对侧转圈;5分:不能自发行走,向对侧跌倒。
1.3.3听性脑干反应(auditory brainstem response, ABR)测试:造模前及造模后24小时后,对两组动物进行右耳ABR检测。具体方法为:10%水合氯醛(0.35m l/100g)腹腔注射麻醉,置于隔声屏蔽室内,采用美国ICS听性脑干诱发电位仪检测,使用针式电极,记录电极置于颅顶正中皮下,参考电极置于右耳耳廓皮下,接地电极置于鼻尖。选用短声为刺激声,极性为交替波,速率为21.1次/秒,增益为50k,观察时程为10ms。初始刺激强度从90dB SPL开始,后按5dB SPL逐档递减。至递减到出现两次ABR波Ⅲ波形不一致时,再增加5dBSPL检测。直至重复波形出现一致时,即记为ABR反应阈值。为减少人为误差,同样方法再次测试,两次Ⅲ波重合即可确定为阈值。
1.3.4脑组织含水量测定:大鼠断头快速取脑,冠状切开去除额极。取病变侧约2mm厚脑组织,放入已称重的锡纸中称重。然后用锡纸包裹,放入95℃烤箱中烘干24h,取出恢复至室温称重。采用公式计算脑组织含水量:(脑组织湿重-脑组织干重)/脑组织湿重×100%。
1.3.5脑梗死体积测定:大鼠断头迅速取脑,PBS冲洗,均匀切成5片冠状切片,浸入2%TTC溶液中,37℃温箱中染色30min,4%多聚甲醛固定24h,拍照后应用图像分析软件计算梗死体积。梗死体积百分比=[总梗死体积-(梗死侧半球体积-梗死对侧半球体积)]/梗死对侧半球体积×100%。
1.3.6 Evans blue含量测定:大鼠处死前2h经尾静脉缓慢注射2%Evansblue溶液(4m l/kg),2h后10%水合氯醛麻醉,PBS心脏灌注,经血液循环将脑组织中其它部位的Evansblue溶液冲洗掉。断头取脑并拍照,收集损伤侧大脑半球并称重,用50%三氯乙醇做为匀浆介质进行匀浆(1.5ml/g脑组织)。取上清液,室温静置10min后4℃3000g离心20min。冰上静置10min后将上面的液体完全取出,无水乙醇稀释(液体:无水乙醇=1:3)混匀,酶标仪上620nm处测量吸光度,与标准曲线对照后计算Ev⁃ansblue含量(ug/g脑组织)
1.3.7 TUNEL法检测凋亡神经细胞:麻醉后暴露心脏,自心尖处插入灌注针,以4%多聚甲醛灌注后取脑。参照《大鼠脑立体定位图谱》确定听皮层区域并于显微镜下剥离皮层组织取材。置于4%多聚甲醛中固定24小时以上,石蜡包埋。按照大鼠的冠状位进行切片,5um/片,从听皮层开始到最后,每5张脑片选择一张,常规脱蜡至水,按照试剂盒说明书进行操作,光镜下观察,细胞核内棕黄色为阳性细胞。分别随机选择5个高倍视野,计算凋亡指数:AI=(凋亡细胞数/细胞总数)×100%
1.3.8 Western-blotting检测基质金属蛋白酶(Ma⁃trixmetalloproteinase-9,MMP-9)、紧密连接蛋白-5(Claudin-5)、闭锁蛋白(Occludin)、突触后密度蛋白95(postsynaptic density protein-95,PSD-95)、连接蛋白43(Connexin-43,CX-43)、钠离子通道α(Na+-α)蛋白表达:显微镜下取梗死侧听皮层脑组织,制备脑组织匀浆,12000r/min4℃离心30min后取上清,BCA法蛋白定量。后经变性、上样、电泳、转膜,5%脱脂奶粉室温封闭1h,加入兔抗MMP-9多克隆抗体(1:400)、兔抗Claudin-5多克隆抗体(1:400)、兔抗Occludin多克隆抗体(1:500)、兔抗PSD-95多克隆抗体(1:500)、兔抗CX43单克隆抗体(1:400)、兔抗Na+-α单克隆抗体(1:400)、兔抗β-actin多克隆抗体(1:500),4℃孵育过夜后洗膜,加入羊抗兔IgG荧光抗体(1:3000),37℃孵育1h,远红外荧光扫描成像系统扫描,测定目标带单位密度,以β-actin的表达为内参照,MMP-9/β-actin、Claudin-5/β-actin、Occludin/β-actin、PSD-95/ β-actin、CX-43/β-actin、Na+-α/β-actin比值代表各蛋白相对表达水平。
1.4统计学方法
2 实验结果
2.1神经功能缺失评分、脑组织含水量和脑梗死体积比较
Sham组无行为学改变,脑组织经TTC染色后显示出均匀的红色(图1)。与Sham组比较,I/R组则表现出不同程度的脑缺血性损伤的表现,例如不同程度的前肢屈曲,转圈,对侧肢体瘫痪等症状,表明缺血再灌注后造成了明显的神经功能缺损。用干湿重法测得到脑组织含水量显示,I/R组病变侧脑组织含水量明显升高;病变侧脑组织经TTC染色后显示为大范围苍白色梗死区域(图1)。两组神经功能缺失评分、脑组织含水量和脑梗死体积比较,差异均具有统计学意义(P<0.01)(表1、图1)。
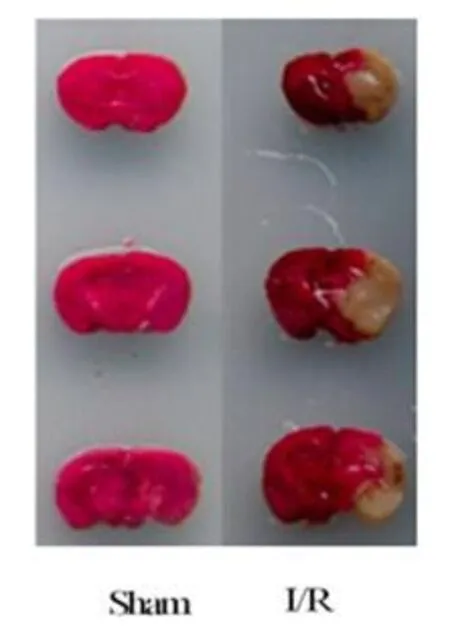
图1 Sham组和I/R组TTC染色Fig.1 The TTCStaining of Sham and I/R groups
表1 I/R 24h后两组神经功能评分、脑组织含水量、脑梗死体积、脑组织EB含量及凋亡指数测定结果(±s)Table 1 The Resultof neurologicalscores、water content、infarctvolume、EBContentsand AIat24hrs post-operation(±s)

表1 I/R 24h后两组神经功能评分、脑组织含水量、脑梗死体积、脑组织EB含量及凋亡指数测定结果(±s)Table 1 The Resultof neurologicalscores、water content、infarctvolume、EBContentsand AIat24hrs post-operation(±s)
Groups Sham group I/R group tP Neurological Scores(n=30)0 3.60±0.55 -35.851 <0.001 Water Contentof Brain(%)(n=5)75±2.45 83.60±3.36 -4.6244 =0.002 InfarctVolume(%)(n=5)0 61.80±2.39 -57.8197 <0.001 EB Contents(ug/g)(n=5)0.74±0.02 3.46±0.04 -136 <0.001 AI(%)(n=5)3.4±1.5 41.6±3.3 -23.5641 <0.001
2.2 ABR反应阈
造模前两组ABR反应阈分别为24.38±4.35和24.88±3.85dB SPL,两组比较差异无统计学意义。造模后分别为24.88±3.85和55.60±3.36dBSPL。两组比较差异有统计学意义,P<0.01。Sham组造模前后比较差异无统计学意义。I/R组造模前后比较差异有统计学意义,提示听力严重损伤。(表2、图2)

图2 Sham组和I/R组ABR检测结果Fig.2 TheABRRssultof Sham and I/R groups(A:Sham group;B:I/R group)
2.3 Evansblue含量测定
缺血再灌注后24h,通过测量酶标仪上吸光度来检测脑组织中Evans blue的漏出量来评估BBB的完整性,结果显示,I/R组缺血侧Evansblue渗漏较Sham组明显增加,差异均具有统计学意义(P< 0.01)(表1、图3)。
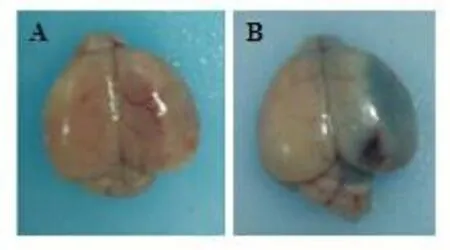
图3 Evansblue染色A:Sham组;B:I/R组Fig.3 The Evansblue Staining of Sham and I/R groups(A:Sham group;B:I/R group)
2.4 TUNEL法检测凋亡神经细胞
TUNEL法可以原位特异性的显示检测凋亡细胞。结果显示缺血再灌注后24h,I/R组病变侧梗死灶周边组织阳性细胞明显增多,两组AI比较为41.6±3.3%vs 3.4±1.5%,差异具有统计学意义(P< 0.01)。细胞形态上有改变,例如核浓缩,DNA片段化,凋亡小体等,提示缺血再灌注可以诱导细胞凋亡的发生(表1、图4)。

图4 神经细胞Tunel染色(×200)A:Sham组;B:I/R组;Fig.4 The TunelStaining ofneuralcells(×200)(A:Sham group;B:I/R group)
2.5 MMP-9、Claudin-5、Occludin、PSD-95、CX-43、Na+-α蛋白表达
Sham组皮层脑组织中有少量MMP-9蛋白表达,大量Claudin-5、Occludin、PSD-95、Na+-α蛋白表达。I/R组缺血皮层MMP-9、CX-43蛋白表达明显上升,Claudin-5、Occludin、PSD-95、Na+-α蛋白表达显著下降,两组比较差异具有统计学意义(P< 0.01)(图5、图6、图7)。

图5 Western-blotting检测MMP-9和CX-43蛋白表达A、B:MMP-9;C、D:CX-43*P<0.01vs Sham组Fig.5 The Protein Expression of MMP-9 and CX-43 by Wesern-blotting(A、B:MMP-9;C、D:CX-43),*P<0.01vs Sham group
表2 两组实验动物右耳ABR检测结果(±s,n=30,dBSPL)Table2 TheABRResultof the RightEarof two Groups(±s,n=30,dBSPL)
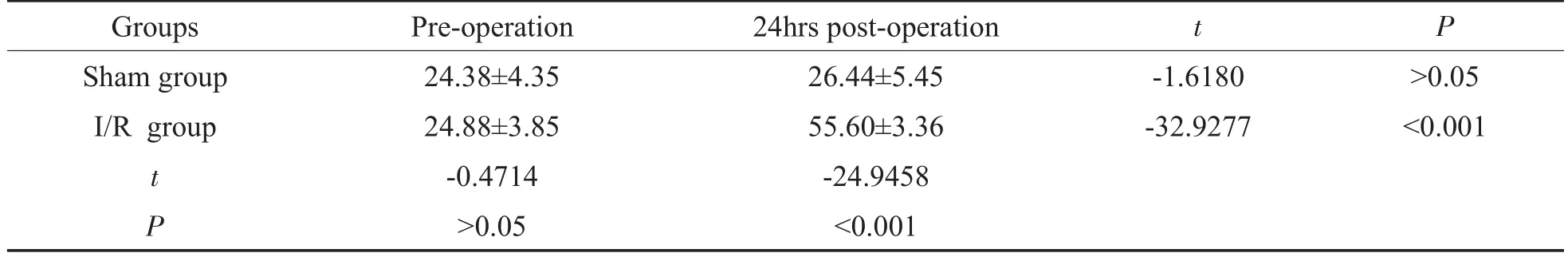
表2 两组实验动物右耳ABR检测结果(±s,n=30,dBSPL)Table2 TheABRResultof the RightEarof two Groups(±s,n=30,dBSPL)
Groups Sham group I/R group t P Pre-operation 24.38±4.35 24.88±3.85 -0.4714 >0.05 24hrspost-operation 26.44±5.45 55.60±3.36 -24.9458 <0.001 -1.6180 -32.9277 >0.05 <0.001 tP
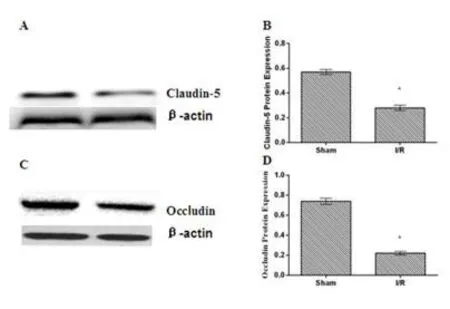
图6 Western-blotting检测Claudin-5和Occludin蛋白表达A、B:Claudin-5;C、D:Occludin*P<0.01vs Sham组Fig.6 The Protein Expression of Claudin-5 and Occludin by Western-blotting(A、B:Claudin-5;C、D:Occludin),*P< 0.01vs Sham group

图7 Western-blotting检测PSD-95和Na+-α蛋白表达A、B:PSD-95;C、D:Na+-α*P<0.01vs Sham组Fig.7 The Protein Expression of PSD-95 and Na+-αbyWestern-blotting(A、B:PSD-95;C、D:Na+-α),*P<0.01vs Sham group
3 讨论
脑缺血再灌注后可以引发一系列复杂的分子学和生化机制,包括细胞凋亡、血脑屏障、基质金属蛋白酶激活、缝隙连接、突触异常、离子通道开放等。这几种因素相互作用,构成一个非常复杂的调控网络,造成系列病理级联反应[10]。我们应用线栓法建立局灶性脑缺血再灌注损伤(I/R)模型,手术操作简便,创伤小,可良好模拟人类大脑中动脉局灶性脑缺血状态。I/R后通过神经功能评分、脑含水量及梗死体积测定提示大脑皮质损伤。对听觉通路高级中枢听皮层的进一步检测提示神经元出现结构和功能的变化,本研究实验组在缺血再灌注24h后ABR反应阈较Sham组显著升高,说明外周听觉神经至脑干通路的神经电活动异常,听功能出现损害,提示在脑卒中大鼠存在着听力损害。
BBB是维持并稳定中枢神经系统内环境的重要结构,脑微血管内皮细胞及其间紧密连接(tight junction,TJ)是BBB的核心结构。Claudin-5及Oc⁃cludin是构成TJ的主要蛋白。脑缺血时可以激活炎性细胞因子,如NF-κB、IL-6等,促进与炎症有关的细胞因子表达,扩大炎症反应[11]。NF-κB还可以调节某些促炎性基因如MMP-9的表达。脑缺血再灌注后激活的神经元、胶质细胞以及浸润的中性粒细胞均能释放MMP-9。而MMP-9可以攻击TJ蛋白和毛细血管基底膜,导致白细胞浸润、血管源性水肿及BBB开放。同时中枢神经系统产生大量氧自由基,增加兴奋性氨基酸释放,增强血脑屏障的通透性[12]。吴捧莲等[13]发现脑缺血再灌注后MMP-9表达升高,claudin-5表达降低,而PJ34可以通过抑制MMP-9表达,增加claudin-5表达来维持血脑屏障通透性,对I/R损伤有神经保护作用。Zehendner等[14]报导凋亡会通过降解occludin和Claudin-5而致TJ蛋白改变。与上述所有研究一样,我们也发现脑缺血时MMP-9蛋白表达增加,说明MMP-9积极参与了缺血的病理过程。I/R后通过Tunel染色发现凋亡细胞增多,Occludin及Clau⁃din-5蛋白表达显著下降。Occludin及Claudin-5表达减少使微血管完整性破坏,从而使BBB破坏,并可使缺血后大脑炎症细胞因子渗透入脑[15]。结合Evansblue染色及含量测定结果,提示微血管完整性破坏,BBB破坏。
细胞连接是细胞间、细胞与细胞外基质之间的一些特化的连接装置。神经细胞通过缝隙连接(gap junction,GJ)及化学突触进行神经信息传递和转导,实现细胞间的信息交流。神经细胞缺血后可通过GJ以“钙波”形式改变周围细胞内的钙离子浓度,从而使缺血损伤蔓延[16]。研究表明,抑制GJ功能可以减轻脑缺血再灌注损伤[17]。脑组织中分布最广泛的是CX43蛋白。活化后的星形胶质细胞通过CX43半通道释放一系列物质作用于星形胶质细胞,释放更多的炎症物质和其它物质促进神经元死亡[18]。突触是神经元之间信息交流的物质结构基础,神经元突触对脑缺血损伤极为敏感,可以导致突触数目、结构及功能的变化,进而直接影响神经信息的传递。PSD95是突触后致密物中的主要蛋白,与突触活动、细胞内信号转导及离子通道有关。研究表明脑缺血时PSD95直接参与了缺血信号的转导,PSD95的改变直接影响突触的传递功效,对突触功能和神经元存活有明显影响[19-20]。我们的研究同样也证实了I/R后CX43蛋白表达明显升高,PSD-95蛋白表达显著降低,提示脑缺血后缝隙连接通道功能活化和突触功能异常。
离子通道是神经信号发生和传递的基本单元,并可影响神经递质的释放、兴奋性突触后电位等。神经细胞通过它们进行神经信息传递和转导,实现细胞间的信息交流。钠通道是由α,β亚基组成的跨膜糖蛋白,钠电流可引起细胞的去极化和传导兴奋,是细胞动作电位产生的结构基础。缺氧时Na+内流持续增加导致细胞内Na+增多,引起继发性钙超载、兴奋性氨基酸和自由基释放增加,以及水和氯离子内流并使细胞肿胀,最终导致细胞损伤和坏死的级联反应[21]。我们的研究证实I/R后Na+-α蛋白表达降低,提示Na+介导的电流中断或失活,这可能是缺血后听力损伤的可能机制之一。
因此,我们推测,在脑缺血再灌注导致听皮层损伤及听力受损的过程中,脑缺血激活炎性细胞因子及神经元、胶质细胞后,MMP-9表达上调,TJ蛋白和毛细血管基底膜破坏,BBB渗透性增加。同时缺血再灌注影响细胞周围钙离子浓度及兴奋性氨基酸的释放,影响细胞之间的缝隙连接、突触及离子通道,进一步影响神经信息传递和转导。但是,听觉的形成是非常复杂的过程,ABR异常结果有可能受到其他因素影响,缺血对耳蜗的血供影响,血管纹、毛细胞等的异常,也会对ABR的阈值异常产生影响,听觉系统的改变单独用中枢或外周器官听觉器官的损伤或结构改变来解释并不能得到满意的答复。脑缺血再灌注后听力损伤,其机制是一个多环节、多途径、多因素的级联反应,每种因素并非是单独存在,而是相互影响或互为因果。本研究只是对脑缺血再灌注后听皮层的神经元的病理变化进行了初步探讨,对于外周器官的变化,如耳蜗、毛细胞等等变化并未进行观察,同时对于缺血再灌注后ABR不同频率的听阈、潜伏期改变及中枢传导时间变化并未进行检测,这将是我们下一步研究的重点。
1 Edwards DF,Hahn MG,Baum CM,et al.Screening patients with stroke for rehabilitation needs:validation of the post-stroke reha⁃bilitation guidelines[J].Neurorehabil Neural Repair,2006,20(1): 42-48.
2 Bamiou DE,Werring D,Cox K,et al.Patient-reported auditory functions after stroke of the central auditory pathway[J].Stroke, 2012,43(5):1285-1289.
3汪志伟,杨海弟,李永贺等.盐酸椒苯酮胺对豚鼠耳蜗缺血再灌注损伤后细胞凋亡的影响[J].中国听力语言康复科学杂志, 2015,13(2):117-119.
Wang ZW,Yang HD,Li YH,et al.Effect by piperphentonamine hy⁃drochliride on apoptosis in cochlea of guinea pigs with ischemia reperfusion injury[J].Chinese Scientific Journal of Hearing and Speech Rehabilitation,2015,13(2):117-119.
4姜振东,钟诚,李太军等.大鼠耳蜗缺血再灌注后APE/Ref-1表达研究[J].中华耳科学杂志,2014,12(1):147-150.
Jiang ZD,Zhong C,Li TJ,etal.Expression of APE/Ref-1 in the co⁃chlear ischemia and reperfusion injury in rats[J].Chinese Journal ofOtology,2014,12(1):147-150.
5施宁华,张志坚,许燕等.全脑缺血再灌注后大鼠耳蜗组织内巢蛋白与神经生长因子的表达[J].江苏大学学报,2011,21(1):5-8.
ShiNH,Zhang ZJ,Xu Y,etal.Expression of nestin and NGF of co⁃chlea in rats after whole cerebral ischemia-reperfusion[J].Journal of Jiangsu University,2011,21(1):5-8.
6梁媛,张淑君,张勋等.5-磷酸二酯酶抑制剂对噪声性聋影响到实验研究[J].中华耳科学杂志,2016,14(1):99-103.
Liang Y,Zhang SJ,Zhang X,et al.Effect of a PDE5 inhibitor on noise-induce hearing loss[J].Chinese Journal of Otology,2016,14 (1):99-103.
7 Rey B,Frischknecht R,Maeder P,etal.Patterns of recovery fol⁃lowing focalhemispheric lesions:relationship between lasting def⁃icit and damage to specialized networks[J].Restor Neurol Neuro⁃sci,2007,25(3-4):285-294.
8任红苗,王宜南,陈继川.年龄相关性听力损失小鼠听皮层神经元凋亡及听功能变化[J].中华耳科学杂志,2013,11(3):457-460.
Ren HM,Wang YN,Chen JC.Electrophysiological and pathological changes in C57BL/6Jmice with age-related hearing loss[J].Chi⁃nese JournalofOtology,2013,11(3):457-460.
9 Longa EZ,Weinstein PR,Carlson S,et al.Reversiblemiddle cere⁃bral artery occlusion without craniectomy in rats[J].Stroke,1989, 20(1):84-91.
10 Kappelle LJ,Van DerWorp HB.Treatmentor prevention of compli⁃cations of acute ischemic stroke[J].Curr Neurol Neurosci Rep, 2004,4(1):36-41.
11 Savarin C,Stohlman SA,Rietsch AM,et a1.MMP9 deficiency doesnotdecrease blood-brain barrier disruption,but increasesas⁃trocyte MMP3 expression during viral encephalomyelitis[J].Glia, 2011,59(11):1770-1781.
12郭向飞,赵雅宁,李建民等.阻塞性睡眠呼吸暂停低通气综合征模式低氧对脑缺血再灌注大鼠学习记忆的影响[J].中华耳鼻咽喉头颈外科杂志,2016,51(4):282-285.
Guo XF,Zhao YN,Li JM,etal.Effectof obstructive sleep apnea hy⁃poxia on learningmemory capacity after cerebral ischemiareperfu⁃sion in rats[J].Chin JOtorhinolaryngol Head Neck Surg,2016,51 (4):282-285.
13吴捧莲,李岩,付新慧等.PJ34对大鼠局灶性脑缺血再灌注脑组织MMP-9、Claudin-5表达的影响[J].中国医科大学学报,2015, 44(8):694-699.
Wu PL,Li Y,Fu XH,et al.Influence of PJ34 on the expression of MMP-9 and Claudin-5 in ratwith focal cerebral ischemiareperfu⁃sion injury[J].Journal of China Medical University,2015,44(8): 694-699.
14 Zehendner CM,Librizzi L,de Curtis M,et al.Caspase-3 contrib⁃utes to ZO-1 and Cl-5 tight-junction disruption in rapid anoxic neurovascularunitdamage[J].PLoSOne,2011,6(2):e16760.
15 Shichita T,Sugiyama Y,Ooboshi H,et al.Pivotal role of cerebra interleukin-17-producing gammadeltaT cells in the delayed phaseof ischemic brain injury[J].NatMed,2009,15(8):946-950.
16周子懿,高俊鹏,卢鸿基等.缝隙连接蛋白43参与灯盏生脉胶囊对大鼠脑缺血再灌注损伤的保护作用[J].实用医学杂志,2015, 31(15):2430-2433.
Zhou ZY,Gao JP,Lu HJ,et al.Neuroprotective effect of Dengzhan Shengmai capsule on ischemia/reperfusion in rats[J].The Journal ofPracticalMedicine,2015,31(15):2430-2433.
17 Wang N,De Vuyst E,Ponsaerts R,et al.Selective inhibition of Cx43 hemichannels by Gap19 and its impact on myocardial isch⁃emia/reperfusion injury[J].Basic ResCardiol,2013,108(1):309.
18 Kerr NM,Johnson CS,Zhang J,et al.High pressure-induced retinal ischemia reperfusion causes upregulation of gap junction protein connexin43 prior to retinal ganglion cell loss[J].Exp Neurol,2012, 234(1):144-152.
19 Bo Wang,Bohua Hu,Shiming Yang.Cell junction proteins within the cochlea:A review of recent research[J].Journal of Otology, 2015,10(4):131-135.
20刘洋,孙建宁,董世芬等.永久性局灶性中动脉阻断脑缺血(pM⁃CAO)模型大鼠脑内突触相关蛋白表达的免疫组织化学观察[J].中国比较医学杂志,2012,22(8):43-49.
Liu Y,Sun JN,Dong SF,et al.Immunohistochemical observation of brain synaptic proteins in the ratmodels of permanentmiddle ce⁃rebral artery occlusion(pMCAO)[J].Chinese Journal of Compara⁃tiveMedicine,2012,22(8):43-49.
21丁超,郭洁,王冬梅等.重组人脑钠肽对兔缺血再灌注后心室肌细胞L-钙离子通道电流的影响[J].中国循证心血管医学杂志, 2013,5(1):73-75.
Ding C,Guo J,Wang DM,et al.Influence of recombinant human brain natriuretic peptide on current of ventricularmyocyte L-type calcium channels in rabbits after myocardial ischemia-reperfu⁃sion[J].Chin JEvid Based Cardiovasc Med,2013,5(1):73-75.
Auditory center injury after focalcerebral ischem ia-reperfusion injury in RATS
LVZhe,ZHANGYing,ZHANGYubo,SHIMeijuan,MENGQing,LUHong
DepartmentofOtolaryngology,Second HospitalofHebeiMedicalUniversity,Shijiazhuang 050000,China
LUHong Email:wx_900804@163.com
Objective To investigate themechanism of auditory center injury and hearing loss after focal cerebral ischem ia-reperfusion injury in rats.M ethods Sixty healthy male adult SD rats were random ly divided into an ischemia-reperfusion(I/R)group and a sham operation group(n=30 in each group).For rats in the I/R group,themiddle cerebral artery occlusion(MCAO)modelwas established by suturing,w ith ischemia for 60mins followed by reperfusion for 24 hrs;while for those in the control group,only cervical vessels isolation was performed w ith no thread embolism inserted.The auditory brainstem response(ABR)was tested before and at24 hrs after operation,respectively.At24 hrs post-operation,neurological function,changes of water content in the brain(using dry-wetweightmethod)and infarct volume(using TTCmethod)weremeasured.The integrity of blood-brain barrier(BBB)was also evaluated by view ing exudation of Evans blue,and apoptosis of neurocyteswas exam ined by TUNEL to determ ine the apoptotic index(AI). Expression of MMP-9,Claudin-5,Occludin,PSD-95,CX-43 and Na+-αprotein were tested by Western blotting.Results Compared w ith the sham operation group,neurological function scores,infarct volume and water contentof brain were higherw ith elevated ABR thresholdsand AIin the I/R group.Expression ofMMP-9 and CX-43 proteinwas significantly up-regulated,while expression of Claudin-5,Occludin,PSD-95 and Na+-αprotein was significantly down-regulated.Conclusions Themechanism of hearing loss after focal cerebral ischem ia-reperfusion injury is perhaps related to MMPsactivation,BBB damage,gap junction activation,synaptic dysfunction and destruction of ion channels.
Ischemia-reperfusion injury;Blood-brain barrier;Gap junction;Matrix metalloproteinase-9;Ion channels
R764
A
1672-2922(2017)02-222-7
2017-02-02审核人:郭维维)
10.3969/j.issn.1672-2922.2017.02.016
吕哲,硕士,副主任医师,耳聋及眩晕的基础和临床研究
路虹,Email:wx_900804@163.com

