石榴蜜中多酚类成分测定及其抗氧化活性的研究
谭洪波+王丽华++张红城++吴黎明


摘要:利用固相萃取-高效液相色谱研究了6个石榴蜜样品中多酚类成分含量,以及石榴蜜对DPPH 自由基的清除作用,通过ORAC法测定其抗氧化能力,并对其还原力进行测定。结果表明,石榴蜜的总酚含量在 29.28~37.25 mg/100 g 之间,总黄酮含量在 2.31~2.47 mg/100g,其中酚酸含量较高的样品1和样品2抗氧化能力较强。石榴蜜各样本中均含脱落酸、木樨草素及芹菜素3种酚类化合物。同时,所有石榴蜜样品均具有一定的抗氧化活性,与总酚含量呈现量效关系,呈正相关。
关键词:石榴蜜;总酚;总黄酮;抗氧化活性
中图分类号: S896.1;R284.1文献标志码: A文章编号:1002-1302(2017)08-0179-04
蜂蜜是指蜜蜂采集蜜源植物的花蜜、分泌物或蜜露,并与自身分泌物混合后,经充分酿造而成的天然甜物质[1],是公认的具有多种生物学活性的天然食品[2]。近年来对蜂蜜的研究主要集中在各种活性成分及抗氧化等活性能力方面。多酚类成分是蜂蜜中的重要活性物质之一,包括黄酮、单宁、酚酸及其衍生物等[3]。酚酸是蜂蜜中的主要多酚类化合物,具有抗氧化等多种保健功能[4]。黄酮类化合物具有抗氧化、抗癌、抗菌、抗炎[5]等生物学活性。由于蜂蜜蜜源植物的不同,蜂蜜中的酚酸和黄酮类化合物的含量和种类也有很大差异。
石榴树(Punica granatum L.)为石榴蜜蜜源,是桃金娘目石榴科石榴属多年生落叶乔木或灌木。石榴在全国部分地区有分布,可食用的名品有安徽淮北百子糖石榴、山东枣庄软子石榴、陕西临潼石榴、广西胭脂红石榴、四川青皮石榴以及云南蒙自青壳石榴等。云南省地理气候特征独特又复杂,区域差异非常明显,在此条件下孕育出了极其丰富的蜜源植物。云南省一年四季如春,花开不断,养蜂条件优越,出产的蜂蜜品种较多,但关于该地区石榴蜜中酚酸、黄酮类化合物含量的报道较少。本研究测定 6 个云南石榴蜜样品中多酚类成分的含量,并对其抗氧化活性进行研究,旨在发现石榴蜜的保健功能,以期为开发云南的特色蜂蜜提供一定的理论依据。
1材料与方法
1.1试验材料与试剂
1.1.1样品6个石榴蜜样品均为2015年产自云南省,1、2号蜜样采自蒙自县;3、4号蜜样采自巧家县;5、6号蜜样采自建水。样品采集后均置于4 ℃冰箱保存。
1.1.2試剂三氯化铁、三氯乙酸、铁氰化钾、磷酸二氢钠、磷酸氢二钠、亚硝酸钠、邻苯三酚、碳酸钠、氢氧化钠、硝酸铝、鲁米诺等均为分析纯,均购自北京化学试剂公司;1,1-二苯基-2-苦基苯肼DPPH,荧光素钠(sodium fluorescein),6-hydroxy-2,5,7,8-tetramethylchr- oman-2-carboxylic acid trolox,2,2,-azobis(2-methylpropionamidine) dihydrochloride ABAP均购自美国Sigma公司;甲醇购自美国Fisher公司;没食子酸(98%)、脱落酸、芸香苷对照品购自上海佳和生物科技有限公司;木樨草素、芹菜素购自四川成都生物技术有限公司;乙酸购自J.T Baker公司;Strata-X-A固相萃取柱(60 mg/3 mL)购自广州菲罗门科学仪器有限公司。
1.1.3主要仪器与设备微量移液器,购自德国Eppendorf公司;AL204型分析天平,购自梅特勒-托利多仪器有限公司;SHB-Ⅲ循环水式真空泵,购自长城科工贸有限公司;DZF-6090型真空干燥箱,购自科学仪器有限公司;超纯水系统,购自Merk Millipore公司;KQ-50DB型数控超声波清洗器,购自超声仪器有限公司;HZS-H型水浴摇床,购自东明医疗仪器厂;24孔固相萃取装置,购自美国Supelco公司;恒温水浴氮吹仪,购自北京科林工贸有限公司;SY21-K型电热恒温水浴锅,购自北京长风仪器仪表公司;Synergy TM HT型多功能酶标仪,购自美国Bio-tek公司;LC-6AD高效液相色谱仪,购自日本岛津公司。
1.2方法
1.2.1蜂蜜提取液的制备在Dimitrova和孙春丽研究[6-7]的基础上进行了改进,具体步骤如下:(1) 对固相萃取柱预处理,用3 mL甲醇进行活化,用3 mL pH值=7的超纯水进行平衡;(2) 称取蜂蜜样品30 g,用120 mL超纯水稀释,玻璃棒搅拌至蜂蜜完全溶解。然后用氨水调节至pH值=7,8 000 g离心除去固体不溶物,取上清液倒入处理好的固相萃取柱中。上样结束后,用3 mL的超纯水 (pH值=7) 清洗,然后用 5 mL 甲酸甲醇 (5 ∶95,V/V) 溶液进行洗脱。将洗脱液在 45 ℃ 恒温水浴中用氮吹至干燥,然后用2 mL色谱级甲醇溶液复溶,最后用0.22 μm滤膜过滤后放于上样瓶中4 ℃保存备用。
1.2.2蜂蜜提取物中总酚含量的测定[8]采用Folin-Ciocalteu法,以没食子酸作为对照建立总酚含量标准曲线,吸取30 μL蜂蜜提取液,以没食子酸相对含量表示,每1个品牌的蜂蜜样品做3次平行试验。
1.2.3蜂蜜提取物中总黄酮含量的测定[8]采用AICI3 法,以芸香苷作为对照建立总黄酮标准曲线,吸取1 mL蜂蜜提取物溶液,用芸香苷的相对含量表示样品中黄酮含量,每1个品牌的蜂蜜样品做3次平行试验。
1.2.4DPPH自由基清除能力测定将蜂蜜样品用超纯水分别稀释成2.5、2.0、1.5、1.0、0.5 g/mL,吸取1 mL稀释后的蜂蜜样品,并加入0.2 mmol/L 的4 mL DPPH溶液(2 mmol/L)以及5 mL对应的溶剂,混匀,于室温下避光静置30 min。然后,在波长517 nm处测定石榴蜂蜜样品的吸光度,计算石榴蜜样品对DPPH自由基的清除率[9]。
DPPH自由基清除率=(D0-D)/D0×100%;
式中,D0表示空白试剂的吸光度,D表示石榴蜜样品溶液吸光度。
1.2.5蜂蜜还原力的测定蜂蜜中的多酚类化合物能够将[Fe(CN)6]3- 还原成为[Fe(CN)6]4-,3分子的[Fe(CN)6]4- 和FeCl3又能转化为Fe4[Fe(CN)6]3-,这种物质称为普鲁士蓝,是1种深蓝色的复合物,在700 nm处有强吸度[10]。
在10 mL的试管中分别加入200 μL稀释成不同浓度的蜂蜜水溶液,然后依次加入0.2 mol/L的磷酸盐缓冲液(pH值= 6.6)2.5 mL、铁氰化钾(2.5 mL,1%),水浴20 min (50 ℃),冷却至室温后加入1 mL 三氯乙酸(10%),取上清液2.5 mL,加入蒸馏水2.5 mL,三氯化铁0.5 mL (0.1%),700 nm下测定石榴蜜样品的吸光度。以不同浓度Trolox对比溶液吸光度作标准曲线(y=0.001 62x+0.153 17,r2=0990 54),不同浓度蜂蜜样品根据吸光度变化对照标准曲线,计算其Trolox当量,结果用mg Trolox/100 g表示。
1.2.6过氧阴离子清除能力(ORAC法)的测定在Zulueta等研究[11]的基础上进行了改进,具体步骤如下:吸取20 μL的稀释后的蜂蜜样品液至96孔板中,然后在每个加样孔中加入150 μL 荧光素溶液 (8.16×10-2 μmol/L ),覆膜后预热(37 ℃)10 min。加入30 μL的ABAP (153 mmol/L),使用荧光酶标仪进行测定。酶标仪测定条件:发射波长是528 nm、激发波长是485 nm、振荡5 s后测定1次/min,总测定时间为50 min。ORAC值为μmol Trolox/100 g。
抗氧化能力=AUC(抗氧化剂)-AUC(空白)。
样品得出的面积差代入Trolox标准曲线即可得出该样品相应的Trolox当量,换算成美国农业部的单位即为该样品的ORAC值(IC50),ORAC值越大代表抗氧化能力越弱。
1.2.7HPLC色谱条件色谱柱:150×4.6 mm,5μm (Phenomenex Gemini C18),具体参数设置:检测波长280 nm、柱温箱温度35 ℃、进样量为20 μL。流动相:B相是甲醇 (含有2%乙酸),A相是水 (含有2%乙酸)。梯度洗脫程序如下:0~8 min,0%~3% B;8~10 min,3%~9% B;10~12 min,9~33;12~16 min,33% B;16~21 min,33%~34% B;21~31 min,34%~36% B;31~41 min,36%~40% B;41~51 min,40%~45% B;51~61 min,45%~52% B;61~71 min,52%~57% B;71~81 min,57%~65% B;81~86 min,65%~99% B;86~110 min,99%~100% B;总流速为0.7 mL/min。
1.3数据处理
使用SPSS 13.0软件,采用邓肯法对数据进行方差分析[12]。
2结果与分析
2.1石榴蜜中总酚和总黄酮含量
由表1可知,不同的石榴蜜样品的总酚和总黄酮含量具有一定的差异。4号蜜的总酚含量最低,仅为29.28 mg/100 g;1号蜜和2号蜜的总酚含量较高,分别为37.25、35.18 mg/100 g。其中,样品1、2、6总酚含量之间差异不显著,样品1、3、4之间呈显著差异。
此外,不同石榴蜜样品的黄酮含量相差不大,在 2.31~2.47 mg/100 g 之间,各样本之间差异不显著。同时,各样品的黄酮含量和总酚含量并无明显的相关性。
2.2石榴蜜的抗氧化能力
总酚和总黄酮含量较高的1号蜜样和2号蜜样具有较高的清除DPPH·自由基的能力,IC50值分别为(45.54±9.73)、(47.98±7.83) mg/mL;4号蜜的IC50值为(78.54±11.01) mg/mL,是6个样品中清除DPPH·自由基能力最弱的。6个样品清除DPPH·自由基能力由大到小依次为2>1>5>6>3>4(表2)。
由表2可知,6个石榴蜜样品均具有一定强度的还原力,在157.64~179.67 mg Trolox/100 g蜂蜜之间,并差异不显著。这表明采自不同地区的同一品种石榴蜜,还原能力并无明显差异,即石榴蜜的还原能力可能与蜜源植物的地域并无线性关系。
氧化自由基吸收能力测定法(ORAC方法),已成为衡量食品抗氧化能力的标准方法,美国农业部2007、2010年公布的一系列食品的抗氧化能力都是采用ORAC法测定的[13-14]。各样本石榴蜜都有明显的抗氧化性,其中2号蜜的抗氧化能力最强,ORAC值为(210.73±10.98) μmol Trolox/100 g,与3、5、6号蜜之间呈显著差异(P<0.05);5号蜜样的抗氧化能力最弱,ORAC值为182.67±8.21 μmol Trolox/100 g。同时,对其显著性分析可知,5号蜜与1、2号蜜之间也呈显著性差异(P<0.05) (表2)。石榴蜜样品分别采自不同的地区,这可能是导致其抗氧化性差异的1个因素,由2号蜜(采自云南蒙自)抗氧化能力最强,或许可以推断这一地区的蜜源植物(石榴)比较优质。
2.3石榴蜜中多酚类成分测定
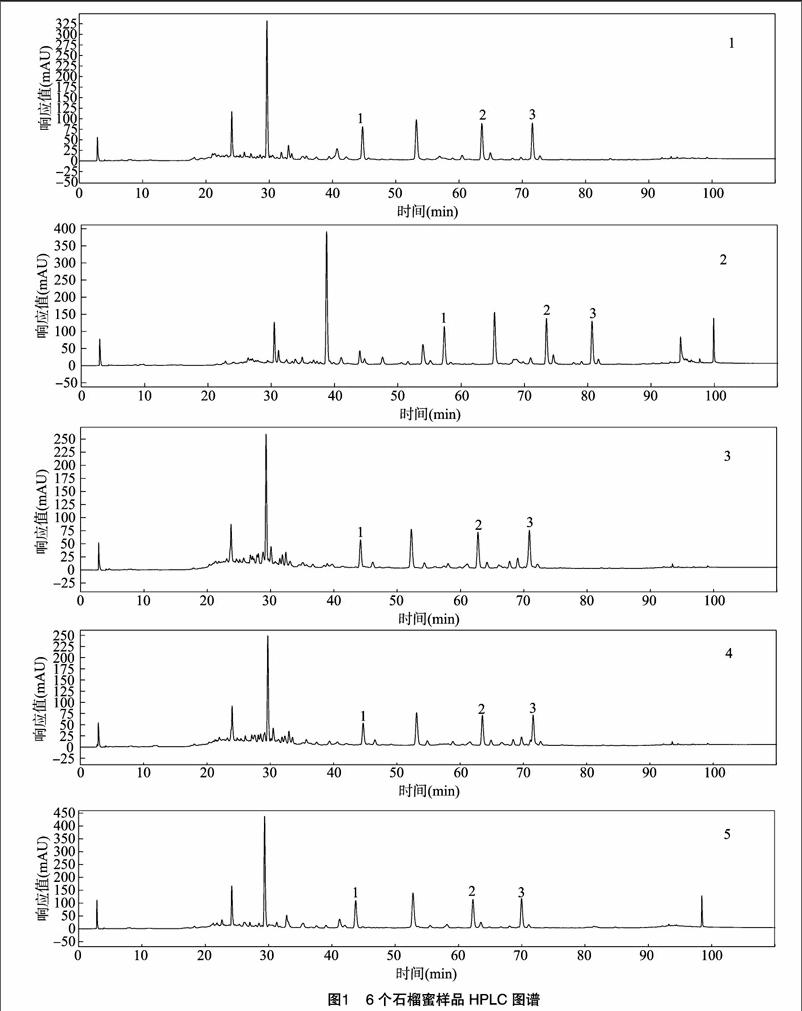
按相同的色谱条件检测6个石榴蜜样品中的3种酚类化合物含量,每个样品重复测定3次,数据处理采用SPSS 13.0,结果见表3,样品色谱图见图1(其中1、2、3号峰分别代表脱落酸、木樨草素和芹菜素)。
2.4石榴蜜中3种酚类化合物含量
由表3可知,6个石榴蜜样品的酚类化合物含量差异显著,脱落酸含量2号蜜最高(144.12 μg/100 g),4号蜜最低(65.02 μg/100 g);木樨草素含量同样是2号蜜中最高
3讨论
试验结果表明,不同石榴蜜的總酚含量、清除 DPPH 自由基能力、清除过氧阴离子能力及还原能力各不相同。总酚含量与还原能力、抗氧化能力呈正相关,而总黄酮含量与总酚含量、还原能力及清除DPPH 自由基能力无明显的相关性。与其他研究的比较,所有石榴蜜样品均具有一定的抗氧化活性,抗氧化能力与还原能力及总酚酸含量正相关。石榴蜜具有一定的抗氧化活性,其抗氧化能力因样品产地的不同而有所差异。不同产地的石榴蜜样品所含的酚类化合物的含量不同,导致其抗氧化能力不尽相同。同种蜂蜜所具有的化学成分的种类和结构与不同种蜂蜜相差较小,因而总黄酮含量与还原能力能够表现出高度的相关性。石榴蜜来源复杂,并且环境条件对蜜源也有一定的影响,因而导致不同样本的石榴蜜在酚类成分的含量及抗氧化活性方面表现出一定的差异性。
参考文献:
[1]中华人民共和国卫生部. 蜂蜜:GB 14963—2011[S]. 北京:中国标准出版社,2011.
[2]杨敬宇. 养蜂知识[M]. 武汉:中国社会教育出版社,2010:87-91.
[3]Buratti S,Benedetti S,Cosio M. Evaluation of the antioxidant power of honey,propolis and royal jelly by amperometric flow injection analysis[J]. Talanta,2007,71(3): 1387-1392.
[4]Li H B,Wong C C,Cheng K W,et al. Evaluation of antioxidant capacityand total phenolic content of different fractions of selected micoalgae[J]. Food Chemistry,2007,102(3): 771-776.
[5]梁铖,卢焕仙,刘宏程,等. 蜂蜜黄酮类化合物检测方法建立及其在云南5种特色蜂蜜中的分布[J]. 食品科学,2013,34(6):148-151.
[6]Dimitrova B,Gevrenova R,Anklam E. Analysis of phenolic acids in honeys of different floral origin by solid-phase extraction and high-performance liquid chromatography[J]. Phytochemical Analysis : PCA,2007,18(1): 24-32.
[7]孙春丽. 洋槐蜜中多酚类化合物提取方法及提取物种类研究[D]. 北京:中国农业科学院,2015.
[8]Aline M,Lamien C E,Romito M,et al. Determination of the total phenolic,flavonoid and proline contents in Burkinna Fasan honeys,as well as their radical scavenging activity[J]. Food Chemistry,2005,91(3): 571-577.
[9]Scherer R,Godoy H T. Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method[J]. Food Chemistry,2009,112(3): 654-658.
[10]董捷,张红城,李慧,等. 八种蜂花粉醇提物的体外抗氧化能力研究[J]. 营养学报,2010,32(3):309-312.
[11]Zulueta A,Esteve M J,Frigola A. ORAC and TEAC assays comparison to measure the antioxidant capacity of food products[J]. Food Chemistry,2009,114(1): 310-316.
[12]陈平雁. SPSS软件应用教程[M]. 北京:人民卫生出版社,2006:109-123.
[13]刘波静. 气相色谱/质谱法分析研究蜂胶中化学成分[J]. 分析化学,2001,29(7):861.
[14]Midorikawa K,Banskota A H,Tezuka Y,et al. Liquid chromatography-mass spectrometry analysis of propolis[J]. Phytochemical Analysis,2001,12(6):366-373.

