骨髓间充质干细胞移植对光气吸入性肺损伤大鼠肺组织及血浆炎症因子的干预作用
闵思庆, 何岱昆, 钟志越, 陈俊峰, 申 捷
复旦大学附属金山医院重症监护室,上海 201508
·短篇论著·
骨髓间充质干细胞移植对光气吸入性肺损伤大鼠肺组织及血浆炎症因子的干预作用
闵思庆, 何岱昆, 钟志越*, 陈俊峰, 申 捷
复旦大学附属金山医院重症监护室,上海 201508
目的: 观察骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells, BMD-MSCs)移植对光气吸入性肺损伤大鼠肺组织及血浆炎症因子的干预作用。方法: 96只雄性SD大鼠随机分为:空气对照组(A组)、BMD-MSCs干预对照组(AM组)、光气染毒组(PH组)、光气染毒后BMD-MSCs 干预组(PM组),每组8只。染毒组按8.33 mg/L动态恒量染毒5 min。PM组染毒后即刻经尾静脉注射106BMD-MSCs。4组分别于模型完成后6、24、48 h处死大鼠,取肺组织行病理检查及肺湿/干比、血气分析,取血浆行Bio-Plex细胞因子检测。结果: PH组较A组TNF-α浓度明显升高(P<0.05);PM组较PH组TNF-α浓度降低(P<0.05)。PM组与PH组血浆IL-4浓度6 h、24 h均降低,以PM组下降更明显(P<0.05);48 h明显升高,以PM组升高更明显(P<0.05)。PH组较A组IL-10浓度高(P<0.05);PM组较PH组IL-10浓度高(P=0.013)。结论: 经尾静脉注射BMD-MSCs后可以使大鼠血浆中抗炎因子IL-4和IL-10逐渐升高,促炎因子TNF-α逐渐下降,提示其对光气致急性肺损伤大鼠肺具有保护作用。
光气;急性肺损伤;细胞因子;骨髓间充质干细胞
急性肺损伤目前缺乏有效的的治疗方法。尽管近年来通过呼吸支持系统治疗急性肺损伤取得了一些进步,但是由不同病因引起的急性肺损伤患者的死亡率仍约占40%[1]。因此有必要研究治疗急性肺损伤的有效方法。
光气一种具有强烈毒性的化学物质。光气中毒会导致急性肺损伤,其易发展为难治性肺水肿,甚至引起死亡。目前,光气导致人体中毒的机制尚不明确。目前国内外对研究急性肺损伤中TNF-α、IL-4、IL-10等细胞因子的变化较为关注[2],但有关骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells, BMD-MSCs)移植对急性肺损伤中促炎因子与抗炎因子影响的研究较少。因此,本研究通过探索多种细胞因子在光气吸入性肺损伤中及用BMD-MSCs干预后的变化,以期发现这些细胞因子在急性肺损伤中的变化规律及相互作用,并分析BMD-MSCs移植对急性肺损伤的干预作用。
1 材料与方法
1.1 主要试剂及仪器 无血清低糖DMEM、胎牛血清购自美国ScienCell公司。固体三光气购自浙江海宁中联化学有限公司,N,N-二甲基甲酰胺、环己烷购自国药集团化学试剂有限公司。动态恒量染毒柜购自第二军医大学,Bio-Plex 200 System高通量蛋白悬浮芯片分析系统及蛋白悬浮芯片试剂盒购自美国Bio-Rad公司。其他用于本研究的生化试剂为进口分装或国产纯化,具体操作参照说明书。
1.2 实验大鼠分组及处理 SPF级雄性SD大鼠96只,体质量180~220 g,购自上海西普尔-必凯实验动物有限公司。将大鼠随机分为4组:空气对照组(A组)、BMD-MSCs干预对照组(AM组)、光气染毒组(PH组)、杀毒后BMD-MSCs干预组(PM组),每组24只。A组大鼠吸入空气,经尾静脉注射PBS;AM组吸入空气,经尾静脉注射106BMD-MSCs;PH组进行光气染毒,经尾静脉注射PBS;PM组光气染毒后,经尾静脉注射106BMD-MSCs。染毒方法[3]:将大鼠置于动态恒量染毒柜中,通入浓度为8.33 mg/L的光气(由固体三光气完全溶解于环己烷后,与N,N-二甲基甲酰胺反应生成),染毒5 min。
所有大鼠模型建立后正常进食水。分别于A组吸入空气,AM组注射BMD-MSCs,PH组染毒、PM组注射BMD-MSCs后6、24、48 h各处死8只大鼠,经腹主动脉采血。全血经800×g4℃离心5 min,取血浆-20℃保存待检。取大鼠肺组织初步处理后待检。
1.3 大鼠间充质干细胞(mesenchymal stem cells, MSCs)培养及鉴定 采用贴壁法分离培养MSCs,方法简述如下:将大鼠断颈处死后,无菌分离股骨和胫骨;用注射器将骨髓从骨髓腔内冲出,收集悬液后离心沉淀;用无血清低糖DMEM洗涤沉淀2次后,加入含20%胎牛血清的低糖DMEM,置于37℃、5%CO2培养箱中。细胞的表型用流式细胞仪鉴定。收集4~5代细胞用于急性肺损伤的治疗。
1.4 BMD-MSCs移植 在分离培养5代的BMD-MSCs细胞中加入携带GFP的腺病毒,于37℃、5%CO2培养箱中培养48 h(转染率约60%)。大鼠经光气暴露染毒成功后,立即经尾静脉注射106BMD-MSCs细胞。转染率=暗视野所见发绿色荧光的细胞数/明视野所见细胞数。每个标本任取3个高倍镜视野。
1.5 肺湿/干比分析及病理检查 将新鲜分离的肺组织经PBS洗涤去除残留血块后称质量,计作湿质量;将肺组织经80℃烤箱烘烤至恒重再次称质量,计作干质量。两者的比值即为干湿比。
取右肺上叶置于10%甲醛固定,经石蜡包埋制成5 μm厚的组织切片,进行苏木精-伊红(H-E)染色后,于显微镜下观察,分析大鼠肺组织的病理改变,以判断肺损伤及肺水肿程度。
1.6 Bio-Plex高通量蛋白悬浮芯片细胞因子检测 检测大鼠血浆中肿瘤坏死因子α(TNF-α)、白细胞介素4(IL-4)、IL-10。所有血浆样品检测前4℃水浴解冻,560×g4℃离心10 min,取上清待检。按说明书准备标准样品、微珠、检测抗体及Streptavidin-PE荧光色素,以100 μL Bio-Plex Assay缓冲液湿润滤板,真空吸板机吸净后,每孔加入微珠混悬液50 μL并吸净PBS,每孔分别加入标准品或样品50 μL、抗体25 μL、Streptavidin-PE荧光色素溶液50 μL后室温摇床10 min。真空吸板机吸净滤板并用PBS清洗3次,然后用PBS 125 μL重悬微珠,560×g4℃离心10 min室温摇床30 s后放入仪器中检测。
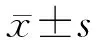
2 结 果
2.1 病理检查结果 H-E染色(图1)显示:同一时间点PH组大鼠肺组织出血点较其他3组明显增多,PM组较其他3组明显减少。A组与AM组肺泡结构完整,无明显渗出;PH组染毒6 h及24 h肺泡结构破坏,肺泡腔内出现大量红细胞;PM组较PH组肺泡结构改善。

图1 不同时间点各组大鼠肺组织H-E染色结果
2.2 肺湿/干比 PH组与PM组肺湿/干比明显高于A组与AM组,差异有统计学意义(P<0.05);PM组肺湿/干比低于PH组,差异有统计学意义(P=0.008)。PH组及PM组染毒后6、24、48 h肺湿/干比呈下降趋势,差异有统计学意义(P<0.05,表1)。

表1 各组大鼠不同时间点肺湿/干比 n=8,
*P<0.05与A组相比;△P<0.05与AM组相比;▲P<0.05与PH组相比
2.3 血氧分压(PaO2) PH组及PM组PaO2低于A组及AM组,差异有统计学意义(P<0.05);PM组PaO2大于PH组,差异有统计学意义(P=0.02);PH组和PM组染毒后6、24、48 h PaO2逐渐回升,差异有统计学意义(P<0.05,表2)。

表2 各组大鼠不同时间点PaO2 p/mmHg; n=8,
1 mmHg=0.133 kPa.*P<0.05与A组相比;△P<0.05与AM组相比;▲P<0.05与PH组相比
2.4 Bio-Plex高通量蛋白悬浮芯片细胞因子检测结果 PH组大鼠血浆TNF-α值较A组和AM组升高,随时间推移逐渐下降,但仍高于A组,差异有统计学意义(P<0.05);PH组血浆IL-4浓度在染毒后6、24 h降低,48 h时升高,差异有统计学意义(P<0.05);PH组血浆IL-10浓度在染毒后6 h时升高,随时间推移逐渐下降,但仍高于A组(P=0.02)。PM组TNF-α在BMD-MSCs移植后6、24 h与PH组差异无统计学意义,48 h时下降(P=0.013);PM组血浆IL-4浓度BMD-MSCs移植后呈上升趋势,48 h时高于PH组(P=0.009);PM组血浆IL-10在BMD-MSCs移植后呈下降趋势,但在6、24、48 h时检测值均高于PH组(P<0.05,表3~表5)。

表3 各组大鼠不同时间点血清TNF-α检测结果 ρB/(pg·mL-1); n=8,
*P<0.05与A组相比;△P<0.05与AM组相比;▲P<0.05与PH组相比

表4 各组大鼠不同时间点血清IL-4检测结果 ρB/(pg·mL-1); n=8,
*P<0.05与A组相比;△P<0.05与AM组相比;▲P<0.05与PH组相比

表5 各组大鼠与不同时间点血清IL-10检测结果 ρB/(pg·mL-1); n=8,
*P<0.05与A组相比;△P<0.05与AM组相比;▲P<0.05与PH组相比
3 讨 论
细胞因子在肺损伤的炎症发展过程中起到十分重要的作用[4-5]。各种原因引起的肺损伤均有细胞因子参与。光气所致的肺损伤机制目前认为有酰化作用、酸烧伤理论、氧化应激学说等[6]。其中,炎症反应及细胞因子发挥重要作用。细胞因子在炎症反应中存在相互作用,如:白介素(IL)可激活多种信号转导通路如JAK/STAT、Ras/ERK和PI3K/Akt[7],MIP-3趋化因子可以通过自分泌作用增强巨噬细胞活性,促进TNF-α产生[8]。
本研究中,光气致肺损伤时,促炎因子TNF-α浓度明显升高,与邵义如等[9]的研究相似。本研究还发现,光气中毒大鼠IL-1β、IL-6、IL-8水平明显升高。研究[10]发现,光气暴露后,小鼠支气管肺泡灌洗液(BALF)中IL-6、IL-1β、MIP-2升高。这些研究表明,一些促炎因子在光气吸入性肺损伤时可上调。研究[5, 10]显示,在肺损伤早期,肺泡巨噬细胞受抗原刺激后分泌TNF-α,而TNF-α可介导中性粒细胞、淋巴细胞等进入肺泡腔,且TNF-α及IL-1均可激活免疫细胞释放其他细胞因子,活化Na/K-ATP酶,导致肺水肿。本研究进一步证明,在光气吸入早期(6 h),肺损伤仍未明显进展时,促炎因子的血浆浓度均升高。因此认为,光气中毒时机体迅速发生炎症反应,大量免疫细胞激活,释放炎症因子,促进肺损伤及肺水肿的发生发展。
抗炎因子可负反馈调节炎症反应,降低炎症反应程度。IL-4是体内主要的抗炎因子,可以抑制Th1细胞分化,抑制中性粒细胞激活和调节趋化因子[11]。本研究中光气染毒大鼠血浆IL-4呈先下降后上升的变化趋势,48 h时明显高于正常水平。结果说明,光气中毒早期,抗炎因子的合成及释放均被抑制,随着炎症反应持续,抗炎因子水平才逐步恢复。促炎因子与抗炎因子的失衡可能是肺损伤及肺水肿的发病机制之一。
目前认为BMD-MSCs的抗炎机制有直接和间接两种。直接机制:首先,BMD-MSCs能调节Th2细胞,使其分泌IL-10,然后通过重组人角质形成细胞生长因子(rhKGF)等因子间接起到抑炎效果[12];其次,改变树突状细胞(dendritic cell,DC)免疫应答,使成熟的DC1减少TNF-α的分泌,而使DC2增加IL-10的分泌,进而导致Th1释放干扰素γ(INF-γ)减少,Th2、Treg细胞分泌IL-4、 IL-10增加[13]。间接机制:BMD-MSCs通过分泌白细胞介素受体拮抗剂(interleukin-1 receptor antagonist,IL1Ra),抑制巨噬细胞分泌TNF-α及T细胞分泌IL-1,进而减轻急性肺损伤时的炎症反应[14]。续玉林等[15]通过BMD-MSCs移植,上调了IL-10的表达,进而减轻了十八烯酸所致的大鼠肺损伤。本研究中,光气肺损伤大鼠移植BMD-MSCs后,TNF-α降低,IL-4、IL-10升高,与上述研究相似。但是,目前关于BMD-MSCs对急性肺损伤的炎症调节机制仍不清楚,还有待进一步的研究。
综上所述,BMD-MSCs移植对光气致急性肺损伤大鼠有一定保护作用;BMD-MSCs移植可升高IL-4、IL-10抗炎因子浓度,降低促炎因子TNF-α浓度,说明BMD-MSCs移植可作为治疗急性肺损伤的有效手段,值得进一步研究。
[1] SCIUTO A M, HURT H H. Therapeutic treatments of phosgene-induced lung injury[J]. Inhal Toxicol, 2004, 16:565-580.
[2] 廖 画, 刘 华.骨髓间充质干细胞移植对急性肺损伤大鼠的治疗作用[J].中国当代医药, 2014, 21(3): 188-193.
[3] 黄文彬, 申 捷, 张 琳, 等. 乌司他丁对光气致大鼠急性肺损伤的保护及与基质金属蛋白酶-9的关系[J]. 中华劳动卫生职业病杂志,2010,28(7):498-504.
[4] CHEN J, SHAO Y, XU G, et al. Bone marrow-derived mesenchymal stem cells attenuate phosgene-induced acute lung injury in rats[J]. Inhal Toxicol, 2015, 27(5): 254-261.
[5] GOODMAN R B, PUGIN J, LEE J S, et al. Cytokine-mediated inflammation in acute lung injury[J]. Cytokine Growth Factor Rev,2003,14:523-535.
[6] 何岱昆, 申 捷. 光气吸入性肺损伤的研究进展[J]. 职业卫生与应急救援,2007,25(2):78-81.
[7] HIRANO T, ISHIHARA K, HIBI M. Roles of STAT3 in mediating the cell growth, differentiation and survival signals relayed through the IL-6 family of cytokine receptors[J]. Oncogene,2000,19(21):2548-2556.
[8] WARD P A. Role of complement, chemokines, and regulatory cytokines in acute lung injury[J]. Ann N Y Acad Sci,1996,796:104-112.
[9] 邵义如, 申 捷, 李 卫,等. 磷酸化丝裂原活化蛋白激酶在大鼠光气吸入性肺损伤中的作用及其与基质金属蛋白酶9的关系[J]. 中华烧伤杂志,2013,29(3):261-266.
[10] DADA L A, SZNAJDER J I. Hypoxic inhibition of alveolar fluid reabsorption[J]. Adv Exp Med Biol,2007,618:159-168.
[11] WU C L, LIN L Y, YANG J S, et al. Attenuation of lipopolysaccharide-induced acute lung injury by treatment with IL-10[J]. Respirology,2009,14(4):511-521.
[12] HUH J W, KIM S Y, LEE J H, et al. Bone marrow cells repair cigarette smoke-induced emphysema in rats[J]. Am J Physiol Lung Cell Mol Physiol, 2011,301(3):L255-L266.
[13] AGGARWAL S, PITTENGER M F. Human mesenehymal stemcells modulate allogeneic immune cell responses[J].Blood,2005,105(4):1815-1822.
[14] ORTIZ L A, DUTREIL M, FATTMAN C, et al. Interleukin 1 receptor antagonist mediates the antiinflammatory and antifibrotic effect of mesenchymal stem cells during lung injury[J]. Proc Natl Acad Sci USA,2007, 104(26):11002-11007.
[15] 续玉林, 李 刚, 吕小东, 等. 骨髓间充质干细胞移植调节TNF-α和IL-10浓度减轻十八稀酸诱导的大鼠急性肺损伤[J]. 心肺血管病杂志,2012,31(3):324-327.
[本文编辑] 姬静芳
The intervention effect of bone marrow-derived mesenchymal stem cells on inflammatory factors in lung tissue and plasma of phosgene inhalation lung injury rats
MIN Si-qing, HE Dai-kun, ZHONG Zhi-yue*, CHEN Jun-feng, SHEN Jie
Intensive Care Unit, Jinshan Hospital, Fudan University, Shanghai 201508, China
Objective: To observe the intervention effect of bone marrow-derived mesenchymal stem cells (BMD-MSCs) on inflammatory factors in lung tissue and plasma of phosgene inhalation lung injury rats. Methods: 96 male SD rats were randomly divided into air control group (group A), BMD-MSCs intervention control group (group AM), phosgene exposure group (group PH) and BMD-MSCs intervention group after phosgene exposure (group PM), with 8 rats in each group. Group PH was exposed to dynamic constant phosgene at 8.33 mg/L for 5 min. Group PM was injected with 106BMD-MSCs via the tail vein immediately after phosgene exposure. The rats in the 4 groups were sacrificed at 6, 24 and 48 h after the models were completed. The lung tissues were taken for pathological examination, lung wet / dry ratio and blood gas analysis. The plasma was taken for the Bio-Plex cytokine test. Results: The level of TNF-α was higher in group PH than group A, and the difference was statistically significant (P=0.02). The level of TNF-α was lower in the group PM than group PH (P<0.05). The plasma IL-4 concentration in group PM and group PH decreased by 6h and 24 h, which was more significant in group PM (P<0.05). It increased significantly by 48h, which was more significant in group PM (P<0.05). The level of IL-10 was higher in group PM than group PH, and the difference was statistically significant (P<0.05). The level of IL-10 was higher in group PM than group PH, and the difference was statistically significant (P<0.05). Conclusions: Anti-inflammatory cytokines IL-10 and IL-4 were increased and pro-inflammatory cytokines TNF-α was decreased by the tail vein injection of BMD-MSCs, so BMD-MSCs has a protective effect in rats with acute lung injury induced by phosgene.
phosgene; acute lung injury; cytokines; bone marrow-derived mesenchymal stem cells
2017-02-18 [接受日期] 2017-04-10
复旦大学附属金山医院科学技术研究项目(2013-11). Supported by Science and Technology Program of Jinshan Hospital, Fudan University(2013-11).
闵思庆, 住院医师. E-mail:49162128@qq.com
*通信作者(Corresponding author). Tel: 021-34189990-5430, E-mail: zzy1388@aliyun.com
10.12025/j.issn.1008-6358.2017.20170124
R -332
A

