木薯渣中酵母菌的分离鉴定及发酵性能测定
杨承剑,谢芳,李孟伟,梁辛,梁贤威*,李丽莉,郭艳霞,彭开屏
(中国农业科学院广西水牛研究所,广西南宁530001)
木薯渣中酵母菌的分离鉴定及发酵性能测定
杨承剑,谢芳,李孟伟,梁辛,梁贤威*,李丽莉,郭艳霞,彭开屏
(中国农业科学院广西水牛研究所,广西南宁530001)
为筛选出适合木薯渣发酵的专用酵母菌,试验以自然发酵的堆贮木薯渣为样品,采用传统分离培养法分离得到8株酵母菌,分别命名为Y1、Y4、Y7、Y8、Y11、Y12、Y18、Y21。通过形态学、生理生化特征鉴定及26S rDNAD1/D2区序列分析,最终鉴定出菌株Y7、Y8、Y11、Y18、Y21为皱褶假丝酵母(Candida rugosa),菌株Y1、Y4、Y12为乙醇假丝酵母(Candida ethanolica),并对其两种代表菌株Y1和Y7进行发酵性能测试,结果表明,菌株Y1和Y7的最适培养温度分别为34℃和36℃,最适pH分别为6.5和6.0,培养16 h左右,其OD600nm值均达到最大值,分别为2.872和2.984。
木薯渣;酵母;分离;鉴定;26S rDNA
木薯(Manihot esculenta)又名树薯,与马铃薯、红薯并列为世界三大薯类作物[1-2]。木薯渣是生产木薯淀粉和酒精后的副产物,处理不当会造成极大的浪费,污染周边环境。木薯渣饲料化是有效利用途径之一,但木薯渣中含有氢氰酸,过量饲喂容易引起动物中毒,从而导致生产性能下降[3]。研究木薯渣的饲用价值,不仅可以减少环境污染,实现资源就地转化,还能缓解当前饲料原料紧张状态,促进畜牧业的发展[4]。木薯渣堆贮发酵是一个复杂的微生物菌群更替过程,有大量的乳酸菌和酵母菌参与,改变其理化性质,使其所含的粗纤维降解为动物易消化吸收的单糖、双糖、氨基酸等小分子物质,从而提高木薯渣作为动物饲料的利用率[5]。酵母是一类单细胞微生物,具有个体大、蛋白质含量高、杂食性强、易分离培养、代谢产物多、综合利用广等特点,广泛应用于酿酒、面点、饮料等食品生产领域,而饲用酵母一般有热带假丝酵母、产朊假丝酵母、啤酒酵母、红酵母等[6]。近年来,酵母在饲料中的研究较多,但从自然发酵木薯渣中分离酵母菌并应用于木薯渣发酵的研究仍十分有限,本试验拟从堆贮的木薯渣中筛选出适合木薯渣发酵的优良酵母菌并对其发酵特性进行研究,以期将其扩大培养后发酵木薯渣,提高木薯渣的品质和适口性,为木薯渣的饲料化利用提供科学依据。
1 材料与方法
1.1 材料与试剂
木薯渣样品5份,于实验当天取自广西水牛研究所水牛种畜场,在取样1 h内到达实验室,5份样品各取5 g混匀,置于500 mL装有无菌水三角瓶中,用200目纱布过虑后备用。
酵母膏胨葡萄糖琼脂培养基(yeast extract peptone dextrose,YPD)、YPD肉汤培养基:青岛日水生物技术有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)快速提取试剂盒、蛋白酶K、TaqDNA:北京康为世纪科技有限公司;无水乙醇、β-巯基乙醇:天津市科密欧化学试剂有限公司;其他试剂(磷酸二氢钾、磷酸氢二钾、氯化钠、盐酸、氢氧化钠)均为国产分析纯。
1.2 仪器与设备
SW-CJ-1F超净工作台:苏州苏洁净化设备有限公司;SPX-150生化培养箱:北京科伟永兴仪器有限公司;UV-8000紫外可见分光光度计:上海无析仪器有限公司;Thermo Scientific涡旋振荡器:雷琪实验器材有限公司;YM50立式压力蒸气灭菌器:上海三申医疗器械有限公司;HC-2518R冷冻高速离心机:北京京立离心机有限公司;JD500-2型电子天平:梅特勒-托多利仪器有限公司;ECLIPSE 50i正置生物显微镜:Nikon日本公司;DYCP-31DN DNA电泳槽、DYY-5稳压电泳仪:北京六一仪器厂;DK-8D电热恒温水槽:上海一恒科学仪器有限公司;FR980凝胶成像仪:上海复日科技仪器有限公司;2720 thermal cycler聚合酶链式反应仪(polymerase chain reaction,PCR):美国应用生物系统公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京康为世纪科技有限公司。
1.3 试验方法
1.3.1 酵母菌的分离纯化
取10 mL混合木薯渣过滤后的溶液于90 mL无菌生理盐水中,在涡旋仪上充分混匀,按梯度分别稀释成10-1、10-2、10-3、10-4、10-5样液。取以上5种稀释度的样液各20 μL,用无菌玻璃刮铲均匀地涂布于YPD琼脂平板上,于28℃恒温培养箱中培养48~72 h,用灭菌牙签挑取生长较快、形态、颜色不同的菌落,划线接种于YPD琼脂平板上,反复分离、纯化,直至得到单一菌落,将纯化后的菌株分别接种于灭菌后的YPD肉汤培养基中增殖培养12 h,编号、保存于20%甘油管中,置-20℃冰箱中保藏备用。
1.3.2 酵母菌的形态特征及生理生化鉴定
形态特征:将菌株接种到含杜氏管的YPD肉汤培养基中,27℃培养3 d,观察杜氏管内是否有气泡、是否浑浊、试管底部是否成环或成岛,并制水浸片于显微镜下观察,观察记录酵母菌的无性繁殖方式及细胞形状[7]。
生理生化鉴定:参照《酵母菌的特性与鉴定手册》[8]和《真菌鉴定手册》[9]进行。
1.3.3 菌株的26S rDNA D1/D2区序列分析鉴定
DNA提取:样品DNA使用酵母菌基因组DNA提取试剂盒提取,具体操作步骤按说明书进行;
PCR扩增:使用康为世纪2×EsTaqMasterMix进行PCR扩增,扩增引物:正向引物NL1(5′-GCATATCAATAAGCG GAGGAAAAG-3′),反向引物NL4(5′-GGTCCGTGTTTC AAGACGG-3′);
反应体系如下:10×PCR缓冲液5 μL;正、反向引物均为10 mmol/L各2.5 μL;dNTP(10 mmol/L)4 μL;基因组DNA 1.0 μL;TaqDNA聚合酶0.5 μL;双蒸水34.5 μL。PCR扩增循环参数为:98℃预变性2 min;98℃变性10 s,56℃退火15 s,72℃延伸2 min,共35个循环;再72℃延伸5 min;
电泳:使用1%的琼脂糖凝胶电泳,电压120 V,电泳30 min,每孔上样1 μL。
1.3.4 构建系统进化树
将测序结果与GenBank中的序列进行比对,选取GenBank中相似性最高的已知序列构建系统进化树,通过Clustalx1.83比对后,再用MEGA4.0软件采用Neighbour-Joining方法构建系统发育树[10]。
1.3.5 菌株的发酵性能测定
选取分离鉴定出的菌株进行发酵性能测定,将菌株活化后,以3%的接种量接种到YPD肉汤培养基内,28℃培养过夜,在不同发酵温度(22℃、24℃、26℃、28℃、30℃、32℃、34℃、36℃、38℃、40℃)[11]、不同pH(4.0、4.5、5.0、5.5、6.0、6.5、7.0)培养24 h,以确定菌株的最适生长温度和pH值,然后分别在最适温度和pH值条件下培养菌株,观察其24 h菌株的生产力,期间每隔2 h取样一次,用紫外可见分光光度计在波长600 nm处测定其吸光度值[12],绘出菌株生长曲线的变化趋势。
2 结果与分析
2.1 酵母菌的形态特征及生理生化鉴定
从木薯渣中筛选出的菌株在YPD平板培养基上大致呈现出2种不同的菌落形态,其主要包括:菌落是否有突起、大小、颜色、表面光滑度等[13]。挑取同一平板上菌落形态相同的菌株3~5株,经多次纯化后,其菌落形态、镜检结果均保持一致。选取生长旺盛、形态不同的菌落,进一步划线分离,最终分离得到8株具有代表性的单菌落,将其分别编号为Y1、Y4、Y7、Y8、Y11、Y12、Y18、Y21。分离菌株的菌落及细胞形态特征见表1和图1,生理生化鉴定结果如表2所示。

图1 显微镜下酵母菌形态(40×10)Fig.1 Morphology of yeasts under microscopy(40×10)
由表1可知,菌株的菌落形态特征为表面光滑,不透明,菌落呈卵圆形。

表1 酵母菌的形态特征Table 1 Morphological characteristics of yeasts

表2 酵母菌的生理生化特征Table 2 Physiological and biochemical characteristics of yeasts
由表2可知,所有菌株的碳源试验中麦芽糖、D-半乳糖、蔗糖、乳糖、淀粉均不能被同化;菌株Y7、Y8、Y11、Y18、Y21在37℃培养试验中生长良好,重氮基兰B(DBB)试验与脲酶试验均为阴性,这与Candida属的Candida rugosa的特征极为相似,而菌株Y1、Y4、Y12则在42℃培养试验中生长良好,且重氮基兰B(diazo base blue,DBB)试验与脲酶试验均为阴性,与Candida属的Candida ethanolica的特征相同,参照《酵母菌的特征与鉴定手册》检索表,可初步判定菌株Y1、Y4、Y12可能为酿酒酵母属(Saccharomyces)或假丝酵母属(Candida),而菌株Y7、Y8、Y11、Y18、Y21可初步判断为假丝酵母属(Candida)。然而,仅根据形态和生理生化特性并不能准确鉴定菌株至种水平,还需要靠分子生物学鉴定来进一步确认[14]。
2.2 菌株的26S rDNA鉴定
将分离到的8株酵母菌基因组进行26S rDNA区PCR扩增[15],对扩增结果进行琼脂糖凝胶电泳检测,电泳顺序为:2 000 bp Marker、Y1、Y4、Y7、Y8、Y11、Y12、Y18、Y21,菌株扩增后的电泳结果见图2。

图2 菌株26S rDNA PCR扩增产物电泳图Fig.2 Electrophoretograms of 26S rDNA PCR amplification products of strains
由图2可知,这8株菌扩增出的片段长度在500~750bp,条带清晰可见,无杂带,可用于菌株26S rDNA测序。将酵母菌基因PCR扩增成功的电泳目的条带片段回收,送生工生物(上海)有限公司进行测序,将测序结果拼接并输入GenBank数据库,运用BLAST程序将测序结果与NCBI核酸数据库中的公开序列进行比对(http://blast.ncbi.nlm.nih. gov/Blast),并运用MEGA4.0软件采用Neighbour-Joining方法构建系统发育树,结果如图3所示。
从图3可知,菌株Y7、Y8、Y11、Y18、Y21的26S rDNA与数据库存报道的Candida rugosa菌株的26S rDNA核苷酸序列聚集于同一簇且同源性达到99%以上,菌株Y1、Y4、Y12的26S rDNA与数据库存报道的Candida ethanolica菌株的26S rDNA核苷酸序列聚集于同一簇,且同源性达到99%以上,结合之前的形态特征及生理生化特性,确定为Y1、Y4、Y12为乙醇假丝酵母(Candida ethanolica),Y7、Y8、Y11、Y18、Y21确定为皱褶假丝酵母(Candida rugosa)。

图3 菌株26S rDNA基因序列系统发育树Fig.3 Phylogenetic tree of 26S rDNA gene sequence of strains
2.3 菌株的发酵性能测定
2.3.1 筛选酵母菌的最适生长温度测定
根据图3的结果可以看出,因菌株Y1和Y7 PCR扩增出的目的条带明显处在不同位置条带上,Y1靠近700 bp,Y7靠近500 bp,说明这两株菌分可能属不同菌种,再后面通过26S rDNA测序结果Y1、Y4、Y12为乙醇假丝酵母(Candida ethanolica),Y7、Y8、Y11、Y18、Y21确定为皱褶假丝酵母(Candidarugosa),取Y1和Y7为代表菌株进行下面的发酵实验,以避免重复实验。Y1(乙醇假丝酵母Candidaethanolica)和Y7(皱褶假丝酵母Candida rugosa)接种于YPD肉汤培养基中,以不同温度条件下,将菌株增殖培养24 h后,测定其OD600nm值,结果如图4所示。
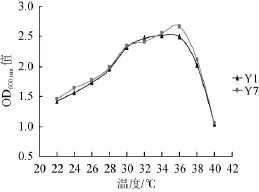
图4 不同温度条件下分离菌株在YPD肉汤培养基中的生长曲线Fig.4 Growth curve of isolated strains in broth medium under different temperature
由图4可知,菌株Y1和Y7的OD600nm值是在24~36℃范围内随着温度的升高而逐渐增大,在36℃后变小;Y1的 OD600nm值在34℃时达到最高值2.512,Y7的OD600nm值则在36℃时达到最高值2.663。故Y1和Y7的最适生长温度分别是34℃和36℃。
2.3.2 筛选酵母菌的最适生长pH测定
选取鉴定出的菌株Y1和Y7,分别在不同pH值的YPD肉汤培养基中,按各自最适温度培养24 h,测定其OD600nm值,结果如图5所示。

图5 不同pH值条件下分离菌株在YPD肉汤培养基中的生长曲线Fig.5 Growth curve of isolated strains in broth medium under different pH
由图5可知,菌株在pH4.0时受到明显抑制,基本不生长,而在pH4.5~6.0范围内,OD600nm值则随着pH值的升高而增加;Y1的OD600nm值在pH6.5时达到最高,之后逐渐下降,而Y7的OD600nm值则在pH6.0时达到最高,之后也逐渐下降。故Y1和Y7的最适生长pH值分别是6.5和6.0。
2.3.3 筛选酵母菌生长曲线的测定
选取鉴定出的菌株Y1和Y7,分别在其最适温度和最佳pH的YPD肉汤培养基中培养24 h,测定其OD600nm值,结果如图6所示。

图6 最适温度和pH条件下分离菌株在YPD肉汤培养基中的生长曲线Fig.6 Growth curve of isolated strains in broth medium under the optimal temperature and pH
由图4~图6综合可知,菌株Y1和Y7的最适培养温度分别是34℃和36℃,最适pH分别为6.5和6.0,两株菌都在培养10 h左右开始进入对数生长期,培养16 h后,其OD600nm值达到最大,分别为2.872和2.984,之后便进入稳定期,其OD600nm值不再继续增加。
3 结论
试验采用传统分离培养方法从自然发酵堆贮木薯渣样品中分离筛选出8株酵母菌,通过形态、生理生化及26SrDNA鉴定出乙醇假丝酵母(Candida ethanolica)3株,皱褶假丝酵母(Candida rugosa)5株,分别选取其中代表性菌株Y1和Y7进行发酵性能测试,结果表明,菌株Y1和Y7最适培养温度分别为34℃和36℃,最适生长pH分别为6.5和6.0,将其在最适温度和pH各培养16 h左右,其发酵生产力均达到最大。本研究侧重于适合木薯渣发酵酵母菌的筛选与鉴定,可为后续木薯渣饲料化提供优良的酵母菌株。
[1]黄萍,齐仁立.木薯渣作为饲料资源的开发与利用[J].四川畜牧兽医,2013,39(12):34-36.
[2]艾必燕,刘长忠,陈建康,等.木薯渣发酵饲料的工艺筛选[J].饲料工业,2012,33(7):57-60.
[3]樊懿萱,王锋,王强,等.发酵木薯渣替代部分玉米对湖羊生长性能、血清生化指标、屠宰性能和肉品质的影响[J].草业学报,2017,26(3):92-93.
[4]冀凤杰,王定发,侯冠彧,等.木薯渣饲用价值分析[J].中国饲料,2016,12(6):37-38.
[5]张爱华,邓雪娟,李婷婷,等.木薯渣饲料资源在畜禽生产中的应用研究进展[J].饲料与畜牧,2015,12(9):45-46.
[6]白晓婷.酵母类产品在饲料中的研究与应用[J].中国饲料,2015,12(2):8-9.
[7]李豪,章霞,张静,等.草莓果酒酵母菌的筛选、鉴定及耐受性研究[J].中国酿造,2017,36(2):86-87.
[8]巴尼特J A.胡瑞卿译.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1990:120-397.
[9]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1997:102-117.
[10]谢芳,曾庆坤,杨承剑,等.水牛乳中高产γ-氨基丁酸乳酸菌的筛选与鉴定[J].中国酿造,2015,34(4):103-104.
[11]马斌,隋超,马长中.林芝青稞酒曲酵母菌的分离鉴定及性能测定[J].中国酿造,2017,36(2):82-83.
[12]赵娜,程金芝.籽粒苋营养面包酵母菌的分离与鉴定[J].食品研究与开发,2015,36(24):169-170.
[13]武伟伟,牟德华,李艳.树莓酒自然发酵过程中酵母菌的分离与鉴定[J].食品工业科技,2015,36(10):187-188.
[14]邵冰洁,陶永清,王素英,等.传统法糯米发酵炸糕中酵母菌的分离鉴定及优势菌株筛选[J].现代食品科技,2016,32(7):92-93.
[15]何蕾.我国传统奶制品中乳酸菌多样性研究[D].成都:四川农业大学,2010.
Isolation,identification and fermentation ability of yeasts from cassava residues
YANG Chengjian,XIE Fang,LI Mengwei,LIANG Xin,LIANG Xianwei*,LI Lili,GUO Yanxia,PEN Kaiping
(Guangxi Buffalo Research Institute,Chinese Academy of Agricultural Sciences,Nanning 530001,China)
In order to screen the optimal dedicated yeasts for cassava residue fermentation,using natural fermented cassava residue as raw material, eight stains were isolated by traditional culture method,namely Y1,Y4,Y7,Y8,Y11,Y12,Y18,and Y21.The strains were identified by morphology, physiological and biochemical characteristics and 26S rDNA sequence analysis.The results showed that strain Y7,Y8,Y11,Y18,Y21 wereCandida rugosa,strain Y1,Y4,Y12 wereCandida ethanolica.The results of fermentation ability of representative strains showed that the optimal temperature and optimal pH of strain Y1 and Y7 was 34℃,36℃,respectively,and 6.5,6.0,respectively.After 16 h incubation,the OD600nmof both strains reached the maximum,which were 2.872 and 2.984,respectively.
cassava residues;yeast;isolation;identification;26S rDNA
Q939.9
0254-5071(2017)07-0090-05
10.11882/j.issn.0254-5071.2017.07.020
2017-03-31
广西水产畜牧兽医局科技项目(桂渔牧科201352039);广西自然科学基金面上项目(2014GXNAFA118082);国家自然科学基金项目(31460613)
杨承剑(1981-),男,副研究员,博士,主要从事水牛营养与饲料科学研究工作。
*通讯作者:梁贤威(1962-),男,研究员,硕士,主要从事水牛营养与繁殖研究工作。

