红麻EST-SSR标记的开发及其多态性评价
万雪贝李东旭徐 益徐建堂张力岚张列梅林荔辉祁建民,*张立武,*
1福建农林大学作物科学学院 /作物遗传育种与综合利用教育部重点实验室 /福建省作物设计育种重点实验室;2福建农林大学海峡联合研究院基因组与生物技术中心,福建福州 350002
红麻EST-SSR标记的开发及其多态性评价
万雪贝1,2李东旭1,2徐 益1,2徐建堂1张力岚1,2张列梅1林荔辉1祁建民1,*张立武1,2,*
1福建农林大学作物科学学院 /作物遗传育种与综合利用教育部重点实验室 /福建省作物设计育种重点实验室;2福建农林大学海峡联合研究院基因组与生物技术中心,福建福州 350002
红麻是最重要的自然纤维作物之一,然而SSR标记的匮乏限制了其遗传改良。本研究从红麻90 175个EST序列中挑出含有转录因子的EST,开发了94对SSR引物。以24份不同红麻种质资源的DNA为模板,利用9%非变性聚丙烯酰胺凝胶电泳检测多态性。结果表明,85对引物(占90.4%)至少在2个材料之间存在多态性,表明开发的EST-SSR具有很好的多态性。其中,三核苷酸重复所占比例最多,重复基元AAT和ATG的多态性较高。聚类分析表明,24份红麻种质资源的遗传相似系数变化在0.62~0.92之间,表现出丰富的遗传基础。这些结果不仅丰富了红麻的分子标记数量,而且为红麻的遗传分析提供资源。
红麻;SSR;遗传多样性;标记开发
红麻(Hibiscus cannabinus)又叫大麻槿,属于锦葵科木槿属一年生草本韧皮纤维作物。具有耐旱、耐盐碱、抗逆性强、根系发达、生长速度快、生物产量高、易栽培等特点[1-3]。红麻主要是作为麻纺工业的原料,近年来在建材、可降解性塑料、吸污、饲料、造纸、地膜、麻油、药用等领域都有广泛的应用[4-6]。其主要种植地区为中国、泰国、印度、孟加拉国、越南、古巴、巴西、印度尼西亚、伊朗等[7]。
SSR(simple sequence repeat,简单重复序列),又称微卫星标记,是由1~6个核苷酸组成的短序列串联重复多次而组成的一段DNA。因为SSR中重复单元的重复次数不同,所以扩增的SSR序列长度呈现出多态性。SSR标记具有多态性较高、重复性好、稳定性好等特点,被广泛应用于基因定位、遗传关系分析、品种鉴定等领域,被认为是十分有效的分子标记之一[8-9]。根据序列来源,SSR标记可以划分为基因组 SSR和表达序列标签 SSR(EST-SSR, expressed sequence tags-SSR)。由于EST-SSR来源于转录区域,往往跟功能基因连锁[10-11]。在真核生物中,存在着大量的转录因子(transcription factor),这些转录因子在植物的产量、品质、抗逆等性状中发挥着重要作用[10-11]。因而,基于转录因子开发EST-SSR标记,在遗传研究与分子标记辅助育种中具有明显的优势。
EST-SSR标记已经在小麦[12]、大豆[13]、甘蓝[14]、花椰菜[15]、苎麻[16]等领域上有所应用,如王庆彪等[14]筛选出20对核心EST-SSR引物构建了中国50个甘蓝代表品种的SSR指纹图谱;刘晨晨等[16]利用21对EST-SSR引物评价了19个苎麻品种,表明ESTSSR在苎麻近缘种中具有很好的通用性。然而红麻的分子标记研究起步较晚,仅极少数实验室开展了有关工作。目前可查的红麻SSR标记是部分来源于陆地棉SSR[17]。由于缺乏可供利用的SSR标记,一些红麻遗传育种研究者只能利用随机多态性位点的分子标记,如ISSR、RAPD等。徐伟[18]利用RAPD分子标记对红麻7个常规栽培种和12个野生种及5个近缘种进行了亲缘关系研究。由于红麻至今尚无参考基因组序列,因此很难大规模开发SSR分子标记。鉴于红麻SSR数目多,还有大量的未被发现,且EST-SSR具有重要的理论和应用价值。本研究旨在利用公共数据库NCBI中转录组测序获得的90 175个EST[19],选择包含有转录因子的EST,开发SSR标记并鉴定其多态性,为红麻的遗传研究与分子标记辅助育种提供资源。
1 材料与方法
1.1 供试材料
用于研究的24份红麻种质资源,由福建农林大学麻类遗传育种与综合利用研究室提供(表1),均于2015年5月1日种植于福建农林大学洋中科教基地。
1.2 基因组DNA提取
采用改良的CTAB法提取24份试验材料的幼苗DNA[7]。
1.3 红麻表达序列标签序列来源及SSR引物开发
红麻表达序列标签序列数据来源于NCBI的SRA数据库(http://www.ncbi.nlm.nih.gov/sra),登录号为SRP060459[19]。为了筛选具有潜在功能标记的SSR,选择包含有转录因子的EST,共1031条。根据SSR的重复次数进行筛选:二核苷酸>6次,三核苷酸>4次,四核苷酸>3次,五核苷酸>2次。利用网上的SSRPrimer工具(http://hornbill.cspp.latrobe.edu. au/ssrdiscovery.html)搜索这些序列所包含的 SSR,共得到94对SSR引物,编号分别为HcES0001至HcES0094。这些引物由上海生工生物技术有限公司合成。
1.4 PCR体系及电泳
PCR体系为10 μL,含2.0 μL DNA(50 ng μL–1)、0.5 μL引物(10 μmol μL–1)、3.75 μL 2×Taq Master Mix (试剂购自上海进岸生物科技有限公司)、3.75 μL dd H2O。用10 μL石蜡油覆盖。
PCR程序为3 min预变性94℃;94℃变性30 s, 60℃退火30 s,72℃延伸45 s,共10个循环,每个循环退火温度降低0.5℃;94℃变性30 s,55℃退火30 s, 72℃延伸45 s,共35个循环;最后72℃延伸10 min, 4℃保存。采用9%非变性聚丙烯酰胺凝胶电泳检测PCR扩增产物。
1.5 读带与数据分析
利用本研究开发的EST-SSR对供试材料进行基因分型,利用PowerMarker V3.25软件计算其多态性信 息 含 量 PIC (polymorphism information content)[10]。基于非加权平均数UPGMA(unweight pair-group method using arithmetic averages)方法计算遗传相似性,利用NTSYSv2.10软件进行聚类分析[20]。
2 结果与分析
2.1 SSR标记分布频率及重复基元种类
选择包含有转录因子的EST,总共开发94对SSR引物,重复基元分为二至六核苷酸。其中三核苷酸重复所占比例最多,为62.7%,其次是二核苷酸重复,占34.0%,四核苷酸重复和六核苷酸重复所占比例较少,分别为2.1%和1.1%。
基于这些SSR引物,分析各重复基元种类及分
布频率(表2)。发现二核苷酸重复基元以AT和TA为主,三核苷酸重复基元以CAA、AAT、ATG和GCA为主。
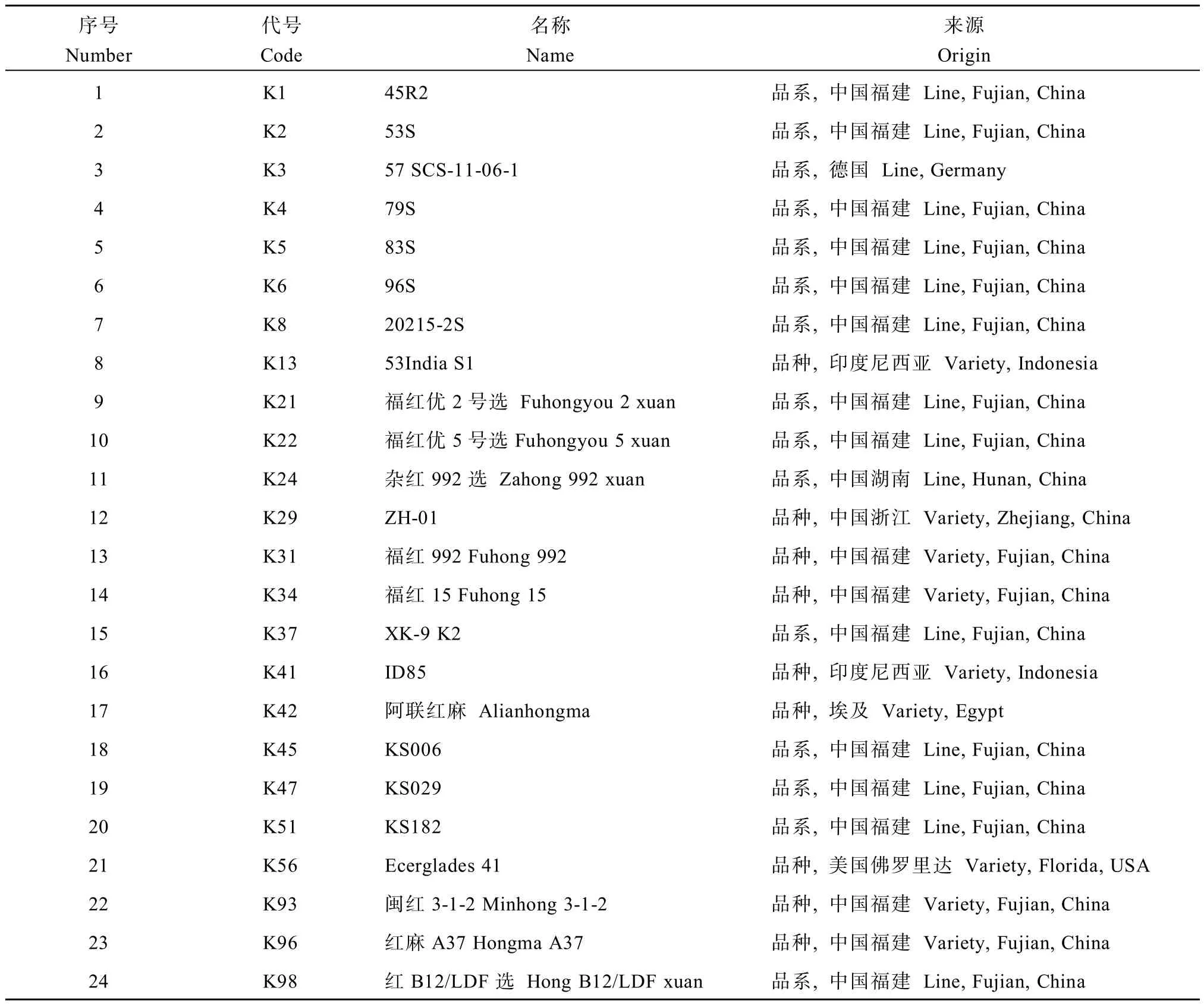
表1 供试红麻品种(系)的名称及来源Table 1 Names and origins of tested kenaf varieties(lines)

表2 红麻EST-SSR中不同重复类型的分布Table 2 Frequencies of EST-SSR repeat types in kenaf

(续表2)
2.2 EST-SSR引物的多态性检测
为了评估这些新开发的SSR标记多态性,以24份红麻DNA为模板进行PCR扩增,利用9%非变性聚丙烯酰胺凝胶电泳进行多态性检测(图1和表3)。结果表明,85(90.4%)对引物得到清晰的PCR产物,且至少在2个材料间存在差异,表现出多态性。
这些SSR引物的多态性信息含量(PIC)(表3)变化在0~0.88之间,平均值为0.514。根据Bostsein提出的衡量基因变异程度高低的PIC指标[21],即当PIC>0.5时,该位点为高度多态位点;0.25 2.3 红麻品种(系)遗传多样性分析 图1 SSR引物HcES0037对红麻24份品种(系)的扩增结果 24份红麻品种(系)具有丰富的遗传基础,其遗传相似系数变化在0.62~0.92之间,变异系数为39%。以遗传相似系数0.77为分割线,可将24份材料划分为3组(图2)。其中,45K R2、83K、20215-2、阿联红麻、KS029、红麻A37、福红15、XK-9 K2聚为一组;6K、53 India S1、杂红992选、福红优2号选、KS182、Ecerglades 41、闽红3-1-2、红B12/LDF选聚为一组;3K、KS006、57KSCS-11-06-1、福红992、ID85、79K、福红优5号选、ZH-01聚为一组。分析各组的地理来源,可以看出,来自德国的57KSCS-11-06-1与来自埃及的阿联红麻被划分为不同的两组,表明这2个品种(系)遗传关系较远,可能存在较强的杂种优势。这些结果为后续的红麻杂交种的亲本选配提供参考。 图2 基于遗传相似系数的24份红麻品种(系)UPGMA树状图 3.1 红麻EST-SSR标记的开发 SSR标记是一种广泛应用于遗传研究与分子标记辅助育种的标记类型[12-16]。与主要农作物相比,红麻的研究相对滞后。由于没有可供利用的SSR标记,一些红麻遗传育种研究者只能利用随机多态性位点的分子标记,如郑海燕等[22]利用SRAP分子标记构建红麻品种(系)的指纹图谱。相对于SRAP等标记而言,SSR具有带型简单,重复性好等优点。为了利用SSR标记,武耀龙[17]对棉花的SSR引物在红麻上的通用性进行了研究,64对棉花SSR引物中,57对引物扩增出了条带,通用性比例高达89%。但这是基于同为锦葵科的棉花序列开发而来,其多态性重复性尚需进一步验证。而本研究基于红麻EST序列开发了94对SSR引物,并进行多态性检测。发现85对引物扩增出多态性条带,占90.4%,其多态性比例较高,这不仅可以丰富红麻分子标记的数量,而且为剖析红麻重要性状的遗传机制提供了资源。虽然两者SSR多态性比例相当,但本研究是基于红麻转录组测序得到的表达序列标签序列。与基于棉花序列开发的SSR标记相比,本研究开发的SSR标记对不同的红麻品种(系)将具有更好的通用性。 在这新开发的SSR引物中,大部分SSR重复基元为二至六核苷酸。其中,三核苷酸重复基元所占比例最多,为62.7%。这和大部分植物基因组中三核苷酸重复的分布频率较高的结果一致[23-24]。Hong等[23]分析白菜基因组中的SSR重复基元表明,三核苷酸重复基元序列比例为37.0%。Goff等[24]在水稻基因组中,发现三核苷酸重复基元序列比例为59.0%。继而分析其重复基元,发现红麻含有重复基元AAT和ATG的SSR引物,多态性较高。 3.2 EST-SSR标记为红麻的遗传分析提供资源 通过多态性SSR引物的聚类分析,可将24份红麻种质资源划分为3组,表明这些标记可用于红麻种质资源的遗传多样性分析。来自德国的57KSCS-11-06-1与来自埃及的阿联红麻被划分至不同的两组,表明这2个品种(系)具有明显的遗传差异。根据杂交种的亲本选配的遗传差异原则,这些红麻品种(系)配制的杂交种可能具有较强的杂种优势。 刘强等[25]发现,转录因子可以通过调节植物防卫基因的超量表达来激活植物多个抗逆功能基因的表达,从而提高植物的抗逆性。因此,基于转录因子基因开发的SSR标记是具有潜在的功能标记。本研究开发的SSR标记基于红麻转录因子序列,是潜在的功能标记,但尚需进一步验证。在未来的红麻分子标记辅助育种或指纹图谱构建等遗传研究中,研究人员可以优先考虑使用这些SSR引物。 利用红麻含有转录因子的EST开发出94对SSR引物,这些SSR标记具有较好的多态性和稳定性,是潜在的功能标记。(AAT)n和(ATG)n三核苷酸重复基元多态性高,可作为红麻SSR引物设计的首选。24份红麻种质资源可划分为3组,表现出丰富的遗传基础。 [1]熊和平.麻类作物育种学.北京:中国农业科学技术出版社, 2008.pp 156–185 Xiong H P.Breeding Science of Bast Fiber Crops.Beijing:China Agricultural Science and Technology Press,2008.pp 156–185(in Chinese) [2]陶爱芬,祁建民,林培青,方平平,吴建梅,林荔辉.红麻优异种质产量和品质性状主成分聚类分析与综合评价.中国农业科学,2008,41:2859–2867 Tao A F,Qi J M,Lin P Q,Fang P P,Wu J M,Lin L H.Cluster analysis and evaluation of elite kenaf germplasm based on principal components.Sci Agric Sin,2008,41:2859–2867(in Chinese with English abstract) [3]祁建民,陈幼玉,周瑞阳,林荔辉,梁康迳,吴建梅,方平平.红麻产量和纤维品质性状的遗传效应与杂种优势分析.作物学报,2005,31:469–475 Qi J M,Chen Y Y,Zhou R Y,Lin L H,Liang K J,Wu J M,Fang P P.Genetic effects and heterosis analysis for yield and quality traits in kenaf(Hibiscus cannabinus L.).Acta Agron Sin,2005, 31:469–475(in Chinese with English abstract) [4]颜婷婷.黄、红麻纤维的木质素结构特征及其脱胶研究.东华大学博士学位论文,上海,2011 Yan T T.Research on Lignin Structural Characterization and Degumming Process of Jute and Kenaf Fiber.PhD Dissertation Donghua University,Shanghai,China,2011(in Chinese with English abstract) [5]李志明,吴星娥,周景辉.红麻全秆纸地膜保温与降解应用试验.中国造纸,2004,(8):22–24 Li Z M,Wu X,Zhou J H,Kenaf mulch:heat preservation and Biodegradation.China Pulp&Paper,2004,(8):22–24(in Chinese with English abstract) [6]袁小红,陈东生,倪海燕.黄/红麻在纺织领域的应用探讨.中国麻业科学,2007,(4):217–220 Yuan X H,Chen D S,Ni H Y.Discussion on the application of jute and kenaf in textile field.Plant Fiber Sci China,2007,(4): 217–220(in Chinese with English abstract) [7]Zhang L,LiA,Wang X,Xu J,Zhang G,Su J,Qi J,Guan C.Genetic diversity of kenaf(Hibiscus cannabinus)evaluated by inter-simple sequencerepeat(ISSR).BiochemGenet,2013,51:800–810 [8]Cheng X,Xu J,Xia S,Gu J,Yang Y,Fu J,Qian X,Zhang S,Wu J, Liu K.Development and genetic mapping of microsatellite markers from Genome survey sequences in Brassica napus. Theor Appl Genet,2009,118:1121–1131 [9]Zhang L,Cai R,Yuan R,Tao A,Xu J,Lin L,Fang P,Qi J. Genetic diversity and DNA fingerprinting in jute(Corchorus spp.) based on SSR markers.Crop J,2015,3:416–422. [10]Liu T,Zhu S,Fu L,Tang Q,Yu Y,Chen P,Luan M,Wang C, Tang S.Development and characterization of 1827 expressed sequence tag-derived simple sequence repeat markers for ramie (Boehmeria nivea L.Gaud).PLoS One,2013,8:e60346 [11]Zhang L,Li Y,Tao A,Fang P,Qi J.Development and characterization of 1906 EST-SSR markers from unigenes in jute (Corchorus spp.).PLoS One,2015,10:e0140861 [12]潘海涛,汪俊君,王盈盈,齐照良,李斯深.小麦EST-SSR标记的开发和遗传作图.中国农业科学,2010,43:452–461 Pan H T,Wang J J,Wang Y Y,Qi Z L,Li S S.Development and mapping of EST-SSR markers in wheat.Sci Agric Sin,2010,43: 452–461(in Chinese with English abstract) [13]常玮,赵雪,李侠,邱波,韩英鹏,縢伟丽,李文滨.大豆EST-SSR标记开发及与genomic-SSR的比较研究.中国油料作物学报,2009,31:149–156 Chang W,Zhao X,Li X,Qiu B,Han Y P,Teng W L,Li W B. Development of soybean EST-SSR marker and comparison with Genomic-SSR marker.Chin J Oil Crop Sci,2009,31:149–156 (in Chinese with English abstract) [14]王庆彪,张扬勇,庄木,杨丽梅,刘玉梅,吕红豪,方智远.中国50个甘蓝代表品种EST-SSR指纹图谱的构建.中国农业科学,2014,47:111–121 Wang Q B,Zhang Y Y,Zhuang M,Yang L M,Liu Y M,Lyu H H, Fang Z H.EST-SSR fingerprinting of fifty cabbage representative varieties from China.Sci Agric Sin,2014,47:111–121(in Chinese with English abstract) [15]林珲,朱海生,陈敏氡,王彬,温庆放,吴卫东.花椰菜ESTSSR反应体系的优化.分子植物育种,2015,13:2610–2615 Lin H,Zhu H S,Chen M D,Wang B,Wen Q F,Wu W D. Establishment and optimization of EST-SSR PCR amplification system in cauliflower.Mol Plant Breed,2015,13:2610–2615 [16]刘晨晨,栾明宝,陈建华,王晓飞,许英,孙志民.苎麻genomic-SSR与EST-SSR分子标记遗传差异性分析.中国麻业科学,2015,(2):57–63 Liu C C,Luan M B,Chen J H,Wang X F,Xu Y,Sun Z M. Genetic differences in ramie analyzed between genomic-SSR and EST-SSR.Plant Fiber Sci China,2015,(2):57–63(in Chinese with English abstract) [17]武耀龙.红麻遗传连锁图谱构建及重要数量性状QTL分析.中国农业科学院硕士学位论文,北京,2014 Wu Y L.Construction Linkage Map and QTL Analysis of Essential Quantitatives Traits for Kenaf(Hibiscus cannabinus L.). MS Thesis of Chinese Academy of Agricultural Science,Beijing, China,2014(in Chinese with English abstract) [18]徐伟.不同基因型红麻及其近缘种亲缘关系的RAPD分析.安徽农业大学硕士学位论文,安徽合肥,2005 Xu W.Relationships ofVariousGenotypes ofHibiscus cannabinus L.and Its Related Species Based on RAPD Markers Analysis.MS Thesis of Anhui Agricultural University,Hefei, China,2005(in Chinese with English abstract) [19]Zhang L,Wan X,Xu J,Lin L,Qi J.De novo assembly of kenaf (Hibiscus cannabinus)transcriptome using Illumina sequencing for gene discovery and marker identification.Mol Breed,2015, 10:192–202 [20]Rohlf F.NTSYS-pc:numerical taxonomy and multivariateanalysis system,version 2.10.Exeter Software,New York,2002 [21]Bostsein D,White R L,Skolnick M.Construction of a genetic linkage map in man using restriction fragment polymorphisms. Am J Hum Genet,1980,32:314–331 [22]郑海燕,粟建光,戴志刚,李燕,陈基权,龚友才.红麻种质资源SRAP指纹图谱构建及遗传多样性分析.湖北农业科学, 2011,50:411–415 Zheng H Y,Su J G,Dai Z G,Li Y,Chen J Q,Gong Y C. Fingerprint construction and genetic diversity analysis of kenaf germplasm by SRAP markers.Hubei Agric Sci,2011,50: 411–415(in Chinese with English abstract) [23]Hong C,Piao Z,Kang T,Batley J,Yang T,Hur Y,Bhak J,Park B, Edwards D,Lim Y.Genomic distribution of simple sequence repeats in Brassica rapa.Mol Cells,2007,23:349–356 [24]Goff S,Ricke D,Lan T,Presting G,Wang R,Dunn M, Glazebrook J,Sessions A,Oeller P,Varma H,Hadley D, Hutchison D,Martin C,Katagiri F,Lange B,Moughamer T,Xia Y,Budworth P,Zhong J,Miguel T,Paszkowski U,Zhang S, Colbert M,Sun W,Chen L,Cooper B,Park S,Wood T,Mao L, Quail P,Wing R,Dean R,Yu Y,Zharkikh A,ShenR, Sahasrabudhe S,Thomas A,Cannings R,Gutin A,Pruss D,Reid J,Tavtigian S,Mitchell J,Eldredge G,Scholl T,Miller R M, Bhatnagar S,Adey N,Ruba T,Tusneem N,Robinson R,Feldhaus J,Macalma T,Oliphant A,Briggs S.A draft sequence of the rice genome(Oryza sativa L.ssp.japonica).Science,2002,296: 92–100 [25]刘强,张贵友,陈受宜.植物转录因子的结构与调控作用.科学通报,2000,45:1465–1474 Liu Q,Zhang G Y,Chen S Y.The structure and regulation of plant transcription factors.Chin Sci Bull,2000,45:1465–1474 (in Chinese) Development and Polymorphism Evaluation of EST-SSR Markers in Kenaf WAN Xue-Bei1,2,LI Dong-Xu1,2,XU Yi1,2,XU Jian-Tang1,ZHANG Li-Lan1,2,ZHANG Lie-Mei1,LIN Li-Hui1,QI Jian-Min1,*,and ZHANG Li-Wu1,2,* 1College of Crop Science/Key Laboratory for Genetics,Breeding and Multiple Utilization of Crops of Ministry of Education/Fujian Key Laboratory for Crop Breeding by Design,Fujian Agriculture and Forestry University,Fuzhou 350002,China;2Center for Genomics and Biotechnology,Haixia Institute of Science and Technology,Fujian Agriculture and Forestry University,Fuzhou 350002,China Kenaf is one of the most important crops for natural fber production.However,the lack of SSR markers has resulted in a large gap in kenaf genetic improvement.In this study,94 SSR primers were developed on the basis of the sequences containing transcription factors from 90 175 expressed sequence tags(ESTs)in kenaf.A total of 24 kenaf accessions were used to evaluate the polymorphism of these developed SSRs using 9%polyacrylamide gel electrophoresis.Eighty-five SSR primers(90.4%)were successfully amplified and presented the polymorphism between at least two accessions,indicating their high rate of polymorphism.Among them,AAT and ATG were the dominant repeat motifs.Cluster analysis showed that the genetic similarity coefficient varied from 0.62 to 0.92,indicating an abundant genetic basis among these accessions.These developed EST-SSRs not only enrich molecular markers,but also enhance the resource for genetic analysis in kenaf. Kenaf(Hibiscus cannabinus);Simple sequence repeat;Genetic diversity;Marker development ( ):2016-07-04;Accepted(接受日期):2017-04-20;Published online(网络出版日期):2017-05-08. 10.3724/SP.J.1006.2017.01170 本研究由福建农林大学杰出青年科研基金项目(xjq201401),国家现代农业产业技术体系建设专项(CARS-19-E06),农业部东南黄红麻实验观测站(农科教发2011),福建省科技厅对外合作项目(2015I0001)和福建省麻类种质资源共享平台项目(2010N2002)资助。 This study was supported by the Distinguished Young Research Fund in Fujian Agriculture and Forestry University(xjq201401),the China Agriculture Research System(CARS-19-E06),the Experiment Station of Jute and Kenaf in Southeast China(Nongkejiaofa 2011),Foreign Cooperation Project of Science and Technology Department in Fujian,China(2015I0001),and Construction of Germplasm Resources Platform for Bast Fiber Crops in Fujian,China(2010N2002). *通讯作者(Corresponding authors):祁建民,E-mail:qijm863@163.com,Tel:0591-87644898;张立武,E-mail:lwzhang@fafu.edu.cn 联系方式:E-mail:524073779@qq.com URL:http://kns.cnki.net/kcms/detail/11.1809.S.20170508.1006.004.html





3 讨论
4 结论

