烟曲霉Bem46基因敲除株构建及其功能初步研究
李 雯,李佳娟,冯文莉,马 彦
烟曲霉Bem46基因敲除株构建及其功能初步研究
李 雯,李佳娟,冯文莉,马 彦
目的构建烟曲霉Bem46基因敲除株,初步明确Bem46基因在烟曲霉生长出芽和各种压力传导中的作用,以及对细胞壁形成的影响。方法采用生物信息学方法查找烟曲霉中Bem46基因,设计引物,并以pyrG作为筛选标记构建烟曲霉Bem46基因敲除株(ΔBem46)。观察含不同压力物质培养基上对照菌株和ΔBem46径向生长速度,观察两菌株发芽状况以及在含有细胞壁抑制剂培养基上的生长状况。结果通过序列比对在烟曲霉基因组中找到了Bem46基因,其编号为Afu7g04660,由1 116 bp碱基组成,编码311个氨基酸。使用原生质体法得到烟曲霉ΔBem46并经PCR和Southernblot确认。经观察在含有山梨醇作为渗透压力来源的培养基上ΔBem46生长明显较对照菌株快。显微镜下观察到在GMM液体培养基中,ΔBem46发芽速度慢于对照株。结论烟曲霉Bem46基因涉及由山梨醇引起的渗透压压力传导,并且该基因对促进孢子发芽可能有作用。
Bem46;烟曲霉;发芽率;信号传导
烟曲霉是自然界常见的一种丝状真菌,在正常人群并不会由于经常暴露于烟曲霉而发生感染。然而近年来随着新技术的开展和免疫抑制剂的应用,免疫力低下的患者往往由于暴露于烟曲霉而引起侵袭性曲霉病的发生,其发病率在临床呈现明显上升趋势且病死率极高,因此探讨烟曲霉感染的发病机制刻不容缓。烟曲霉致病同多种因素有关,而菌株在宿主体内的生长发芽,快速适应宿主环境是致病的重要环节[1]。出芽蛋白Bem46是α/β水解酶超家族成员,在进化上相对保守,在模式真菌粗糙脉孢霉(Neurosporacrassa)中出芽蛋白Bem46在其子囊孢子发芽及菌丝形成的过程中有重要作用[2]。该基因在常见的致病真菌如白念珠菌、烟曲霉中的作用目前尚不了解,为了进一步了解其在烟曲霉致病中的作用,帮助我们深入了解烟曲霉的致病机制,发现可能的新药物靶点,我们对其进行了相关的研究。
1 材料与方法
1.1 菌株和质粒 烟曲霉Ku80作为对照菌株,烟曲霉转化用宿主菌为Ku80 pyrG-,该菌株为嘧啶营养缺陷株,在没有尿苷和尿嘧啶的培养基上不能生长。筛选标记pyrG来源于质粒pJW24(由杜克大学William J. Steinbach教授赠送)。
1.2 培养基 GMM基础培养基(1L):20×盐溶液50 mL,微量元素液1 mL,D-葡萄糖10 g,琼脂15 g(1.5%),pH值6.5;溶壁酶: Vinoflow FCE (Novozymes公司);Osmotic Media:1.2 mol/L MgSO4, 10 mmol/L sodium phosphate,4 ℃保存;STC溶液:1.2 mol/Lsorbitol, 10 mmol/L CaCl2, 10 mmol/L Tris-HCl pH 7.5,在4 ℃保存;PEG-CaCl2溶液:60% PEG, 50 mmol/L CaCl2, 50 mmol/L Tris-HCl pH 7.5在室温(25 ℃)保存。0.7%顶层琼脂培养基(SMM) : 20×盐溶液 50 mL,微量元素液1 mL,葡萄糖10 g,琼脂7 g,山梨醇218.6 g,酵母提取物 1g,pH值6.5,加水至1 L,高压灭菌20 min。
1.3 生物信息学分析 在烟曲霉基因组中(www.aspergillusgenome.org)找出与N.crassa同源的Bem46基因开放读码框及其上下游各约1 000 bp序列,进行分析,并与常见致病真菌进行同源性比对。
1.4 构建Bem46基因敲除株
1.4.1Bem46基因克隆及敲除载体的构建 烟曲霉Ku80 pyrG-在过夜培养,收集菌丝;采用冷冻干燥法提取基因组DNA。设计引物分别扩增Bem46基因5′和3′侧翼序列各约1.0 kb的DNA序列。使用限制性内切酶EcoRI,SalI,XbaI和BamHI,将相应克隆片段连接入质粒pJW24,最后得到目的片段产物大小4 869 bp,定量5μg后进行烟曲霉原生质体的转化,具体实验方法见文献[3]。试验中用到的引物见表1。
1.4.2 原生质体法构建Bem46基因敲除株 Ku80 pyrG-菌悬液2 mL,30 ℃,250 r/min摇床培养过夜培养(16~20 h)。40mLOsmotic Media中溶解3 g Vinoflow FCE,加入收集的菌丝并混匀,28 ℃,75 r/min摇床培养3~4 h。4 ℃,3 500 r/min离心10 min,吸出离心管夹层的原生质体,并加3倍体积的STC混匀,离心。吸出原生质体层,用1 mL的STC重悬原生质体。取5 μg的融合酶切产物加入到200 μL的原生质体中,冰上静置1 h。将200 μLDNA-原生质体放入到1.25 mL的PEG-CaCl2中混匀,室温(25 ℃)放置20 min,加入4 mLSTC混匀,取400 μL与10 mL SMM顶层培养基混合后铺板,放置于37 ℃孵箱中培养。具体实验方法见文献[4]。
1.5 Bem46基因敲除株验证
1.5.1 首先使用PCR法进行验证 在GMM液体培养基中过夜培养单克隆转化子,并提取基因组DNA。并设计相关引物进行验证,验证用引物见表1。1.5.2 通过Southernblot进行验证 设计探针,具体实验步骤按照试剂盒说明进行。探针设计上下游引物序列命名为Bem46-probe-F,Bem46-probe-R 具体序列见表1。
1.6 Bem46相关功能研究
1.6.1 Ku80与ΔBem46在不同生长条件下的生长状况对比。生长条件分别为:37 ℃时GMM基础培养基、含卡泊芬净(1 μg/mL和4 μg/mL)和尼可霉素(1 μg/mL)的培养基、含过氧化氢(1 mmol/L, 2 mmol/L,3 mmol/L)和甲酰胺(10 μmol/L和50 μmol/L)的培养基、含有氯化钠(1 mol/L)和山梨醇(1.2 mol/L)的培养基,及55 ℃时GMM基础培养基。分别将Ku80与ΔBem46孢子10 μL( 1×106个)点种于平皿中央,每日记录菌落直径,并拍照。
1.6.2 孢子发芽率实验 分别取100 μL浓度为1×107个/mL的Ku80及ΔBem46菌悬液,并分别加入到10 mL的GMM液体培养基,在37 ℃以200 r/min转速的摇床孵育。从肿胀孢子阶段(大约4 h)开始,每30 min在显微镜下观察一次,并计数孢子的发芽百分率,重复3次。
1.6.3 统计学软件 采用SPSS22.0重复测量方差分析软件对结果进行统计学分析,P<0.05为差异有统计学意义。
2 结 果
2.1 生物信息学分析结果 在烟曲霉基因组中通过序列比对找到了Afu7g04660,1 116 bp个碱基编码311个氨基酸。380-715碱基间编码水解酶的保守区域。在细胞极性,孢子发芽,以及定位在内质网膜都有重要的意义。序列比对见图1,可知烟曲霉Bem46基因同常见致病菌种的同源基因有较强的同源性。
2.2 构建Bem46基因敲除载体结构 如图2Bem46全基因使用筛选标记pyrG替代。设计探针并使用KpnI酶切, Suthernblot验证时在对照菌株和ΔBem46产生不同条带,分别为4.8 kb和2.3 kb。
2.3 基因敲除株验证结果 经过原生质体法转化烟曲霉共得到6株转化子,转化子的验证主要通过PCR法和Southernblot进行验证。

表1 试验中使用到的引物Tab.1 Primer were used in the construction of ΔBem46
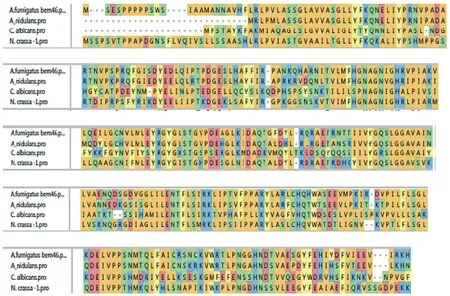
图1 烟曲霉,构巢曲霉,白念珠菌和粗糙脉孢霉中 Bem46基因序列同源性比对Fig.1 Homologous sequence alignment results of Bem46 gene among the A. fumigatus, A. nidulans, Candida albicans and Neurospora crassa
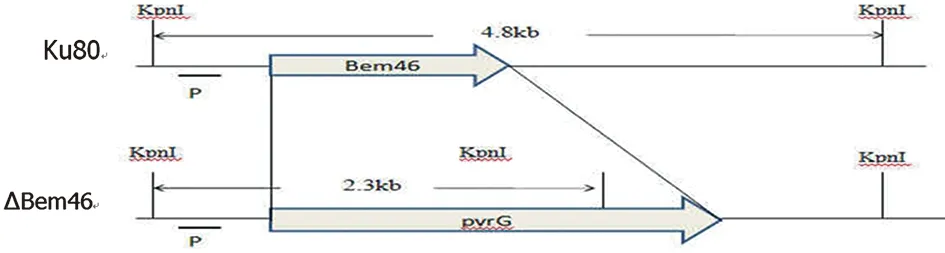
图2 构建Bem46基因敲除载体示意图Fig.2 Strategy for deleting Bem46 gene by replacing with pyrG gene by homologous recombination
2.3.1 验证 根据Bem46序列设计了如下引物扩增和验证使用了2对引物来进行转化子的验证,第1对引物证明有筛选标记的插入,第2对引物证明基因敲除株同对照之间的不同。具体实验用引物见表1。
2.3.2 用PCR及Southernblot验证ΔBem46 图3a为PCR验证所需引物扩增Ku80及ΔBem46引物的相应片段大小;图3b为使用第1对引物PCR验证结果;图3c为使用第2对引物PCR验证结果;图3d为Southernblot验证结果。
由图3b可见对照菌株未扩增出该基因,而转化子1,2,4,5,6,7均有筛选标记扩增成功,说明转化子中有pyrG成功插入;由图3c可见只有2号和4号扩增出大约5.3 kb的片段;根据烟曲霉Bem46基因敲除构建示意图可见对基因DNA酶切后进行探针标记验证,在对照菌株和烟曲霉Bem46基因敲除株应该有2条明显不同的条带,在烟曲霉Bem46基因敲除大约可见2.3 kb大小条带,而在对照菌株可见约为4.8 kb大小的条带。由图3d可见在2号菌株确实只有一条大小约为2.3 kb的条带,而对照菌株和1、3、5号基因敲除株均有大小约为4.8 kb的条带,说明只有2号菌株为正确的基因敲除株。该菌株用来进行后续的实验。
2.4 观察Bem46基因对烟曲霉相关功能的影响:
2.4.1 对照菌株与ΔBem46在不同培养基上的生长状况 图4a为二者在普通GMM培养基上的生长比较;图4b为二者在含有卡泊芬净和尼可霉素2种药物的培养基上生长结果比较;图4c为在含有不同浓度过氧化氢培养基上二者菌落直径生长速度比较;图4d为在含有不同浓度甲酰胺培养基上二者生长速度比较;图4e为在含有氯化钠、山梨醇的培养基上和不同温度条件下二者生长结果比较。
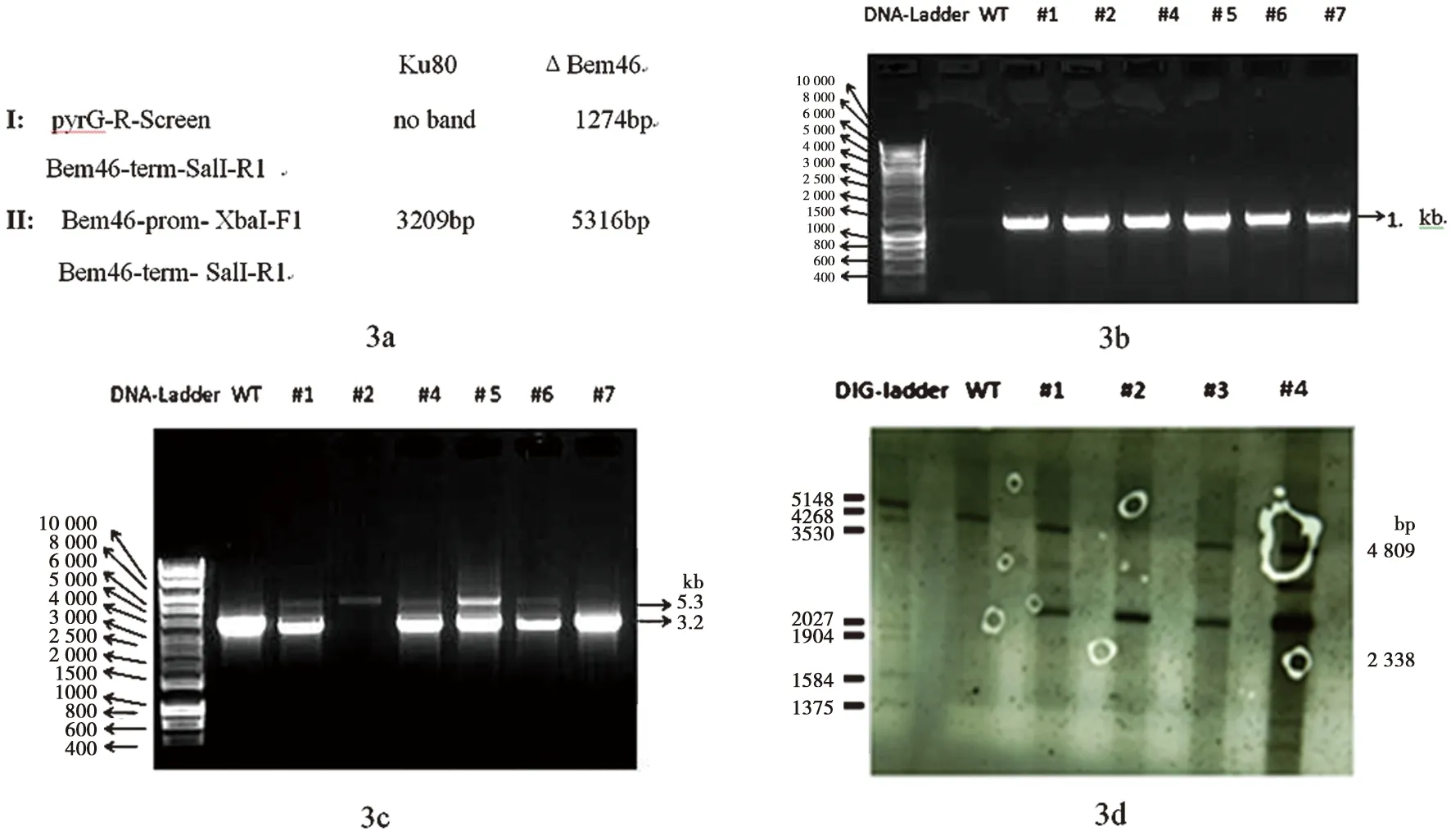
图3 PCR及Southernblot验证ΔBem46Fig.3 Confirmation of ΔBem46 by PCR and Southernblot
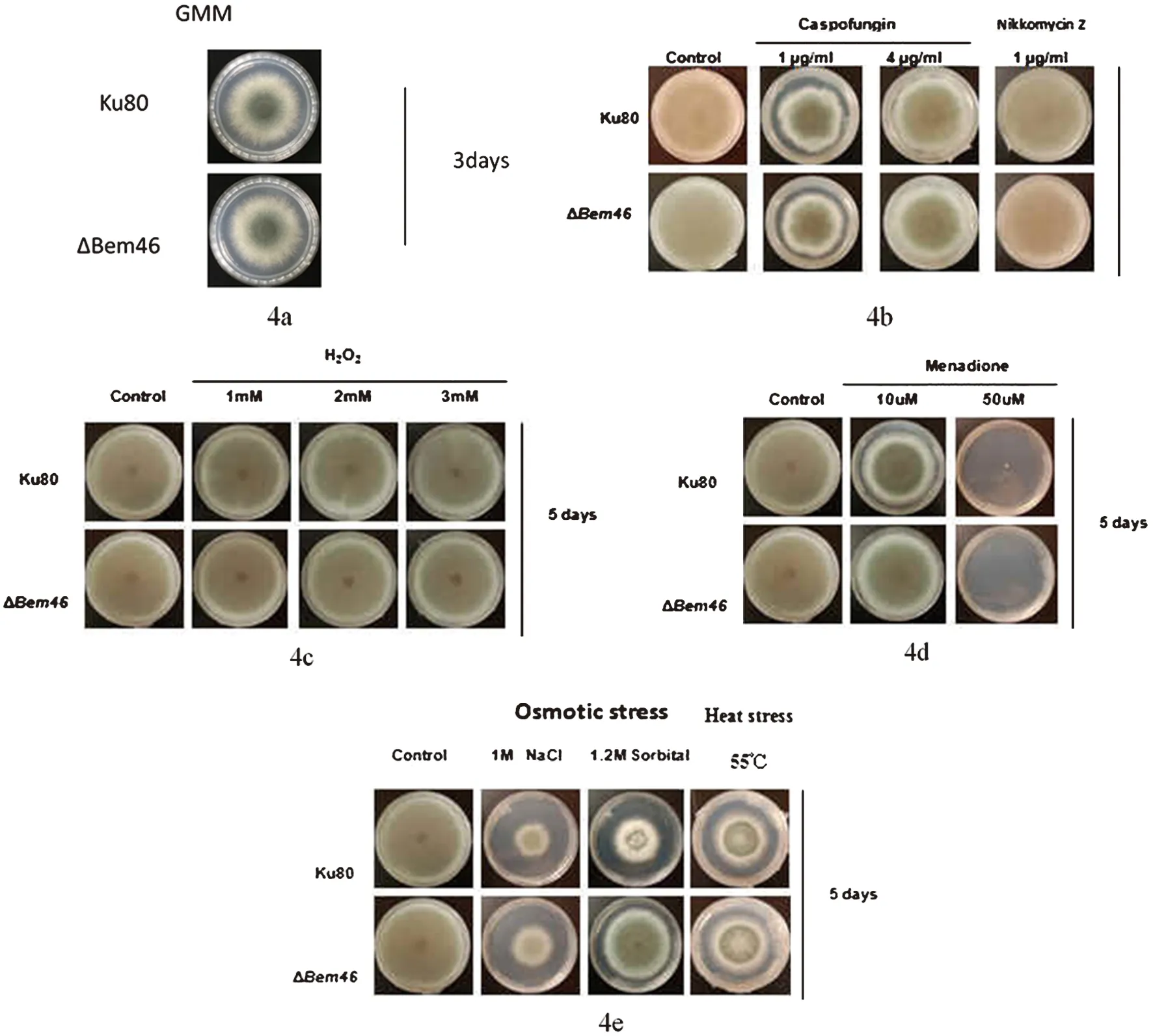
图4 Ku80与ΔBem46在不同培养基上的生长状况比较Fig.4 Comparison on the growth diameter of the Ku80 and the ΔBem46 on different medium
实验结果显示在GMM培养基上,Ku80与ΔBem46生长状况无明显差异;在对抑制真菌细胞壁药物敏感试验中可见烟曲霉对照菌株与Bem46基因敲除株在含有卡泊芬净和尼可霉素这2种药物的平皿上生长无明显差异;对氧化压力敏感性试验中,对照菌株与ΔBem46在含有不同浓度过氧化氢的培养基、及含有不同浓度甲酰胺的培养基上二者的生长状况无明显差异;对渗透压敏感试验和温度敏感试验中,55 ℃条件下,二者生长状况无明显差异,以氯化钠介导的渗透压变化也没有对二者的生长状况产生影响,但在以山梨醇介导的渗透压变化使得二者的生长状况产生了差异,即在浓度为1.2 mol/L的山梨醇培养基上,烟曲霉Bem46基因缺陷株明显较对照菌株Ku80生长要快。以上菌落直径结果均经SPSS22.0软件分析。
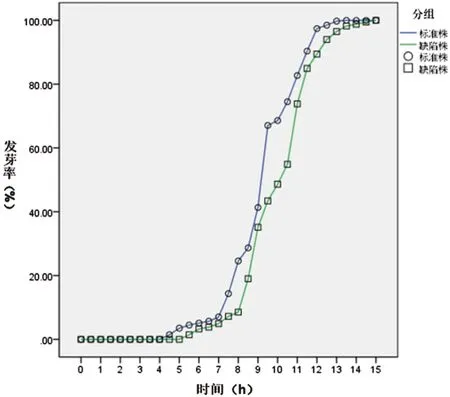
图5 Ku80与ΔBem46发芽率百分率比较Fig.5 Comparison on the germination rate of the Ku80 and the ΔBem46
2.4.2 观察烟曲霉Bem46基因在孢子发芽中的作用见图5,经SPSS22.0软件分析,由图可见,在13 h时,对照株Ku80已经完全发芽,而缺陷株ΔBem46在15 h时才实现完全发芽,缺陷株ΔBem46出芽明显滞后于对照株Ku80(F=3536.191,P<0.05)。15 h后二者均全部发芽。
3 讨 论
烟曲霉是主要的致病丝状真菌,尤其在中性粒细胞减少的患者中感染烟曲霉可以发展成为侵袭性曲霉病,如果造成播散型感染就可能有较差的预后[5]。尽管在诊断技术和抗真菌药物的研究上取得了很大的进步,但是侵袭性曲霉病的发病和致死率仍然很高,也就显得对烟曲霉生理生化性质以及其同烟曲霉的致病性,抗真菌药物敏感性相关性的一些细节研究更有必要[6]。目前对Bem46蛋白了解有限,只对模式丝状真菌N.crassa有所研究,在N.crassa中该基因在子囊孢子发芽是必须的,且该基因定位到内质网膜[2],在N.crassa该基因编码的蛋白在细胞特异性种类极性的形成是必不可少的,Bem46基因定位在内质网周,在靠近细胞膜处形成斑点状[7-8]。鉴于N.crassa同致病真菌烟曲霉基因同源性较高,是非常好的丝状真菌的模式菌,我们推测该基因可能在烟曲霉中有类似作用。因而我们构建了该基因缺陷株。通过原生质体法我们成功获得烟曲霉Bem46基因缺陷株ΔBem46,并且观察了其对烟曲霉一般生长性状的影响。在基础培养基上,我们发现该基因的缺失对于烟曲霉的生长没有明显的影响。烟曲霉细胞壁的合成是其生长过程中重要的一环,如果合成出现异常,则可能为我们提供新的药物靶点。因此,我们选择了临床常用的2种影响细胞壁合成的药物卡泊芬净和尼克霉素Z。卡泊芬净主要抑制β-1,3葡聚糖合成酶,阻碍葡聚糖的形成,而尼克霉素Z的作用机制抑制细胞壁中几丁质的合成,这2种药物从不同的方面来验证该基因是否在烟曲霉细胞壁形成过程中发挥作用,由我们的结果可见Bem46这个基因在含有此2种物质的培养基上生长速度同对照菌株并没有明显差异,因此我们推测该基因可能并不参与烟曲霉细胞壁的合成。以往的研究表明氧化压力、渗透压力以及温度对于烟曲霉的致病都有重要的意义[9],因此我们进一步研究了该基因在氧化压力、渗透压力和温度敏感性中的作用。本研究显示该基因对于过氧化氢和甲酰胺产生的氧化压力和对照菌株没有明显的差异,也就是对这两种物质产生的氧化压力不敏感,可能不参与其产生的氧化压力的传导。在渗透压力的敏感性中,由氯化钠产生的渗透压力并未对二者生长产生不同的影响,但同时发现基因缺陷株ΔBem46对山梨醇产生的渗透压力呈现阳性反应,即相比野生对照菌株而言其生长明显加快,推测也许Bem46参与了由山梨醇介导的渗透压力传导通路,在山梨醇存在的条件下,Bem46基因有抑制生长的作用。在比较二者孢子发芽的实验中发现,缺陷株实现完全发芽的时间明显慢与对照株实现完全发芽的时间,即Bem46基因的缺失导致了其发芽滞后,而15 h后二者均全部发芽,表明Bem46基因的缺失并不会阻止烟曲霉孢子发芽。所以我们推测,Bem46基因极有可能有促进孢子出芽的作用,参与孢子的出芽生长过程,但其并不是烟曲霉孢子出芽的决定性基因。
总之,研究通过构建烟曲霉Bem46基因缺陷株,初步了解该基因对烟曲霉生长状况的影响,提示可以从山梨醇介导的渗透压传导通路入手,研究Bem46基因对烟曲霉生长的抑制作用;Bem46基因缺陷使得发芽速度减慢提示可从参与孢子出芽过程的基因入手,研究其对出芽生长的传导通路产生的影响;研究也将进一步进行相关的实验,以期发现该基因更多更有意义的性状。
[1] Abad A, Fernandez-Molina JV, Bikandi J, et al. What makesAspergillusfumigatusa successful pathogen? Genes and molecules involved in invasive aspergillosis[J]. Rev Iberoam Micol, 2010, 27(4): 155-182. DOI:10.1016/j.riam.2010.10.003
[2] Mercker M, Kollath-Leiss K, Allgaier S, et al. The BEM46-like protein appears to be essential for hyphal development upon ascospore germination inNeurosporacrassaand is targeted to the endoplasmic reticulum[J]. Curr Genet, 2009, 55(2): 151-161.DOI:10.1007/s00294-009-0232-3
[3] Fan H,Guo JY,Ma SL,et al.Construction and identification of eukaryotic expression plasmids of synthetic TAG gene ofPneumocystisp55 antigen[J].Chin J Zoonoses,2015,31(5):399-402.DOI: 10.3969/j.issn.1002-2694.2015.05.002(in Chinese)
樊华,国九英,马素丽.等. 人工合成肺孢子菌p55抗原串联基因真核表达载体的构建及表达[J].中国人兽共患病学报,2015,31(5):399-402.
[4] Steinbach WJ, Cramer RA, Jr.Perfect BZ, et al. Calcineurin controls growth, morphology, and pathogenicity inAspergillusfumigatus[J]. Eukaryot Cell, 2006, 5(7): 1091-1103.DOI:10.1128/EC.00139-06
[5] Segal BH. Aspergillosis[J]. N Engl J Med, 2009, 360(18): 1870-1884.DOI:10.1056/NEJMra0808853
[6] Erjavec Z, Kluin-Nelemans H, Verweij PE. Trends in invasive fungal infections, with emphasis on invasive aspergillosis[J]. Clin Microbiol Infect, 2009, 15(7): 625-633.DOI:10.1111/j.1469-0691.2009.02929.x
[7] Martinez-Martinez S, Rodriguez A, Lopez-Maderuelo MD, et al. Blockade of NFAT activation by the second calcineurin binding site[J]. J Biol Chem, 2006, 281(10): 6227-6235.DOI:10.1074/jbc.M513885200
[8] Kumar A, Kollath-Leiss K, Kempken F. Characterization of bud emergence 46 (BEM46) protein: sequence, structural, phylogenetic and subcellular localization analyses[J]. Biochem Biophys Res Commun, 2013, 438(3): 526-532.DOI:10.1016/j.bbrc.2013.07.103
[9] Ma Y, Qiao J, Liu W, et al. The sho1 sensor regulates growth, morphology, and oxidant adaptation inAspergillusfumigatusbut is not essential for development of invasive pulmonary aspergillosis[J]. Infect Immun, 2008, 76(4): 1695-1701.DOI:10.1128/IAI.01507-07
ConstructionofBem46knockoutstrainandtheroleoftheBem46geneinAspergillusfumigatus
LI Wen, LI Jia-juan, FENG Wen-li, MA Yan
(DepartmentofDermatologyandVenereology,theSecondHospitalofShanxiMedicalUniversity,Taiyuan030001,China)
The aims of this study are to construct theBem46 knockout strain ofAspergillusfumigatus, investigate the effect of theBem46 in the growth and germination, and observe the sensitivity of the oxidative stress, the osmotic stress, the temperature and the response to caspofungin and nikkomycin. TheBem46 gene was identified by sequence alignment inA.fumigatusgenome database. TheBem46 knockout strain was construction by the protoplast. The growth was observed and compared between Ku80 and ΔBem46 on different culture medium, such as GMM, GMM containing hydrogen peroxide, formamide, sodium chloride and sorbitol. The growth diameter was measured under the different temperatures. The germination rate was observed and compared by microscope. Results showed that theBem46 gene, Afu7g04660, contained 1 116 bp bases pair and encoding 311 amino acids. Six transformants were obtained by gene cloning and protoplast method and only one was confirmed by PCR and Southernblot. The ΔBem46 grew significantly faster than the control strain on the medium containing sorbitol. And there were no visible difference between ΔBem46 and Ku80 on the other medium. The germination rate of the ΔBem46 was more retarded than the Ku80 in GMM liquid medium. In conclusion, theBem46 gene plays a role in osmotic stress inA.fumigatusand involved in osmotic pressure induced by sorbitol. And there is no visible effect in oxidative stress. TheBem46 gene has a positive effect on spore germination.
Bem46;Aspergillusfumigatus; germination rate; signal transduction
10.3969/j.issn.1002-2694.2017.08.006
国家青年科学基金项目资助(No.81101233),山西省青年科技研究基金(No.2010021036-2),山西省卫生计生委科研课题(No.2015043),山西省回国留学人员科研资助项目(No.2016-052)联合资助
马 彦: Email:mayan197522@163.com
山西医科大学第二医院皮肤科,太原 030001
Supported by the National Science Foundation for Young Scientists of China(No. 81101233), the Natural Science Foundation for Youth in Shanxi Province (No.2010021036-2), the Research Project of Health and Family Planning Commission of Shanxi Province (No.2015043), and the Research Project Supported by Shanxi Scholarship Council of China (No.2016-052) Corresponding author: Ma Yan, Email: mayan197522@163.com
R378
:A
:1002-2694(2017)08-0694-06
2016-11-14编辑:梁小洁

