愈创木酚甘油醚和右美沙芬复方制剂中杂质同时测定的方法研究
柴洪帆,郑 扬,曹 霞
(海南澳美华制药有限公司,海南 海口 570311)
·检验检测·
愈创木酚甘油醚和右美沙芬复方制剂中杂质同时测定的方法研究
柴洪帆,郑 扬,曹 霞
(海南澳美华制药有限公司,海南 海口 570311)
目的 建立可同时检测愈创木酚甘油醚和右美沙芬复方制剂中有关物质的方法。方法 色谱柱为Waters XBridge C18柱(250 mm× 4.6 mm,3.5 m),流动相A为pH=3.0的磷酸二氢钾溶液-乙腈(90∶10,V/V),流动相B为pH=2.8的磷酸二氢钾溶液-乙腈-甲醇(10∶10∶80,V/V/V),梯度洗脱,检测波长为280 nm。结果 强制降解条件(氧化、酸、碱、高温、光照)下,主成分与杂质均得到了有效检测。愈创木酚甘油醚、右美沙芬和其他8种特定杂质质量浓度在线性范围内与峰面积线性关系良好。结论 所建立的方法准确度、检测限、定量限、精密度、耐用性等均符合人用药品注册技术要求国际协调会议(ICH)指导原则的要求。
反相高效液相色谱法;愈创木酚甘油醚;右美沙芬;复方制剂;杂质
右美沙芬(dextromethorphan,DM)为 3-甲氧基-17-甲基-(9α,13α,14α)-吗啡喃氢溴酸一水合物,为白色或类白色结晶性粉末,无臭[1]。愈创木酚甘油醚(guaifenesin,GG)为 3-(2-甲氧基苯氧基)丙烷-1,2-二醇,口服后刺激胃黏膜,反射性引起支气管分泌增加,使痰液稀释[2]。二者的复方制剂临床主要用于治疗急、慢性支气管炎和流行性感冒引起的咳嗽、痰多、咽痛等[3],也常用于儿童咳嗽的治疗[4]。有关物质的检测是复方制剂质量控制中最具挑战性的任务。愈创木酚甘油醚和氢溴酸右美沙芬收载于美国药典(USP35)和欧洲药典(EP8.0),复方制剂未见收载。目前,单一组分的检测方法得到了广泛研究[5-8],但关于右美沙芬和愈创木酚甘油醚复方制剂的质量研究较少[9-11]。本研究的主要目的是建立愈创木酚甘油醚和右美沙芬复方制剂的有关物质测定方法,用于监控产品的化学杂质,保证产品的安全性和有效性。现报道如下。
1 仪器与试药
1.1 仪器
高效液相色谱仪,包括Waters Alliance E2695分离系统、Waters 2998光电二极管阵列检测器、柱温箱及 Empower 3色谱工作站;Waters XBridge C18柱(250 mm×4.6 mm,3.5 μm);Binder 720P型药物稳定性试验箱;XS 105DU型十万分之一电子天平,XP26型百万分之一电子天平(MettlerToledo公司)。
1.2 试药
甲醇(色谱纯,FisherScientific);氢溴酸右美沙芬对照品(DM,批号为100201-201204),愈创木酚甘油醚对照品(GG,批号为100528-201303),均购自中国食品药品检定研究院;氢溴酸右美沙芬杂质A对照品(DM-A,批号为Y0000261,EP);氢溴酸右美沙芬杂质B对照品(DM-B,批号为492,LGC);氢溴酸右美沙芬杂质C对照品(DM-C,批号为35952,LGC);氢溴酸右美沙芬杂质氮氧化物(DM-N-Oxide,批号为 32441,LGC);愈创木酚甘油醚杂质A对照品(GG-A,批号为C4X-1294-1510,CATO);愈创木酚甘油醚杂质B对照品(GG-B,批号为21182,LGC);愈创木酚甘油醚杂质C对照品(GG-C,批号为52038,LGC);愈创木酚甘油醚杂质 D对照品(GG-D,批号为 CX4-1294-1601,CATO);复方氨酚美沙芬口服液(批号为16071401,16072201,16072202,自制样品);其他试剂均为分析纯。各杂质化学名及简写见表1。

表1 愈创木酚甘油醚和右美沙芬杂质的化学名及简写
2 方法与结果
2.1 溶液制备
系统适用性溶液:分别精密称取愈创木酚甘油醚杂质对照品(GG-A,GG-B,GG-C,GG-D),氢溴酸右美沙芬杂质对照品(DM-A,DM-B,DM-C,DM-NOxide),氢溴酸右美沙芬对照品和愈创木酚甘油醚对照品,分别配制成约含愈创木酚甘油醚杂质对照品0.003 g/L,氢溴酸右美沙芬杂质对照品0.02 g/L,GG 0.6 g/L及DM 4 g/L的溶液,作为系统适用性溶液。
供试品溶液:精密吸取复方氨酚美沙芬口服液2.4 g,置10 mL容量瓶中,加入甲醇-水(50∶50)溶液适量,超声30 min,定容至刻度,滤过,取续滤液,作为供试品溶液。
2.2 色谱条件优选
2.2.1 检测波长
采用全波长检测,分别对主成分DM和GG及其他8种已知杂质进行测定,结果全部组分在215~230 nm及273~304 nm波长范围有最大吸收,由于215~230 nm波长接近末端吸收,最终选择280 nm作为检测波长。试验结果显示,在此检测波长下,主成分及其他杂质均有良好吸收,同时基线较为平稳。特定杂质紫外吸收光谱图见图1。
2.2.2 流动相梯度洗脱条件
起始梯度洗脱条件的流动相:流动相A为缓冲盐-乙腈(90∶10,V∶V),流动相B为缓冲盐-乙腈-甲醇(10∶10∶80,V∶V∶V);缓冲盐为0.01 mol/L的磷酸二氢钠和0.004 6 mol/L的正辛烷磺酸钠水溶液,稀磷酸调节pH为3.0,梯度洗脱条件见表2。分别考察不同的色谱条件下,系统适用性试验中各杂质峰和主峰,以及杂质峰之间的分离情况,结果显示,由于DM-A,DM,DM-N-Oxide极性极为相似,色谱图中杂质峰与主峰重叠而无法分离(见图2)。通过后续的梯度洗脱条件、缓冲盐溶液浓度和种类、柱温等优化筛选得到了最终梯度洗脱条件(见表2),系统适用性溶液中主峰和8个杂质峰可达到分离要求。

图1 特定杂质的紫外吸收光谱图

表2 流动相优选过程中代表性梯度洗脱条件
梯度洗脱起始条件(阶段1)筛选:通过筛选起始条件,调整主成分在适当的时间出峰,更有利于主成分与其他8个特定杂质的分离。通过阶段1起始流动相比例调整和梯度斜率的变化,最终选择起始流动相A与B比例由85∶15变化为92∶8,使主成分GG的保留时间由初始的约10 min调整至约20 min,相应DM的保留时间由21 min调整至35~38 min。结果最终选定流动相A与B的比例为92∶8作为启动梯度条件。后续进一步考察DM及与其极性相似的组分(DM-A,DM-NOxide)的分离情况。

图2 优化前色谱条件下系统适用性试验色谱图
梯度变化阶段条件(阶段2和阶段3)筛选:在设定阶段2条件流动相比例为50∶50时分离效果不理想的情况下,保持梯度比例斜率不变,进一步考察流动相A与B的比例由50∶50变化为40∶60(即梯度5和梯度17)的分离效果,初步确定采用40∶60更有利于DMA,DM,DM-N-Oxide的分离。进一步筛选阶段3梯度条件的变化(梯度11至梯度17),结果显示,流动相A比例升高有助于各成分分离,阶段3等度洗脱时效果更佳,进一步增加流动相A比例后更有利于DM-A,DM,DM-N-Oxide,DM-A,GG-C的分离。筛选过程中具有代表性的梯度条件参见图3。

图3 梯度洗脱条件筛选
梯度条件优化:等度洗脱无法达到完全分离,因此变更为梯度洗脱,变化流动相A的比例,同时为达到全部杂质能尽快出峰而得到检测,提高阶段4的有机相比例,从而得到优化的最终梯度洗脱条件(见表2)。采用优化的梯度条件进行检测,全部组分达到了分离度要求(图4)。梯度条件优化过程中具有代表性的梯度条件见图5。

图4 最终选定色谱条件下系统适用性试验色谱图

图5 梯度洗脱条件优化
2.2.3 流动相缓冲盐溶液
缓冲盐溶液组成:分别采用不同的磷酸盐(磷酸二氢钠、磷酸二氢钾)配制缓冲盐溶液并配制流动相,依法进行检测。结果显示,不同种类的盐对吸收强度有影响,配制相同浓度的缓冲盐,采用磷酸二氢钾作为流动相时杂质的响应值更高,更有利于方法的灵敏度。最终选择磷酸二氢钾配制缓冲盐溶液。
缓冲盐溶液浓度:分别采用磷酸二氢钾配制不同浓度的缓冲盐溶液并配制流动相,依法进行检测。结果显示,缓冲盐浓度对峰形有影响。最终选择磷酸二氢钾浓度为0.01 mol/L和正辛烷磺酸钠浓度为0.004 6 mol/L。
缓冲盐溶液pH:分别调节缓冲盐溶液的不同pH,进一步配制成流动相,依法进行检测。结果显示,不同pH的流动相对基线均有一定的影响,pH=2.8时基线最平稳,更有利于方法的灵敏度。最终选择缓冲盐溶液的pH=2.8。
2.2.4 样品稀释剂
分别采用不同的稀释剂制备供试品加样溶液(加入限度水平的杂质),依法检测。结果显示,由于不同成分(主成分或杂质)的化学稳定性不同,稀释剂体系会影响供试品溶液的稳定性,采用甲醇-水溶液(50∶50)为稀释剂时稳定性最佳,能保证供试品加样溶液在24 h内稳定。
2.2.5 色谱柱
所建立的检测方法需同时测定10种成分,其中3种成分极性与DM极为相似,为保证方法的适用性,进行了色谱柱的筛选。分别对品牌、型号、常规参数等不同的色谱柱行比较试验,最终选择Waters XBridge C18柱(250 mm×4.6 mm,3.5 μm)。
2.2.6 柱温
在45~55℃范围内对柱温进行考察,结果随着温度的升高,主峰与杂质峰的分离度增大,柱温为50℃时分离度良好。
2.3 初步拟订的检测色谱条件
色谱柱:Waters XBridge C18柱(250 mm×4.6 mm,3.5μm);流动相:流动相A为缓冲盐溶液-乙腈(90∶10),流动相B为缓冲盐溶液-乙腈-甲醇(10∶10∶80),缓冲盐溶液为0.01 mol/L的磷酸二氢钠和0.004 6 mol/L的正辛烷磺酸钠水溶液,稀磷酸调节pH为2.8,梯度洗脱,洗脱程序见表2的最终条件;流速:0.8 mL/min;柱温:50℃;进样量:20 μL;检测波长:280 nm。
2.4 方法学考察
2.4.1 专属性试验
将样品经高温、光照、酸、碱和氧化破坏,依法测定。结果显示,样品在高温及光照环境中较稳定,基本无降解;在碱性环境极不稳定,降解产物有待进一步明确。同时,在各降解条件下,DM和GG与辅料峰、各杂质峰及降解产物峰均能达到良好分离,方法专属性良好。色谱图见图6。

图6 强制降解试验的典型图谱
2.4.2 检测限测定
取各杂质对照品适量,配制成母液,将母液逐步稀释,依法进样测定。将信噪比(S/N)为3∶1时的进样量作为检测限,结果见表3。
2.4.3 线性关系考察
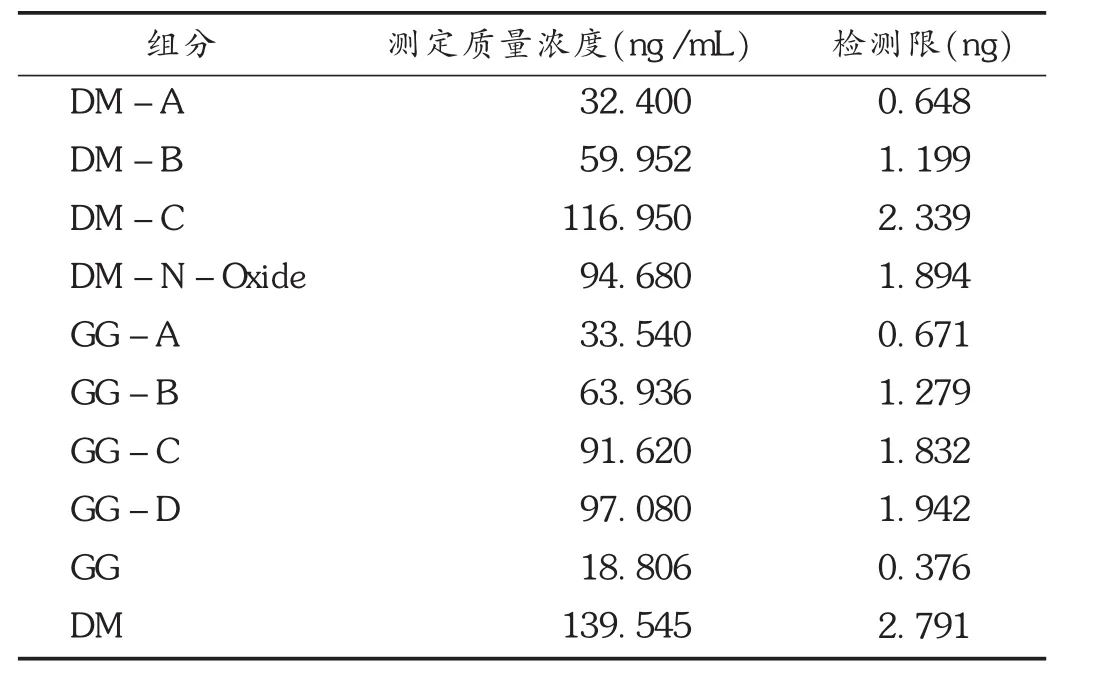
表3 检测限测定结果
取各杂质对照品适量,配制系列对照品溶液,注入高效液相色谱仪测定,记录色谱图。以质量浓度(X,μg/mL)和峰面积(Y)进行线性回归,计算得回归方程。结果表明,主成分和各杂质对照品质量浓度在线性范围内与峰面积线性关系良好。根据测定的标准曲线,采用标准曲线测定法进一步计算校正因子,用于杂质含量的计算。结果见表4。

表4 线性关系考察结果

表5 样品有关物质测定结果(%)
2.4.4 精密度试验
平行配制6份供试品溶液,依法进样测定。结果峰面积的 RSD≤1.5%(n=6),表明仪器精密度良好。
2.4.5 稳定性试验
取加样供试品溶液,分别于配制0,2,4,6,8,10,12,18,20,24 h时各进样测定1次。结果主峰峰面积的RSD为 1.6%(n=10),各限度水平的杂质峰面积的RSD≤5.0%(n=10),表明供试品溶液在室温放置24 h内稳定性良好。
2.4.6 耐用性试验
分别考察了不同批号色谱柱、流动相配比、流速和柱温的微小波动对系统适用性溶液中各峰分离度的影响。结果上述条件微小变化及色谱柱批号变化后,各物质峰之间仍能达到基线分离,杂质峰之间分离度均不小于1.2,表明方法的耐用性良好。
2.5 样品检测
取3批样品,依法进样测定,以加校正因子主成分自身对照法计算有关物质的含量。结果见表5。
3 讨论
经查询文献,右美沙芬复方制剂的法定标准或药典标准皆未收载其有关物质检查方法,因此,建立其有关物质检测与控制方法对于产品的质量控制具有重要意义。右美沙芬复方制剂中,氢溴酸右美沙芬和愈创木酚甘油醚的稳定性具有差异,同时规格相差较大(氢溴酸右美沙芬为3 g/mL,愈创木酚甘油醚为20 g/L),为保证质量,需要明确各杂质的归属并进行控制,且需要检验方法具有较高的专属性和灵敏度。
复方制剂中主成分氢溴酸右美沙芬和愈创木酚甘油醚极性相差较大,DM-C,DM,DM-N-Oxide,DM-A和GG-C极性相似,为有关物质方法的研究带来了挑战。采用高效液相色谱法分析,能够实现较好的分离效果。因此,本研究中采用反相高效液相色谱梯度洗脱条件进行设计,分别对梯度洗脱条件、缓冲盐的种类和溶液浓度、柱温、色谱柱等色谱条件进行了筛选。结果表明,在拟订色谱条件下,主成分DM和GG、防腐剂苯甲酸钠(BN)、DM和GG的8个已知杂质,以及其他杂质均可达到良好分离,从而建立了行之有效的有关物质检测方法,可用于产品的质量控制[12]。进一步对检测方法进行方法学考察,结果表明,方法的准确度、检测限、定量限、精密度、耐用性等均符合ICH指导原则的要求。
[1]Papich MG.Dextromethorphan.Saunders Handbook of Veterinary Drugs(Fourth Edition):Small and Large Animal[M].Elsevier LTD:Oxford,2016:225-226.
[2]Sherrington LA,Sherrington A.Guaifenesin[J].Analytical Profilesof Drug Substances and Excipients,1998,25:121-164.
[3]Paul IM,Yoder KE,Crowell KR,et al.Effect of dextromethorphan,diphenhydramine,and placebo on nocturnal cough and sleep quality for coughing children and their parents[J].Pediatrics,2004,114(1):85-90.
[4]Yoder KE,Shaffer ML,La Tournous SJ,et al.Child assessment of dextromethorphan,diphenhydramine,and placebo for nocturnalcough due to upper respiratory infection[J].Clin Pediatr(Phila),2006,45(7):633-640.
[5]Amaratunga P,Clothier M,Lorenz Lemberg B,et al.Determination of Dextromethorphan in Oral Fluid by LC-MS-MS[J].J Anal Toxicol,2016,40(5):360-366.
[6]Xu R,Xu T,Wang Z,et al.Simultaneous determination of dextromethorphan and dextrophan in rat plasma by LC-MS/MS and its application to a pharmacokinetic study[J].Pharmazie,2012,67(6):485-489.
[7]Reddy PS,Sudhakar Babu K,Kumar N,et al.Development and validation of stability indicating the RP-HPLC method for the estimation of related compounds of guaifenesin in pharmaceutical dosageforms[J].PharmaceuticalMethods,2011,2(4):229-234.
[8]Grosa G,Del Grosso E,Russo R,et al.Simultaneous,stability indicating,HPLC-DAD determination of guaifenesin and methyl and propyl-parabens in cough syrup[J].Journal of Pharmaceutical and Biomedical Analysis,2006,41(3):798-803.
[9]Eichhold TH,McCauley-Myers DL,Khambe DA,et al.Simultaneous determination of dextromethorphan,dextrorphan,and guaifenesin in human plasma using semi-automated liquid/liquid extraction and gradient liquid chromatography tandem mass spectrometry[J].Pharm Biomed Anal,2007,43(2):586-600.
[10]Raju R,Kumar NA,Kumar SR.Development and Validation of a Stability-Indicating RP-HPLC Method for the Simultaneous Estimation of Guaifenesin and Dextromethorphan Impurities in PharmaceuticalFormulations[J].Chromatography Research International,2013:315145.
[11]McSharry WO,Savage IV.Simultaneous high-pressure liquid chromatographic determination of acetaminophen,guaifenesin,and dextromethorphan hydrobromide in cough syrup[J].Journal of Pharmaceutical Sciences,1980,69(2):212-214.
[12]Rajagopalan R.Review of regulatory guidance on impurities[J].Separation Science and Technology,2004,5:27-37.
Simultaneous Determination of Impurities in Guaifenesin and Dextromethorphan Compound Preparation
Chai Hongfan,Zheng Yang,Cao Xia
(Hainan Bright Future Pharmaceutical Co.,Ltd.,Haikou,Hainan,China 570311)
Objective To establish a method for simultaneous determination of guaifenesin and dextromethorphan compound preparation.Methods The chromatographic column was Waters XBridge C18column(250 mm×4.6 mm,3.5μm).The mobile phase A consisted of pH=3.0 monopotassium phosphate solution-acetonitrile(90∶10,V/V),the mobile phase B consisted of pH=3.0 monopotassium phosphate solution-acetonitrile-methanol(10∶10∶80,V/V/V),gradient elution,the detection wavelength was 280 nm.Results Under the conditions of forced degradation(oxidation,acid,alkali,high temperature,light),the principal components and impurities were effectively detected.Guaifenesin,dextromethorphan and other 8 kinds of specific impurities had a good linear relationship in the concentration range.Conclusion The established method is validated according to ICH guidelines with respect to accuracy,limits of inspection,limits of quantification,precision and durability.
RP-HPLC;guaifenesin;dextromethorphan;compound preparation;impurity
R927
A
1006-4931(2017)16-0018-06
2016-12-07;
2017-04-28)
10.3969/j.issn.1006-4931.2017.16.006
柴洪帆,女,硕士研究生,中级工程师,研究方向为药品质量控制,(电子信箱)wangy1580@163.com。

