珠三角高产养殖池塘浮游动物群落结构及水质评价
李志斐谢 骏张晓可,王广军连玉喜余德光王翠翠郁二蒙张 凯
(1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广州 510380; 2. 安庆师范大学水生生物保护与水生态修复安徽省高校工程技术研究中心, 安庆 246133)
珠三角高产养殖池塘浮游动物群落结构及水质评价
李志斐1谢 骏1张晓可1,2王广军1连玉喜2余德光1王翠翠1郁二蒙1张 凯1
(1. 中国水产科学研究院珠江水产研究所, 农业部热带亚热带水产资源利用与养殖重点实验室, 广州 510380; 2. 安庆师范大学水生生物保护与水生态修复安徽省高校工程技术研究中心, 安庆 246133)
为进一步了解珠三角高产池塘养殖环境状况, 分析珠三角高产池塘浮游动物群落特征及与池塘水质的相关性, 研究于2016年7—8月对珠三角地区6种主要高产养殖模式30口池塘的浮游动物和环境因子进行了调查。研究结果表明: (1)共采集浮游动物55种, 其中原生动物17种、轮虫29种、枝角类4种、桡足类5种。6种养殖模式池塘中, 大口黑鲈S池塘浮游动物种类数最多, 为34种; 草鱼池塘最少, 为18种。(2)30口池塘共记录优势种8种, 其中原生动物和轮虫各4种, 枝角类和桡足类均不占优势。在6种养殖模式池塘中, 优势种也仅包括原生动物和轮虫, 优势种种类数变化范围为5—8种。(3)30口池塘浮游动物平均密度和生物量均较高, 分别为21354 ind./L和9.36 mg/L。方差分析结果表明6种养殖模式池塘浮游动物密度和生物量均不存在显著差异。(4)RDA分析结果表明, TP和pH是影响珠三角池塘浮游动物分布的主要因素。采用浮游动物丰度和生物量对水质的评价结果显示, 6种养殖模式池塘均处于富营养化状态; 运用Shannon-Wiener多样性指数和Margalef多样性指数对水质的评价结果表明, 6种模式养殖池塘均处于α-中污状态, 且以草鱼池塘的污染最为严重。本研究首次利用浮游动物对珠三角高产池塘进行水质评价, 研究结果可为池塘生态修复和管理提供一定的指导意见。
珠三角; 池塘; 浮游动物; 群落结构; 水质评价
浮游动物(Zooplankton)几乎分布于各种水体,它们个体小、数量多、代谢活动强烈[1]。作为重要的次级生产者, 它们不仅能够通过下行效应控制浮游植物群落的变化, 还能够在一定程度上影响富营养化的过程[2], 因此在水域生态系统中发挥着十分重要的作用。此外, 浮游动物由于生存周期较长,对外界环境变化较为敏感, 其种类组成、现存量及多样性特征能够较好反应水体健康状况[3,4]。因此浮游动物在富营养化治理、水体健康评价和水质监测等方面越来越受到人们的重视。
珠三角位于广东省东南部, 是由西江、北江与东江等共同冲积形成的三角洲复合体, 面积约11000 km2。区域内属于亚热带气候, 雨量充沛, 池塘棋布, 是全国最大的淡水鱼养殖生产基地, 具有种类多、单产高、产业化程度高等特点。近几十年来, 该区域水产养殖技术得到快速发展, 使渔产量大大提高, 然而, 这一转变主要是通过增加养殖密度和投饵量来实现, 池塘水质常受到较为严重的污染[5]。考虑到池塘水环境对水产品质量安全的影响, 一些研究者采用水化学方法对珠三角池塘水体理化参数开展了研究[6], 但利用水生生物系统地评价珠三角地区主要密养池塘水质的研究鲜有报道。草鱼(Ctenopharyngodon idellus)、罗非鱼(Oreochromis mossambicus)、大口黑鲈(Micropterussalmoides)和杂交鳢(Channa maculate♀ × Channa arguss♂)是珠三角地区的主体养殖品种, 其养殖技术和产量均处于国际领先水平。为掌握珠三角池塘高峰养殖季节浮游动物的群落结构特征, 进而评价养殖池塘的水质状况, 本研究于2016年7—8月对以上4种主要养殖鱼类共计30个池塘进行了调查,探讨珠三角密养池塘浮游生物群落结构及其与环境因子的关系, 旨在为管理好密养池塘水质和提高养殖效果提供科学依据。
1 研究区域与方法
1.1 样点设置
4种鱼类根据养殖规格和投喂食物不同可分为6种模式, 分别为: (1)草鱼池塘(Grass carp pond, GC): 草鱼规格40—45 cm, 完全投喂饲料(粗蛋白≥26%、TP≥0.6%), 渔产量3.75 kg/m2/年; (2)罗非鱼池塘(Tilapia pond, TI): 罗非鱼规格10—15 cm, 完全投喂饲料(粗蛋白≥30%、TP≥0.7%), 渔产量2.10 kg/ m2/年; (3)大口黑鲈S池塘(Largemouth bass pond-S, LB-S): 大口黑鲈规格12—15 cm, 完全投喂饲料(粗蛋白≥42%、TP≥1.0%), 渔产量6.00 kg/m2/年; (4)大口黑鲈S+B池塘(Largemouth bass pond-S+B, LB-S+B): 大口黑鲈规格12—15 cm, 投喂冰鲜鱼类和饲料(粗蛋白≥42%、TP≥1.0%)各占一半, 渔产量6.00 kg/m2/年; (5)杂交鳢Y池塘(Hybrid snakehead pond-Y, HS-Y): 杂交鳢规格6—7 cm, 完全投喂饲料(粗蛋白≥40%、TP≥1.0%), 渔产量6.00 kg/m2/年; 6)杂交鳢C池塘(Hybrid snakehead pond-C, HS-C):杂交鳢规格35—40 cm, 完全投喂饲料(粗蛋白≥40%、TP≥1.0%), 渔产量6.00 kg/m2/年。
每种模式均选择5个池塘, 每个池塘水深1.9—3.0 m, 面积4000—6670 m2。采用5点采样法(每个池塘4角和中心各设1个采样点, 然后混合)对所有池塘浮游动物进行采集。采样区域见图 1。

图 1 珠三角不同类型养殖池塘采样区域分布图
1.2 研究方法
于2016年7—8月对6种养殖模式池塘浮游动物和相关环境因子进行了调查。用YSI多功能水质分析仪(Pro Plus)测定水体的温度(Temperature, Temp)、溶解氧(Dissolved oxygen, DO)、电导率(Conductivity, Cond)、pH、溶解性固体总量(Total dissolved solids, TDS)等指标, 然后每个池塘均取混合水样, 带回实验室按照标准方法[7]测定水体中的总氮(Total nitrogen, TN)、总磷(Total phosphorus, TP)、磷酸盐(Phosphorous salts,和总有机碳(TOC, Total organic carbon)含量等指标。浮游动物分定性和定量采集, 定性采集使用25号浮游生物网捞取, 加福尔马林固定后带回实验室, 参照相关资料进行种类鉴定。原生动物和轮虫标本的定量采集取1 L水样加入鲁哥氏液固定, 然后倒入有刻度的沉淀器定容, 静置24h后, 用虹吸管吸取上清液,并把沉淀物倒入已标定容积(30 mL)的小塑料瓶中。桡足类和枝角类的定量采集取20 L水样经25号浮游生物网滤缩后放入小塑料瓶中, 加福尔马林固定后鉴定。
1.3 数据分析
根据浮游动物不同物种的出现频率(fi)和个体数量(Ni)与总数量(N)的比例来计算优势度, 公式为优势度Y=(Ni/N)fi。当Y≥0.02时, 确定为优势种[8]。在SPSS18.0软件中运用单因素方差分析(One-way ANOVA)来检验6种养殖模式池塘环境因子和浮游动物密度、生物量之间差异的显著性。若有显著差异, 采用Duncan’s多重比较来检验组之间的差异。采用Canoco4.5软件对浮游动物与环境因子之间的关系进行冗余分析(Redundancy analysis, RDA)。在RDA分析前, 首先选取浮游动物优势度Y≥0.005的物种构建矩阵, 然后对浮游动物多度数据进行除趋势对应分析(Detrended correspondence analysis, DCA), 据其第一轴长度确定分析类型(大于4使用CCA分析, 小于3使用RDA分析, 处于3—4二者均可[9])。
采用浮游动物丰度和生物量对池塘水体的营养状态进行评价, 评价标准为丰度<1000 ind./L为贫营养型、1000—3000 ind./L为中营养型、>3000 ind./L为富营养型; 生物量<1.0 mg/L为贫营养型、1—3 mg/L为中营养型、>3 mg/L为富营养型[10]。采用Shannon多样性指数(H′)、Margalef多样性指数(D)来评价养殖池塘水体的污染状况, 其计算公式: (1) H′=–Σ(Pi)(lnPi), 公式中Pi为物种i个体数所占的比例[11]。(2) D=(S–1)/lnN, 公式中N为样品中所有物种的总个体数, S为样品中种类总数[12]。两者评价标准均为: 0—1为多污型、1—2为α-中污、2—3为β-中污、3—4为寡污型、>4为清洁[2]。
2 结果
2.1 水体理化性质
2.2 种类组成
30个池塘共采集浮游动物55种, 其中轮虫种类数最多, 为29种; 其次是原生动物, 为17种; 枝角类和桡足类种类数最少, 仅分别为4和5种(表 2)。

表 1 珠三角6种养殖模式水体理化性质(表中数值为平均值和标准差)Tab. 1 Physico-chemical parameters of six model aquaculture ponds in the Pearl River Delta (presented as mean and standard deviation)
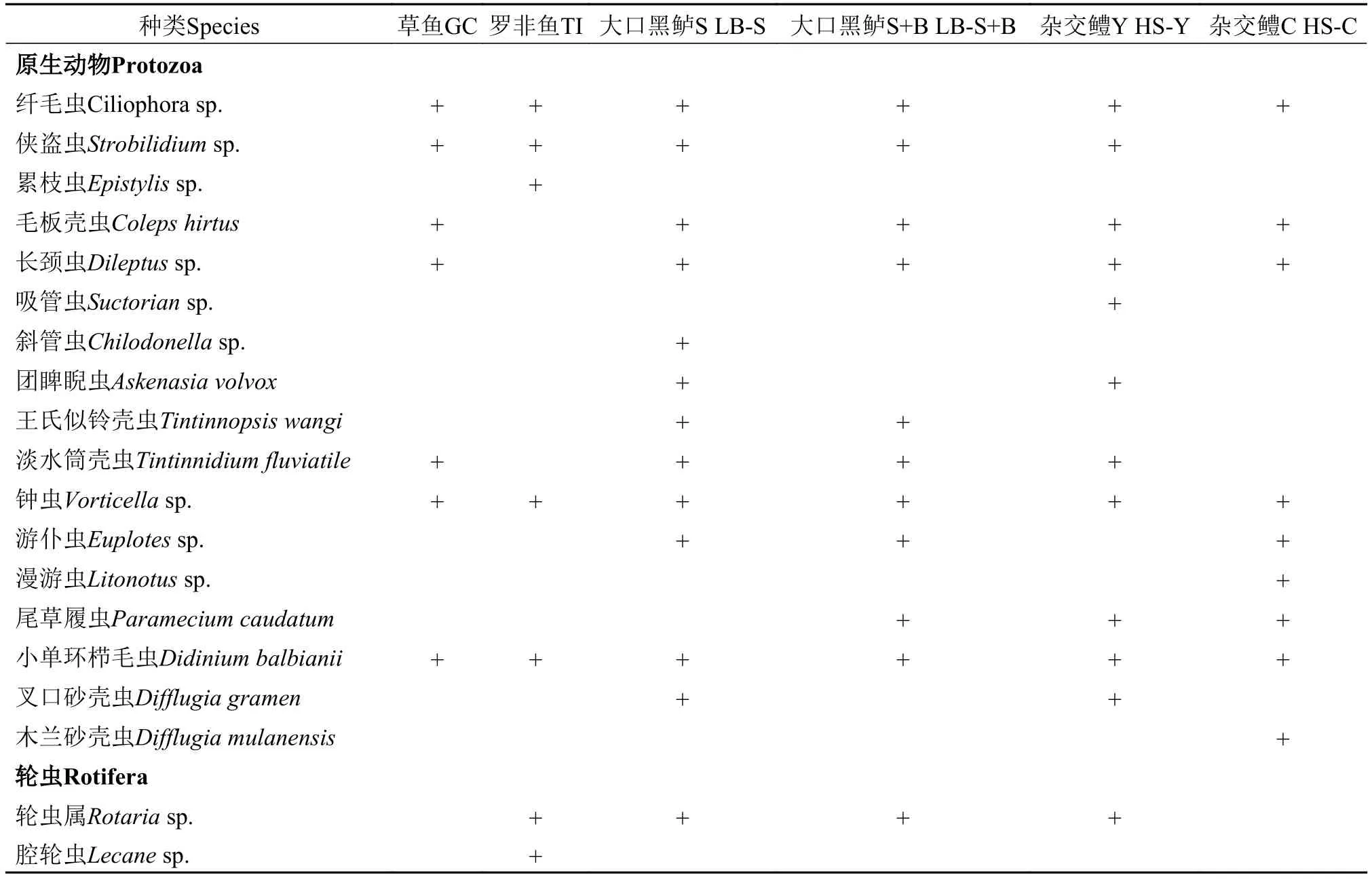
表 2 珠三角6种养殖模式池塘浮游动物种类组成Tab. 2 Species composition of zooplankton in six model aquaculture ponds in the Pearl River Delta

续表 2
6种养殖模式池塘浮游动物种类数差异较大。大口黑鲈S池塘种类数最多, 为34种; 草鱼池塘种类数最少, 为18种; 其余4种模式种类数从多到少依次为大口黑鲈S+B、杂交鳢Y、罗非鱼和杂交鳢C池塘, 分别为32、30、28和24种(表 2)。从分类群上来看, 6种模式池塘均是以轮虫为主, 其次是原生动物, 枝角类和桡足类种类数均较少(图 2)。
2.3 优势种
以优势度Y≥0.02作为优势种, 珠三角池塘共记录到优势种8种, 其中原生动物4种, 分别为纤毛虫一种(Ciliophora sp.)、毛板壳虫(Coleps hirtus)、钟虫一种(Vorticella sp.)和小单环栉毛虫(Didinium balbianii); 轮虫4种, 分别为长三肢轮虫(Filinia longiseta)、广布多肢轮虫(Polyarthra vulgaris)、暗小异尾轮虫(Trichocerca pusilla)和角突臂尾轮虫(Brachionus angularia)(表 3)。枝角类和桡足类优势度均较小。优势度和出现频率最大的物种均为纤毛虫一种。

图 2 珠三角6种模式池塘不同类群浮游动物种类数
6种养殖模式池塘优势种也仅包括原生动物和轮虫。其中, 草鱼池塘7种、罗非鱼池塘5种、大口黑鲈S池塘6种、大口黑鲈S+B池塘8种、杂交鳢Y池塘6种、杂交鳢C池塘8种(表 3)。除杂交鳢Y池塘优势度最大的种为钟虫一种外, 其余池塘均为纤毛虫一种(表 3)。
2.4 密度和生物量
珠三角池塘浮游动物平均密度为21354 ind./L,其中原生动物、轮虫、枝角类和桡足类平均密度分别为15310、5834、41和169 ind./L, 分别占总密度的71.7%、27.3%、0.2%和0.8%。珠三角池塘浮游动物平均生物量为9.36 mg/L, 其中原生动物、轮虫、枝角类和桡足类平均生物量分别为0.76、7.00、0.82和0.77 mg/L, 分别占总密度的8.2%、74.8%、8.8%和8.2%。
6种模式中草鱼池塘浮游动物密度最高, 为28212 ind./L; 罗非鱼池塘密度最低, 为6973 ind./L;其余4种模式密度在15039—26425 ind./L (图 3)。杂交鳢C池塘浮游动物生物量最高, 为16.27 mg/L,草鱼池塘生物量最低, 为5.35mg/L; 其余四种模式生物量在6.58—10.65 mg/L (图 3)。方差分析结果表明, 6种养殖模式池塘浮游动物密度和生物量均不存在显著差异。
从不同分类群上看, 6种模式池塘中原生动物密度所占比例最高, 其次是轮虫, 枝角类和桡足类所占比例均很小; 6种模式池塘中轮虫生物量所占比例最高, 其他3个类群生物量在不同模式中所占比例差异较大(图 3)。
2.5 影响因素
图 4显示了优势度Y≥0.005的15个物种与环境因子的关系。RDA排序轴前两轴的特征值分别为0.236和0.084, 分别解释了53.5%和19.0%的物种-环境关系变量。Monte Carlo检验分析表明排序轴的特征值具有显著性(P<0.05)。在9个环境因子中, 影响珠三角浮游动物分布的主要因素是TP和pH, 其中TP主要贡献于第一轴, 而pH主要贡献于第二轴。

表 3 珠三角6种养殖模式池塘浮游动物优势种出现频率和优势度Tab. 3 Occurrence frequencies and dominance of dominant species in six model aquaculture ponds in the Pearl River Delta
2.6 水质评价
如表 4所示, 按照丰度和生物量评价等级标准, 6种模式池塘均处于富营养化状态。按照Shannon-Wiener多样性指数(H′)和Margalef多样性指数(D)评价等级标准, 6种模式池塘多样性指数均处于1—2,均处于α-中污状态。其中, 草鱼池塘的污染最为严重。

图 3 珠三角6种养殖模式池塘浮游动物密度和生物量
3 讨论
3.1 浮游动物群落结构

图 4 珠三角池塘浮游动物与环境因子的RDA分析

表 4 基于浮游动物的珠三角6种养殖模式池塘水质生物学评价Tab. 4 Bioassessment of water quality based on zooplankton in six aquaculture ponds of in Pearl River Delta
一般认为, 在中营养水平水体中浮游动物群落结构复杂, 多样性较高; 而在极端贫营养或富营养水体中物种多样性较低[13]。这主要是由于贫营养水体中浮游动物的食物资源较为匮乏, 而在富营养水体中一些对污染敏感的种类消失[14]。养殖池塘作为一种相对封闭的生态系统, 由于其自净能力十分有限, 常遭受更为严重的污染[6]。按照《地表水环境质量标准》(GB3838-2002), 珠三角池塘水体TN和TP含量均远超V类水质标准, 因此其种类组成也相对较为简单。6种模式池塘种类数变化范围仅为18—34种, 远低于长江中下游一些湖泊[15,16]。优势种组成方面, 毛板壳虫(Coleps hirtus)、小单环栉毛虫(Didinium balbianii)、长三肢轮虫(Filinia longiseta)、广布多肢轮虫(Polyarthra vulgaris)、萼花臂尾轮虫(Brachionus calyciflorus)和角突臂尾轮虫(B. angularia)均为富营养水体的常见指示物种,均具有较强的耐污能力[17,18]。此外, 一些对富营养化水体的研究结果还表明, 随着水体富营养化程度的增加, 浮游动物的密度和生物量均逐渐增加, 其中小型浮游动物原生动物和轮虫的增长尤为迅速,因此浮游动物往往还表现出小型化趋势[13,19]。一般认为这主要是由2方面造成的, 一是在较多的营养输入下, 浮游植物可以为浮游动物提供更丰富的食物来源[20]; 二是鱼类对浮游动物的捕食具有选择性, 在同等能量消耗下, 会优先选择个体较大的种类[21]。在本研究中, 无论从优势种的组成, 还是从不同类群密度和生物量所占比例方面, 小型浮游动物均占绝对优势, 与以上结论一致。国内对华中地区主养草鱼池塘的研究也获得了相似的结果[22], 然而赵超等[23]对山东微山县乌鳢(Channa argus)养殖池塘浮游动物的研究结果却刚好相反。后者认为小型浮游动物(原生动物和轮虫)对环境的反应更敏感, 养殖池塘定期的消毒会对其产生更明显的不利影响, 这也许是池塘管理措施差异影响的结果。
在6种养殖模式池塘中, 浮游动物的密度和生物量虽然存在一定差异, 但并没有达到显著水平,这可能主要是由于同一养殖模式内部池塘具有较大差异造成的。虽然珠三角地区大多是标准化鱼塘, 同一养殖模式池塘的面积、水深、长宽比、饲料类型等基本相同, 但养殖池塘间不同的养殖管理措施, 例如饲料投喂量和时间、增氧机的使用、水质改良剂等物质的使用等, 可能会在短时间内改变水体的理化性质(如pH、溶氧和营养盐含量等), 从而对浮游动物的密度和生物量产生较大影响。这与国内其他一些池塘的研究结果一致[22]。此外, 值得注意的是杂交鳢C池塘浮游动物平均密度和生物量均高于杂交鳢Y池塘, 这可能主要是由于杂交鳢幼鱼对池塘浮游动物的捕食压力较大造成的。有研究表明杂交鳢幼鱼可捕食部分枝角类和桡足类,而20 cm以上成鱼则基本不捕食浮游动物[24]。
3.2 影响因素及水质评价
影响浮游动物群落结构的因素较多, 常见的生物因素包括食物的质量和浓度、竞争、捕食等, 而非生物因素包括水温、光照、pH和营养盐含量等[25]。一般认为, 非生物因子中对浮游动物影响最大的是水温[24]; 因为高温时浮游动物的寿命减小、内禀增长率增大[26], 并且其生长速率也随温度的增加而增大[27]。然而, 本研究6种养殖模式池塘的调查时间均在夏季, 平均水温的变化范围仅为32.14—33.94℃, 因此水温可能对浮游动物群落结构的影响较小。RDA分析结果表明TP和pH是影响浮游动物分布的主要因素。从二维排序图(图 4)中可以看出,纤毛虫一种、淡水筒壳虫(Tintinnidium fluviatile)、长三肢轮虫、广布多肢轮虫和角突臂尾轮虫均与TN正相关, 而与TP显著正相关。这些物种除纤毛虫一种外, 均是富营养水体的指示物种[17,18]; 而对纤毛虫的一些研究也表明, 其丰度和生物量与富营养程度呈显著正相关[28]。在TN和TP的相反方向上,则主要分布着长颈虫(Dileptus sp.)、裂痕龟纹轮虫(Anuraeopsis fissa)和暗小异尾轮虫(Trichocerca pusilla)等寡营养水体的指示物种[17,18], 这表明RDA分析具有一定的合理性。pH也是影响浮游动物的重要因素, 浮游动物一些种类(如轮虫和枝角类)对pH非常敏感, 高的pH对臂尾轮虫属种类的生长十分有利, 却常导致一些酸性水体轮虫种类的消失[29]。在本研究二维排序图中, 萼花臂尾轮虫与pH成显著正相关, 也与此一致。
目前利用浮游动物来评价水质状况已有较多研究, 但评价对象大多是河流[30]、湖泊[15]和水库[10]等大型水体。本研究首次采用浮游动物对珠三角池塘的水质进行了评价。根据浮游动物的丰度和生物量评价等级, 6种养殖模式池塘均处于富营养化状态; 根据Shannon-Wiener多样性指数和Margalef多样性指数评价等级标准, 6种养殖模式池塘均处于α-中污染状态。根据沈韫芬等[17]的标准, 生物多样性指数值越低则水质越差。6种养殖模式中草鱼池塘的水质最差、污染也最为严重, 而草鱼池塘浮游动物的密度最高也间接证明了这一点。此外, 本研究结果也表明, 如果养殖池塘的污染进一步加剧, 势必会影响珠三角渔业的可持续发展。鉴于本研究的结果, 针对珠三角地区养殖现状, 需要加强池塘水质和水生生物的监测, 同时改变养殖观念, 加强密养池塘生态环境修复, 发展生态渔业、无公害现代新型渔业, 保障珠三角地区水产品质量安全。
致谢:
中国水产科学研究院珠江水产研究所李家磊、付兵等在野外采样和水化学测定中给予帮助,特此感谢!
[1]Yang Y F, Huang X F. Advances in ecological studies on zooplankton [J]. Journal of Lake Sciences, 2000, 12(1): 81—89 [杨宇峰, 黄祥飞. 浮游动物生态学研究进展. 湖泊科学, 2000, 12(1): 81—89]
[2]Lin Q, You W H, Xu F J, et al. Zooplankton community structure and its relationship with environmental factors in Dishui Lake [J]. Acta Ecologica Sinica, 2014, 34(23): 6918—6929 [林青, 由文辉, 徐凤洁, 等. 滴水湖浮游动物群落结构及其与环境因子的关系. 生态学报, 2014, 34(23): 6918—6929]
[3]Tavernini S, Mura G, Rossetti G. Factors influencing the seasonal phenology and composition of zooplankton communities in mountain temporary pools [J]. International Review of Hydrobiology, 2005, 90(4): 358—375
[4]Echaniz S A, Vignatti A M, De Paggi S J, et al. Zooplankton Seasonal Abundance of South American Saline Shallow Lakes [J]. International Review of Hydrobiology, 2006, 91(1): 86—100
[5]Liu Q F, Lai Z N, Wang C, et al. Studies on dynamics of Chl.a and water environment of intensive fishponds in Pearl River Delta [J]. Chinese Agricultural Science Bulletin, 2015, 31(2): 138—145 [刘乾甫, 赖子尼, 王超, 等.珠三角地区密养淡水鱼塘水体叶绿素a及水环境动态研究. 中国农学通报, 2015, 31(2): 138—145]
[6]Liu Q F, Lai Z N, Yang W L, et al. Assessment of water quality of intensive ponds in the Pearl River Delta region [J]. South China Fisheries Science, 2014, 10(6): 36—43 [刘乾甫, 赖子尼, 杨婉玲, 等. 珠三角地区密养淡水鱼塘水质状况分析与评价. 南方水产科学, 2014, 10(6): 36—43]
[7]State Administration of Environmental Protection ed. Analysis in Water and Wastewater [M]. Beijing: China Environmental Science Press. 2002, 236—257 [国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法(第四版). 北京: 中国环境科学出版社. 2002, 236—257]
[8]Deng D G, Yang W, Meng X L, et al. Seasonal variations of Crustacean zooplankton community structure in the middle reaches of the Huaihe River [J]. Acta Hydrobiologia Sinica, 2013, 37(5): 869—875 [邓道贵, 杨威, 孟小丽, 等. 淮河中游浮游甲壳动物群落结构的季节动态.水生生物学报, 2013, 37(5): 869—875]
[9]ter Braak C J F, Verdonschot P F M. Canonical correspondence analysis and related multivariate methods in aquatic ecology [J]. Aquatic Sciences, 1995, 57(3): 255—289
[10]Ju Y F, Yu H X, Yu T, et al. The zooplankton community structure and water quality of Xiquanyan reservoir [J]. Acta Ecologica Sinica, 2016, 36(16): 5126—5132 [鞠永富, 于洪贤, 于婷, 等. 西泉眼水库夏季浮游动物群落结构特征及水质评价. 生态学报, 2016, 36(16): 5126—5132]
[11]Shannon C E, Wiener W J. The Mathematical Theory of Communication [M]. Urbana: University of Illinois Press. 1949, 296
[12]Margalef D R. Information theory in ecology [J]. Generation Systems, 1957, 3: 36—71
[13]Qian F P, Xi Y L, Wen X L, et al. Eutrophication impact on community structure and species diversity of rotifers in five lakes of Anhui [J]. Biodiversity Science, 2007, 15(4): 344—355 [钱方平, 席贻龙, 温新利, 等. 湖泊富营养化对轮虫群落结构及物种多样性的影响. 生物多样性, 2007, 15(4): 344—355]
[14]Dussart B H, Fernando C H, Matsumura-Tundisi T, et al. A review of systematics, distribution and ecology of tropical freshwater zooplankton [A]. In: Dumont H J, Tundisi J G (Eds.), Tropical Zooplankton [C]. Netherlands: Springer. 1984, 77—91
[15]Wang F J, Hu Z Q, Tang J, et al. Evaluation of water quality and the type of nourishment in the Eastern Zone of Lake Chaohu by means of zooplankton [J]. Ecologic Science, 2006, 25(6): 550—553 [王凤娟, 胡子全, 汤洁,等. 用浮游动物评价巢湖东湖区的水质和营养类型. 生态科学, 2006, 25(6): 550—553]
[16]Wu L, Feng W S, Zhang T L, et al. Characteristics of zooplankton community and its relation to environmental factors in lake Wuhu in spring and autumn [J]. Journal of Hydroecology, 2011, 32(2): 31—37 [吴利, 冯伟松, 张堂林, 等. 春, 秋季武湖浮游动物群落特征及其与环境因子的关系. 水生态学杂志, 2011, 32(2): 31—37]
[17]Shen Y F, Gu M R, Gong X J, et al. The New Detection Technique on Minibiology [M]. Beijing: China Architecture Industry Press. 1900, 152—175 [沈韫芬, 顾曼如, 龚循矩, 等. 微型生物监测新技术. 北京: 中国建筑工业出版社. 1990, 152—175]
[18]Sládeček V. Rotifers as indicators of water quality [J]. Hydrobiologia, 1983, 100(1): 169—201
[19]Yang Y F, Huang X F. Structure of zooplankton community in Donghu Lake of Wuhan [J]. Chinese Journal of Applied Ecology, 1994, 5(3): 319—324 [杨宇峰, 黄祥飞.武汉东湖浮游动物群落结构的研究. 应用生态学报, 1994, 5(3): 319—324]
[20]Jeppesen E, Peder Jensen J, SØndergaard M, et al. Trophic structure, species richness and biodiversity in Danish lakes: changes along a phosphorus gradient [J]. Freshwater Biology, 2000, 45(2): 201—218
[21]Hall D J, Threlkeld S T, Burns C W, et al. The size-efficiency hypothesis and the size structure of zooplankton communities [J]. Annual Review of Ecology and Systematics, 1976, 7: 177—208
[22]Zhang N, Xie C X, Zhao F, et al. Community structure characteristics of zooplankton in the Ctenopharyngodon idellus aquaculture ponds and correlations between zooplankton and environmental factors [J]. Freshwater Fisheries, 2014, 44(2): 89—93 [张念, 谢从新, 赵峰, 等. 主养草鱼池塘浮游动物群落结构特征及与池塘环境关系的研究. 淡水渔业, 2014, 44(2): 89—93]
[23]Zhao C, Zhang H H, Chen L, et al. Effects of snakehead culture on zooplankton community structure [J]. Chinese Journal of Zoology, 2014, 49(1): 63—70 [赵超, 张洪海,陈磊, 等. 乌鳢养殖对浮游动物群落结构的影响. 动物学杂志, 2014, 49(1): 63—70]
[24]Gao Y, Lai Z N, Wang G J, et al. Biomass characteristics of zooplankton of different aquaculture ponds in Pearl River Delta [J]. Chinese Agricultural Science Bulletin, 2015, 31(5): 63—69 [高原, 赖子尼, 王广军, 等. 珠三角地区不同养殖池塘浮游动物生物量特征. 中国农学通报, 2015, 31(5): 63—69]
[25]Wang S B. Zooplankton structure in shallow lakes along the middle and lower reaches of the Yangtze River [D]. Thesis for Doctor of Science, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2008 [王松波. 长江中下游浅水湖泊的浮游动物群落结构研究. 博士学位论文, 中国科学院水生生物研究所, 武汉. 2008]
[26]Huang X F. Studies on the biology of three freshwater cladoceran species [J]. Oceanologia et Limnologia Sinica, 1985, 16(3): 188—198 [黄祥飞. 三种淡水枝角类生物学的研究. 海洋与湖沼, 1985, 16(3): 188—198]
[27]Benider A, Tifnouti A, Pourriot R. Growth of Moina macrocopa (Straus 1820) (Crustacea, Cladocera): influence of trophic conditions, population density and temperature [J]. Hydrobiologia, 2002, 468(1-3): 1—11
[28]Cai H J. The response of ciliated protozoans to eutrophication in Meiliang Bay of Taihu Lake [J]. Journal of Lake Sciences, 1998, 10(3): 43—48 [蔡后建. 原生动物纤毛虫对太湖梅梁湾水质富营养化的响应. 湖泊科学, 1998, 10(3): 43—48]
[29]Huang X F, Hu C Y, Wu Z T. Rotifers in Lake Donghu, Wuhan [J]. Acta Hydrobiologia Sinica, 1985, 9(2): 129—143 [黄祥飞, 胡春英, 伍焯田. 武汉东湖的轮虫.水生生物学报, 1985, 9(2): 129—143]
[30]Zhou S C, Huang X F, Tao T, et al. Primary studies on plankton Rotifers and water quality assessment in Xiangxi Bay of the Three Gorges Reservoir [J]. Acta Hydrobiologia Sinica, 2006, 30(1): 52—57 [周淑婵, 黄祥飞,唐涛, 等. 香溪河库湾轮虫现状及水质评价初探. 水生生物学报, 2006, 30(1): 52—57]
COMMUNITY CHARACTERISTICS OF ZOOPLANKTON AND ASSESSMENT OF WATER QUALITY IN AQUACULTURE PONDS OF THE PEARL RIVER DELTA
LI Zhi-Fei1, XIE Jun1, ZHANG Xiao-Ke1,2, WANG Guang-Jun1, LIAN Yu-Xi2, YU De-Guang1, WANG Cui-Cui1, YU Er-Meng1and ZHANG Kai1
(1. Key Lab. of Tropical and Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture, Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, China; 2. Research Center of Aquatic Organism Conservation and Water Ecosystem Restoration in Anhui Province, Anqing Normal University, Anqing 246133, China)
To understand the community characteristics of zooplankton and further assess the water quality in aquaculture ponds, a field survey of zooplankton and environmental parameters was conducted in 30 ponds with six aquaculture models from July to August 2016. The results showed that: (1) a total of 55 species were identified, which included 17 Protozoa, 29 Rotifera, 4 Cladocera, and 5 Copepoda. Among the six model ponds, the most species were found in largemouth bass ponds fed by feedstuff (34 species), while the fewest species were present in grass carp ponds (18 species); (2) eight dominant species were recorded in 30 ponds, including 4 Protozoa and 4 Rotifera. The dominant species in the six model ponds was also composed of Protozoa and Rotifera, and there were between 5 and 8 species; (3) the average density and biomass of zooplankton in 30 ponds were 21354 ind./L and 9.36 mg/L, respectively. However, variance analyses showed that the density and biomass of zooplankton among the six model ponds were not significantly different; and (4) RDA analysis indicated that total phosphorus (TP) and pH were the main factors influencing the distribution of zooplankton in the Pearl River Delta. Water quality results showed that all of the six model ponds were in the state of eutrophication, using richness and biomass of zooplankton, and α-mesosaprobic, using the Shannon-Wiener index and the Margalef index. This study is the first assessment of aquaculture ponds using zooplankton in Pearl River Delta, and the results provide guidance for the ecological restoration and management of aquaculture ponds.
Pearl River Delta; Ponds; Zooplankton; Community structure; Assessment of water quality
Q145.2
A
1000-3207(2017)05-1071-09
10.7541/2017.134
2016-11-01;
2017-02-15
十二五国家科技计划农村领域项目(2012BAD25B04); 公益性行业(农业)科研专项(201203083); 农业部热带亚热带水产资源利用与养殖重点实验室开放课题资助 [Supported by the National Great Project of Scientific and Technical Supporting Program (2012BAD25B04); Special Fund for Agro Scientific Research in the Public Interest (201203083); Open Topic of Key Laboratory of Tropical and Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture]
李志斐(1983—), 男, 河南内黄人; 助理研究员; 主要从事池塘环境修复技术研究。E-mail: lzf@prfri.ac.cn
余德光, E-mail: gzyudeguang@163.com
- 水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE

