大亚湾水域并基拟菱形藻的种类鉴定和产毒特征分析
黄春秀 徐国双 李 扬
(华南师范大学生命科学学院, 广州市亚热带生物多样性与环境生物监测重点实验室, 广州 510631)
大亚湾水域并基拟菱形藻的种类鉴定和产毒特征分析
黄春秀 徐国双 李 扬
(华南师范大学生命科学学院, 广州市亚热带生物多样性与环境生物监测重点实验室, 广州 510631)
为了丰富我国海域拟菱形藻(Pseudo-nitzschia Peragallo)的物种多样性, 并澄清其产毒特征, 研究从广东大亚湾海域分离并建立了一株拟菱形藻的单克隆培养株系MC298, 通过光学显微镜下的群体特征和透射电镜下的超微形态特征观察, 结合基于核糖体转录间隔区(Internal Transcribed Spacer, ITS)的分子系统学数据, 以及基于ITS2转录RNA的二级结构分析, 鉴定到我国拟菱形藻属的1个新记录种: 并基拟菱形藻P. decipiens Lundholm & Moestrup。研究对其形态学特征进行了较为详细地描述, 并与相似种进行了比较, 还对其ITS2-RNA的特有标志结构进行了阐述。同时, 利用高效液相色谱-质谱联用法(Liquid chromatography tandem mass spectrometry, LC-MS/MS)对该藻株的产毒特征进行了检测, 结果未检测到DA的存在。研究不仅丰富了我国拟菱形藻属的物种多样性, 也可为拟菱形藻的产毒特征研究提供基础数据。
并基拟菱形藻; 分类学; 形态; 核糖体转录间隔区; ITS2-RNA二级结构; 多莫酸
拟菱形藻(Pseudo nitzschia Peragallo)是一类常见的海洋浮游硅藻, 广泛分布于全球近岸水体[1,2]。人们对于拟菱形藻的高度关注始于1987年的一次中毒事件。当年11月, 在加拿大爱德华王子岛发生了一起由于食用紫贻贝(Mutilus edulis Linnaeus)而引起的中毒事件, 造成100多人中毒, 其中3人死亡[3]。后经充分研究, 确认引发中毒的物质是多莫酸(Domoic acid, DA), 而产生DA的肇事生物是一种拟菱形藻: 多列拟菱形藻P. multiseries (Hasle) Hasle。此后, 能够产生DA的拟菱形藻种类又陆续在欧洲、大洋洲被报道[1,2], 人们开始意识到硅藻种类也可以产生毒素, 拟菱形藻也由此受到人们的广泛关注,并成为研究热点[4—9]。
随着研究的深入, 以及物种多样性的快速增加,拟菱形藻种类的准确鉴定越来越困难, 对鉴定技术和人员素养均提出了较高的要求。不同种类之间的形态学差异非常细微, 需要应用透射电镜进行观察, 但是以超微形态学特征对拟菱形藻进行鉴定仍存在着许多困难和争议[10]。近十几年来, 分子标记技术在拟菱形藻属的分类学中得到广泛应用, 并取得了显著成果, 证实了该属中隐形种(Cryptic species)和拟隐形种(Pseudo cryptic species)的普遍存在[4,11,12], 这也极大增加了拟菱形藻种类鉴定的难度。目前已有多种分子标记应用于拟菱形藻属的分类学研究中, 其中转录间隔区序列(Internal Transcribed Spacer, ITS)被认为是针对拟菱形藻属的最适标记[4,11]。另外, 近年来依据ITS2转录RNA二级结构的分析工作, 也对拟菱形藻的分类学研究起到了促进作用[6—8,13]。截止目前, 国际上报道的拟菱形藻种类已有48个[6—8,13], 而我国的相关研究还相对滞后, 只报道了17种[9,10,14,15], 而且多数工作都是仅基于透射电镜下的形态特征进行物种鉴定。相对于我国绵长的海岸线和辽阔水域而言, 目前报道的拟菱形藻物种多样性明显偏低, 或许还有未被认知的种类存在。
另一方面, 全球记录的48种拟菱形藻中, 有24种可产生DA的报道[1,2,8], 其中有些种类在我国也有分布[9,10,14,15], 但截至目前, 我国尚未有拟菱形藻产生DA的直接报道。在以往的研究中, 我国学者曾尝试检测中国海域拟菱形藻株系的DA毒素,均未检测到DA的存在[9,14]。然而近年来, 我国一些海产品中已有DA检出的报道[16—18], 证实了DA在我国沿海的分布, 但其真正的生物来源尚不明确, 这也影响到了DA中毒事件的预警预报。
基于上述原因, 本文尝试建立中国的拟菱形藻单克隆培养株系, 结合形态学和分子分类学技术,开展物种多样性的工作。本文报道了我国的1个新记录种: 并基拟菱形藻P. decipiens Lundholm & Moestrup。同时利用高效液相色谱-质谱联用法(LC-MS/MS)开展DA的检测工作。以期能够丰富我国拟菱形藻属的物种多样性, 并为其毒理研究提供基础数据。
1 材料与方法
1.1 单克隆藻株的建立
利用浮游植物网(孔径10 μm)进行水平拖网, 以采集活体浮游植物样品, 并尽快带回实验室。利用毛细管法在倒置显微镜下挑取目标藻细胞, 转移至盛有f/2培养液的载玻片上, 经过多洗水洗和转移,以确保目标藻的纯化, 然后再转移至滴有f/2培养液的96孔细胞培养板中[9], 放置在室温20℃、光周期12h:12h的条件下培养。待其存活并繁殖达到约100个藻细胞之后, 转移到盛有f/2培养液的100 mL锥形瓶中扩大培养, 以MC (Marine collection)序列进行编号, 本文从广东大亚湾海域分离并建立了一株并基拟菱形藻MC298。
1.2 形态学观察
光镜观察: 取处于对数生长期的藻液0.1 mL,滴在0.1 mL浮游植物计数框中, 加上盖玻片后在Olympus BX53光学显微镜下进行微分干涉(Differential interference contract, DIC)观察, 并利用Olympus DP27数码相机拍照。
透射电镜观察: 取对数生长期的藻液10 mL, 静置沉淀浓缩至2—5 mL, 加入等量浓硫酸(>95%)以去除有机质, 然后用蒸馏水多次水洗至中性[9]。用微量进样器吸取5—10 μL酸化后的水样, 滴加在喷镀碳膜的铜网上, 自然晾干后, 即可在JEM-1010 TEM下观察和拍照。
1.3 分子系统学分析
用0.22 μm醋酸纤维滤膜过滤对数生长期藻液10 mL, 收集滤膜上的藻细胞, 进行总DNA的提取[19]。利用引物1380F和ITS4进行核糖体转录间隔区(ITS)的扩增和测序[19]。从NCBI下载拟菱形藻属各个种类的ITS序列, 使用BioEdit软件进行序列的比对和矩阵[5], 基于MrModeltest 2.3计算的最适模型[19], 然后分别用RAxML-HPC2[20]和MrBayes 3.2[21]构建最大似然树(Maximum likelihood, ML)和贝叶斯推理树(Bayesian inference, BI)。其中ML分析的自检值(Bootstrap test)设定为1000。
1.4 ITS2二级结构的预测及CBCs分析
从GenBank下载P. sabit的ITSrDNA序列, 参考序列标注, 将其ITS2片段截下。使用Mfold[13]在线预测P. sabit ITS2的二级结构, 所得二级结构含4个环和一个拟菱形藻属环。以P. sabit二级结构同源模板, 使用ITS2 Database[13]在线预测目标藻株的RNA二级结构。使用VARNA[13]观察并下载二级结构。同时使用4SALE v.1.7[8]软件中自带的补偿碱基变化(CBCs)Table观察CBC情况, 分析生殖隔离情况。
1.5 LC-MS/MS法检测藻毒素
取处于生长稳定期中后期的藻液5 mL, 经0.22 μm醋酸纤维滤膜过滤, 收集滤液于离心管中, 用于分析胞外DA量; 另外用5 mL灭菌海水将滤膜上的藻细胞重悬, 转移到另一个离心管中。将藻液用超声波破碎仪冰浴破碎3—5min, 经0.22 μm滤膜过滤,滤液于–20℃下保存备用或直接进样分析。
采用Prominence UFLC超快速液相色谱(Shimadzu公司)和5500 QTRAP四极杆-线性离子阱复合质谱检测系统(SCIEX公司)对预处理的样品进行DA检测, 参见Wu等[22]方法进行分析。DA标准品购自德国Sigma公司。
2 结果
2.1 拟菱形藻的分类学研究
基于形态学和分子系统学的数据, 以及ITS2-RNA二级结构的分析结论, 本文鉴定到我国拟菱形藻属的一个新记录种: 并基拟菱形藻P. decipiens。
形态学描述 并基拟菱形藻 Pseudo nitzschia decipiens Lundholm & Moestrup(图 1A—G)
细胞具有两个黄褐色的色素体, 对称分布在中节两侧, 可单个细胞生活, 也可形成2—4个细胞的链状群体(图 1A), 重叠部为壳面全长的1/5—1/6。细胞壳面纵轴呈现披针形(图 1B), 壳端钝圆(图1C), 两壳端形状相似。壳面长45—47 μm, 宽1.4—1.6 μm。管壳缝强烈偏心(图 1D, E)。有中央较大船骨点(图 1E)。肋突分布在壳缘, 排列不规则(图 1D), 密度为20—27个/10 μm。点条纹由两排孔纹组成, 密度为46—50条/10 μm。孔纹为不规则的六边形, 密度1 μm内9—13个。观察到3条环带(图1F), 壳环带宽2个孔纹, 高2—3个孔纹, 点条纹密度50—53个/10 μm, 孔纹内部由六角形的筛孔构成(图 1G); 第二条环带一侧有孔纹, 另一侧为无纹区;第三条环带未见孔纹。

图 1 并基拟菱形藻
本研究建立了1个培养株系MC298, 主要形态学特征与以往报道基本相符。
毒性: 本种尚未有产生多莫酸的报道[4], 本文亦未检测到。
生态: 海水浮游生活。
分布: 标本采自大亚湾海域(4月)。本种曾报道于黑海、加那利群岛、墨西哥湾、意大利第勒尼安海[4, 23]。
基于ITS序列分析的分子系统学分析 利用RAxML对ITS1-5.8S-ITS2序列的733个碱基进行了比对分析, 建立了分子系统树(图 2)。MC298与已报道的三株并基拟菱形藻聚在同一个分支上, 且具有较高的置信值(BPP>95, ML>90), 这表明分子分类的结果也支持形态鉴定的结论。同时, MC298与其他海域的并基拟菱形藻也存在少许遗传差异, 与墨西哥图斯潘海域株系(Mex13)具有完全相同的ITS序列, 与马来西亚株系(PnKk38)有3个碱基的差异, 与西班牙加那利群岛株系(GranCan4-1)的遗传差异最大, 有9个碱基的差异。
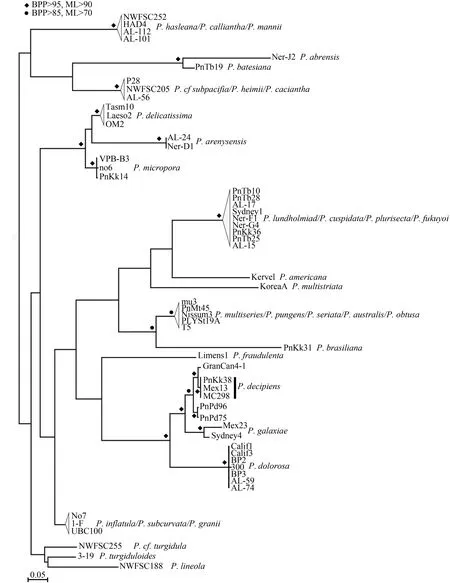
图 2 基于核糖体转录间隔区ITS1-5.8S-ITS2的分子系统树(以N. bizertensis为外类群)Fig. 2 The phylogenetic tree based on ITS1-5.8S-ITS2 rDNA with N. bizertensis as outgroup
ITS2二级结构分析 并基拟菱形藻ITS2二级结构模型显示了ITS2结构的普遍特征, 有4个单环和1个拟环IIa(图 3), 与其他拟菱形藻种类的ITS2二级结构基本一致[6,23]。MC298与以往报道的并基拟菱形藻株系(Mex13、PnKk38)具有完全一致的ITS2二级结构, 但GranCan4-1在helixⅢ有两个HCBCs (半补偿性碱基变化)(G:U ↔ G:C; C:G ↔U:G; 1 SNP)的差异, 而且分子系统树上GranCan4-1与其他两个株系处在不同的分支上(图 2), 基于P. mannii和P. calliantha只有一个HCBCs的差异[23], 因此GranCan4-1是否为并基拟菱形藻有待后续的研究。将MC298与系统发育树上亲缘关系最近的P. sabit相比较, 发现有2—3个HCBCs的差异, 还有3—4 SNPs(单核苷酸多态性)差异。并基拟菱形藻ITS2-RNA的特有分子特征主要在helix III, 31 bp信号区域: 5′-UUGUUACUAGCUGUUUGAACGA CUACUAAAA-3′。基于MC298具有与以往报道的其它并基拟菱形藻株系(Mex13和PnKk38)的完全一致的ITS2二级结构, 亦支持了形态学与ITS分子鉴定的结果。

图 3 并基拟菱形藻ITS2二级结构图Fig. 3 The secondary structure of ITS2-RNA in Pseudo-nitzschia decipiens strain MC298
2.2 多莫酸产毒特征的LC-MS检测
以DA标准品浓度(μg/mL)为横坐标, 峰面积为纵坐标, 建立多莫酸LC-MS检测的标准曲线, 多莫酸浓度为0.1—16 μg/mL时, 其峰面积与质量浓度有良好的线性关系(R2=0.9999), 回归方程为: y= 87.1875x。本方法的检测下限为10 ng/mL。多莫酸的出峰保留时间为13.613min。对常规培养的并基拟菱形藻进行LC-MS检测, 结果在预定的保留时间内都未出现样品峰。表明本藻株未检出DA。
3 讨论
3.1 并基拟菱形藻与相似种的比较
2006年Lundholm等[4]对分离自不同海域的多个“柔弱拟菱形藻P. delicatissima Cleve”株系进行了形态学和分子数据的研究, 发现它们在形态学特征上相似, 但在ITS序列构建的系统树中存在较大遗传学差异, 推测柔弱拟菱形藻中存在(拟)隐形种,并根据形态学、ITS系统发育的数据, 报道了2个新种: 并基拟菱形藻和疑难拟菱形藻P. dolorosa Lundholm & Moestrup, 继而提出了柔弱拟菱形藻复合群P. delicatissima complex的概念, 并基拟菱形藻正是该复合群的种类之一。2009年Quijano-Scheggia等[24]利用形态学与ITS系统发育分析, 研究了地中海西北部的柔弱拟菱形藻株系, 并测试了一些株系的有性繁殖和生殖隔离, 发现这些株系呈现两个截然不同的遗传分支, 而且出现了生殖隔离, 以此为依据报道了1个新种: 阿雷拟菱形藻P. arenysensis Quijiao-Scheggia, Garcés & Lundholm。该研究也认为以往报道的柔弱拟菱形藻应该是一个复合群, 包含有多个(拟)隐形种, 这也验证了Lundholm等[7]的观点。截止目前, 柔弱拟菱形藻复合群包含有6个种: 柔弱拟菱形藻、并基拟菱形藻、疑难拟菱形藻、亚太平洋拟菱形藻P. subpacifia (Hasle) Hasle、肿胀拟菱形藻P. turgidula (Hustedt) Hasle和阿雷拟菱形藻。
柔弱拟菱形藻复合群的种类具有较为相似的形态学特征: (1)壳面披针形; (2)点条纹由两排孔纹组成; (3)具有中央较大船骨点。同时, 它们之间也存在细微的区别, 主要体现在肋突、点条纹和孔纹的密度上。并基拟菱形藻的肋突密度(20—26 μm)、点条纹密度(41—46 μm)、孔纹密度(9—13 μm)明显高于疑难拟菱形藻(18—22 μm, 30—36 μm, 5—8 μm)[4]和肿胀拟菱形藻(13—18 μm, 23—28 μm, 7—9 μm)[25], 而且环带上的孔纹密度(48—55 μm)也明显高于疑难拟菱形藻(40—44 μm)[4]。肿胀拟菱形藻和亚太平洋拟菱形藻的壳面横轴明显较宽(1.4—2.4 vs. 2.5—3.5 μm; 1.4—2.4 vs. 3—5 μm)[4,25]。并基拟菱形藻与柔弱拟菱形藻的区别在于, 前者点条纹密度(41—46 μm)、孔纹密度(9—13 μm)和环带上孔纹密度(48—55 μm)都略高于后者(35—40 μm, 8—12 /μm, 43—48 μm)[4]。并基拟菱形藻与阿雷拟菱形藻最为相似, 只在点条纹密度(41—46 vs. 34—43 μm)和环带上孔纹密度(48—55 vs. 40—50 μm)较高于后者[4,24]。
分子系统学的研究已经证实, 拟菱形藻属内的多个复合群, 如柔弱拟菱形藻复合群、伪柔弱拟菱形藻复合群等, 都是基于相似形态学特征而建立的种类集群, 并不能反映各个种类之间的系统学关系[4,7,8,24]。在分子系统树中, 柔弱拟菱形藻复合群的各个种类分别位于不同的分支上, 只有疑难拟菱形藻与并基拟菱形藻的亲缘关系比较接近(图 2)。并基拟菱形藻的遗传相似种类主要有3个: 镰刀拟菱形藻P. sabit Teng, Lim, Lim & Leaw、银河拟菱形藻P. galaxiae Lundholm & Moestrup和疑难拟菱形藻。除了疑难拟菱形藻之外, 并基拟菱形藻与其他遗传相似种在形态学上都有明显区别。并基拟菱形藻与镰刀拟菱形藻的亲缘关系最为接近, 但两者形态上存在明显差异, 最大的区别在于后者的壳面呈独特的镰刀状[7]。并基拟菱形藻与银河拟菱形藻在形态学上最明显的区别是: 前者的点条纹由明显的两排孔纹构成, 而后者点条纹中未见明显的孔纹[4]。并基拟菱形藻与疑难拟菱形藻的形态学特征较为相似, 除了前面已经比较过的肋突、点条纹、孔纹密度区别之外, 后者壳面点条纹会出现单排孔纹的情况, 而前者则未见单排孔纹[7]。
在以往关于拟菱形藻的分类学或生态学研究中, 柔弱拟菱形藻是我国沿海的常见种类, 在多个海域均有报道[26—28]。但是基于最新的国际研究动态, 并基拟菱形藻与柔弱拟菱形藻具有极为相似的形态特征, 单纯依据形态特征的观察, 缺少分子数据支持, 难以进行准确的物种鉴定。因此, 在我国海域广泛分布的, 究竟是柔弱拟菱形藻, 还是并基拟菱形藻, 亦或是其他相似种类, 还需后续研究加以澄清。
3.2 拟菱形藻属DA产毒特征分析
并基拟菱形藻首先报道于墨西哥湾[4], 之后在意大利第勒尼安海也有记录[23], 均未检测到多莫酸的存在。本研究从中国海域分离并建立了并基拟菱形藻的室内培养株系, 利用LC-MS技术检测DA,结果也没有检测到DA的存在。
截至目前, 全球已报道能够产生DA的拟菱形藻种类达到24种[1,8], 其中7种在我国也有分布[9]。但是我国并未有拟菱形藻产毒的直接报道。拟菱形藻的产毒是一个复杂的生理学现象, 有着地域、环境和种源的差异。如采自马来西亚波德申(Port Dickson)的5株柯氏拟菱形藻P. kodamae Teng, Lim, Leaw & Lim可产生DA, 但采自东马来西亚美里(Miri coast)海岸的3株柯氏拟菱形藻却没有检测到DA[8]。同样的情况也出现在尖刺拟菱形藻P. pungens Hasle、多纹拟菱形藻P. multistriata Takano等[9]种类。随着研究的深入, 发现拟菱形藻不同株系间产毒性能存在很大的差异, 这可能与不同地理环境有关, 如物理因素, 生物因素及营养参数[1]。
另一方面, 除了拟菱形藻以外, 咖啡双眉藻(Amphora coffaeiformis)可产生低浓度的DA[29]。近年来有报道称在越南虾池内采集到一种底栖菱形藻(Nitzschia navis-varingica)可产生大量的DA[30]。随后日本、泰国、越南和菲律宾等地都有发现产生DA的Nitzschia navis-varingica[31,32]。2014年Smida等[33]在突尼斯分离出的Nitzschia bizertensis也检测到低浓度的DA。上述研究表明DA的生物来源应该是多样性的。
虽然中国沿海至今未有拟菱形藻产生DA的直接报道, 但是水产品中已有DA的检出报道。陈西平等[34]在采自我国渤海等海域部分海产品中检测出DA, 检出率为50%, 其中象牙蚌、珍珠贝等含量最高, 为8.14 μg/g。李大志等[35]在采自大连海域黑石礁的扇贝中也检测到DA。宋俐俐等[16]在浙江沿海的水产品中检测到DA。吉薇等[17]在湛江、北海等地多种贝类中均检测出DA, 其中, 钝齿短浆蟹和扇贝的含量最高, 可达18.2 μg/g。王恒[18]在舟山海域出产的贝类中也检测到DA的存在, 检出率大于64%。那么存在于这些贝类中的DA从何而来?来自于拟菱形藻, 还是有其他生物来源?因此, 对中国沿海DA来源的排查应该引起重视, 除了加大对中国沿海拟菱形藻的产毒检测力度之外, 还需关注其他已报道的产毒硅藻种类。
[1]Lelong A, Hégaret H, Soudant P, et al. Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning: revisiting previous paradigms [J]. Phycologia, 2012, 51(2): 168—216
[2]Trainer V L, Bates S S, Lundholm N, et al. Pseudo-nitzschia physiological ecology, phylogeny, toxicity, monitoring and impacts on ecosystem health [J]. Harmful Algae, 2012, 14(1): 271—300
[3]Bates S S, Bird C J, deFreitas A S W, et al. Pennate diatom Nitzschia pungens as the primary source of domoic acid, a toxin in shellfish from eastern Prince Edward Island, Canand [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1989, 46(7): 1203—1215
[4]Lundholm N, Moestrup Ø, Kotaki Y, et al. Inter- and intraspecific variation of the Pseudo-nitzschia delicatissima complex (Bacillariophyceae) illustrated by rRNA probes, morphological data and phylogenetic analyses [J]. Phycologia, 2006, 42(2): 464—481
[5]Lundholm N, Bates S S, Baugh K A, et al. Cryptic and pseudo-cryptic diversity in diatoms—with descriptions of Pseudo-nitzschia hasleana sp. nov. and P. fryxelliana sp. nov. 1 [J]. Journal of Phycology, 2012, 48(2): 436—454
[6]Teng S T, Lim H C, Lim P T, et al. Pseudo-nitzschiakodamae sp. nov. (Bacillariophyceae), a toxigenic species from the Strait of Malacca, Malaysia [J]. Harmful Algae, 2014, 34(1): 17—28
[7]Teng S T, Lim P T, Lim H C, et al. A non-toxigenic but morphologically distinct new species of Pseudo-nitzschia, P. sabit sp. nov. (Bacillariophyceae) [J]. Journal of Phycology, 2015, 51(4): 706—725
[8]Teng S T, Tan S N, Lim H C, et al. High diversity of Pseudo-nitzschia along the northern coast of Sarawak (Malaysian Borneo), with description of P. bipertita sp. nov. and P. limii sp. nov. (Bacillariophyceae) [J]. Journal of Phycology, 2016, doi: 10.1111/jpy.12448-15-095
[9]Xu G S, Li Y. Two new records of diatom genus Pseudonitzschia from Chinese waters and analysis of their domoic acid production [J]. Journal of Tropical and Subtropical Botany, 2015, 23(6): 614—624 [徐国双, 李扬. 我国沿海拟菱形藻属的2新记录种及其产毒特征分析. 热带亚热带植物学报, 2015, 23(6): 614—624]
[10]Li Y, He L N, Ma Y Y, et al. The study on morphological taxonomy of Pseudo-nitzschia pseudodelicatissima complex [J]. Acta Hydrobiologica Sinica, 2010, 34(2): 302—311 [李扬, 何利娜, 马艳艳, 等. 伪柔弱拟菱形藻复合群的形态分类学研究. 水生生物学报, 2010, 34(2): 302—311]
[11]Amato A, Kooistra W H C F, Levialdi G J H, et al. Reproductive isolation among sympatric cryptic species in marine diatoms [J]. Protist, 2007, 158(2): 193—207
[12]Lundholm N, Moestrup Ø, Hasle G R, et al. A study of the Pseudo-nitzschia pseudodelicatissima/cuspidata complex (Bacillariophyceae): what is P. pseudodelicatissima [J]? Journal of Phycology, 2003, 39(4): 797—813
[13]Percopo I, Ruggiero M V, Balzano S, et al. Pseudo-nitzschia arctica sp. nov., a new cold-water cryptic Pseudonitzschia species within the P. pseudodelicatissima complex [J]. Journal of Phycology, 2016, 52(2): 184—199
[14]Xing X L, Yang J X, Kang Y Y, et al. Morphological study and toxic analysis for two Pseudo-nitzschia species isolated from Daya Bay [J]. Journal of Oceanography in Taiwan Strait, 2007, 26(4): 576—582 [邢小丽, 杨军霞,康燕玉, 等. 大亚湾水域两种拟菱形藻的形态学鉴定及毒素分析. 台湾海峡, 2007, 26(4): 576—582]
[15]Lü S H, Li Y, Lundholm N, et al. Diversity, taxonomy and biogeographical distribution of the genus Pseudonitzschia (Bacillariophyceae) in Guangdong coastal waters, South China Sea [J]. Nova Hedwigia, 2012, 95(1-2): 123—152
[16]Song L L, Zhang H Q, Hou J D, et al. High-performance liquid chromatography-tandem mass spectrometry for the determination of residue of domoic acid in shellfish [J]. Journal of Fisheries of China, 2008, 32(6): 950—956 [宋琍琍, 张海琪, 侯镜德, 等. 液相色谱-串联质谱法测定贝类毒素软骨藻酸的残留. 水产学报, 2008, 32(6): 950—956]
[17]Ji W, Zheng J Y, Zeng X P, et al. HPLC analysis of domoic acid poisoning in South China Sea [J]. Modern Food Science and Technology, 2011, 27(1): 120—122 [吉薇, 郑洁莹, 曾雪萍, 等. 南海海域软骨藻酸(DA)贝类毒素的HPLC方法检测. 现代食品科技, 2011, 27(1): 120—122]
[18]Wang H. An investigation of domoic acid content in shellfish in Zhoushan islands [J]. Chinese Journal of Health Laboratory Technology, 2011, 21(12): 2986—2988 [王恒. 舟山海域贝类海产品中软骨藻酸含量调查. 中国卫生检验杂志, 2011, 21(12): 2986—2988]
[19]Lim H C, Teng S T, Leaw C P, et al. Three novel species in the Pseudo-nitzschia pseudodelicatissima complex: P. batesiana sp. nov., P. lundholmiae sp. nov., and P. fukuyoi sp. nov.(Bacillariophyceae) from the Strait of Malacca, Malaysia [J]. Journal of Phycology, 2013, 49(5): 902—916
[20]Miller M A, Pfeiffer W, Schwartz T. Creating the CIPRES Science Gateway for inference of large phylogenetic trees [C]. Gateway Computing Environments Workshop (GCE). IEEE, 2010, 1—8
[21]Ronquist F, Teslenko M, Mark P, et al. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space [J]. Oxford Journals, 2012, 61(3): 539—542
[22]Wu H, Guo M, Tan Z, et al. Liquid chromatography quadrupole linear ion trap mass spectrometry for multiclass screening and identification of lipophilic marine biotoxins in bivalve mollusks [J]. Journal of Chromatography A, 2014, 1358: 172—180
[23]Amato A, Montresor M. Morphology, phylogeny, and sexual cycle of Pseudo-nitzschia mannii sp. nov. (Bacillariophyceae): a pseudo-cryptic species within the P. pseudodelicatissima complex [J]. Phycologia, 2008, 47(5): 487—497
[24]Quijano-Scheggia S I, Garcés E, Lundholm N, et al. Morphology, physiology, molecular phylogeny and sexual compatibility of the cryptic Pseudo-nitzschia delicatissima complex (Bacillariophyta), including the description of P. arenysensis sp. nov [J]. Phycologia, 2009, 48(6): 492—509
[25]Hasle G R. Nitzschia and Fragilariopsis species studied in the light and electron microscopes. II. The group Pseudo-nitzschia. Skrifter Utgitt av Det Norske Videnskaps-Akademi i Oslo I. Mat.-Naturv [J]. Klasse Ny serie, 1965, 18: 1—45
[26]Gao Y H, Yu Q B, Qi Y Z, et al. Speries composition and ecological distribution of planktnic diatoms in the Changjiang river estuary during spring [J]. Chinese Journal of Applied Ecology, 2003, 14(7): 1044—1048 [高亚辉, 虞秋波, 齐雨藻, 等. 长江口附近海域春季浮游硅藻的种类组成和生态分布. 应用生态学报, 2003, 14(7): 1044—1048]
[27]Gao Y H, Xie W L, Li Y, et al. Pseudo-nitzschia: taxonomy and biogeographic distribution in the estuary of Changjiang River, China [C]. Witkowski A. Proceedings of 18th International Diatom Symposium. Bristol: Biopress Limited. 2006, 75—90
[28]Wang Y, Lin M, Lin G M, et al. Yearly changes of phytoplankton in the ecological monitoring zone of Daya Bay [J]. Marine Science, 2012, 36(4): 86—94 [王雨, 林茂, 林更铭, 等. 大亚湾生态监控区的浮游植物年际变化. 海洋科学, 2012, 36(4): 86—94]
[29]Shimizu Y, Gupta S, Masuda K, et al. Dinoflagellate and other microalgal toxins: chemistry and biochemistry [J]. Pure and Applied Chemistry, 1989, 61(3): 513—516
[30]Kotaki Y, Koike K, Yoshida M, et al. Domoic acid production in Nitzschia sp. (bacillariophyceae) isolated from a shrimp culture pond in do son, Vietnam [J]. Journal of Phycology, 2000, 36(6): 1057—1060
[31]Kotaki Y, Lundholm N, Katayama T, et al. ASP toxins of pennate diatoms and bacterial effects on the variation in toxin composition. In: Ø. Moestrup (Eds.), Proceedings of the 12th International Conference on Harmful Algae. 2008, 300—302
[32]Romero M L J, Lirdwitayaprasit T, Kotaki Y, et al. Isolation of ASP toxin-producing Nitzschia from Thailand [J]. Marine Research Indonesia, 2008, 33(2): 225—228
[33]Smida D B, Lundholm N, Kooistra W H, et al. Morphology and molecular phylogeny of Nitzschia bizertensis sp. nov.-A new domoic acid-producer [J]. Harmful Algae, 2014, 32: 49—63
[34]Chen X P, Wang C B, Hu J M , et al. Determination of domoic acid in water and aquatic animals by high performance liquid chromatography [J]. Journal of Hygiene Research, 2001, 30(4): 247—248 [陈西平, 王成斌, 胡俊明, 等. HPLC方法检测水及水生动物中软骨藻酸. 卫生研究, 2001, 30(4): 247—248]
[35]Li D Z, Zhu W J, Song W B, et al. Capillary electrophoretic analysis of amnesic shellfish toxin-domoic acid [J]. Chinese Journal of Chromatography, 2002, 20(2): 125—128 [李大志, 祝文君, 宋文斌, 等. 记忆缺失性贝类毒素的主要成分-软骨藻酸的毛细管电泳分析. 色谱, 2002, 20(2): 125—128]
THE IDENTIFICATION OF PSEUDO-NITZSCHIA DECIPIENS FROM DAYA BAY AND ANALYSIS OF ITS DOMOIC ACID PRODUCTION
HUANG Chun-Xiu, XU Guo-Shuang and LI Yang
(Guangzhou Key Laboratory of Subtropical Biodiversity and Biomonitoring, College of Life Science, South China Normal University, Guangzhou 510631, China)
The marine diatom genus Pseudo-nitzschia Peragallo, the main biological source of Amnesic Shellfish Poisoning (ASP) - domoic acid (DA), has attracted great attention worldwide, and has became the hotspot in the research field of phycology and environmental toxins. Lots of progress has been made in the past two decades with 48 newly described taxa and 24 species that can produce DA. In China, a total of 17 taxa has been reported without any detectable DA from Chinese Pseudo-nitzschia strains. To investigate the species diversity of Pseudo-nitzschia in Chinese coast and the ability of DA production for Chinese Pseudo-nitzschia, monoclonal strains were isolated and established from Daya Bay, the South China Sea. These strains were identified based on the morphological characteristics by light microscopy and transmission electron microscopy and molecular analysis using the internal transcribed spacer region of ribosomal rRNA encoding gene, and the secondary structure of ITS2 RNA transcripts. We reported one newly recorded species for China, P. decipiens Lundholm & Moestrup. Its morphology was described and compared with both morphology-similar and molecule-close taxa, and the unique molecular feature of the secondary structure of ITS2-RNA was analyzed. No detectable DA was observed from this species using a single liquid chromatography tandem mass spectrometry (LC-MS/MS) injection. This study enriches the diversity of the genus Pseudo-nitzschia in China, and may provide detail information for the further studies about DA production of Chinese Pseudo-nitzschia strains.
Pseudo-nitzschia decipiens; Taxonomy; Morphology; Internal transcribed spacer; ITS2-RNA secondary structure; Domoic acid
10.7541/2017.140
2016-08-05;
2016-11-20
国家自然科学基金(31570205, 31370235); 广东省科技计划项目(2015A030401084)资助 [Supported by the National Natural Science Foundation of China (31570205, 31370235); Science and Technology Program Guangdong Province (2015A030401084)]
黄春秀(1989—), 女, 广东茂名人; 硕士研究生; 主要从事藻类学研究。E-mail: 3127166788@qq.com
李扬, E-mail: liyang@scnu.edu.cn
Q949.27
A
1000-3207(2017)05-1118-08
- 水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE

