猪种、牛种、羊种、绵羊种布鲁菌多重PCR检测方法的建立及应用
何亚鹏,许信刚,付明哲,张 琪
(西北农林科技大学 动物医学院,陕西杨凌 712100)
猪种、牛种、羊种、绵羊种布鲁菌多重PCR检测方法的建立及应用
何亚鹏,许信刚,付明哲,张 琪
(西北农林科技大学 动物医学院,陕西杨凌 712100)
为建立在临床样本能够同时检测猪种、牛种、羊种、绵羊种布鲁菌的多重PCR方法,根据NCBI已收录的布鲁菌全基因,设计并合成4对特异性引物,通过优化多重PCR的反应条件,建立能够同时检测4种布鲁菌的多重PCR诊断方法。特异性试验结果表明,可以从4种布鲁菌以及 4 种细菌混合物中扩增出大小分别为276、494、733和976 bp的特异性条带,对照组的检测结果为阴性;敏感性试验结果表明,对4种病原菌基因组DNA的检出量为猪种32.2 pg、牛种21.3 pg、羊种27.5 pg、绵羊种43.2 pg;人工模拟感染样本检测结果表明,能从混合感染的病料中特异地检测出 4 种病原菌。应用该方法对 200 份临床奶山羊乳样进行检测,结果检出4份阳性。建立的多重PCR方法具有特异性强、敏感度高、稳定性好的特点,可以有效地检测 4 种布鲁菌的感染。
猪种布鲁菌;牛种布鲁菌;羊种布鲁菌;绵羊种布鲁菌;多重PCR
布鲁菌病是由布鲁菌(Brucella)引起的人畜共患传染病,严重危害经济发展和公共健康,世界动物卫生组织(OIE)将其列为B类重要传染病,中国将其列为二类传染病[1]。现已确定的布鲁菌有 7 个种(牛种、羊种、绵羊附睾种、猪种、犬种、沙林鼠种、海洋种)和20 个生物型[2]。布鲁菌对牛、羊和猪的危害巨大,感染牛的有牛种、羊种和猪种布鲁菌;感染山羊的有羊种、牛种布鲁菌;感染绵羊的有绵羊种、牛种菌和羊种布鲁菌;感染猪的有猪种、牛种和羊种布鲁菌[3]。
布鲁菌病临床症状极为相似,在临床上很难确定是那种病原感染所致,另外,临床上还有混合感染的病例。目前,布病的诊断主要采用病原学和血清学方法,但这些传统方法存在着检测时间长、操作步骤繁琐、假阳性和假阴性较高等问题,并对实验人员的健康安全构成一定的威胁[4]。目前PCR方法对布鲁菌的试验鉴定多以种鉴定为主[5],因此有必要建立能同时、快速、精确检测鉴别 4 种布鲁菌感染的多重PCR检测方法。多重PCR技术是在同一PCR体系中加入多对引物对多种目的基因进行同时扩增的分子生物学检测方法,它具有快速、灵敏、特异等优点。 IS711基因为布鲁菌的转座基因,一般布鲁菌的基因组里都有多个 IS711插入序列,不同种布鲁菌的 IS711插入序列数量也不同。 IS711基因序列本身在种间的差别很小,但不同种布鲁菌的 IS711基因插入位置有种间特异性,可用于鉴别诊断[6]。本研究根据布鲁氏菌不同种型 IS711序列拷贝数的差异设计引物检测特异性目的基因,建立能同时检测布鲁菌 4 种种型的多重PCR方法,该方法具有较好的特异性、敏感性及重复性,比传统的细菌学方法简便、经济,可以应用于兽医临床诊断以及食品安全的快速检测。
1 材料与方法
1.1 材 料
1.1.1 菌株 标准猪种布鲁菌S2(CVCC 70502)、牛种布鲁菌A19(CVCC 70202)、羊种布鲁菌M5 疫苗株为新疆天康畜牧生物技术股份有限公司产品;绵羊种布鲁菌由西北农林科技大学动物医学院兽医微生物实验室分离,经测序鉴定后保存;金黄色葡萄球菌、无乳链球菌、沙门菌、大肠埃希菌、多杀性巴氏杆菌由西北农林科技大学动物医学院兽医微生物实验室保存。
1.1.2 主要试剂TaqDNA聚合酶、dNTPs、DL 2000 DNA marker等均购自康为世纪生物科技有限公司;细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;其他试剂均为国产分析纯。
1.1.3 试验动物 6 周龄雌性BALB/c小鼠购自第四军医大学实验动物研究中心。
1.1.4 样品来源 200 份乳样采自陕西省某奶山羊养殖场。
1.2 方 法
1.2.1 模板的制备 将布鲁菌及试验用各菌株分别接种于各自适宜的液体培养基,放入摇床,37 ℃、220 r/min培养24 h。取1 mL细菌培养液,12 000 r/min离心1 min,弃上清后按照细菌基因组DNA提取试剂盒说明书操作,提取的各细菌DNA保存于-20 ℃冰箱,备用。
1.2.2 引物设计 根据GenBank中已发布的猪种(B.suis)、牛种(B.abortus)、羊种(B.melitensis)、绵羊种(B.ovis)布鲁菌的 IS711基因序列,并参照国内外相关文献[7-10],利用Primer 5.0分析软件,设计用于扩增布鲁菌种特异性基因的4对特异性引物。引物序列及其位置、扩增产物的大小见表1,引物由Invitrogen上海贸易有限公司合成。

表1 PCR引物信息Table 1 Information of primer for PCR
1.2.3 单项PCR检测方法的建立 为确定单项PCR扩增的最佳条件及检测单基因PCR扩增的特异性,分别以 4 个细菌的DNA为模板,用相应的引物进行单项PCR扩增。PCR反应体系(25 μL):模板DNA 2 μL,上、下游引物各0.5 μL(20 pmol/μL),2 μL dNTP(2.5 mmol/L),2 μL MgCl2(25 mmol/ L),Taq酶0.2 μL(5 U/μL),10×PCR buffer 2.5 μL,其余用灭菌ddH2O补足。PCR反应程序:95 ℃变性5 min;94 ℃变性45 s,55 ℃退火40 s,72 ℃延伸45 s,30 个循环;最后 72 ℃延伸10 min。为摸索不同退火温度的影响,将退火温度设定为51、53、55、57 ℃ 4个梯度进行PCR反应,以确定单项PCR最佳退火温度。
1.2.4 多重PCR反应条件的优化 影响多重PCR反应的主要因素是退火温度和引物浓度,因此对这2 个反应条件进行优化。将猪种、牛种、羊种、绵羊种布鲁菌的DNA均稀释为100 μg/mL,等量混匀作为模板。根据引物初始退火温度,按照2 ℃梯度设定51、53、55、57、59 ℃的多重PCR退火温度试验;按照0.2 μmol/L浓度梯度设定各引物对浓度组合(0.2、0.2、0.2、0.2 μmol/L;0.4、0.4、0.4、0.4 μmol/L;0.6、0.6、0.6、0.6 μmol/L;0.8、0.8、0.8、0.8 μmol/L;1.0、1.0、1.0、1.0 μmol/L)的引物优化试验,筛选多重PCR扩增的最佳反应体系和程序。
1.2.5 多重PCR特异性试验 分别以猪种、牛种、羊种、绵羊种布鲁菌及4种细菌随机组合混合物的基因组作为模板,以金黄色葡萄球菌、大肠埃希菌、多杀性巴氏杆菌、沙门菌、无乳链球菌等细菌DNA和双蒸水作为阴性对照,使用4对引物的混合物,采用优化的多重PCR扩增条件进行扩增,测试多重PCR反应的特异性。
1.2.6 多重PCR灵敏性试验 分别提取4种细菌DNA,经核酸蛋白定量仪测得猪种、牛种、羊种、绵羊种布鲁菌DNA的质量浓度分别为322.42、213.34、275.14、432.13 ng/μL,多重PCR从初始质量浓度开始,按101~106梯度进行倍比稀释,采用优化的多重PCR条件进行扩增,以检测其敏感性。
1.2.7 重复性试验 用建立的多重PCR方法,分别对猪种、牛种、羊种、绵羊种布鲁菌及4者混合的阳性样品、金黄色葡萄球菌、大肠埃希菌、多杀性巴氏杆菌、沙门菌、无乳链球菌等细菌对照样品各2份重复检测3次,以验证多重PCR方法的稳定性。
1.2.8 人工模拟试验 将4种细菌进行不同种类的排列与组合,按照下列设计对16只小鼠进行腹腔感染细菌:猪种(0.2 mL);牛种(0.2 mL);羊种(0.2 mL);绵羊种(0.2 mL);猪种+牛种(每种菌0.1 mL);猪种+羊种(每种菌0.1 mL);猪种+绵羊种(每种菌0.1 mL);牛种+羊种(每种菌0.1 mL);牛种+绵羊种(每种菌0.1 mL);羊种+绵羊种(每种菌0.1 mL);猪种+牛种+羊种(每种菌0.07 mL);猪种+羊种+绵羊种(每种菌0.07 mL);牛种+羊种+绵羊种(每种菌0.07 mL);猪种+牛种+绵羊种(每种菌0.07 mL);猪种+牛种+羊种+绵羊种(每种菌0.05 mL);生理盐水(0.2 mL对照组)。24 h后将小鼠断颈处死,无菌采取肝、脾、淋巴结等病料,混合样品约100 mg,加液氮充分研磨后转入组织匀浆器中,加入10 mmoL/L PBS(pH 7.2)充分匀浆。按照细菌DNA提取试剂盒方法提取细菌DNA,利用已建立的多重PCR方法进行检测。
1.2.9 临床样品检测 利用已建立的多重PCR方法检测陕西省某奶山羊养殖场送检的200份待检乳样。乳样5 mL 10 000 r/min离心10 min,弃掉上清后按照细菌DNA提取试剂盒方法提取细菌DNA,利用已建立的多重PCR方法进行检测。
2 结果与分析
2.1 单项PCR扩增
单基因PCR扩增后,可分别观察到 276 bp(猪种)、494 bp(牛种)、733 bp(羊种)和 976 bp(绵羊种)的条带(图1),大小与预期相符,表明设计的引物特异。采用不同的退火温度进行PCR反应,结果表明,退火温度为51、53、55、57 ℃时结果差异不大(图1)。
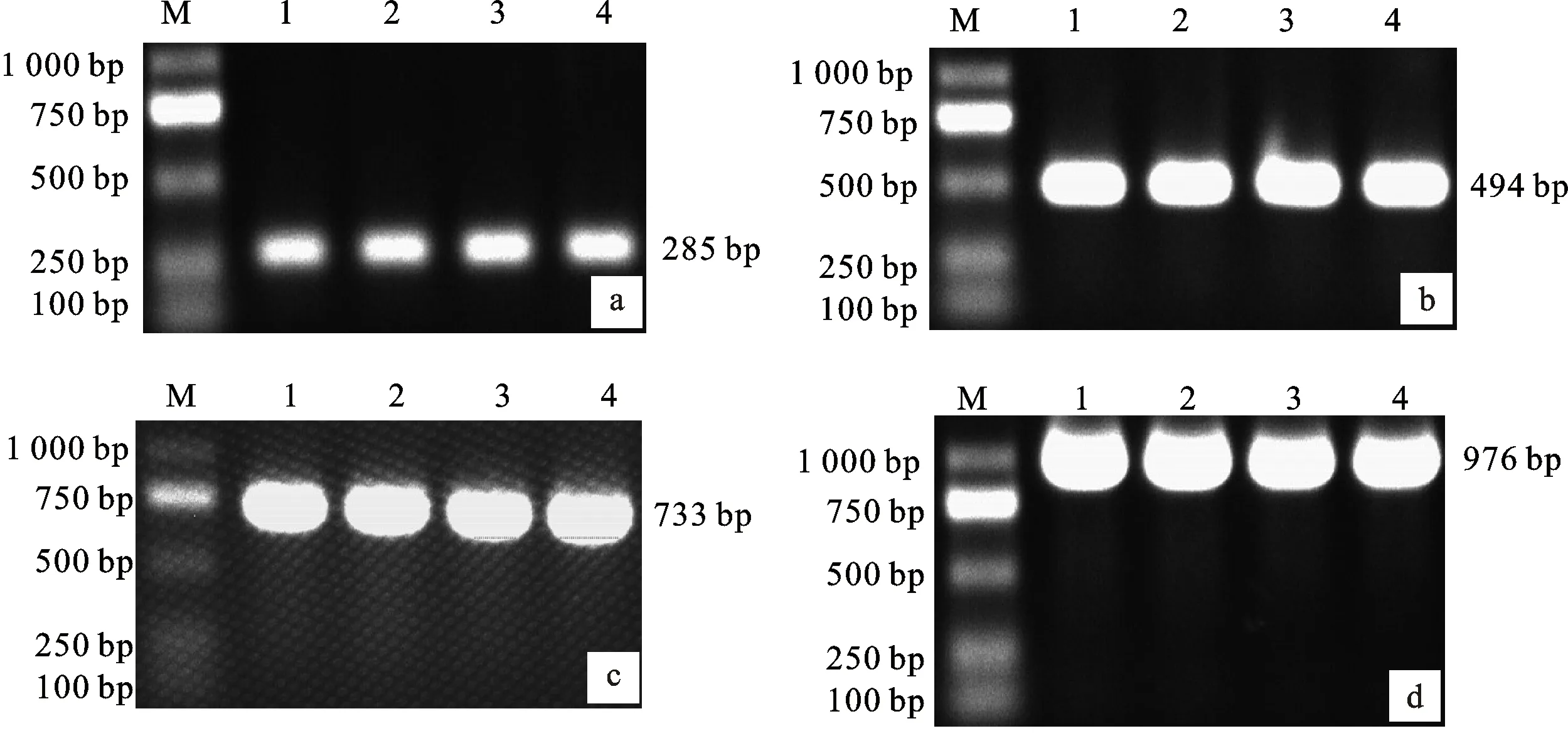
a.猪种布鲁菌B.suis;b. 牛种布鲁菌B.abortus;c.羊种布鲁菌B.melitensis;d.绵羊种布鲁菌B.ovis;M.DL 2000 DNA marker;1~4.退火温度分别为51、53、55、57 ℃ Annealing temperature were 51 ℃,53 ℃,55 ℃,57 ℃, respectively
图1 单项PCR扩增及退火温度的优化
Fig.1 Single PCR amplification and optimization of annealing temperature
2.2 多重PCR退火温度优化
采用不同的退火温度(51、53、55、57、59 ℃)进行多重PCR反应,结果表明,四重PCR反应在 53、55、57 ℃时都有较好的扩增结果(图2),以降低非特异性扩增的可能性及得到理想的扩增效果为原则,最终选择55 ℃作为多重PCR反应的退火温度。

M.DL 2000 DNA marker;1~5.退火温度分别为51、53、55、57、59 ℃ Annealing temperatures were 51 ℃,53 ℃,55 ℃,57 ℃ and 59 ℃, respectively
图2 多重PCR退火温度的优化
Fig.2 Optimal annealing temperature in multiplex PCR
2.3 引物比例优化
取不同浓度的引物组合进行多重PCR反应,以摸索引物的最佳浓度及各引物间的最佳比例。结果表明,4种引物对的浓度均为0.6 μmol/L时多重PCR的扩增效果最理想(图3)。

M.DL 2000 DNA marker;1~5.猪种、牛种、羊种、绵羊种布鲁菌引物的浓度分别为:0.2、0.2、0.2、0.2 μmol/L;0.4、0.4、0.4、0.4 μmol/L;0.6、0.6、0.6、0.6 μmol/L;0.8、0.8、0.8、0.8 μmol/L;1.0、1.0、1.0、1.0 μmol/L Primers concentration(μmol/L)forB.suis,B.abortus,B.melitensisandB.oviswere 0.2, 0.2, 0.2, 0.2 μmol/L;0.4, 0.4, 0.4, 0.4 μmol/L; 0.6, 0.6, 0.6, 0.6 μmol/L; 0.8, 0.8, 0.8 0.8 μmol/L; 1.0, 1.0, 1.0, 1.0 μmol/L,respectively
图3 多重PCR引物浓度的优化
Fig.3 Optimal primer concentration used in multiplex PCR
2.4 多重PCR反应特异性扩增
采用优化的扩增条件进行多重PCR反应。结果表明,猪种、牛种、羊种、绵羊种布鲁菌及 4 种细菌的混合样品均可扩增出特异的目的片段,而其他细菌和水均无扩增条带,结果与预期相符,说明方法特异性良好(图4)。
2.5 多重PCR反应灵敏性试验
采用优化的多重PCR扩增条件扩增倍比稀释的 4 种细菌DNA,分别测出多重PCR对猪种、牛种、羊种、绵羊种布鲁菌的最低检出量分别为 32.2、21.3、27.5、43.2 pg(图5)。

M.DL 2000 DNA marker;1.猪种布鲁菌B.suis;2.猪种+牛种布鲁菌B.suisandB.abortus;3.猪种+牛种+羊种布鲁菌 suis,B.abortusandB.melitensis;4. 猪种+牛种+羊种+绵羊种布鲁菌B.suis,B.abortus,B.melitensisandB.ovis;5.金黄色葡萄球菌Staphylococcusaureus;6.大肠埃希菌Escherichiacoli;7.多杀性巴氏杆菌Pasteurellamultocida;8. 沙门菌Salmonella;9.无乳链链球菌Streptococcusagalactiae;10.双蒸水 ddH2O
图4 多重PCR特异性试验
Fig.4 Specificity test of multiplex PCR

M.DL 2000 DNA marker;1~6. 101~106倍比稀释的4种细菌DNA混合物的PCR扩增结果 PCR result for different dilutions of template from 101to106
图5 多重PCR灵敏性测定
Fig.5 Sensitivity of multiplex PCR assay
2.6 重复性试验
用建立的多重PCR方法在不同时间进行 3 次重复试验,结果获得相同的检测结果,表明该方法重复性良好。
2.7 人工模拟试验
无菌采取1~16号小鼠病料并提取DNA,按照优化的多重PCR方法进行扩增,结果见图 6。每份病料均扩增出所感染细菌相应的特异条带,而生理盐水对照无扩增条带,证明建立的多重PCR方法可以应用于临床病料的检测。

M.DL 2000 DNA marker;1~16.1~16号小鼠样品 Samples of 1-16 mice
图6 人工模拟试验多重PCR检测
Fig.6 Multiple PCR detection results of artificial simulation test
2.8 临床样本检测
对200份奶样进行检测,结果检出 4 份阳性,均为羊种布鲁菌,检出率约为 2%。部分样品的检测电泳结果见图7。4 份阳性样品经回收后测序均为羊种布鲁菌的特异性序列。
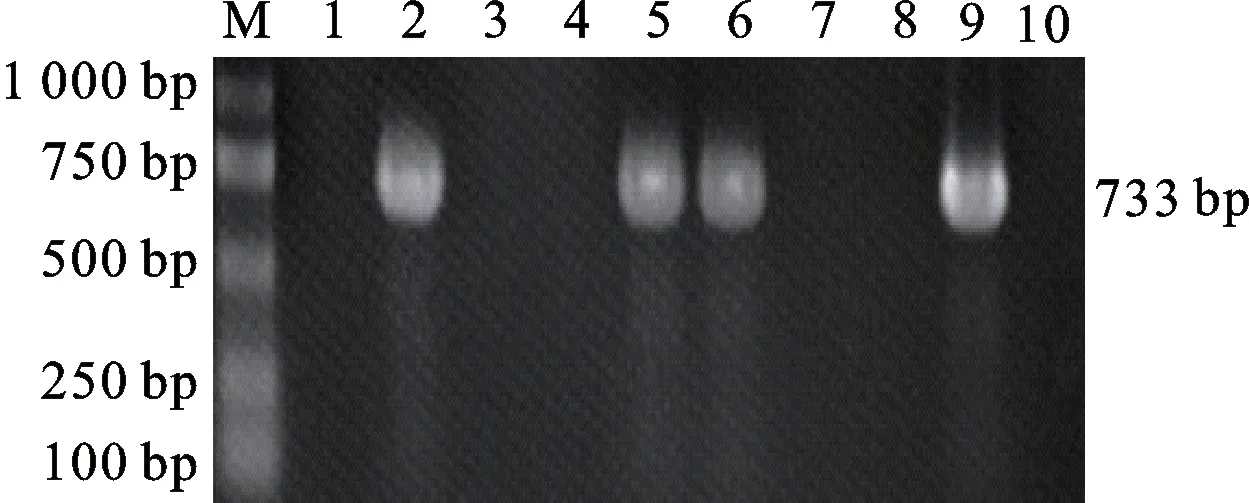
M.DL 2000 DNA marker;1~9. 9个临床样品 Nine clinical samples;;10.阴性对照 Negative control
图7 部分临床样品的多重PCR检测
Fig.7 Multiple PCR detection results of some clinic samples
3 讨 论
布鲁菌可感染猪、牛、羊、绵羊、鼠、犬和人类,对养殖行业以及人类健康构成严重威胁[11]。布鲁菌病在全世界许多国家都有分布,不论它在哪个国家暴发都会给该国带来巨大的经济损失,甚至造成人员的死亡,因此它在公共卫生上有很重要的意义。由于传统的检测方法有很多的缺点和局限性,不能在全世界范围内消灭布氏杆菌病。近年来,随着分子生物学的不断发展和各项技术的广泛应用,为细菌分类鉴定提供一些有效的新方法,可以在基因水平上对布氏杆菌病进行检测,提高检测的准确性和速度。
IS711是布鲁菌基因组中特有的插入序列,该序列在不同种布鲁菌基因组中非常保守,但却存在拷贝数差异[6]。本研究参照Genbank提供的猪种、牛种、羊种、绵羊种布鲁菌的 IS711基因序列和相关文献[6-7,12],选取 4 对特异性引物,扩增片段大小分别为 276 bp(猪种)、494 bp(牛种)、733 bp(羊种)和 976 bp(绵羊种)。本研究首先经过摸索反应条件建立单项PCR反应,然后通过预试验确定多重PCR反应的循环体系及反应条件,重点对影响多重PCR反应的主要因素如退火温度和引物浓度进行适当的调整和优化,最终确定多重PCR的最佳退火温度为 55 ℃,最佳引物浓度为 0.6 μmol/L。本研究建立的多重PCR反应对猪种、牛种、羊种、绵羊种布鲁菌DNA的最低检出量分别为32.2、21.3、27.5、43.2 pg,具有较高的灵敏性,这样的敏感性远高于传统的检测方法,并且已经可以满足临床检测和监测的需要。
本试验中目的片段均间隔 200 bp以上,扩增结果显示,目的条带在琼脂糖凝胶电泳后易于区分且无非特异性扩增出现。用本试验建立的PCR方法对临床模拟样品和临床奶样品进行检测,结果模拟试验显示完全能够检测到四重、三重、两重、单一细菌的感染,临床奶样也检出布鲁菌的污染。本研究建立的多重PCR检测方法可以为快速检测猪种、牛种、羊种、绵羊种布鲁菌提供敏感和特异的技术手段,以期达到对导致动物疫病以及动物奶产品污染的布鲁菌的快速检测。
Reference:
[1] 吐尔洪·努尔,谷文喜,何倩倪,等.布鲁菌病研究进展[J].动物医学进展,2007,28(7):82-87.
TUERHONG·NUER,GU W X,HE Q N,etal.Advance in brucellosis[J].ProgressinVeterinaryMedicine,2007,28(7):82-87(in Chinese with English abstract).
[2] SOLMAZ H,CANTEKIN Z,ALTUG N,etal.A PCR method with internal control for detection ofBrucellaspp.from bovine abortion samples[J].RevueDeMedecineVeterinaire,2014,165(9-10):253-257.
[3] 陆承平.兽医微生物学(第4版)[M].北京:中国农业出版社,2007:151-154.
LU CH P.Veterinary Microbiology[M].4th Edition.Beijing:China Agriculture Press,2007:151-154(in Chinese).
[4] HASHEMI S H,ASADI F T,ALIKHANI M Y,etal.Comparison of serology,culture and polymerase chain reaction (PCR) for diagnosis of human brucellosis[J].InternationalJournalofInfectiousDiseases,2016 (45):476.
[5] 张彦婷,刘艳琴,赵林立,等.布鲁氏菌检测技术的研究进展[J].畜牧与饲料科学,2008,29(6):43-46.
ZHANG Y T,LIU Y Q,ZHAO L L,etal.Research progress of detection technique ofBrucella[J].AnimalHusbandry&FeedScience,2008,29(6):43-46(in Chinese with English abstract).
[6] 陈伟业,胡 森,黄克和,等. IS711和 OMP2作为布氏杆菌种属及种株间分子鉴别诊断标记的研究[J].中国预防兽医学报,2006,28(6):676-680.
CHEN W Y,HU S,HUANG K H,etal. IS711 and OMP2 as molecular markers for identification ofBrucellaspecies and strains[J].ChineseJournalofPreventiveVeterinaryMedicine,2006,28(6):676-680(in Chinese with English abstract).
[7] 丁家波,张存帅,彭小兵,等.布鲁菌种属鉴定多重PCR方法的建立及初步应用[J].中国兽医学报,2009,29(5):594-597.
DING J B,ZHANG C SH,PENG X B,etal.Development and preliminary application of multi-PCR in differentiatingBrucellaspp[J].ChineseJournalofVeterinaryScience,2009,29(5):594-597(in Chinese with English abstract).
[8] ALAMIAN S,AGHAIIPOOR K,ZAHRAEI SALEHI T,etal.Detection ofBrucellamelitensisandBrucellaabortusstrains using a single-stage PCR method[J].ArchivesofRazi,2015,70(1):51-55.
[9] ALI S,ALI Q,MELZER F,etal.Isolation and identification of bovineBrucella,isolates from Pakistan by biochemical tests and PCR[J].TropicalAnimalHealth&Production,2014,46(1):73-78.
[10] NAN W,TAN P,WANG Y,etal.Duplex PCR for differentiation of the vaccine strainBrucellasuis S2 andB.suisbiovar 1 from other strains ofBrucellaspp[J].TheVeterinaryJournal,2014,201(3):427-428.
[11] MARZETTI S,CARRANZA C,Roncallo M,etal.Recent trends in humanBrucellacanis infection[J].ComparativeImmunology,MicrobiologyandInfectiousDiseases,2013,36(1):55-61.
[12] CHOTHE S,SAXENA H M,CHACHRA D.Comparative evaluation of PCR and ELISA for diagnosing bovine brucellosis[J].IntasPolivet,2013,14(1):80-85.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Foundation and Initial Application of Multiplex PCR Method for DetectingB.suis,B.abortus,B.melitensisandB.ovisInfection
HE Yapeng, XU Xingang, FU Mingzhe and ZHANG Qi
(College of Veterinary Medicine,Northwest A&F University,Yangling Shaanxi 712100,China)
In order to develop multiplex PCR assay for clinical detection ofB.suis,B.abortus,B.melitensisandB.ovisinfection, four pairs of primers were designed and synthesized based on highly conserved regions ofB.suis,B.abortus,B.melitensisandB.ovisgenome sequence in Genbank. The multiplex PCR reaction condition was optimized and multiplex PCR method for detectingB.suis,B.abortus,B.melitensisandB.ovisinfection was established. The specificity test showed that fragments of 276 bp, 494 bp, 733 bp and 976 bp were amplified from genomic DNA ofB.suis,B.abortus,B.melitensisandB.ovis,respectively. No amplification was achieved from control groups of other bacteria. The sensitivity test showed that the multiplex PCR could detect genome DNA of 21.3 pg forB.abortus, 27.5 pg forB.melitensis, 43.2 pg forB.ovisand 32.2 pg forB.suis. The artificial simulation test showed that the multiplex PCR could detect four kinds of pathogens from co-infection disease material. The initial application test showed 200 clinical goat’s milk samples were subjected to PCR. Among 4 clinical samples wereB.melitensis-positive. The result indicated the multiplex PCR method had advantages of specificity, sensitivity, repetition, and it could effectively detect the infection ofB.suis,B.abortus,B.melitensisandB.ovisin clinical samples.
B.suis;B.abortus;B.melitensis;B.ovis; Multiplex PCR
2016-05-03 Returned 2016-05-23
Scientific and Technological Projects of Shaanxi Province (No.2016NY-092); Project of Major Industrial Innovation Chain of Shaanxi Province(No.2016KTZDNY02-06);Project for Technology Achievement Extension of Demonstration Station(Base)of Northwest A&F University(No.TGZX2015-32).
HE Yapeng, male, master student.Research area:molecular etiology and immunology. E-mail:879533817@qq.com
ZHANG Qi, female, Ph.D, lecturer.Research area:molecular etiology.E-mail:273010466@qq.com
日期:2017-08-18
2016-05-03
2016-05-23
陕西省农业科技创新与攻关(2016NY-092);陕西省重点产业创新链(2016KTZDNY02-06);西北农林科技大学试验示范站(基地)科技成果推广(TGZX2015-32)。
何亚鹏,男,硕士研究生,从事分子病原学与免疫学研究。E-mail:879533817@qq.com
张 琪,女,博士,讲师,主要从事分子病原学研究。E-mail:273010466@qq.com 付明哲,男,高级兽医师,主要从事羊病研究。E-mail:286567031@qq.com
S855.1
A
1004-1389(2017)08-1135-06
FU Mingzhe, male, senior veterinarian.Research area:sheep diseases.E-mail:286567031@qq.com
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170818.0938.012.html

