微透析采样考察玉龙散中乌头碱在大鼠皮肤局部的透皮吸收过程△
李怀国,李子鸿,刘东文,郑芳昊
(佛山市中医院,广东 佛山 528000)
微透析采样考察玉龙散中乌头碱在大鼠皮肤局部的透皮吸收过程△
李怀国*,李子鸿,刘东文,郑芳昊
(佛山市中医院,广东 佛山 528000)
目的:考察玉龙散中乌头碱的透皮吸收过程。方法:采用HPLC-MS/MS技术建立SD大鼠皮肤微透析液中乌头碱含量的测定方法。通过考察微透析技术中对乌头碱体内回收率的影响因素,确定采样条件。经皮给药后,考察乌头碱的局部透皮吸收过程。结果:本实验成功建立了HPLC-MS/MS测定微透析样品中乌头碱含量的方法。微透析采样流速选择1.5 μL·min-1,采样间隔为30 min。乌头碱的AUC为18 973.27 h·ng·mL-1,MRT为14.97 h,Cmax为2 976.38 ng·mL-1,Tmax为11.76 h。结论:微透析采样技术可用于玉龙散中乌头碱的透皮吸收过程研究。
玉龙散;乌头碱;微透析
玉龙散是佛山市中医院自发研制的传统外用制剂,具有温经散寒、活血止痛的功效,临床主要用于跌打旧患、寒邪着络引起的关节酸痛或外科关节痛等症。本制剂制备工艺简单,取各味中药粉碎成细粉,过筛,混匀,即得。使用时将本品与加热的水及蜜糖混合均匀,平铺于敷药纸上,敷患处即可。该方由生草乌、生天南星等共7味中药组成。其中,生草乌祛风除湿、温经止痛,起主要治疗作用,在方中所占比例较大,为君药[1-4]。根据文献报道,生草乌的主要有效成分为乌头类生物碱,但同时也是其产生毒性的成分。在院内制剂标准中,本品对乌头碱的含量进行了限定,按质量计应低于3 mg·g-1。但是,关于乌头碱的透皮吸收过程却并不清楚,为该品种的合理使用带来了极大的风险。本研究拟采用微透析技术考察玉龙散中乌头碱在皮肤局部的透皮吸收过程。
1 仪器与材料
1.1 仪器
RWD302微透析系统(深圳市瑞沃德生命科技有限公司),CMA30微透析探针(瑞典CMA公司),HPLC-MS/MS联用仪(1200 HPLC和6410 Triple Quad 液质联用仪,美国安捷伦科技有限公司)。
1.2 试药
玉龙散(佛山市中医院自制,批号:1421301),经测定乌头碱含量为2.43 mg·g-1;乌头碱对照品(中国食品药品检定研究院,批号:1213511-2012521);盐酸普罗帕酮对照品(中国食品药品检定研究院,批号:100047-200305)。
1.3 动物
SD雄性大鼠(SPF级)20只,体重(200±20)g,由广州中医药大学实验动物中心提供,动物合格证号:SCXK(粤)2008-0021。
2 方法
2.1 微透析法收集局部皮肤透析液
2.1.1 Ringer’s液与探针的预处理 分别称取氯化钠4.30 g、氯化钙0.12 g、氯化钾0.15 g,转移至500 mL容量瓶中,用蒸馏水定容前加稀盐酸调pH至7.4,经微孔滤膜(0.45 μm)过滤后得Ringer’s液,使用前超声脱气20 min。将新探针浸泡于水中,以2 μL·min-1的流速灌流2 h,洗去杂质。体内试验前,将透析膜浸泡于肝素钠注射液中超过20 min。
政府和社会一直大力支持和倡导“全民阅读”,为了鼓励民众培养良好的阅读习惯, 2017年在国务院法制办会议审议并原则通过《全民阅读促进条例(草案)》中,计划将全民阅读纳入国家战略。[1]全民阅读已成为全社会共同参与的一项重大工程,以大学生为目标群体的高校图书馆在全民阅读中有着不可推卸的责任,承担着重要的角色。从20世纪90年代末至今,高校图书馆服务内容在不断发生变化,阅读推广作为新兴服务门类,发挥着越来越重要的作用,包括读书讲座、阅读研讨、展览、影视鉴赏等内容的阅读推广活动成为图书馆评估工作中的重要一环。许多高校图书馆成立专门的阅读推广部门,组织专业的阅读推广团队策划组织阅读活动。
2.1.2 微透析手术 取SD雄性大鼠,实验前用脱毛膏去腹部毛,并用20%乌拉坦按体质量(0.1 mL·g-1)麻醉。根据微透析采样要求,于敷药纸黏贴皮肤中心位置植入微透析探针,平均深度为83.26 μm。取玉龙散药粉10 g,加煮热的水及蜜糖(水、蜜糖用量均为10 mL),混合均匀后平铺于敷药纸上(4 cm×4 cm),敷于裸露皮肤处。分别于给药前及给药后每隔30 min收集透析液。
2.2 HPLC-ESI-MS/MS法测定大鼠局部皮肤微透析液中乌头碱的含量
2.2.1 内标对照品溶液的制备 精密称取普罗帕酮对照品,加甲醇溶解制成0.1 mg·mL-1的溶液,作为储备对照品溶液。临用前,将储备液用甲醇稀释至规定浓度,先用氮气吹干,再用同体积Ringer’s液溶解,得到内标对照品溶液。
2.2.2 标准透析液样品及质控样品的制备 精密称取乌头碱对照品,加甲醇溶解制成0.1 mg·mL-1的溶液,作为储备对照品溶液。取储备对照品溶液,用甲醇分别稀释至1、10、50、100、500、1000、2000、5000、10 000 ng·mL-1,得乌头碱对照品系列工作溶液。分别吸取各浓度的工作溶液100 μL,先用氮气吹干,再用Ringer’s液溶解,得到浓度为1~10 000 ng·mL-1的标准透析液系列样品。其中,10、500、5000 ng·mL-1的标准透析液样品分别作为乌头碱的低、中、高质控样品。
2.2.3 供试品溶液的制备 以体积比1∶1混合待测透析液和内标标准溶液后即得供试品溶液。
2.2.4 色谱条件 色谱柱:苯基柱(Alltima Phenyl,250 mm×4.6 mm,5 μm);流动相:0.1%甲酸-乙腈(40∶60);流速:0.35 mL·min-1;柱温:35 ℃;运行时间:2.5 min;进样量:2 μL。
质谱条件:辅助雾化气压力:35 Psi(1 Psi=6.895 kPa);毛细管电压:±4000 V;离子源温度:350 ℃;干燥气(N2)流速:8.0 L·min-1。具体参数见表1。

表1 乌头碱含量测定的质谱参数
2.3 乌头碱在SD大鼠皮肤局部的药代动力学过程
采用建立的微透析采样条件,于SD大鼠给药皮肤处植入微透析探针,分别于给药前及给药后每隔30 min收集透析液,连续收集24 h。通过2.2项下建立的LC-MS条件测定透析液中乌头碱的含量。运用DAS3.0软件进行非房室模型拟合,计算乌头碱在大鼠皮肤局部的药时曲线下面积(AUC)、平均滞留时间(MRT)、达峰药物浓度(Cmax)和达峰时间(Tmax)等药动学参数。
3 结果
3.1 LC-MS测定透析液中乌头碱含量的方法学考察
3.1.1 专属性考察 根据2.2.4项下的色谱及质谱条件,分别将对照品、供试品和空白阴性溶液进样检测,比较三者的LC-MS图谱。结果如图1、2所示,乌头碱和内标的出峰时间处无杂质干扰,峰型良好。在现行检测条件下,可以进一步进行样品分析。
3.1.2 基质效应考察 参照质控样品的浓度,以Ringer’s液溶解的高、中、低浓度乌头碱溶液进样后测定的峰面积为分子,以对应浓度对照品溶液进样后测定的峰面积为分母,计算乌头碱的基质效应。同时,平行取5份内标溶液,测定内标物的基质效应,结果如表2所示,乌头碱和内标的基质效应较小,均无明显离子增强或抑制现象,不影响乌头碱的含量测定。
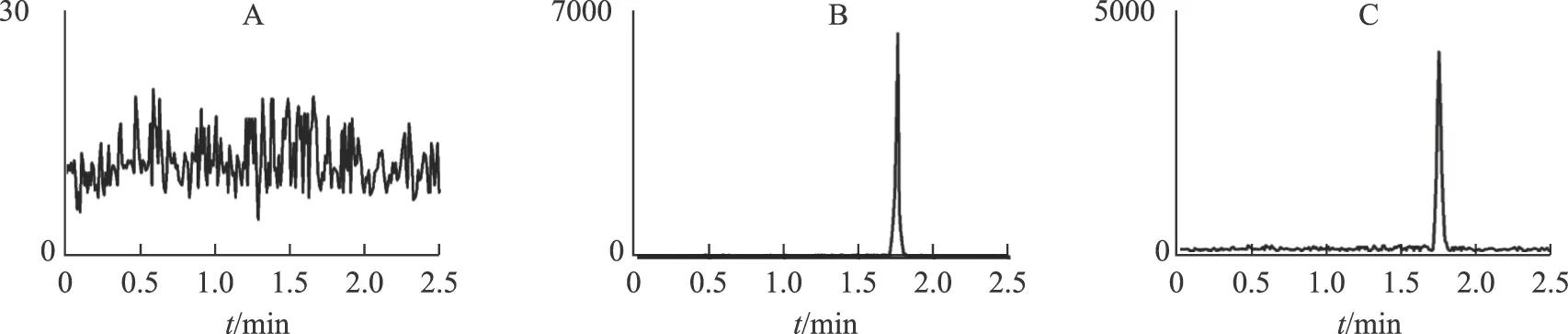
注:A.空白;B.对照品;C.供试品。图1 内标(普罗帕酮)LC-MS图
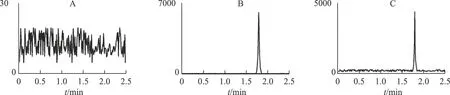
注:A.空白;B.对照品;C.供试品。图2 乌头碱LC-MS图
表2 乌头碱基质效应考察结果
3.1.3线性关系考察及线性范围和定量下限 分别取不同浓度的乌头碱标准透析液系列样品进样,以乌头碱与内标的峰面积比为Y,以乌头碱的浓度为X,采用加权(w=1/X2)最小二乘法进行回归运算。结果表明,乌头碱在0.5~5000 ng·mL-1线性关系良好,线性回归方程为Y=0.362 8X-0.004 5,r=0.999 3,定量下限(LLOQ)为0.5 ng·mL-1。
3.1.4 日内及日间精密度和准确度考察 分别取高、中、低浓度的乌头碱质控样品,每组平行5份,样品处理后连续进样3 d,计算精密度和准确度。结果如表3所示,不同浓度的乌头碱样品日内及日间精密度和准确度良好,准确度均在±5%内,精密度质量均小于5%。
3.1.5 回收率考察 分别取高、中、低浓度的乌头碱质控样品,每组平行5份,以质控样品与空白透析液混合进样后测定的峰面积为分子,以对应浓度对照品溶液与空白透析液混合后直接进样测定的峰面积为分母,计算乌头碱的提取回收率。同样,平行取5份内标溶液,测定内标物的回收率。结果如表4所示,乌头碱和内标的回收率均大于90%,RSD均小于5%,平行性良好。
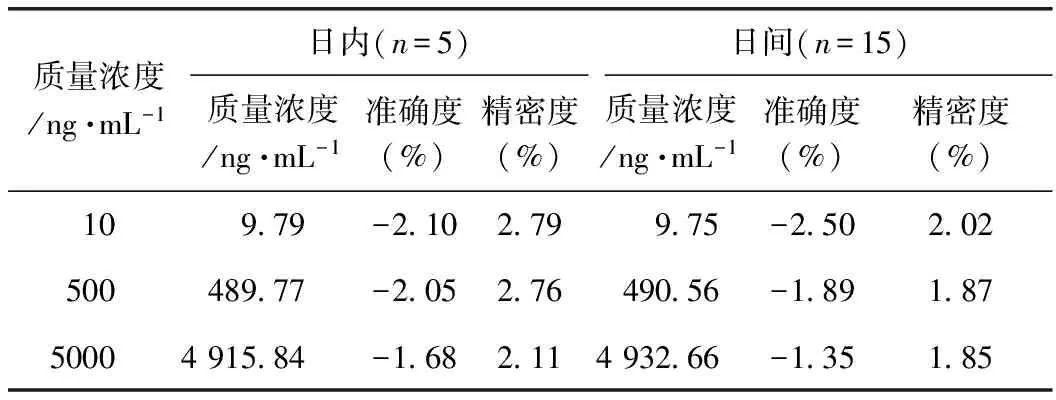
表3 日内及日间精密度和准确度考察结果
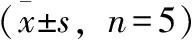
表4 回收率考察结果
3.1.6 稳定性考察 分别取高、中、低浓度的乌头碱质控样品,每组平行5份,在下述条件下考察乌头碱的稳定性:室温放置8 h,反复冻融3次,-20 ℃放置15 d。结果如表5所示,上述条件对乌头碱的含量测定均无显著影响,准确度均在±5%内。
3.2 微透析采样条件的确立
3.2.1 微透析流速对体内回收率的影响 探针植入平衡2 h后,分别在1.0、1.5、2.0、2.5 μL·min-1流速下灌注含有乌头碱(500 ng·mL-1)的Ringer’s液。每个流速收集5份样品,每份样品收集40 μL,分别测定透析液(C1)和含药Ringer’s液(C2)中乌头碱的含量,按公式RL=(C2-C1)/C2×100%计算体内相对损失率(RL),按公式RR=C1/C2×100%计算回收率(RR)。结果如表6所示,随着流速的增加,体内相对损失率逐渐减少,回收率增加。综合考虑,1.5 μL·min-1的流速较为合理。
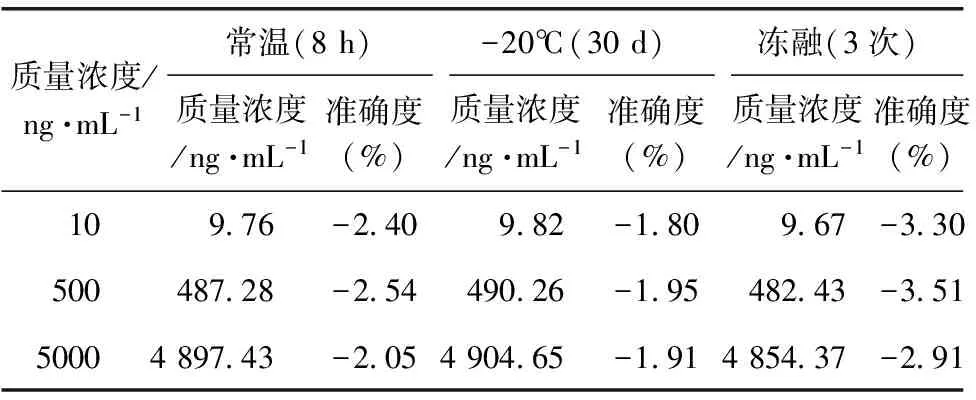
表5 稳定性考察结果(n=5)
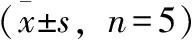
表6 微透析流速对体内回收率的影响
3.2.2 药物浓度对体内回收率的影响 探针植入平衡2 h后,以1.5 μL·min-1的流速分别灌注含有乌头碱质量浓度为100、500、1000、2000、5000 ng·mL-1的Ringer’s液。每个流速收集5份样品,每份样品收集45 μL,分别计算体内相对损失率和回收率。结果表明,不同浓度下乌头碱的体内回收率平均值为19.27%,RSD=3.27%。说明在100~5000 ng·mL-1内,乌头碱的浓度对探针回收率无明显影响。
3.2.3 体内回收率的稳定性考察 以1.5 μL·min-1的流速分别灌注含乌头碱为500 ng·mL-1的Ringer’s液,每30 min收集1次透析液,连续灌流24 h。结果表明,24 h内乌头碱的体内回收率平均值为79.78%,RSD=4.46%。说明24 h内乌头碱的体内回收率无明显变化,半透膜稳定性良好。
3.3 乌头碱在SD大鼠皮肤局部的药代动力学过程
玉龙散中乌头碱在大鼠皮肤局部的经时曲线如图3所示。乌头碱的AUC为18 973.27 h·ng·mL-1,MRT为14.97 h,Cmax为2 976.38 ng·mL-1,Tmax为11.76 h。
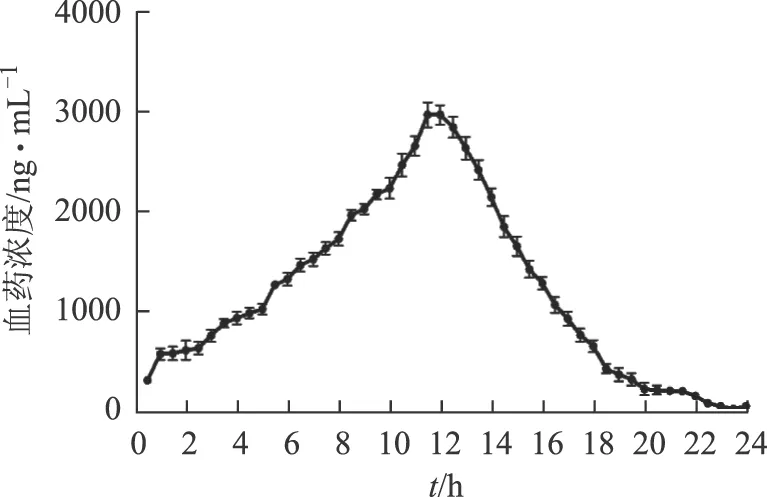
图3 乌头碱在大鼠皮肤局部的药物浓度-时间曲线(n=6)
4 讨论
乌头碱的含量测定方法包括高效液相色谱法(HPLC)、液质联用法(LC-MS)等。LC-MS体现了色谱和质谱优势的互补,将色谱对复杂样品的高分离能力,与MS具有高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合起来,在药物分析尤其是生物样品定量分析中得到了广泛的应用。如黎晓丽等[5]采用LC-MS测定了微透析样品中6种乌头类生物碱的含量。李国卫等[6]采用LC-MS分析了制川乌单煎液及乌头汤中乌头类生物碱成分的差异,对各成分的MS2和MS3谱图进行了解析。辛杨等[7]利用LC-MS分析了干姜对乌头类生物碱在大鼠肠内吸收的影响。朱玲英等[8]利用LC-MS体外分析了肝匀浆液中乌头碱及其代谢产物的含量和变化。陶长戈等[9]利用LC-MS研究了静脉注射给药后乌头碱在大鼠体内的毒代动力学过程。本文成功建立了LC-MS测定微透析液中乌头碱含量的方法。经方法学验证,该方法稳定可靠,重现性良好,可用于测定微透析样品中乌头碱的含量。
通常可以从体内和体外研究药物的透皮吸收机制。但是,体外研究虽然可以初步了解效应成分的透皮能力,却无法真实反映药物的经皮吸收全过程。传统的体内研究则无法满足动态、精确定量的实验要求。微透析采样不仅在国外得到了广泛应用,在国内也越来越多地被用来进行中药外用制剂的透皮吸收分析,具有活体取样、动态观察、定量分析、对组织损伤小、取样少、方便、快捷、可连续监测且易实现自动化等优点,可减少实验动物的使用量,降低个体差异[10-11]。黎晓丽等[5]运用微透析技术研究了制川乌—白芍配伍对6种酯性生物碱局部药动学的影响。结果发现,微透析采样联合液质联用分析技术可以用于乌头碱透皮吸收过程的研究。但是,制乌头中乌头碱的Tmax为(1±0.71)h,MRT为(2.71±0.36)h。药对配伍后,Tmax与MRT虽有所减少,仍与我们的实验结果差异较大。这可能与玉龙散的制备工艺、使用方法、在临床中需要缓释的用药目的有关。
本实验成功建立了微透析技术用于乌头碱体内采样的方法,采用本文的灌流液和流速,既可以保证乌头碱的体内回收率,同时又可以满足LC-MS对样品分析的要求。通过本文的研究,初步明确了玉龙散中乌头碱在皮肤局部的透皮吸收过程,为制剂工艺优化、质量标准提高以及新药药效学评价提供了实验参考依据。
[1] 梁丽谊,黎建颜.追风透骨胶囊联合玉龙散外敷治疗腰痛的疗效观察[J].今日药学,2016,26(7):509-511.
[2] 范伟锋,陈衍尧,朱秋贤,等.玉龙散外敷对椎动脉型颈椎病血流动力学参数的影响[J].湖南中医药大学学报,2015,35(8):47-49.
[3] 江丽娇,梁瑞媚,梁丽谊,等.玉龙散与活血散缓解骨科慢性疼痛效果对比观察[J].护理学报,2013,20(6):56-58.
[4] 李丹凤,邱沈虹,杜雪莲,等.玉龙散外敷治疗腰椎间盘突出症腰腿疼痛的效果观察[J].护理学报,2013,20(13):51-53.
[5] 黎晓丽,吴璐,吴维刚,等.在体皮肤微透析法研究制川乌白芍配伍对6种酯型生物碱局部药动学的影响[J].中国中药杂志,2016,41(5):948-954.
[6] 李国卫,吴成凤,桂蜀华.配伍对乌头汤中乌头碱型生物碱的影响[J].中国实验方剂学杂志,2015,21(10):5-8.
[7] 辛杨,皮子凤,宋凤瑞,等.利用液质联用技术分析干姜对乌头类生物碱在大鼠肠内吸收的影响[J].化学学报,2012,70(5):551-560.
[8] 朱玲英,沈红,武洁.LC-MS/MS法体外测定肝匀浆液中乌头碱及其代谢产物[J].药物分析杂志,2012,32(11):1923-1928.
[9] 陶长戈,李文军,彭成.乌头碱在大鼠体内的毒代动力学研究[J].湖北中医药大学学报,2011,13(3):21-23.
[10]韩金钊,胡晋红.微透析技术在皮肤药理学中的应用进展[J].中国新药杂志,2011,20(14):1273.
[11]董冉冉,王萌,刘志东,等.微透析技术在中药成分体内分析研究中的应用[J].中草药,2015,46(20):3117-3124.
PharmacokineticsofAconitineinRatsTreatedwithYuLongSanbyMicrodialysis
LI Huaiguo*,LIZihong,LIUDongwen,ZHENGFanghao
(FoshanHospitalofTCM,Foshan528000,China)
Objective:To investigate the pharmacokinetics of aconitine in rats treated with Yu Long San by microdialysis.Methods:The suitable microdialysis sampling technical conditions of aconitine were developed by investigating the velocity,the concentration of aconitine and other factors.The rat plasma samples were collected by microdialysis sampling technique.The concentration of aconitine was determined by LC-MS.Results:The suitable conditions of microdialysis for ephedrine were the velocity of 1.5 μL·min-1,sample interval for 30 min.The AUC was 18 973.27 h×ng·mL-1,MRT was 14.97h,Cmaxwas 2 976.38 ng·mL-1,Tmaxwas 11.76 h.Conclusion:Microdialysis is suitable for studying the pharmacokinetics of aconitine in rats treated with Yu Long San.
Yu Long San;aconitine;microdialysis
2014年佛山市医学类科技攻关项目(2014AB00330)
] 李怀国,副主任药师,研究方向:中药新药研发;Tel:(0757)81092310,E-mail:2402811567@qq.com
10.13313/j.issn.1673-4890.2017.7.016
2017-01-14)
*[

