MAPK/FOXA2介导香烟烟雾提取物对支气管上皮细胞分化的影响
杜春玲, 段艳红, 周 磊, 吴 波
复旦大学附属中山医院青浦分院呼吸内科,上海 201700
·短篇论著·
MAPK/FOXA2介导香烟烟雾提取物对支气管上皮细胞分化的影响
杜春玲, 段艳红, 周 磊, 吴 波
复旦大学附属中山医院青浦分院呼吸内科,上海 201700
目的: 探讨吸烟对支气管上皮细胞分化的影响及丝裂原活化蛋白激酶(MAPK)/叉头框转录因子 A2(FOXA2)信号通路在此过程中发挥的作用。方法: 培养BEAS-2B细胞,分为空白对照组、香烟烟雾提取物(CSE)处理组、CSE+ERK抑制剂U0126处理组、CSE+JNK抑制剂SP600125处理组、CSE+p38抑制剂SB203580处理组。ELISA测定各组磷酸化的ERK1/2、JNK、p38蛋白的水平;实时荧光定量PCR检测FOXA2、E-cadherin、CD44、ZO-1的mRNA水平;用Western印迹检测FOXA2、E-cadherin、CD44、ZO-1的蛋白水平。结果: 与空白对照组相比,用CSE的细胞中磷酸化的ERK1/2、JNK、p38蛋白水平明显升高(P<0.05),而FOXA2、 E-cadherin、CD44、ZO-1的mRNA及蛋白表达水平均明显降低(P<0.05);CSE处理同时采用ERK、JNK或 p38抑制剂处理显著改善上述基因及蛋白表达的变化(P<0.05)。结论: 吸烟可影响支气管上皮细胞分化,而MAPK/FOXA2信号通路在此过程中发挥重要调节作用。
丝裂原活化蛋白激酶;叉头框转录因子 A2;香烟烟雾提取物;支气管上皮细胞;分化
香烟烟雾包含多种化学成分,已被证实为多种肺疾病的重要危险因素,例如肺癌和慢性阻塞性肺疾病(COPD)[1-2]。多项体外和在体实验[3-4]已表明,香烟烟雾可导致气道炎症,引起DNA损伤,但是香烟烟雾导致气道病变和肺功能持续恶化的机制非常复杂,目前尚不明确。
香烟烟雾可通过激活丝裂原活化蛋白激酶(MAPK)信号通路而导致支气管上皮细胞异常增生,且MAPK信号通路与吸烟诱导的支气管上皮细胞鳞状化生、黏蛋白(MUC)5AC高分泌密切相关[5-7]。叉头框转录因子A2(FOXA2)是气道上皮细胞分化所必需的因子,与MUC5AC的分泌负相关,在肺泡上皮细胞发育过程中发挥重要的作用,且可参与调控细胞的增殖与成熟[8-10]。但是,FOXA2是否参与香烟诱导的MAPK活化及上皮细胞分化,目前尚未明确。本研究采用香烟烟雾提取物(CSE)刺激人气道上皮细胞,体外模拟吸烟活化的人支气管上皮细胞模型,研究CSE对人支气管上皮细胞分化的影响,以及MAPK信号通路、FOXA2在这个过程中可能发挥的作用及其机制。
1 材料与方法
1.1 细 胞 正常人支气管上皮细胞(BEAS-2B)购自上海博谷生物科技有限公司,在含10%胎牛血清的RMPI 1640完全培养基中培养。
1.2 试剂和仪器 ELISA试剂盒购于Abcam(ab119674)公司;TRIzol、Bio-Serve定量检测扩增试剂盒、Bio-Serve反转录试剂盒购于Invitrogen公司;Western 印迹实验所用一抗购于Abcam公司,二抗购于碧云天公司;ECL显影液购于Pierce公司。酶标仪购于Thermo公司;实时荧光定量PCR仪购于Olympus公司。
1.3 CSE的制备 参照Ballweg等[11]的方法并改良:4支香烟(上海红双喜,焦油含量8 mg/支、烟气烟碱量0.7 mg/支、烟气一氧化碳量10 mg/支)燃烧的烟雾在负压吸引下溶于40 mL无血清培养液中,制成悬液。调节悬液pH值为约7.4,经0.22 μm滤膜过滤除菌后作为100%CSE溶液。每次实验时现制备CSE,稀释到所需浓度后采用。
1.4 MTT法筛选CSE、MAPK抑制剂的适宜浓度 参照文献[12],根据MTT法测定的细胞生长抑制率,筛选1%的CSE及20 μmol/L的ERK、JNK/p38抑制剂用于后续实验。
1.5 细胞分组及干预 无血清培养BEAS-2B细胞。将生长对数期的BEAS-2B细胞铺3个24孔板,每个孔的接种细胞数为1×105;第2天,细胞融合度约60%,制备CSE,细胞换液后,每孔加入适量的CSE制剂和(或)抑制剂,不加抑制剂的孔加入相同体积的DMSO。按照实验设计将细胞分为5组,每板每组4个复孔:对照组,CSE处理组(CSE组),CSE+ERK抑制剂组(CSE+U0126组),CSE+JNK抑制剂组(CSE+SP600125组),CSE+p38抑制剂组(CSE+ SB203580组)。每2天按原浓度换液1次。处理1周后收集细胞,用于后续检测。
1.6 ELISA法测定各组磷酸化的ERK1/2、JNK、p38蛋白水平[1]ELISA试剂盒检测磷酸化的ERK1/2、JNK、p38蛋白水平,检测结果用相对荧光单位(RFU)表示。CSE处理预定的时间后,取其中1个24孔板,吸出培养液,用磷酸盐缓冲液(PBS)洗1遍,每孔加入200 μL新稀释的裂解液,室温裂解10 min,回收,分装待检测磷酸化的ERK1/2、p38、JNK蛋白水平。取检测微板,每孔分别加入50 μL相应的裂解液,继续加入50 μL相应的抗体溶液,室温孵育1 h。每孔用200 μL PBS洗液洗板,洗3遍。每孔加入100 μL底物溶液,室温放置10 min,加入终止液后进行荧光测定。
1.7 实时荧光定量PCR检测FOXA2、E-cadherin、CD44、ZO-1的mRNA水平 CSE处理预定的时间后,取其中1个24孔板,PBS洗板后,TRIzol法抽提总RNA。每份RNA样品取4 μL,采用Bio-Serve反转录试剂盒(Cat No. BS-PCR005)反转录。取等量的标准品和反转录样品2 μL,采用Bio-Serve定量检测扩增试剂盒(Cat No. BS-PCR002)进行定量PCR检测。在72℃检测荧光信号。定量PCR扩增FOXA2、E-cadherin、ZO-1及CD44的引物见表1。

表1 FOXA2、E-cadherin、ZO-1及CD44的扩增引物
1.8 Western印迹检测FOXA2、E-cadherin、CD44、ZO-1的蛋白水平 CSE处理预定的时间后,取其中1个24孔板,胰酶消化每孔细胞,PBS洗板后加入裂解液,冰上裂解30 min,加入5×上样缓冲液后,煮沸10 min,离心(12 000×g)并自然冷却后上样。配制8%的分离胶及3.9%的浓缩胶,每孔加样20 μL,先恒压45 V电泳,待样品在浓缩胶与分离胶之间跑成一条直线时,换成恒压70 V,电泳3~5 h。将蛋白电转移到硝酸纤维素滤膜(NC膜)上,恒流300 mA,1 h(ZO-1为90 min)。丽春红S染色显示转膜成功后行免疫显色:洗膜液洗涤,用封闭液稀释一抗,加一抗( ACTIN鼠单抗、E-cadherin鼠单抗、FOXA2兔多抗、CD44兔多抗或ZO-1羊多抗,比例均为1∶1 000),4℃孵育过夜;洗膜液洗涤,加辣根酶标记的二抗(比例均为1∶500)室温孵育2 h;洗膜液洗涤,最后在暗室中进行ECL(Pierce公司)化学发光法显影。
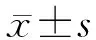
2 结 果
2.1 各组磷酸化ERK1/2、JNK、p38蛋白水平的比较 ELISA法检测结果显示,处理48 h后,CSE组细胞中磷酸化ERK1/2、JNK、p38蛋白水平较对照组升高(P<0.05),提示MAPK信号通路可能是CSE影响支气管上皮细胞生长的重要机制。ERK抑制剂、JNK抑制剂和p38抑制剂处理细胞后,CSE引起的磷酸化ERK1/2、JNK、p38蛋白水平升高被抑制,证明MAPK通路抑制剂有效地发挥了抑制作用(图1)。
2.2 各组FOXA2、 E-cadherin、CD44、ZO-1的mRNA水平比较 与对照组相比,CSE组FOXA2、E-cadherin、CD44、ZO-1的mRNA水平均明显下降(P<0.05),而CSE处理同时用ERK、JNK或 p38抑制剂处理则使CSE诱导的上述因子的mRNA水平下降被抑制(P<0.05,图2)。

图1 各组细胞中磷酸化ERK1/2、JNK、p38蛋白的表达
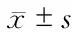

图2 各组细胞中FOXA2、E-cadherin、CD44、ZO-1 mRNA水平
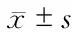
2.3 各组FOXA2、E-cadherin、CD44、ZO-1蛋白水平比较 与对照组相比,CSE组FOXA2、E-cadherin、CD44、ZO-1蛋白水平均明显下降,而CSE处理同时采用ERK、JNK或p38抑制剂处理则可抑制CSE诱导的上述蛋白水平的下降(P<0.05,图3)。

图3 各组细胞中FOXA2、 E-cadherin、CD44、ZO-1蛋白的表达
3 讨 论
MAPK是一组丝氨酸-苏氨酸蛋白激酶,ERK、JNK和 p38均为其亚单位,可参与介导细胞的增殖、凋亡、分化以及对炎症反应的调节等过程。近年来有研究[5-7]发现,吸烟可通过激活ERK、JNK和 p38诱导支气管上皮细胞的鳞状化生和异常增生。这可能是吸烟增加肺癌及COPD发生风险的重要机制[8,13-14]。
FOXA2是气道上皮细胞分化所必需的成份。有研究[15]发现,FOXA2在哮喘等肺病变组织中表达下降;且在小鼠中发现FOXA2的表达与MUC5AC的分泌呈负相关,提示FOXA2在支气管上皮细胞分化中起重要调节作用。E-cadherin是一类跨膜黏附受体,广泛分布于动物及人的各类上皮细胞,在细胞的黏附作用、维持细胞的完整性中发挥调节作用[16]。ZO-1是一类紧密连接蛋白,主要调节细胞的紧密连接[17],同样在维持上皮细胞极性及屏障功能中发挥作用。CD44属于介导细胞与基质、细胞与细胞间黏附的黏附因子,是一组分布广泛、多分子形式的膜整合蛋白[18]。气道上皮细胞是COPD发病机制中关键的细胞之一,也是新兴的治疗靶点之一[18]。作为上皮细胞的标志物,E-cadherin、ZO-1及CD44的变化能反映上皮细胞的极性、黏附功能的变化,与气道上皮细胞的分化状态相关,也是上皮间质转化(epithelial mesenchymal transition,EMT) 的重要标志。肺癌与COPD具有很多共同特点:吸烟为重要病因,疾病起始于气道上皮细胞,与气道炎症相关。因此,探究CSE诱导人气道上皮细胞分化的改变以及MAPK参与的机制可能对进一步阐明COPD、肺癌的发病机制有重要意义。
本研究采用正常人支气管上皮细胞体外吸烟模型,探究MAPK信号通路对吸烟诱导的上皮细胞分化的影响,发现CSE处理后的支气管上皮细胞中E-cadherin、CD44、ZO-1的mRNA水平及蛋白水平均明显下降,表明支气管上皮细胞的分化出现异常,细胞连接、黏附及完整性受到破坏。研究[10]认为,FOXA2作为支气管上皮细胞分化的调节因子,也是肺癌抑制基因。本研究中,CSE引起FOXA2下降,说明FOXA2参与了吸烟诱导的支气管异常分化。但这种分化的改变是否与吸烟导致的肺癌有关需要进一步研究。本研究发现,E-cadherin、CD44、ZO-1与FOXA2的表达变化一致,但是否受到FOXA2的调控还需进一步研究。研究[19]证实,在胰腺导管细胞癌细胞系,FOXA2能激活E-cadherin启动子,是内源性E-cadherin的强活化剂;而FOXA2表达受抑可诱导EMT,同时伴有E-cadherin表达的下降。该研究结论与本研究相似,且说明E-cadherin的表达可能受到FOXA2的调控,提示CD44和ZO-1也可能受到FOXA2的调控。
本研究中,当MAPK信号通路受到抑制时,可明显抑制CSE对支气管上皮细胞的影响,ERK、JNK、p38受到抑制后,由CSE引起的FOXA2、 E-Cadherin、CD44、ZO-1的表达回升,说明MAPK信号通路参与了支气管上皮细胞的分化调节,与研究[13]结论相似,提示CSE可能通过MAPK信号通路诱导支气管上皮细胞的异常分化。而气道上皮细胞的这种分化改变可能参与COPD、肺癌的发病。然而,MAPK信号通路如何调控FOXA2以及E-cadherin、CD44、ZO-1的表达,或FOXA2与E-cadherin、CD44、ZO-1之间是否有级联调控作用仍不明了,尚需进一步研究。
综上所述,本研究发现,吸烟可导致支气管上皮细胞异常分化,这可能是吸烟增强COPD、肺癌发生风险的原因之一;吸烟对支气管上皮细胞分化的影响可能通过MAPK/FOXA2信号通路介导,ERK、JNK和p38的抑制剂可明显抑制细胞的分化。本研究可能为吸烟导致COPD、肺癌的发生提供了潜在的分子机制,也为COPD、肺癌的治疗提供了靶点。
[ 1 ] PAUWELS R A, BUIST A S, CALVERLEY P M, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO Global Initiative for Chronic Obstructive Lung Disease (GOLD) Workshop summary[J]. Am J Respir Crit Care Med, 2001, 163(5):1256-1276.
[ 2 ] NYUNOYA T, MEBRATU Y, CONTRERAS A, et al. Molecular processes that drive cigarette smoke-induced epithelial cell fate of the lung[J]. Am J Respir Cell Mol Biol, 2014, 50(3):471-482.
[ 3 ] HASWELL L E, HEWITT K, THORNE D, et al. Cigarette smoke total particulate matter increases mucous secreting cell numbers in vitro: a potential model of goblet cell hyperplasia[J]. Toxicol In Vitro,2010, 24(3):981-987.
[ 4 ] PESCH B, KENDZIA B, GUSTAVSSON P, et al. Cigarette smoking and lung cancer--relative risk estimates for the major histological types from a pooled analysis of case-control studies[J]. Int J Cancer, 2011, 131(5):1210-1219.
[ 5 ] ZHONG C Y, ZHOU Y M, DOUGLAS G C, et al. MAPK/AP-1 signal pathway in tobacco smoke-induced cell proliferation and squamous metaplasia in the lungs of rats[J]. Carcinogenesis, 2005, 26(12):2187-2195.
[ 7 ] XIAO J, WANG K, FENG Y L, et al. Role of extracellular signal-regulated kinase 1/2 in cigarette smoke-induced mucus hypersecretion in a rat model[J]. Chin Med J (Engl), 2011, 124(20):3327-3333.
[ 8 ] 江德鹏, VICTOR P KOLOSOV, JULIY M PERELMAN,等. 白细胞介素-13刺激大鼠气道黏液高分泌的分子机制[J]. 南方医科大学学报, 2011, 31(1):73-76.
[ 9 ] ZHEN G, PARK S W, NGUYENVU L T, et al. IL-13 and epidermal growth factor receptor have critical but distinct roles in epithelial cell mucin production[J]. Am J Respir Cell Mol Biol,2007, 36(2):244-253.
[10] TANG Y, SHU G, YUAN X, et al. FOXA2 functions as a suppressor of tumor metastasis by inhibition of epithelial-to-mesenchymal transition in human lung cancers[J]. Cell Research, 2011, 21(2):316.-326.
[11] BALLWEG K, MUTZE K, KÖNIGSHOFF M, et al. Cigarette smoke extract affects mitochondrial function in alveolar epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(11):L895-L907.
[12] 和 平, 赵玉杰, 刘 原,等. 姜黄素抑制香烟烟雾提取物刺激巨噬细胞RAW264.7所致炎症反应[J]. 山西医科大学学报, 2014, 45(5):343-346.
[13] MOSSMAN B T, LOUNSBURY K M, REDDY S P. Oxidants and signaling by mitogen-activated protein kinases in lung epithelium[J]. Am J Respir Cell Mol Biol, 2006, 34(6):666-669.
[14] SHEN N, GONG T, WANG J D, et al. Cigarette smoke-induced pulmonary inflammatory responses are mediated by EGR-1/GGPPS/MAPK signaling[J]. Am J Pathol, 2011, 178(1):110-118.
[15] WAN H, KAESTNER K H, ANG S L, et al. FOXA2 regulates alveolarization and goblet cell hyperplasia[J]. Development, 2004, 131(4):953-964.
[16] ODA H, TAKEICHI M. Evolution: structural and functional diversity of cadherin at the adherens junction[J]. J Cell Biol, 2011, 193(7):1137-1146.
[17] 翁密霞, 吴翠环, 杨秀萍. E-cadherin、CD44v6和PCNA在非小细胞肺癌组织中的表达及意义[J]. 癌症, 2008, 27(2):191-195.
[18] NAOR D, WALLACH-DAYAN S B, ZAHALKA M A, et al. Involvement of CD44, a molecule with a thousand faces, in cancer dissemination[J]. Semin Cancer Biol, 2008, 18(4):260-267.
[19] SONG Y, WASHINGTON M K, CRAWFORD H C. Loss of FOXA1/2 is essential for the epithelial-to-mesenchymal transition in pancreatic cancer[J]. Cancer Res,2010, 70(5):2115-2125.
[本文编辑] 姬静芳
Effect of cigarette smoke extract on differentiation of bronchial epithelial cells mediated by MAPK/FOXA2
DU Chun-ling, DUAN Yan-hong, ZHOU Lei, WU Bo
Department of Respiratory Medicine, Qingpu Branch of Zhongshan Hospital, Fudan University, Shanghai 201700, China
Objective: To explore the effect of cigarette smoke extract (CSE) on the differentiation of bronchial epithelial cells and the role of mitogen-activated protein kinase (MAPK)/forkhead box A2 (FOXA2) signaling pathways in this process.Methods: BEAS-2B cells were cultivated and treated respectively with cigarette smoke extract (CSE), CSE and ERK inhibitor U0126, CSE and JNK inhibitor SP600125, CSE and p38 inhibitor SB203580. Thus the blank control group and cigarette smoke extract (CSE) treatment group, CSE+ERK inhibitor U0126 treatment group, CSE+JNK inhibitor SP600125 treatment group, and CSE+p38 inhibitor SB203580 treatment group were set. ELISA was developed for detecting the protein levels of phosphorylated ERK1/2, JNK, and p38. The mRNA and protein levels of FOXA2, E-cadherin, CD44 and ZO-1 were measured by real-time fluorescent quantitative PCR and Western blotting, respectively.Results: Compared with the blank control group, the phosphorylated ERK1/2, JNK, and p38 protein levels were significantly increased (P<0.05), and the mRNA and protein expression of FOXA2, E-cadherin, CD44 and ZO-1 were significantly decreased (P<0.05) when cells were treated with CSE. CSE treatment with ERK, JNK or p38 inhibitors significantly improved the expression of the above genes and proteins (P<0.05).Conclusions: Smoking can affect the differentiation of bronchial epithelial cells, and the MAPK/FOXA2 signaling pathway plays an important regulatory role in this process.
mitogen-activated protein kinase; forkhead box A2; cigarette smoke extract; bronchial epithelial cells; differentiation
R 562
A
2016-08-01 [接受日期] 2017-03-28
上海市卫生和计划生育委员会面上项目(20124277).Supported by Program of Shanghai Municipal Commission of Health and Family Planning(20124277).
杜春玲, 博士,主任医师.E-mail:duchunling966@163.com
10.12025/j.issn.1008-6358.2017.20160777

