玉米衰老相关基因在2个杂交种及其亲本中的表达分析
孙高阳,吴向远,叶琳琳,孟淑君,阎鹏帅,汤继华,郭战勇
(1. 河南农业大学农学院,河南 郑州 450002; 2. 河南科技学院生命科技学院, 河南 新乡 453003)
玉米衰老相关基因在2个杂交种及其亲本中的表达分析
孙高阳1,吴向远2,叶琳琳1,孟淑君1,阎鹏帅1,汤继华1,郭战勇1
(1. 河南农业大学农学院,河南 郑州 450002; 2. 河南科技学院生命科技学院, 河南 新乡 453003)
以玉米杂交种先玉335和郑单958及其亲本为材料,分析了叶片和子粒在授粉后不同时期衰老相关基因表达的变化规律。结果表明,2个叶绿体绿色保持基因SGR1和SGR2在杂交种先玉335和郑单958及其亲本穗三叶中的表达随着授粉后时间的延长整体上呈现上升趋势,但是先玉335的基因表达量要高于郑单958。叶片衰老诱导基因SAP1在叶片发育过程中上调表达,SAP2则表现出先增后减的趋势。以不同生长发育时期的子粒为材料,分析了子粒发育中衰老相关基因SAG1,SAG2和SAG3的表达规律。结果表明,SAG1基因的表达水平随着子粒的发育而降低,而SAG2和SAG3基因则在子粒的成熟过程中表达量呈现上升的趋势。
玉米;衰老;持绿性;基因表达
叶片衰老是植物生长发育过程中器官和组织逐步走向功能衰退和死亡的一个必经阶段。在生产实践中,植物衰老期的早晚及衰老延续时间的长短对作物光合作用时间意义重大,影响着作物的产量、品质以及一些花卉和牧草的储藏期[1]。大量研究表明,叶片的衰老过程伴随着细胞结构分解、胞内大分子物质的降解以及营养物质自衰老叶片向子粒等库组织的有效转移[2],对营养元素的循环和再利用等生理活动起着重要的作用;其次,主动的衰老调控对植物在逆境胁迫环境下的适应能力有重要影响。植物叶片的衰老过程同时受遗传和外在环境条件的共同影响,遗传因素在衰老的起始过程中起主导作用。随着叶片衰老的进程推进,大量与衰老相关的基因表达被激活或者抑制,调控整个衰老过程中分解代谢、信号转导及转录激活等途径,从而导致叶片等植物器官一系列生理生化上的变化。近年来,在植物中已经克隆获得许多衰老相关的基因,包括叶绿素代谢[3-4]、蛋白质降解、信号传导等基因。研究叶片衰老不仅有助于对叶片衰老分子机制的了解,而且生产上也能通过协调衰老与光合作用的关系,延长高光合速率的时间来提高作物的产量[5],在蔬菜、水果的收获贮藏中最大化地减少损失[6]。目前,玉米叶片衰老的研究主要集中于叶片衰老的发育规律、光合指标以及营养指标变化、胁迫条件下(例如干旱、高温、低氮以及激素等)生理生化指标的变化等方面,对于叶片衰老相关基因的克隆以及表达调控的分子机制等方面的研究鲜见报道。本研究利用生产上大面积推广的玉米杂交种先玉335和郑单958及其亲本自交系为材料,在已有研究的基础上,筛选出7个与衰老相关的候选基因,通过对其在生长发育后期时空表达变化的分析,解析其在不同材料间表达模式的差异,为后期衰老相关基因的克隆分析奠定基础。
1 材料与方法
1.1试验材料
以中国生产上大面积应用的2个优良玉米杂交种先玉335、郑单958及其亲本自交系为试验材料,其中郑单958具有适应性广、耐密性强、综合抗性好等突出优点,但是存在后期脱水较慢,不适合机械化收获;先玉335具有前期子粒灌浆速率快、后期子粒脱水快等特点。
1.2田间试验
试验材料于2011年5月上旬播种在河南农业大学科教园区,每个材料种植5行,密度为67 500株·hm-2。在苗期选取生长一致,具有代表性的单株挂牌,在散粉后0,15,25,35,40,45 d分别取穗三叶的中部叶片,液氮速冻保存;同时在授粉后0,15,25,35,40和45 d取玉米果穗,带回实验室后置于冰上剥取种胚,液氮速冻后保存在-80 ℃冰箱中备用。
其中先玉335及其亲本PH4CV和PH6WC的开花期为2011-07-01,07-06和07-08,授粉日期为2011-07-04,07-08和07-09;郑单958及其亲本郑58和昌7-2开花期为2011-07-05,07-08和07-08,授粉日期为2011-07-07,07-09和07-09。
1.3RNA提取和cDNA合成
采用Trizol RNA提取试剂盒分别提取叶片和种胚中的总RNA,试剂盒购自北京康为世纪生物工程有限公司。RNA提取所用研钵、枪头等均用1‰的DEPC水过夜浸泡,高温灭菌烘干后备用。RNA的纯度用紫外分光光度计进行检测。RT-PCR反应体系如表1所示。反应程序为:37 ℃ 15 min(反转录反应),85 ℃ 5 s (酶失活反应);反应结束后所合成的c-DNA加10 μL的DEPC处理水,混匀后置于-20 ℃保存备用。

表1 RT-PCR反应体系Table 1 The amplification system of real time PCR
1.4实时荧光定量分析
通过NCBI检索,结合已有文献研究结果[7-10],筛选出7个叶片与种胚衰老相关的基因。依据其cDNA序列和引物设计原则,设计荧光定量PCR引物,基因查询号、引物序列和扩增产物大小(表2)。荧光定量分析引物由上海生物工程有限公司合成。
实时荧光定量PCR使用伯乐公司的iQTM5多重实时荧光定量PCR仪,以玉米的Actin基因作为内参基因,每个反应包括10 μL 2×SYBR Green I,上游和下游引物各250 nmol,50 ng cDNA,最后加ddH2O补充至20 μL。PCR反应程序为:95 ℃ 1 min;40个循环的95 ℃ 15 s ,60 ℃ 1 min;接着从60 ℃升到95 ℃,进行融解曲线的设置。将模板稀释成一系列浓度梯度后做标准曲线,计算出扩增效率,并优化反应体系,使扩增效率为90%~105%。使用相对定量法进行基因的表达差异分析,试验设计和数据分析使用2-△△Ct法,用Microsoft Excel进行数据处理。

表2 实时定量PCR引物序列Table 2 The primer sequences used in real time RT-PCR
2 结果与分析
2.1总RNA的质量检测与PCR扩增
提取RNA样品后,利用1%的琼脂糖凝胶电泳对RNA质量进行检测,结果见图1。从图1可以清晰地看到3条28 S,18 S 以及5 S rRNA主带,说明RNA质量完整性好。
根据已知序列设计的内参基因Actin和7个目的基因引物,通过常规PCR扩增检测引物的质量和扩增产物的片段大小。荧光定量PCR预试验结果显示,各材料融解曲线图上主峰单一(图2),引物设计符合定量PCR要求。

注:M,DNA 2000标记;A~F依次为授粉0 d时郑单958、郑58、昌7-2、先玉335、PH4CV、PH6WC的总RNA,各2个重复;CK为对照。Note: M,DNA 2000 marker;A~F were total RNA Zhengdan 958, Zheng 58, Chang 7-2, Xianyu 335, PH4CV, PH6WC; each had 2 repetitions; CK was control.

图2 部分荧光定量RT-PCR的熔解曲线图Fig. 2 The melting-curve representative of the amplified product partial
2.2叶片持绿性基因SGR1和SGR2的表达分析
SGR1基因在杂交种先玉335及其双亲穗三叶中的表达呈现出相似的规律性,即在授粉开始至授粉后10 d,该基因表达量较低,10 d后开始逐渐升高,到20 d时达到一个小的表达高峰,随后降低,至30 d达到授粉后10 d的表达水平,30 d后目标基因的表达量一直上升,至45 d达到最高峰(图3)。总体而言,先玉335在各自时期的表达量均高于2个亲本,而自交系PH4CV的表达量则高于PH6WC。
SGR1基因在郑单958及其2个亲本穗三叶中的表达趋势基本一致,即随着授粉时间的增加,SGR1基因表达量整体呈现上升趋势,在30 d后出现了迅速增长。授粉后30 d郑单958穗三叶中SGR1的表达量显著高于2个亲本。对2个亲本而言,郑58的穗三叶在授粉后不同时期目标基因的表达量均表现出缓慢增长趋势,但是,自交系昌7-2中目标基因在穗三叶中的表达模式则存在一定的差异(图4)。

注:A:穗上叶;B穗位叶;C穗下叶。下同。Note:A, Maize leaf upper the ear; B, Maize leaf on the ear; C, Maize leaf under the ear. The same as below

图4 郑单958及其亲本穗三叶SGR1的表达模式Fig. 4 The expression pattern of SGR1 in the three leaves of ear in the hybrid Zhengdan 958 and its two parents
SGR2基因在先玉335及其2个亲本的穗三叶不同发育时期的表达模式基本一致,即从授粉后开始升高,到20 d达到一个高峰,然后开始降低,到30 d时与授粉开始时的表达量基本相同,随后开始升高,至45 d达到最高峰。这种表达规律与SGR1的表达模式类似。
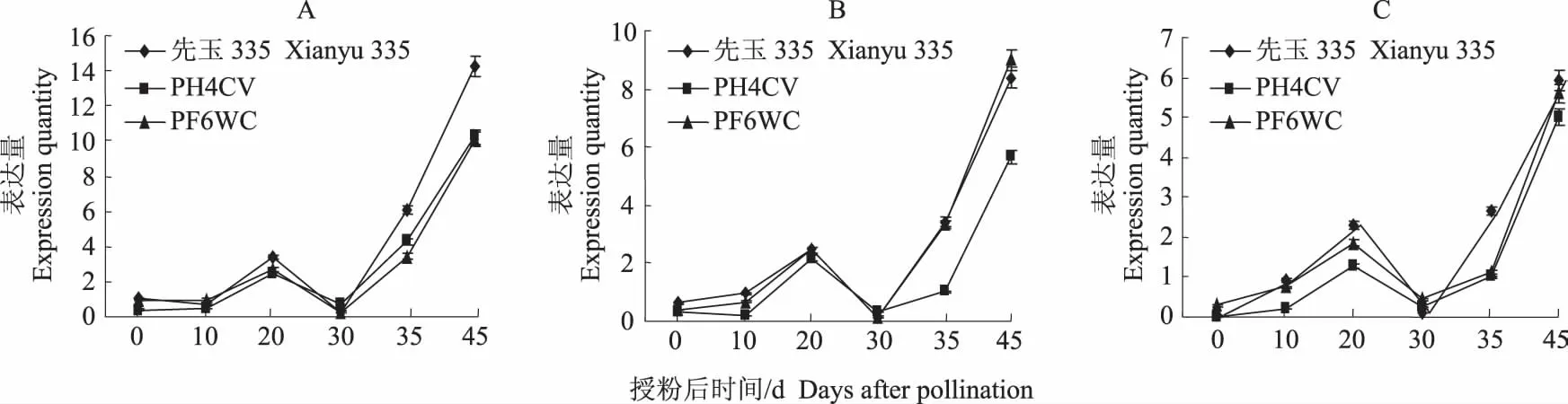
图5 先玉335及其亲本穗三叶SGR2的表达模式
SGR2基因在自交系郑58和昌7-2中的表达模式基本相同,即从授粉开始到45 d一直保持持续增加的趋势,到45 d达到高峰,同时该基因在昌7-2穗三叶不同时期的表达量均高于郑58。SGR2基因在杂交种郑单958穗三叶不同时期中表现出逐渐增加的趋势,但是在穗上叶和穗下叶授粉30 d后急剧增加,并超过了2个亲本;而郑单958穗位叶在授粉35 d的表达量上升幅度开始增加,但是其表达量一直低于亲本昌7-2的表达水平。

图6 郑单958及其亲本穗三叶SGR2的表达模式Fig. 6 The expression pattern of SGR2 in the three leaves of ear in hybrid Zhengdan 958 and its two parents
此外,为明确SGR1和SGR2在先玉335和郑单958不同时期的表达量差异,对目标基因在2个杂交种的相同穗位叶中表达量进行了比较。结果发现,先玉335的2个持绿性基因在所有时期的表达量均高于郑单958,尤其是在生育后期,2个材料间的差异较为显著(图7)。由此可见,SGR1和SGR2两个基因的表达与玉米材料衰老调控存在一定的相关性,其具体的调控机制需进一步研究。

图7 2个杂交种穗三叶不同时期SGR1(A)与SGR2(B)表达模式比较分析Fig. 7 The analysis of expression for SGR1(A)and SGR2(B) in the ear three leaves at the different time of two hybrids
2.3叶片蛋白降解酶基因表达分析
蛋白质和脂质等大分子物质的降解是衰老的代谢过程的重要部分。本研究对衰老相关的蛋白酶基因SAP1和SAP1表达模式进行了分析。SAP1基因在2个杂交种及其亲本材料的表达模式一致,其表达量随生育期推进而上升,说明该基因在叶片衰老过程中可能参与蛋白质降解过程的调节(图8)。该基因在2个杂交种及其亲本中的表达量也存在一定的差异,即在杂交种先玉335及其亲本穗三叶后期中的表达量要显著高于郑单958及其亲本,从而在基因表达水平上证明了先玉335后期脱水速率高于郑单958的原因。
SAP2基因在2个杂交种及其亲本穗三叶不同时期的表达模式如图9所示。该蛋白酶在不同材料的穗三叶中从授粉开始至20 d呈增加趋势,随生育期延长其表达量逐渐降低。说明该基因是主要在灌浆的高峰期表达,在后期的表达量较低,可能负调控叶片的衰老。
2.4玉米种胚衰老相关SAG基因的表达分析
收获时子粒含水量的高低是制约玉米机收子粒的一个限制因子。试验选择玉米种胚相关衰老相关的3个SAG基因,对其在2个杂交种及其亲本不同发育时期的表达规律进行了分析(图10)。由图10可以看出,SAG1基因在2个杂交种及其亲本不同发育时期种胚均表现出逐渐降低的趋势,至种子成熟时达到最低,在总体水平上,2个杂交种种胚中的表达量要低于双亲,说明该基因表现出负的超亲优势。而SAG2和SAG3在2个杂交种及其亲本中的表达量总体表现出逐渐升高的趋势,至成熟达到最高值,但是在2个杂交种及其相应亲本中的表达则存在一定的差异,如SAG2基因在杂交种先玉335授粉后10 d种胚的表达量开始高于双亲,而在郑单958的整个生育期中的表达量则居于2个亲本之间,同时先玉335在生育后期的表达量要明显高于郑单958,说明该基因可能与种子的成熟脱水有关(图11)。同样,SAG3基因在先玉335各个时期的表达量均高于2个亲本,而郑单958在授粉后35 d的表达量才超过双亲,且在生育后期先玉335的表达量要显著高于郑单958,说明该基因可能同样与子粒的成熟脱水有关(图12)。

图8 SAP1在2个杂交种不同穗位叶的表达模式Fig. 8 The expression pattern of SAP1 in the three leaves of ear in the two hybrids and its two parents

图9 SAP2在2个杂交种不同穗位叶的表达模式Fig. 9 The expression pattern of SAP2 in the three leaves of ear in the two hybrids and its two parents

图10 SAG1在2个杂交种不同时期胚中的表达模式Fig. 10 The expression pattern of SAG1 in the different development stage of embryo in the two hybrids and its two parents

图11 SAG2在2个杂交种不同时期胚中的表达模式Fig. 11 The expression pattern of SAG2 in the different development stage of embryo in the two hybrids and its two parents

图12 SAG3在2个杂交种不同时期胚中的表达模式Fig. 12 The expression pattern of SAG3 in the different development stage of embryo in the two hybrids and its two parents
3 结论与讨论
作为作物叶片生长发育的最后一个阶段,叶片的衰老过程中细胞结构完整性逐渐消失,而光合作用所积累干物质从衰老叶片逐步转移至种子等库器官中[11]。该过程涉及到作物产量形成的关键环节,在一定程度上影响着农作物产量,因此,延缓作物叶片的衰老以及延长叶片光合作用功能期能够显著增加作物的光合作用效率和光合产物的合成,从而提高作物的产量[12-13]。
叶片由绿转黄是衰老最显著的一个形态特征,其根本原因是叶绿素的降解。叶片中叶绿素的降解导致功能叶的叶面积减少,降低作物的光合效率,从而影响作物产量。研究表明,衰老是一个受多个基因控制的数量性状,在水稻[14-16]、小麦[17]、高粱[18-19]等作物中已定位到与多个衰老相关的候选基因位点,如 XU等[18]在高粱的RIL群体中定位到4个持绿性状QTL位点。据统计,在44个物种中已发现有5 357个基因与叶片衰老有关,其中拟南芥中有3 747个,玉米94个,小麦132个,水稻321个[20]。为深入了解玉米叶片衰老相关基因的表达模式,本研究对叶片衰老相关基因在2个杂交种及其亲本生育后期的动态表达趋势进行了分析,发现叶片2个持绿性基因SGR1和SGR2在2个杂交种中的表达量随生育期的推进而增加,推测在叶片衰老过程中,玉米自身通过调控持绿基因的表达来协调衰老进程。SGR基因是调控植物叶片细胞中叶绿素降解的关键。在拟南芥[21]、水稻[22]、大豆[23]等植物中鉴定到SGR基因的表达。拟南芥中SGR1通过与叶绿体降解酶(CCEs)以及捕光色素复合体结合调控叶片衰老的过程[24]。已研究表明,在转基因拟南芥和水稻材料中,过表达SGR可以通过调控叶绿素的降解抑制叶片衰老[8]。黑暗以及非生物胁迫条件下,拟南芥SRG2过表达系植株叶片衰老被抑制,而其突变株系叶片有黄化现象[25]。在叶片衰老过程中,SAP基因被诱导表达,该基因编码衰老调控相关的蛋白激酶基因,其中SAP2编码一个玉米磷脂蛋白激酶;Western 杂交结果表明,该蛋白激酶在衰老叶片中积累,并且与低温诱导的叶片衰老有关。本研究发现,在先玉335和郑单958及其亲本中,SAP1上调表达参与叶片衰老的调控,而SAP2蛋白酶在散粉后30 d达到表达量高峰后开始下降,可推测该基因是在衰老的前期表达,通过转录、翻译水平调控等途径实现对衰老的调节。
本研究对种胚3个衰老相关基因的表达模式进行了分析,发现SAG2和SAG3的表达量与生育期呈正相关,且在杂交种先玉335的后期表达量要显著高于郑单958。前人研究结果表明,SAG2和SAG3编码具有WRKY功能域的转录因子[26],且大部分WRKY转录因子家族成员参与植物衰老调控。拟南芥的WRKY57转录因子参与调控了植物激素GA和生长素所介导的植物叶片衰老信号途径之间的交叉调控通路,并发挥重要的调控功能[27],染色质免疫共沉淀试验证实,WRKY57蛋白可以直接结合到衰老相关基因SAG12和SEN4的启动子上,并抑制它们的转录水平。拟南芥WRKY转录因子家族成员中AtWRKY4,6,11和53受衰老诱导表达[28],WRKY6能特异结合衰老诱导的SINK激酶W-box结构域,进而调节植物的衰老进程。
在玉米育种过程中,通过遗传改良延缓玉米叶片的衰老期,增加功能叶的寿命对玉米的增产以及品质改良意义重大。本研究在已有研究基础上,对衰老相关基因在2个优良玉米杂交种先玉335和郑单953及其亲本自交系中的表达模式进行了分析,该研究将为玉米衰老相关基因的克隆及遗传机制分析提供一定的理论依据。
[1] LEE I C, HONG S W, WHANG S S, et al. Age-dependent action of an ABA-inducible receptor kinase, RPK1, as a positive regulator of senescence inArabidopsisleaves [J]. Plant Cell Physiol, 2011, 52(4): 651-662.
[2] GREGERSEN P L, HOLM P B, KRUPINSKA K. Leaf senescence and nutrient remobilisation in barley and wheat[J]. Plant Biol, 2008, 10(1): 37-49.
[3] DENG L C, QIN P, LIU Z, et al. Characterization and fine-mapping of a novel premature leaf senescence mutant yellow leaf and dwarf 1 in rice[J]. Plant Physiol Biochem, 2016, 111: 50-58.
[4] BARAKAT M N, SALEH M, AL-DOSS A A, et al. Identification of new SSR markers linked to leaf chlorophyll content, flag leaf senescence and cell membrane stability traits in wheat under water stressed condition[J]. Acta Biol Hung, 2015, 66(1): 93-102.
[5] WU X Y, KUAI B K, JIA J Z, et al. Regulation of leaf senescence and crop genetic improvement [J]. J Integr Plant Biol, 2012, 54(12): 936-952.
[6] GAN S, AMASINO R M. Making sense of senescence: molecular genetic regulation and manipulation of leaf senescence [J]. Plant Physiol, 1997, 113(2): 313-319.[7] ALEXANDROV N N, BROVER V V, FREIDIN S, et al. Insights into corn genes derived from large-scale cDNA sequencing[J]. Plant Mol Biol, 2009, 69(1/2): 179-194.
[8] PARK S Y, YU J W, PARK J S, et al. The senescence-induced staygreen protein regulates chlorophyll degradation[J]. Plant Cell, 2007, 19(5): 1649-1664.
[9] YANDEAU-NELSON, GUILTINAN M J. Starch-branching enzyme IIa is required for proper diurnal cycling of starch in leaves of maize[J]. Plant Physiology, 2011, 156(2): 479-490.
[10] SODERLUND C, DESCOUR A, KUDRNA D. Sequencing, mapping, and analysis of 27 455 maize full-length cDNAs[J]. PLoS Genet, 2009, 5(11): e1000740.
[11] 王树凤,郑春明,徐礼根. 植物衰老的分子机制及其调控[J]. 草业与畜牧, 2000(4):10-13. [12] LONG S P, ZHU X G, NAIDU S L, et al. Can improvement in photosynthesis increase crop yields[J]. Plant, Cell and Environment, 2006, 29(3): 315-330. [13] ZHANG H. Quantitative trait loci associated with functional stay-green SNU-SG1 in rice[J]. Mol Cells, 2007, 24(1): 83-94.
[14] JIANG G H, HE Y C, LI X H, et al. The genetic basis of stay-green in rice analyzed in a population of doubled haploid lines derived from an indica by japonica cross[J]. Theor Appl Genet, 2004, 108(4): 688-698.
[15] 薛大伟, 郭龙彪, 曾龙军, 等. 水稻叶片保绿相关性状的QTL分析[J]. 作物学报, 2007, 33(2): 389-393.
[16] SHIRDEMOGHANLOO H, TAYLOR J D, LOHRASEB I, et al. A QTL on the short arm of wheat (TriticumaestivumL.) chromosome 3B affects the stability of grain weight in plants exposed to a brief heat shock early in grain filling[J]. BMC Plant Biol, 2016, 16: 100. [17] XU W, SUBUDHI P K, CRASTA O R, et al. Molecular mapping of QTLs conferring stay-green in grainsorghum (Sorghumbicolor(L.) Moench) [J]. Genome, 2000, 43(3): 461-469.
[18] SANCHEZ A C, SUBUDHI P K, ROSENOW D T, et al. Mapping QTLs associated with drought resistance in sorghum (Sorghumbicolor(L.) Moench)[J]. Plant Mol Biol, 2002, 48(5/6): 713-726.
[19] LI Z, ZHAO Y, PENG J, et al. LSD 2.0: an update of the leaf senescence database[J]. Nucleic Acids Res, 2014, 42: 1200-1205. [20] BERBERICH T, SANO H, KUSANO T. Involvement of a MAP kinase, ZmMPK5, in senescence and recovery from low-temperature stress in maize[J]. Mol Gen Genet, 1999, 262(3): 534-542. [21] REN G, AN K, LIAO Y, et al. Identification of a novel chloroplast protein AtNYE1 regulating chlorophyll degradation during leaf senescence inArabidopsis[J]. Plant Physiol, 2007, 144: 1429-1441. [22] PARK S Y, YU J W, PARK J S, et al. The senescence-induced staygreen protein regulates chlorophyll degradation[J]. Plant Cell, 2007, 19: 1649-1664. [23] FANG C, LI C, LI W, et al. Concerted evolution of D1 and D2 to regulate chlorophyll degradation in soybean[J]. Plant J,2014, 77:700-712. [24] SAKURABA Y, SCHELBERT S, PARK S Y, et al. STAY-GREEN and chlorophyll catabolic enzymes inte-ract at light-harvesting complex II for chlorophyll detoxification during leaf senescence inArabidopsis[J]. Plant Cell, 2012, 24(2): 507-518. [25] SAKURABA Y, PARK S Y, KIM Y S, et al.ArabidopsisSTAY-GREEN2 is a negative regulator of chlorophyll degradation during leaf senescence[J]. Mol Plant, 2014, 7(8): 1288-1302. [26] 陈锋,韩成云,任春梅. 植物WRKY转录因子的分子生物学功能[J]. 湖南农业科学, 2010(19): 30-33. [27] JIANG Y, LIANG G, YANG S, et al.ArabidopsisWRKY57 functions as a node of convergence for jasmonic acid- and auxin-mediated signaling in jasmonic acid-induced leaf senescence[J]. Plant Cell, 2014, 26(1): 230-245. [28] ROBATZEK S, SOMSSICH I E. A new member of theArabidopsisWRKY transcription factor family, atWRKY6, is associated with both senescence and defence-related processes[J]. Plant J, 2001, 28(2): 123-133.
(责任编辑:常思敏)
Expressionanalysisofsenescence-associatedgenesinmaizeintwodifferenthybridsanditsparentlines
SUN Gaoyang1, WU Xiangyuan2, YE Linlin1, MENG Shuhjun1, YAN Pengshuai1, TANG Jihua1, GUO Zhanyong1
(1.College of Agronomy, Henan Agricultural University, Zhengzhou 450002,China; 2. College of Life Science and Technology, Henan Institute of Science and Technology, Xinxiang 453003,China)
Maize hybrid Xianyu 335 and Zhengdan 958 as well as its parent lines were employed to analyze the expression pattern of senescence related gene in the development of leaves and embyro. The results showed that two stay-green genesSGR1 andSGR2 were up regulated in hybrid Xianyu 335 and Zhengdan 958 together with its parent lines with age, and the gene expression level in Xianyu 335 was higher than that in Zhengdan 958. Senescence associated geneSAP1 was up expressed in the leaves development process, and the expression ofSAP2 was increased first and then decreased with the leaves development stages. Three embyro senescence associated genes,SAG1,SAG2 andSAG3, were analyzed in different growth period, and the results showed thatSAG1 was down regulated after fertilization, whileSAG2 andSAG3 were up-regulated.
maize; senescence; stay-green; gene expression
S 513
:A
2016-12-10
省部共建小麦玉米作物学国家重点实验室资助项目(SKL2014ZH-09)
孙高阳(1990-),男,河南汝州人,硕士研究生,主要从事玉米遗传育种研究。
郭战勇(1974-),男,河南郑州人,讲师,博士。
1000-2340(2017)02-0140-09

