从雌激素受体探讨解毒祛瘀滋阴药对SLE的治疗机制*
王大维 汪梅姣 谷焕鹏 温成平
(浙江中医药大学基础医学院,浙江 杭州 310053)
·研究报告·
从雌激素受体探讨解毒祛瘀滋阴药对SLE的治疗机制*
王大维 汪梅姣 谷焕鹏 温成平△
(浙江中医药大学基础医学院,浙江 杭州 310053)
目的 观察解毒祛瘀滋阴药含药血清对雌激素受体α和β及其相关通路的调节作用,从而探讨解毒祛瘀滋阴药治疗系统性红斑狼疮(SLE)的机制。方法 CCK-8法检测研究解毒祛瘀滋阴药含药血清对MCF-7细胞增殖的影响;以FITC-Annexin V/PI双染法流式细胞术检测10%解毒祛瘀滋阴药含药血清诱导MCF-7细胞的凋亡率;Realtime-PCR法检测ERα和PI3KmRNA的表达;Western blot法检测雌激素受体相关信号通路蛋白ERα、p-ERα、ERβ、ERK、p-ERK的表达。结果 10%和15%的解毒祛瘀滋阴药含药血清与空白血清相比均能较轻的抑制MCF-7细胞的增殖 (P<0.01)。与空白血清相比,10%的解毒祛瘀滋阴药含药血清:使MCF-7细胞的早期凋亡较多;使ERα和PI3K的mRNA相对表达量明显降低(P<0.05或P<0.01);使ERα的蛋白表达和磷酸化水平降低;使ERβ的蛋白表达水平升高;使ERK的蛋白表达和磷酸化水平降低。结论下调ERα的表达和其磷酸化水平,促进ERβ的表达,下调ERK及其磷酸化进而影响MAPK/ERK信号通路也许是解毒祛瘀滋阴药治疗SLE的部分机制。
解毒祛瘀滋阴药 雌激素受体 信号通路 系统性红斑狼疮
系统性红斑狼疮(SLE)是一种典型的自身免疫性结缔组织病,可累及全身各个系统。SLE病情易迁延反复,严重危害着患者的生活质量,且发病率呈逐年上升的趋势,尤其好发于育龄期女性,患者男女比例约为1∶7~9[1]。SLE 病因复杂,除了遗传因素、环境因素之外,雌激素被认为是影响SLE发生发展的重要因素之一[2-3]。妊娠期患者病情明显加重,而绝经后的患者病情有不同程度的缓解[4]。众多临床研究证明雌激素从不同环节影响着SLE。本课题组长期以来的临床研究发现解毒祛瘀滋阴药对SLE的疗效明显,并且发现其对雌激素有调节作用[5]。因此本文从雌激素受体的调节来探讨其治疗SLE的机制。由于外周血中提取的T、B细胞培养过程中死亡速度较快,导致检测指标不稳定,难以明确数据波动原因,MCF-7细胞既表达雌激素受体α(ERα),又表达雌激素受体 β(ERβ),是研究雌激素受体(ER)相关通路的良好模型。于是本课题组选取表达雌激素受体的人乳腺癌MCF-7细胞作为载体,并加雌激素模拟体内环境,以含解毒祛瘀滋阴药的大鼠血清为主要干预因素进行研究。现报告如下。
1 材料与方法
1.1 实验细胞和动物 人乳腺癌MCF-7细胞购于中国科学院上海细胞库。培养条件:含胎牛血清(FBS)10%的DMEM高糖培养基(青霉素1×105U/L、链霉素100 mg/L),饱和湿度、37 ℃、5%CO2。 培养基一般隔天更换。当细胞汇合约90%时传代。选取对数生长期细胞进行实验。Wistar大鼠,购于浙江中医药大学实验动物中心。
1.2 试药与仪器 解毒祛瘀滋阴方生药购于浙江中医药大学中药饮片厂;DMEM高糖培养基、PBS、0.25%Trypsin均购自于吉诺生物医药技术有限公司;胎牛血清,美国 GEMINI公司;17β-雌二醇(E2),Sigma-Aldrich;CCK-8试剂盒,碧云天生物技术研究所;逆转录试剂盒,宝生物工程(大连)有限公司;Realtime-PCR试剂盒,美国BIO-RAD公司;ERα抗体、p-ERα抗体(phospho S106)、ERβ 抗体 (ab92306)、Akt抗体、ERK 抗体、p-ERK1(pT202/pY204)/ERK2(pT185/pY187)抗体,均购自于英国Abcam公司;引物设计与合成,生工生物工程(上海)股份有限公司。荧光倒置显微镜,Olympus;CO2培养箱,Thermo Scientific;超净工作台,苏州安泰空气技术有限公司;Scientific Varioskan flash多功能酶标仪,Thermo;Realtime-PCR 仪,BIO-RAD; 槽式转印系统,BIO-RAD;双通道红外扫膜仪(Odyssey),Licon。1.3 含药血清的制备 解毒祛瘀滋阴方1剂以单蒸水800 mL煎煮1 h,共煎2次,将2次的中药水煎剂混合后,再以R202型旋转蒸发器将中药水煎剂浓缩成4 g/mL。取20只Wistar大鼠,随机分为空白组和中药组,每组10只。中药组按人等效剂量的16倍生药剂量灌胃解毒祛瘀滋阴方水煎剂;空白组以同等体积的生理盐水灌胃。每日1次,前6 d灌胃期间正常饲养。第7日灌胃前禁食12 h(自由饮水),灌胃1 h后心脏采血。血液室温静置45 min,3000 r/min离心30 min。吸取上清,同组上清合并,并于56℃水浴30 min灭活。于超净工作台内以0.22 μm孔径滤膜过滤除菌,分装,得到空白血清和含药血清,-80℃保存。
1.4 CCK-8法检测细胞增殖 取对数生长期细胞,以5000/孔接种于96孔板,每孔液体总量为100 μL。接种12 h后分组用药。1)空白组:100 μL DMEM高糖培养基(含10%FBS),不含细胞和药物。2)空白对照组:正常培养的人乳腺癌MCF-7细胞;3)空白血清组:正常培养的人乳腺癌MCF-7细胞加10%(体积比)的空白血清;4)10%含药血清组:正常培养的人乳腺癌MCF-7细胞加10%的含药血清。5)15%含药血清组:正常培养的人乳腺癌MCF-7细胞加15%的含药血清。各组均加E2:300 pg/mL,并设3个复孔。用药干预24 h后,每孔加10 μL的CCK-8,继续培养1 h。摇床低速摇10 min,用酶标仪以450 nm检测各孔吸光度值(A450)。实验重复3次。细胞存活率的计算:细胞存活率(%)=(实验组 A450 均值-空白组 A450 均值)/(空白对照组A450均值-空白组A450均值)×100%
1.5 流式细胞术检测MCF-7细胞的凋亡 取对数生长期细胞,以1×105/mL种于六孔板,培养12 h后按实验分组用药,分别为空白对照组,含10%FBS的DMEM高糖培养基;空白血清组,含10%空白血清的DMEM高糖培养基;含药血清组,10%含药血清的DMEM高糖培养基;各组均加E2:300 pg/mL。药物作用24 h后以不含EDTA的0.25%的胰蛋白酶消化,1000 r/min离心5 min,收集细胞。预冷的PBS漂洗细胞,离心弃上清,以 1×Binding Buffer 100 μL 重悬细胞。每管加入 5 μL FITC Annexin V,室温避光孵育10~15 min。上机前5 min每管加入 5 μL PI,而后 1×Binding Buffer 400 μL 混匀,上机检测。正常培养的MCF-7细胞分为3组:阴性对照组,即不加荧光染料的细胞;Annexin V-FITC组;Annexin V-PI组。
1.6 Realtime-PCR法检测ERα和PI3K的表达 取对数生长期细胞,以1×105/mL种于六孔板,培养12 h后分为3组,分组同前(同流式细胞术检测)。每组均加E2:300 pg/mL。每组3个复孔。继续培养24 h后以Trizol提取总RNA。按逆转录试剂盒说明书,选30 μL体系,加1.5 μg总RNA进行逆转录。逆转录条件为:37℃,15 min;85℃,5 s;4℃冷却;-20℃保存。PCR 引物如下,GAPDH,F:CTGCCAACGTGTCAGT。 R:GTTG AGGGCAATGCCA;ERα。F:AGATAATCGACGCCAGG GTG。 R:AGCATAGTCATTGCACACTGCAC。 PI3K,F:ATGGGGATGATTTACGGC。 R:TCTCCTTTGTTCTTGT CTTTGA。PCR反应体系20 μL,反应条件:预变性94 ℃,5 min;94 ℃,30 s;55 ℃,30 s;72 ℃,15 s; 扩增40个循环;72℃,10 min。溶解曲线条件:以60℃为初始温度,每隔30 s升高0.5℃,直到温度升至95℃。空白血清组和含药血清组的目的基因相对于正常组的表达量通过 2-△△Ct计算得出。△△Ct=(Ct目的基因-Ct内参基因)血清组-(Ct目的基因-Ct内参基因)空白对照组。
1.7 Western blot法检测雌激素受体相关蛋白的表达上述各组细胞以相应药物作用48 h后,以0.25%Trypsin消化,1000 r/min离心5 min收集细胞,以4℃预冷的PBS漂洗。而后每孔细胞(六孔板)用预冷的RIPA 200 μL (含 1%PMSF) 在冰上裂解 30 min,12000 r/min,4 ℃离心 15 min, 小心吸取上清 100 μL。Bradford法测各样本的蛋白浓度,以生理盐水调整使浓度一致。将各组样本以5×Loading buffer混匀,金属浴加热100℃10 min充分变性。10%SDS-PAGE凝胶电泳分离,电泳条件:60 V,约30 min;湿转法80 V,2 h,将凝胶中的蛋白转至NC膜;5%脱脂奶粉室温封闭2 h,TBST漂洗。 一抗孵育:4℃,12 h;漂洗后,荧光二抗室温避光孵育2 h;漂洗后以双通道红外扫膜仪扫描。
1.8 统计学处理 应用SPSS19.0和Excel2007统计软件。多组间比较采用单因素方差分析 (one-way anova)。 计量资料以(±s)表示,显著性检验水准为0.05(双侧)。P<0.05为差异有统计学意义。
2 结 果
2.1 解毒祛瘀滋阴药含药血清对人乳腺癌MCF-7细胞增殖的影响 见表1。CCK-8检测结果显示,与空白血清相比10%的含药血清和15%的含药血清均使人乳腺癌MCF-7细胞的增殖活性降低(P<0.01),差异有统计学意义。其中15%的含药血清虽然比10%的低,但二者相比差异无显著性(P>0.05),本实验目的是研究雌激素受体相关通路而不是增殖抑制,故后续实验中以10%的含药血清进行干预。
表1 解毒祛瘀滋阴药含药血清对人乳腺癌MCF-7细胞增殖的影响(s)

表1 解毒祛瘀滋阴药含药血清对人乳腺癌MCF-7细胞增殖的影响(s)
与对照组和空白血清组比较,**P<0.01。下同。
组 别 n OD值 存活率(%)空白对照组 3 0.436±0.001 100.00±0.23空白血清组 3 0.404±0.002 92.75±0.75 10%含药血清组 3 0.368±0.004** 84.58±1.17**15%含药血清组 3 0.358±0.006** 82.11±1.62**
2.2 解毒祛瘀滋阴药含药血清对MCF-7细胞凋亡的影响 见图1,表2。以FITC-Annexin V/PI双染法流式细胞术检测解毒祛瘀滋阴药含药血清对MCF-7细胞凋亡的影响,见图1。空白血清和含药血清都能诱导MCF-7细胞凋亡,含药血清组的总凋亡率最高。对FITC/PI双荧光参数散点图分析早期凋亡和晚期凋亡的分布结果见表2。与空白对照组和空白血清组相比,含药血清主要引起早期凋亡。

图1 FITC-Annexin V/PI双染法流式细胞术检测凋亡率
表2 流式细胞术检测各组细胞凋亡比例s)
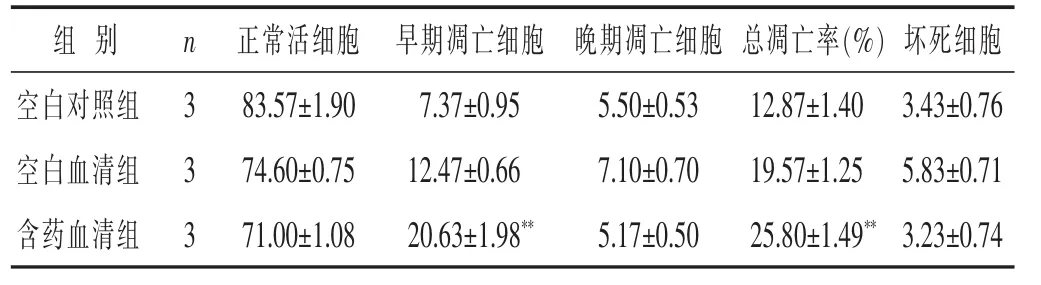
表2 流式细胞术检测各组细胞凋亡比例s)
组 别 n 正常活细胞 早期凋亡细胞 晚期凋亡细胞 总凋亡率(%)坏死细胞空白对照组 3空白血清组 3 83.57±1.90 7.37±0.95 5.50±0.53 74.60±0.75 12.47±0.66 7.10±0.70 12.87±1.40 3.43±0.76 19.57±1.25 5.83±0.71含药血清组 371.00±1.08 20.63±1.98** 5.17±0.5025.80±1.49**3.23±0.74
2.3 Realtime-PCR法检测解毒祛瘀滋阴药含药血清对ERα和PI3K表达的影响 见表3。以目的基因和GAPDH 的 Ct差值,采用双 DELT 法(2-△△Ct)计算实验组目的基因相对于空白对照组的表达量。与空白对照组相比,ERα的mRNA表达量在空白血清组和含药血清组均显著降低(P<0.01);PI3K的mRNA表达量,空白血清组升高(P>0.05),含药血清组表达明显降低(P<0.01)。含药血清组与空白血清组相比,ERα和PI3K的mRNA表达量均降低,且差异有统计学意义(P<0.05 或 P<0.01)。
表3 各组ERα和PI3KmRNA相对表达量比较s)

表3 各组ERα和PI3KmRNA相对表达量比较s)
与空白血清组比较,*P<0.05,**P<0.01;与空白对照组比较,△P<0.05,△△P<0.01。 下同。
组 别 n ERα PI3K空白对照组 3 1 1空白血清组 3 0.48±0.05△△ 1.32±0.17含药血清组 3 0.31±0.06△ 0.27±0.02△△
2.4 解毒祛瘀滋阴药含药血清对雌激素受体相关蛋白表达的影响 见图2,图3。对ERα、p-ERα、细胞外调节蛋白激酶(ERK)、磷酸化的细胞外调节蛋白激酶(p-ERK)、以及丝氨酸苏氨酸蛋白激酶(AKT)的影响,见图2。由图可知与空白对照组和空白血清组相比,10%的解毒祛瘀滋阴药含药血清干预MCF-7细胞24 h后,可以使ERα的蛋白表达和其磷酸化水平降低,使ERK的蛋白表达和其磷酸化水平明显降低,而对AKT的蛋白表达几乎没有影响。与空白血清组相比,含药血清可以使ERβ表达升高,见图3。

图 2 ERα、p-ERα、ERK、p-ERK、AKt蛋白的表达

图3 ERβ的蛋白表达
3 讨 论
有Meta分析认为雌激素与SLE的进展有明显的因果关系[6]。目前认为雌激素受体主要分为两种亚型:α型和β型,在生殖、呼吸、心血管以及骨骼等不同的组织或细胞中表达程度不同,生物学效应也不同[7]。它们不仅仅存在于细胞核也存在于细胞膜、细胞质以及线粒体。雌激素与受体结合后,通过与靶基因雌激素反应元件(ERE)的结合,激活或者抑制靶基因的调控区,实现对靶基因表达的调节,此途径称为雌激素受体作用机制的经典基因组途径,除此之外还有非经典的基因组途径和非基因组途径[8-9]。ERα和ERβ均形成同型或者异型二聚体而发挥作用。已有的研究表明,ERβ对ERα有抑制作用,而且会降低细胞对雌激素的敏感性[10]。 ERβ 的激活也会起到一定的抗炎作用[11]。ERα的活性升高会降低ERβ的稳定性[12]。在SLE的模型动物敲除ERα后蛋白尿和ds-DNA抗体明显降低[13]。似乎ERα/ERβ的比值升高不利于 SLE。但是当ERα不表达时,ERβ可替代ERα的部分作用,说明二者之间呈现的是此消彼长的关系,在某些情况下相互拮抗,有时又互相补充。
ER的快速效应被认为是通过细胞膜上雌激素受体(mER)的非基因组途径来实现的,E2与mER结合后可以活化MAPK信号通路以及磷脂酰肌醇3-激酶(PI3K)/AKT信号通路。后来Thomas研究表明ERβ1可以通过促进c-Cb-1对EGFR的降解而使ERK1/2失活[14]。ERK 属于丝裂原活化蛋白激酶(MAPK)家族,其中ERK1和ERK2目前研究的比较透彻。我们的研究结果表明解毒祛瘀滋阴药的含药血清可以使ERβ表达升高,而ERK和p-ERK的表达均降低。由Thomas的研究结果推断,滋阴药的含药血清使ERK和p-ERK的表达降低是也许由于促进了ERβ的表达而导致的。
MAPK信号通路在细胞的生长、分化、迁移、死亡等方面都起着重要的调节作用。MAPK的级联反应又可以使nER磷酸化,磷酸化的nER激活Pak1、PkA和AKT等[15]。所以雌激素受体的基因组途径和非基因组途径以及MAPK/ERK通路和PI3K/AKT通路之间存在着复杂的相互联系。
PI3K活化后产生第二信使PIP3,后者结合并活化AKT并可以使AKT转移到细胞膜上。活化的AKT磷酸化ERα的AF-1区中的丝氨酸残基,从而调节ERα。Sandra等研究发现PI3K的抑制剂LY294002可以使AKT、p-AKT下调,而且ERα总蛋白和p-ERα也下调[16]。这表明ERα和PI3K/AKT信号通路之间可以形成相互调节相互影响的环路。我们的实验结果显示,解毒祛瘀滋阴药含药血清使PI3K的mRNA和ERα蛋白以及p-ERα表达下调,这有可能对ERα-PI3K/AKT这一环路产生了影响。
综上所述,下调ERα的表达和其磷酸化水平,促进ERβ的表达,下调ERK及其磷酸化进而调节MAPK/ERK信号通路以及ERα-PI3K/AK环路,这也许是解毒祛瘀滋阴药治疗系统性红斑狼疮的部分机制。但是ERβ的调控机制目前仍然没有定论,对ERβ的认识仍然比较狭窄,还有待于深入研究。
[1]Tedeschi SK,Bermas B,Costenbader KH.Sexual disparities in the incidence and course of SLE and RA[J].Clinical Immunology,2013,149(2):211-218.
[2]Cohensolal JFG,Jeganathan V,Grimaldi CM,et al.Sex hormones and SLE:influencing the fate of au toreactive B cells[J].CurrentTopics in Microbiology&Immunology,2006,305(305):67-88.
[3]Incorvaia E,Sicouri L,Petersenmahrt SK,et al.Hormones and AID: balancing immunity and autoimmunity[J].Autoimmunity,2013,46(2):128-137.
[4]Phadungkiatwattana P,Sirivatanapa P,Tongsong T.Outcomes of pregnancies complicated by systemic lupus erythematosus(SLE)[J].Journal of the Medical Association of Thailand=Chotmaihet thangphaet,2007,90(10):1981-1985.
[5]温成平,范永升,唐晓颇,等.解毒祛瘀滋阴药对系统性红斑狼疮患者性激素水平的调节作用[J].中国中西医结合肾病杂志,2003,4(10):580-582.
[6]Rojasvillarraga A,Torresgonzalez JV,Ruizsternberg M.Safety of hormonal replacement therapy and oral contraceptives in systemic lupus erythematosus:a systematic review and metaanalysis[J].Plos One,2017,9(8):e104303.
[7]Patrone C,Cassel TN,Pettersson K,et al.Regulation of postnatal lung development and homeostasis by estrogen receptor β[J].Molecular&CellularBiology,2003,23(23):8542-8552.
[8]Zhang D,Trudeau VL.Integration of membrane and nuclear estrogen receptor signaling[J].Comparative Biochemistry&Physiology Part A Molecular&Integrative Physiology,2006,144(3):306-315.
[9]Acconcia F,Kumar R.Signaling regulation of genomic and nongenomic functions of estrogen receptors[J].Cancer Letters,2006,238(1):1-14.
[10]Ascenzi P,Bocedi A,Marino M.Structure-function relationship of estrogen receptor alpha and beta:impact on human health[J].Molecular Aspects of Medicine,2006,27(4):299.
[11]Harris HA.The unexpected science of estrogen receptor-beta selective agonists:a new class of anti-inflammatory agents[J].Nucl Recept Signal,2005(4):e012.
[12]Cheng L,Li J,Han Y,et al.PES1 promotes breast cancer by differentially regulating ERα and ERβ[J].Journal of Clinical Investigation,2012,122(8):2857.
[13]Bynoté KK,Hackenberg JM,Korach KS,et al.Estrogen receptor-alpha deficiency attenuates autoimmune disease in(NZBxNZW)F1mice[J].Genes&Immunity,2008,9(2):137.
[14]Thomas C,Rajapaksa G,Nikolos F,et al.ERβ1 represses basal-like breast cancer epithelial to mesenchymal transition by destabilizing EGFR[J].Breast Cancer Research,2012,14(6):R148.
[15]范宇,付丽.雌激素受体与乳腺癌[J].诊断病理学杂志,2007,14(2):81-85.
[16]Creighton CJ,Fu X,Hennessy BT,et al.Proteomic and transcriptomic profiling reveals a link between the PI3K pathway and lower estrogen-receptor (ER)levels and activity in ER+breast cancer[J].Breast Cancer Research,2010,12(3):R40.
Exploration on the Mechanism of Jiedu Quyu Ziyin Decoction on SLE from Estrogen Receptor
WANG
Dawei,WANG Meijiao,GU Huanpeng,et al. Basic Medical College of Zhejiang Chinese Medical University,Zhejiang,Hangzhou 310053,China.
Objective: To study the regulation of of Jiedu Quyu Ziyin Decoction (JQZR) on estrogen receptor α and β and their related pathways in the serum,and to explore the mechanism of JQZR on SLE.Methods: CCK-8 method was used to detect the proliferation of MCF-7 cells.The FITC-Annexin V/PI double staining method was used to detect the apoptosis rate of MCF-7 cells induced by medicated serum containing 10%JQZR.The expression of mRNA of ERα and PI3K was detected by Realtime-PCR.The expression of ERα,p-ERα,ERβ,ERK and p-ERK were detected by Western blot.Results:The proliferation of MCF-7 cells was significantly inhibited by 10%and 15%of JQZR Compared with the blank serum(P<0.01).Compared with the blank serum,medicated serum of 10%JQZR made MCF-7 cells more early apoptosis and mRNA expression of ERα and PI3K was significantly decreased (P<0.05 or P<0.01).The protein expression and phosphorylation levels of ERα decreased.Protein expression levels of ERβ increased and protein expression and phosphorylation levels of ERK decreased.Conclusion: Down-regulation of ERα expression and phosphorylation level,promotion of ERβ expression,downregulation of ERK and its phosphorylation and regulation of the signaling pathway of MAPK/ERK may be part of the mechanism of JQZR on SLE.
Jiedu Quyu Ziyin Decoction(JQZR);Estrogen receptor;Signaling pathway;Systemic lupus erythematosus(SLE)
R593.24+1
A
1004-745X(2017)09-1505-05
10.3969/j.issn.1004-745X.2017.09.001
2017-05-26)
国家自然科学基金项目(81373633);浙江中医药大学校级科研基金项目(2012ZY01)
△通信作者(电子邮箱:wengcp@163.com)

