化学合成及废物基锰氧化物对不同形态砷的去除转化机制
梁冠男, 廉新颖, 贾永锋, 杨 昱, 姜永海*, 孙晓玲
1.上海大学环境与化学工程学院, 上海 200444 2.中国环境科学研究院, 北京 100012
化学合成及废物基锰氧化物对不同形态砷的去除转化机制
梁冠男1,2, 廉新颖2, 贾永锋2, 杨 昱2, 姜永海2*, 孙晓玲1,2
1.上海大学环境与化学工程学院, 上海 200444 2.中国环境科学研究院, 北京 100012
为探究不同类型锰氧化物与As(砷)的交互作用,采用沈阳某饮用水处理厂除锰滤池运行周期结束后产生的废料(滤料和管道沉淀物)和化学合成水羟锰矿、酸性水钠锰矿作为不同类型的锰氧化物,研究化学合成及废物基锰氧化物对不同形态As的去除转化机制. 结果表明: 锰氧化物的投加量为0.20 g时,管道沉淀物对As(Ⅴ)的吸附量为90 μg,远小于水羟锰矿、酸性水钠锰矿和滤料的191、192、176 μg吸附量,而且管道沉淀物2 h内不能够完全氧化溶液中As(Ⅲ). 四种锰氧化物对As的吸附都更符合准二级动力学方程,说明去除过程是一个快速吸附和慢速吸附相互叠加的过程,包含外部液膜扩散、表面吸附和颗粒内扩散等. 水羟锰矿、酸性水钠锰矿和滤料有较好锰氧化物晶型,管道沉淀中SiO2是主要晶型,滤料晶型和酸性水钠锰矿一致,但是形貌结构却差别很大. 四种锰氧化物的Mn平均氧化度较高,分别为3.90、3.89、3.84和3.71. 研究显示,滤料作为废物基材料可以替代化学合成的水羟锰矿、酸性水钠锰矿实现对水体中As的去除,达到废物材料的再利用及含As水体修复的协同处置.
锰氧化物; As污染; 形态转化; 吸附
Abstract: In order to explore the interaction between different types of manganese oxides and arsenic, waste manganese oxides (filter and pipeline sediment) produced in a drinking water treatment plant in Shengyang and the chemically synthesized vernadite and birnessite were regarded as different types of manganese oxides to study As removal mechanism. The results showed that the pipeline sediment adsorption capacity of As(V) was 90 μg under 0.20 g dosage, which was much smaller than that of vernadite (191 μg), birnessite (192 μg) and filter (176 μg). As(III) in solution could not be completely oxidized by pipeline sediment in 2 h. The adsorption of As for the four kinds of manganese oxides was more consistent with the pseudo-second order kinetic model, indicating that the removal process was a complex process of rapid adsorption and slow adsorption, including external liquid film diffusion, surface adsorption and particle diffusion. The crystal form of manganese oxides in vernadite, birnessite and filter were preferable, and SiO2was the primary crystal form in the pipeline precipitation. The crystal form of filter was in perfect accordance with birnessite, but the morphologies were very different. The average oxidation degree of Mn in the four manganese oxides was 3.90, 3.89, 3.84 and 3.71, respectively. Studies have shown that the filter as a waste-based material can replace the chemically-synthesized vernadite and birnessite for removing As in water system to achieve the goal of co-processing waste materials and As remediation.
Keywords: manganese oxides; arsenic; species transformation; adsorption
As(砷)是一种毒性很高的原生质毒物,在环境污染物中砷是最毒的元素之一,位居污染有毒元素黑名单之首[1- 2],长期暴露于As污染会导致人体器官发生癌变[3- 4]. 1993年,世界卫生组织(WHO)规定饮用水中ρ(As)的限值为10 μg/L. As在环境中存在四种主要价态(-3,0,+3,+5),在土壤和水体中主要为As(Ⅴ)〔无机砷酸盐,H3AsO4〕和As(Ⅲ)〔亚砷酸盐,H3AsO3〕[5- 7]. As(Ⅴ)可以稳定地存在于有氧的环境,而As(Ⅲ)经常存在缺氧的还原性环境,如地下水[8],但是As(Ⅲ)的毒性和移动性都要大于As(Ⅴ)[9].
虽然我国饮水中ρ(As)不高,但致癌风险不容忽略,仍需要研究更加有效可行的方法削减ρ(As),保障人们的饮水安全[10]. 目前地下水中As的去除方法主要包括吸附法(AD)、混凝/沉淀法(CPC)、离子交换法(IE)和膜处理(MT)等[11- 16]. 由于应用简单、经济高效,吸附法的运用最为广泛[17- 18]. 吸附法一般对As(Ⅴ)去除高效,而对As(Ⅲ)的去除效果不太理想,所以将As(Ⅲ)转化成As(Ⅴ)的预处理过程必不可少[19]. 锰氧化物是广泛存在于自然环境界的一种活性氧化物,具有强的氧化和吸附重金属的能力[20]. 研究发现,锰氧化物可以在多种环境条件下氧化Cr(Ⅲ)[21],并且对Zn(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Ni(Ⅱ)等重金属离子有较强的吸附作用[22- 24].
锰氧化物不仅能够吸附As(Ⅴ),还具有氧化As(Ⅲ)的能力,节省了As(Ⅲ)形态转化的预处理过程,因此可以作为修复水体中砷污染的绝佳修复材料[25]. 该研究采用比较常见的两种锰氧化物——水羟锰矿和酸性水钠锰矿以及自来水厂除锰滤池运行周期结束后产生的废料滤池中的滤料(以下简称滤料)和滤池管道中沉淀物物(以下简称管道沉淀物)作为四种不同类型的锰氧化物材料,对比研究对As(Ⅲ)/As(Ⅴ)的去除转化机制,讨论废物基滤料和管道沉淀物用于除砷的可能,以期为As污染水体修复提供经济高效的方法.
1 材料与方法
1.1 材料
NaAsO2(亚砷酸钠)、Na3AsO4(砷酸三钠)、MnCl2·4H2O、HCl、NaOH、NaCl、KMnO4均为分析纯,所有的溶液都使用去离子水(电阻率<18.3 MΩ)配制. 滤料和管道沉淀物来源于沈阳某自来水厂除锰滤池. 滤料为水厂除锰滤池运行周期结束后的废料,管道沉淀物是除锰滤池进出水管道里的黑色沉淀物,均经过真空干燥后过100目(0.149 mm)筛备用.
采用XRD(X射线衍射仪)对化学合成的氧化锰、滤料以及管道沉淀物进行结构晶型分析;采用SEM(扫描电镜)进行表面形貌分析;采用EDX(能谱仪)进行元素分析;采用XPS(X射线光电子能谱)进行材料中Mn的价态分析.
1.2 水羟锰矿和酸性水钠锰矿的制备
水羟锰矿[26]:75.14 g MnCl2·4H2O溶于1 280 mL去离子水,记为A;40.00 g KMnO4溶于1 280 mL去离子水,记为B;28.00 g NaOH溶于1 440 mL去离子水,记为C. 首先将B缓慢加入C中,此过程持续约5 min,边加边搅拌. 然后将A缓慢加入B、C混合液中,此过程持续约35 min,边加边搅拌,形成黑色沉淀(约50 g). 加完继续搅拌10 h,悬浮液静置4 h,悬浮液用1 mol/L NaCl溶液真空抽滤洗涤,再用去离子水真空抽滤洗涤,直至滤液电导率小于20 μS/cm,然后在冻干机中冻干,磨细过100目(0.149 mm)筛装瓶备用,存于干燥器中.
酸性水钠锰矿[27]:将63.64 g KMnO4溶于600 mL去离子水,形成溶液盛于1 L的锥形瓶中,将此溶液在110 ℃恒温油浴锅中按一定速率边搅拌边加热煮沸. 然后将60 mL 6 mol/L HCl溶液按一定的速率(约4.5 s/滴)逐滴加入后,在沸腾条件下反应30 min,反应结束后将悬浮液自然冷却至室温,产物在60 ℃下老化处理12 h,再用去离子水洗涤所有矿物直至电导率小于2 μS/cm,然后在冻干机中冻干后,磨细过100目(0.149 mm)筛装瓶备用,存于干燥器中.
1.3 砷吸附试验
在25 ℃下,将不同量的水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物加入到400 mL、1 000 μg/L As(Ⅲ)/As(Ⅴ)溶液中,溶液pH用0.1 mol/L NAOH或HCl调整至7,然后置于磁力搅拌器上充分搅拌(100 r/min). 定时取样后,过0.45 μm的滤膜后,ρ(TAs)(TAs为总砷)通过ICP-MS(电感耦合等离子体质谱)测定,ρ〔As(Ⅲ)〕和ρ〔As(Ⅴ)〕通过HPLC-AFS(高效液相-原子荧光形态分析仪)测定.
2 结果与讨论
2.1 锰氧化物的表征

图1 水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的XRD图谱Fig.1 X-ray diffraction spectrum of vernadite, birnessite, filter and pipeline sediment
图1(a)(b)分别是典型的乱层水羟锰矿和酸性水钠锰矿,其中乱层水羟锰矿主要在2θ约为37°和66°出现两个宽衍射峰;酸性水钠锰矿主要在2θ约为14°、25°、37°和68°出现明显的衍射峰,峰的位置、形状和相对强度都和早期的研究[20,28- 30]相似. 图1(c)在2θ约为14°、25°、37°和68°出现衍射峰,与图1(b)的XRD图谱极为相似,说明滤料中的锰氧化物主要以酸性水钠锰矿的形式存在. 而图1(d)在2θ约为21°和26°出现的两个尖锐衍射峰,符合SiO2所产生的衍射峰,没有明显的氧化锰的峰,说明锰氧化物不是管道沉淀物的主要成分.
由图2可见,水羟锰矿为片层状结构,在片状结构之间存在大量空隙,结合图3(a)可以得出,水羟锰
矿中Mn、O元素含量较高,是水羟锰矿的主要组成元素. 酸性水钠锰矿为粒径在300 nm左右的球状体,而且球状颗粒的表面如花瓣状,有助于比表面积的增加,从图3(b)可见,Mn、O是酸性水钠锰矿的主要组成元素. 滤料晶型虽与酸性水钠锰矿相同,但是通过SEM发现,其微观形貌并不一致,滤料的粒径约为10 μm,远大于合成的酸性水钠锰矿,而且滤料表面呈极不规律的蜂窝状. 滤料取自于滤池石英砂表面,图3(c)显示,滤料的主要组成元素为Mn和O,并含有微量的Cu、Ca和Si元素. 管道沉淀物为块状结构,表面粗糙,由图3(d)可见,其含有一定量的Mn元素,但是O、Si是主要的元素组成,并含有一定量的Al元素,结构特征形貌与SiO2相同,说明SiO2是其主要组成部分,这也与XRD分析结果一致. 滤料和管壁沉淀物虽是废物基材料,从EDX结果可知它们的组分简单,不含其他有害成分,避免了除砷过程中引入新的污染物.

图2 水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的SEM图谱Fig.2 SEM images of vernadite, birnessite, filter and pipeline sediment
从图4可见,四种锰氧化物的Mn 2p3/2谱峰都不对称,因此氧化物中的Mn存在一种以上的化学价态.以Mn(Ⅲ)(EMn(Ⅲ)为641.7 eV)和Mn(Ⅳ)(EMn(Ⅳ)为642.2 eV)的激发终态对Mn 2p3/2窄区谱进行分峰拟合[31- 34],得到水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物中Mn(Ⅳ)和Mn(Ⅲ)的摩尔比分别为9.21∶1、8.74∶1、5.33∶1和2.71∶1,所以Mn的平均氧化度为3.90、3.89、3.84和3.71. 化学合成的水羟锰矿和酸性水钠锰矿的平均氧化度高于滤料和管道沉淀物.

图3 水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的EDX图谱Fig.3 EDX peaks of vernadite, birnessite, filter and pipeline sediment

图4 水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的XPS图谱Fig.4 XPS peaks of vernadite, birnessite, filter and pipeline sediment

锰氧化物投加量/g: 1—0.20; 2—0.10; 3—0.05.图5 不同投加量时锰氧化物对As(Ⅴ)的吸附Fig.5 Adsorption curve of As(V) under different dosage of manganese oxides
2.2 锰氧化物投加量对As去除的影响
2.2.1As(Ⅴ)模拟废水
四种锰氧化物对废水中As(Ⅴ)的吸附如图5所示. 随着水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的投加量从0.05 g增至0.20 g,As(Ⅴ)的吸附量都有一定程度的增加,饱和吸附量分别从83、167、92、40 μg增至191、192、176、90 μg. 水羟锰矿、酸性水钠锰矿和滤料对As(Ⅴ)的吸附量远大于管道沉淀物,这与管道沉淀物中锰氧化物含量较低有关. 管道沉淀物的主要成分为SiO2,吸附能力不如锰氧化物,并且由图2知其粒径较大,表面粗糙程度也不如水羟锰矿、酸性水钠锰矿和滤料,不利于吸附的进行. 相比较于水羟锰矿和滤料,酸性水钠锰矿在低投加量的条件下就有着较大的吸附量,随着投加量的增加对As(Ⅴ)的吸附量的增加并不明显. 这是因为酸性水钠锰矿为纳米级颗粒并具有蜂窝状结构,因此比表面积会远大于其他三种材料,在有限的容积里,增加投加量会更容易导致颗粒相互胶连在一起,并不能有效增加As(Ⅴ)的吸附位点. 虽然吸附量都随着投加量的增大而增加,但是单位吸附量却大幅降低. 反应18 h 时,水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的单位吸附量分别从1 654、3 356、1 848、880 μg/g降至954、958、881、451 μg/g. 随着投加量的增大,吸附剂对As(Ⅴ)吸附的效率不断下降.
2.2.2As(Ⅲ)模拟废水
四种锰氧化物对废水中As(Ⅲ)的吸附如图6所示. 随着水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物投加量从0.05 g增至0.20 g,As的吸附量随投加量都有一定的增加,饱和吸附量分别从114、155、99、47 μg增至206、191、203、109 μg. 相比较于其他三种材料,增加投加量对于水钠锰矿对As吸附量的提高不大,机理同2.2.1节. 同样单位吸附量都随投加量的增加而降低,反应18 h时,水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物的单位吸附量分别从 2 285、3 115、1 984、952 μg/g降至 1 031、959、1 016、548 μg/g. 在没有预氧化处理的情况下,一般吸附材料对As(Ⅲ)的去除效果会大不如比As(Ⅴ),而锰氧化物对As(Ⅲ)和As(Ⅴ)却有着相同的去除效果.
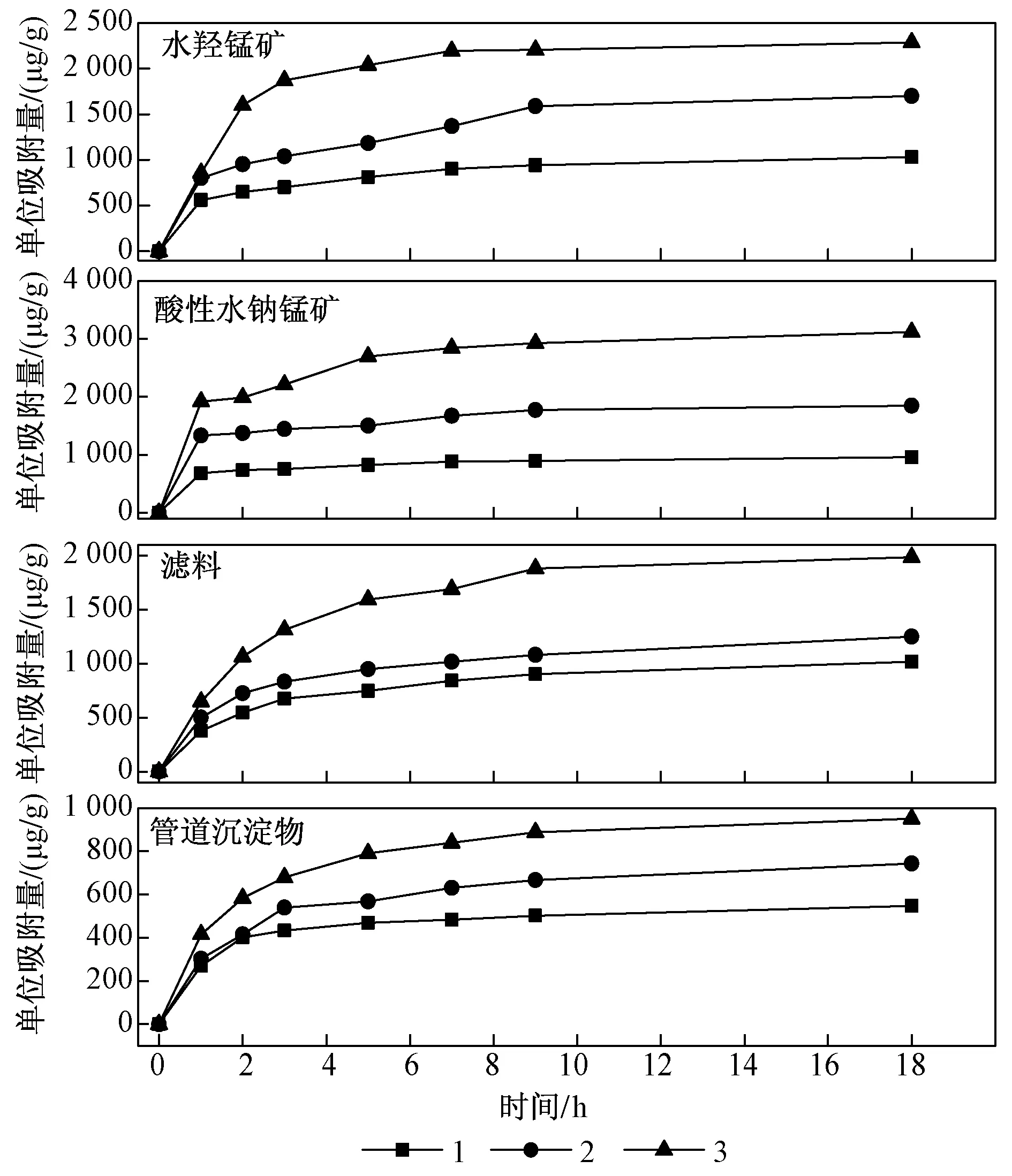
锰氧化物投加量/g: 1—0.20; 2—0.10; 3—0.05.图6 不同投加量时锰氧化物对As(Ⅲ)的吸附Fig.6 Adsorption curve of As(III) under different dosage of manganese oxides
2.3 As吸附动力学
2.3.1As(Ⅴ)吸附动力学
由图5可见,四种锰氧化物材料对As(Ⅴ)的吸附均可分为快速和缓慢吸附2个阶段. 前2 h为快速吸附阶段,该阶段锰氧化物比表面积大,吸附活性点位多,吸附反应容易进行. 随着吸附时间的增加,材料表面的吸附位点逐渐被占据,此时的吸附作用主要依靠内扩散来进行,因此进入缓慢吸附阶段,吸附速率逐步下降. 最终水羟锰矿、酸性水钠锰矿、滤料对As(Ⅴ)吸附量相差不大,滤料作为自来水厂运行周期结束后产生的废料,具有和合成的水羟锰矿、酸性水钠锰矿对As(Ⅴ)相近的吸附量,可以达到废物再利用的目的,具有经济效益.
为进一步研究水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅴ)的吸附动力学特征,分别采用准一级动力学模型〔见式(1)〕和准二级动力学模型〔见式(2)〕对吸附过程进行模拟:
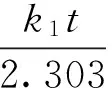
(1)

(2)
式中:qe1和qe2分别为准一级和准二级动力学模型中的平衡吸附量,μg/g;k1为准一级速率常数,h-1;k2为准二级速率常数,g/(μg·h);qt为t时刻的吸附量,μg/g.

图7 水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物与As(Ⅲ)的反应动力学Fig.7 Kinetics of As(III) oxidation by vernadite, birnessite, filter and pipeline sediment
由表1中拟合曲线动力学参数可知,与准一级动力学模型相比,水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅴ)的吸附过程更符合准二级动力学方程. 从准二级动力学方程计算得到的羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅴ)的拟合得到的平衡吸附量分别为 1 050、970、935、500 μg/g,与试验得到的平衡吸附量qe,exp非常接近. 准二级动力学方程能够更好的描述水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅴ)的吸附动力学过程,这说明四种锰氧化物对As(Ⅴ)的吸附是一个快速吸附和慢速吸附相互叠加的过程. 准二级动力学方程包含外部液膜扩散、表面吸附和颗粒内扩散等所有因素,所以准二级动力学模型更真实全面地反映四种锰氧化物对As(Ⅴ)吸附动力学机制[35- 37].

表1 吸附As(Ⅴ)的动力学拟合参数
2.3.2As(Ⅲ)的转化及吸附动力学
图7是水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物投加量为0.20 g的条件下对As(Ⅲ)的氧化吸附过程. 由图7可知,水羟锰矿、酸性水钠锰矿和滤料都对As(Ⅲ)有很强的氧化作用,1 h后溶液中As(Ⅲ) 几乎全部转化为As(Ⅴ),由于管道沉淀物含有大量的SiO2,故其氧化性和吸附能力较弱. 通过XPS分析也可知水羟锰矿和酸性水钠锰矿中锰的氧化度最高. 由此猜测,锰氧化物对As(Ⅲ)的转化及吸附作用有两种可能路径:①溶液中As(Ⅲ)迅速被转化成As(Ⅴ),然后As(Ⅴ)被锰氧化物吸附;②溶液中As(Ⅲ)先被锰氧化物颗粒吸附,然后在固体孔道内部氧化成As(Ⅴ). 由于锰氧化物具有较强的氧化能力,可自身将毒性高、迁移性强的As(Ⅲ)转化为毒性较低、迁移性弱的As(Ⅴ),故可实现对As(Ⅲ)的高效去除. 由图8可知,反应结束后(18 h)溶液中检测到了微量的Mn(Ⅱ),其中管道沉淀物释放的Mn(Ⅱ) 最多,ρ(Mn)为67 μg/L,但四种锰氧化物释放的Mn都远低于GB 5749—2006《生活饮用水卫生标准》,因此水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物可以用As(Ⅲ)的氧化吸附.

图8 反应结束后溶液的ρ(Mn) Fig.8 ρ(Mn) at the end of reaction
同样对水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅲ)的吸附过程进行准一级动力学和准二级动力学模拟. 由拟合结果(见表2)可知,水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅲ)的去除过程更符合准二级动力学方程,拟合得到的平衡吸附量分别为 1 111、990、1 131、578 μg/g,与实际平衡吸附量相近.

表2 吸附As(Ⅲ)的动力学拟合参数
3 结论
a) 无论是As(Ⅴ)模拟废水还是As(Ⅲ)模拟废水,随着投加量从0.05 g增至0.20 g,水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As饱和吸附量都明显增大:对于As(Ⅴ),从83、167、92、40 μg增至191、192、176、90 μg;对于As(Ⅲ),从114、155、99、47 μg增至206、191、203、109 μg. 但是随着投加量的增大,单位吸附量却急剧的下降.
b) 0.20 g投加量的水羟锰矿和酸性水钠锰矿可以快速实现As(Ⅲ)形态的转化,1 h后溶液中几乎检测不到As(Ⅲ),As(Ⅲ)全部被氧化为As(Ⅴ),滤料氧化能力稍弱,而管道沉淀物由于主要组成为SiO2,其氧化能力最弱.
c) 水羟锰矿、酸性水钠锰矿、滤料和管道沉淀物对As(Ⅴ)和As(Ⅲ)的吸附都更符合准二级吸附动力学模型,拟合平衡吸附量与实测值接近. 这说明四种锰氧化物对As的吸附是一个快速吸附和慢速吸附相互叠加的过程,准二级动力学模型可以更真实全面地反映四种锰氧化物对As吸附动力学机制.
d) 对于As(Ⅴ),滤料具有和化学合成的水羟锰矿、水钠锰矿相当的吸附量. 对于As(Ⅲ),滤料对其的氧化性稍弱于水羟锰矿、酸性水钠锰矿,但也在2 h后的反应溶液中检测不到As(Ⅲ),并最终达到与As(Ⅴ)模拟废水相同的去除效果. 滤料作为废物基材料可以替代化学合成的水羟锰矿、酸性水钠锰矿,实现对水体中砷的去除,达到废物材料的再利用及含砷水体修复的协同处置.
[1] SHIH Yujen,HUANG Relin,HUANG Yaohui.Adsorptive removal of arsenic using a novel akhtenskite coated waste goethite[J].Journal of Cleaner Production,2015,87:897- 905.
[2] LITTER M I,MORGADA M E,BUNDSCHUH J.Possible treatments for arsenic removal in Latin American waters for human consumption[J].Environmental Pollution,2010,158(5):1105- 1118.
[3] CHOWDHURY M R I,MULLIGAN C N.Biosorption of arsenic from contaminated water by anaerobic biomass[J].Journal of Hazardous Materials,2011,190(13):486- 492.
[4] 杨若明.环境中有毒有害化学物质的污染与监测[M].北京:中央民族大学出版社,2001:103- 104.
[5] TIAN Haixia,SHI Qiantao,JING Chuanyong.Arsenic biotrans-formation in solid waste residue:comparison of contributions from bacteria with arsenate and iron reducing pathways[J].Environmental Science & Technology,2015,49(4):2140- 2146.
[6] SONG Yu,WANG Shaofeng,JIA Yongfeng,etal.Effects of nutrient and sulfate additions on As mobility in contaminated soils:a laboratory column study[J].Chemosphere,2015,119:902- 909.
[7] POUS N,CASENTINI B,ROSSETTI S,etal.Anaerobic arsenite oxidation with an electrode serving as the sole electron acceptor:a novel approach to the bioremediation of arsenic-polluted ground-water[J].Journal of Hazardous Materials,2015,283(4):617- 622.
[8] SARKAR D,MAKRIS K C,VANDANAPU V,etal.Arsenic immobilization in soils amended with drinking-water treatment residuals[J].Environmental Pollution,2007,146(2):414- 419.
[9] 陈维芳,王宏岩,于哲,等.阳离子表面活性剂改性的活性炭吸附砷(V)和砷(Ⅲ)[J].环境科学学报,2013,33(12):3197- 3204. CHEN Weifang,WANG Hongyan,YU Zhe,etal.Adsorption of arsenate and arsenite by cationic surfactant-modified activated carbon[J].Acta Scientiae Circumstantiae,2013,33(12):3197- 3204.
[10] 张秋秋,潘申龄,刘伟,等.我国重点城市饮用水中砷健康累计风险评价[J].环境科学,2017,38(5):1- 11. ZHANG Qiuqiu,PAN Shenling,LIU Wei,etal.Cumulative risk assessment of arsenic health in drinking water in cities of China[J].Environmental Sciences,2017,38(5):1- 11.
[11] BORDOLOI S,NATH S K,GOGOI S,etal.Arsenic and iron removal from groundwater by oxidation-coagulation at optimized pH:laboratory and field studies[J].Journal of Hazardous Materials,2013,260(1):618- 626.
[12] HARISHA R S,HOSAMANI K M,KERI R S,etal.Arsenic removal from drinking water using thin film composite nanofiltration membrane[J].Desalination,2010,252(13):75- 80.
[13] MOHAN D,PITTMAN JR C U.Arsenic removal from waterwastewater using adsorbents:a critical review[J].Journal of Hazardous Materials,2007,142(12):1- 53.
[14] BALASUBRAMANIAN N,KOJIMA T,SRINIVASAKANNAN C.Arsenic removal through electrocoagulation:kinetic and statistical modeling[J].Chemical Engineering Journal,2009,155(12):76- 82.
[15] KIM J,BENJAMIN M M.Modeling a novel ion exchange process for arsenic and nitrate removal[J].Water Research,2004,38(8):2053- 2062.
[16] TONGAMP W,TAKASAKI Y,SHIBAYAMA A.Precipitation of arsenic as Na3AsS4from Cu3AsS4-NaHS-NaOH leach solutions[J].Hydrometallurgy,2010,105(12):42- 46.
[17] LESCANO M R,PASSAL A C,ZALAZAR C S,etal.Arsenic sorption onto titanium dioxide,granular ferric hydroxide and activated alumina:batch and dynamic studies[J].Journal of Environmental Science and Health,Part A:ToxicHazardous Substances and Environmental Engineering,2015,50(4):424- 431.
[18] YANG J S,KWON M J,PARK Y T,etal.Adsorption of arsenic from aqueous solutions by iron oxide coated sand fabricated with acid mine drainage[J].Separation Science and Technology,2014,50(2):267- 275.
[19] 马会强,吴束,李爽.零价铁渗透性反应墙原位修复含砷地下水的柱试验研究[J].环境工程学报,2017,11(1):33- 40. MA Huiqiang,WU Su,LI Shuang.Experimental study on insitu repairing arsenic containing groundwater by zero-valent iron permeability reaction wall[J].Chinese Journal of Environmental Engineering,2017,11(1):33- 40.
[20] DRITS V A,SILVESTER E,GORSHKOV A I,etal.Structure of synthetic monoclinic Na-rich birnessite and hexagonal birnessite:I.results from X-ray diffraction and selected-area electron diffraction[J].American Mineralogist,1997,82(9):946- 961.
[21] TANG Yuanzhi,WEBB S M,ESTES E R,etal.Chromium(III) oxidation by biogenic manganese oxides with varying structural ripening[J].Environmental Science:Processes & Impacts,2014,16(9):2127- 2136.
[22] CHANG Jianing,TANI Y,NAITOU H,etal.Zn(II) sequestration by fungal biogenic manganese oxide through enzymatic and abiotic processes[J].Chemical Geology,2014,383:155- 163.
[23] CHANG Jianing,TANI Y,NAITOU H,etal.Sequestration of Cd(II) and Ni(II) ions on fungal manganese oxides associated with Mn(II) oxidase activity[J].Applied Geochemistry,2014,47(8):198- 208.
[24] 田静.生物氧化锰对Pb(Ⅱ)Zn(Ⅱ)的吸附及对As(Ⅲ)Cr(Ⅲ) 的氧化[D].武汉:华中农业大学,2013:45- 56.
[25] 王冰清,于丹婷,郑袁明.不同氧化锰矿物与砷的交互作用[J].环境科学学报,2014,34(10):2608- 2614. WANG Bingqing,YU Danting,ZHENG Yuanming.Interaction of different manganese oxides with arsenic[J].Acta Scientiae Circumstantiae,2014,34(10):2608- 2614.
[26] VILLALOBOS M,TONER B,BARGAR J,etal.Characterization of the manganese oxide produced by pseudomonas putida strain MnB1[J].Geochimica Et Cosmochimica Acta,2003,67(14):2649- 2662.
[27] MCKENZIE R M.The synthesis of birnessite,cryptomelane,and some other oxides and hydroxides of manganese[J].Mineralogical Magazine,1971,38(296):493- 502.
[28] 张嵚.几种常见氧化锰矿物光化学降解废水中苯酚的研究[D].武汉:华中农业大学,2006:25- 36.
[29] VILLALOBOS M,LANSON B,MANCEAU A,etal.Structural model for the biogenic Mn oxide produced by pseudomonas putida[J].American Mineralogist,2006,91(4):489- 502.
[30] SASAKI K,YU Qianqian,MOMOKI T,etal.Adsorption characteristics of Cs+on biogenic birnessite[J].Applied Clay Science,2014,101:23- 29.
[31] WÖLLNER A,LANGE F,SCHMELZ H,etal.Characterization of mixed copper-manganese oxides supported on titania catalysts for selective oxidation of ammonia[J].Applied Catalysis A:General,1993,94(2):181- 203.
[32] NESBITT H,BANERJEE D.Interpretation of XPS Mn (2p) spectra of Mn oxyhydroxides and constraints on the mechanism of MnO2precipitation[J].American Mineralogist,1998,83(34):305- 315.
[33] BIKKAROLLA S K,YU Fengjiao,ZHOU Wuzong,etal.A three-dimensional Mn3O4network supported on a nitrogenated graphene electrocatalyst for efficient oxygen reduction reaction in alkaline media[J].Journal of Materials Chemistry A,2014,2(35):14493- 14501.
[34] WANG Huanwei,WANG Yalan,WANG Xuefeng.Pulsed laser deposition of large-area manganese oxide nanosheet arrays for high-rate supercapacitors[J].New Journal of Chemistry,2013,37(4):869- 872.
[35] 李坤权,郑正,罗兴章,等.KOH活化微孔活性炭对对硝基苯胺的吸附动力学[J].中国环境科学,2010,30(2):174- 179. LI Kunquan,ZHENG Zheng,LUO Xingzhang,etal.Adsorption kinetics ofp-nitroaniline onto microporous carbon activation with KOH[J].China Environmental Science,2010,30(2):174- 179.
[36] 黄福,张帆,王波,等.还原态氧化石墨烯对 Zn (Ⅱ) 的吸附动力学与热力学[J].应用化学,2014,31(12):1458- 1464. HUANG Fu,ZHANG Fan,WANG Bo,etal.Adsorption kinetics and thermodynamics of reduced grained graphene on Zn(II) [J].Chinese Journal of Applied Chemistry,2014,31(12):1458- 1464.
[37] OGATA F,TOMINAGA H,YABUTANI H,etal.Adsorption mechanism of copper and cadmium onto defatted waste biomass[J].Journal of Oleo Science,2011,60(7):363- 368.
Removal and Species Transformation Mechanism of Arsenic by Chemical Synthetic and Waste-Based Manganese Oxides
LIANG Guannan1,2, LIAN Xinying2, JIA Yongfeng2, YANG Yu2, JIANG Yonghai2*, SUN Xiaoling1,2
1.School of Environmental and Chemical Engineering, Shanghai University, Shanghai 200444, China 2.Chinese Research Academy of Environmental Sciences, Beijing 100012, China
X52
1001- 6929(2017)10- 1622- 08
A
10.13198/j.issn.1001- 6929.2017.02.66
2017-02-28
2017-04-27
国家自然科学基金项目(413731291008712)
梁冠男(1989-),男,河南驻马店人,liangguannan.123@163.com.
*责任作者,姜永海(1975-),男,黑龙江依安人,研究员,博士,主要从事地下水污染过程模拟、阻控、修复与管理技术研究,jyhai203@126.com
梁冠男,廉新颖,贾永锋,等.化学合成及废物基锰氧化物对不同形态砷的去除转化机制[J].环境科学研究,2017,30(10):1622- 1629.
LIANG Guannan,LIAN Xinying,JIA Yongfeng,etal.Removal and species transformation mechanism of arsenic by chemical synthetic and waste-based manganese oxides[J].Research of Environmental Sciences,2017,30(10):1622- 1629.
——以准噶尔盆地高探1井为例

