超临界CO2体系中磷脂酶A2催化合成高DHA含量DHA-PC的研究
,,, ,
(中国海洋大学食品科学与工程学院,山东青岛 266003)
超临界CO2体系中磷脂酶A2催化合成高DHA含量DHA-PC的研究
李珍珍,许飞跃,韩玉谦*,林洪,冯晓梅
(中国海洋大学食品科学与工程学院,山东青岛266003)
以南极磷虾粉为原料,乙醇浸提后分离纯化得到的精制磷脂酰胆碱的纯度高达90.8%,以此为原料,在超临界CO2体系中使用磷脂酶A2(PLA2)催化磷脂酰胆碱(PC)Sn-2位脂肪酸水解,使游离DHA结合到Sn-2位以制备高DHA含量的磷脂酰胆碱(DHA-PC),并研究了不同参数对该反应的影响。最佳酶解反应条件分别如下:固定化PLA2的添加量15%(占总底物),时间6 h,温度55 ℃,压力12 MPa。在此条件下,南极磷虾磷脂酰胆碱上DHA的含量可达62.3 mol%。由此得出结论,PLA2用于磷脂酰胆碱改性以制备DHA-PC的可行性高。
南极磷虾,磷脂酰胆碱,DHA-PC,固定化,PLA2,酯交换,超临界CO2
Abstract:With the raw material of euphausia superba powder,the purity of the refining phosphatidylcholine gained by ethyl alcohol extraction and separation and purification reached 90.8%,then the refining phosphatidylcholine was used as raw material and phospholipase A2was used to catalyze the fatty acid hydrolysis of Sn-2 position of phosphatidylcholine in supercritical CO2system to make the fish oil DHA to Sn-2 position and form the DHA-PC with high DHA contents. Meanwhile,the effects of different parameters on the reaction were surveyed. The results showed that,the best additive amount of immobilization phospholipase A2was 15%(occupied the total substratio),the best enzymolysis was 6 h,the best enzymolysis temperature was 55 ℃,the best enzymolysis pressure was 12 MPa,respectively. Under such condition,the DHA binding ratio of euphausia superba phosphatidylcholine could reach 62.3 mol%. And it could be concluded that immobilization phospholipase A2is highly viable for phosphatidylcholine modification to prepare DHA-PC.
Keywords:antarctic krill;phosphatidylcholine;DHA-PC;immobilisation;phospholipase A2;transesterification;supercritical carbon dioxide
磷脂特定的极性头部和脂肪酸组成对其生理功能是至关重要的[1]。一些磷脂因为具有特定的结构而具有很高的利用价值,而这样的磷脂在自然界却很少存在(如多不饱和磷脂),所以往往需要通过改性获得。多不饱和磷脂指的是磷脂中含有较多重要的多不饱和脂肪酸,如DHA[2]。Hosokawa等[3]研究表明,以海洋动物磷脂酰胆碱为原料制成的高DHA含量的磷脂酰胆碱(DHA-PC)脂质体在小鼠体内显示出很好的抗纤维肉瘤活性,而大豆磷脂制成的DHA-PC无此活性。南极磷虾磷脂中以磷脂酰胆碱为主,且含有丰富的多不饱和脂肪酸[4-5],所以其为制备海洋源高DHA含量DHA-PC的良好来源。
磷脂酶A2(PLA2)可用于水解磷脂酰胆碱制备溶血磷脂酰胆碱,且它特异性地水解磷脂酰胆碱的Sn-2位,接下来进行酯交换反应可以使其Sn-2位结合更多ω-3系列多不饱和脂肪酸,以制备高多不饱和脂肪酸含量的磷脂酰胆碱。
因为超临界CO2流体具有黏度低、扩散性好且CO2的临界点温度和压力对固定化酶活影响小等诸多利于酶促反应的优点[6-7],使超临界CO2流体成为替代有机溶剂作为酶促反应的介质越来越受到人们关注。再者,没有有机溶剂参与和残留,诸如改性磷脂的酶催化反应物在食品、药品和化妆品等领域的应用将得到大大的拓展[8]。
与游离酶相比较,固定化酶在超临界流体(SCF)中具有以下几个优点:可重复使用;酶与产物易分离;耐热性显著提高;催化稳定性有所改善;防止SCF与酶的化学相互作用而可能发生的酶构象变化[9]。所以为了方便终反应产物的检测,本研究中磷脂酶被固定在相应载体上。
本研究的主要目的是将PLA2引入南极磷虾磷脂酰胆碱改性使其结合更多的DHA,以提高其功能价值而达到高值化利用。此外,研究了催化剂PLA2在超临界状态下不同压力、温度、添加酶量、时间下的催化效果。
1 材料与方法
1.1 材料与仪器
PLA2(Lecitase® Ultra) 丹麦诺维信公司;南极磷虾粉 山东科瑞尔生物技术有限公司;大豆磷脂酰胆碱(纯度≥99%)、脂肪酸标准品 Sigma Aldrich公司;载体树脂D380 郑州勤实科技有限公司;CO2(纯度99.9%) 环宇气体公司;鱼油(该鱼油富含DHA和EPA,其含量分别为77%和5.7%。根据Garcia[10]等人的方法将该鱼油皂化以制备富含DHA的游离脂肪酸) 河北海源健康生物科技公司;氢氧化钾、盐酸、硫酸、磷酸二氢钾、硫酸联氨、钼酸钠、无水硫酸钠、丙酮、氯仿、甲醇 均为分析纯(AR),国药集团化学试剂有限公司。
BS210S型电子分析天天平 上海梅特勒-托利多仪器有限公司;GC-2010pl7s气相色谱仪 日本岛津公司;722S型可见光光度计 上海精密科学仪器有限公司;RE-52A型旋转蒸发器 上海亚荣生化仪器厂;超临界反应装置 自组装,如图1所示;GF254薄层层析硅胶板 青岛圣海精细硅胶化工有限公司。
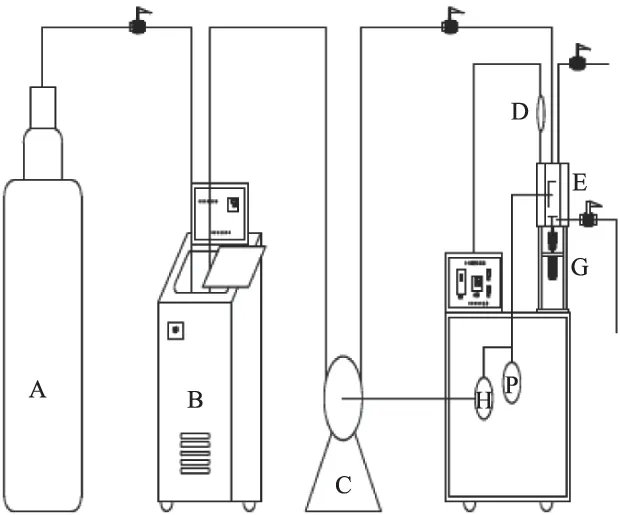
图1 超临界CO2体系酶催化反应装置Fig.1 Device of supercritical CO2 system for enzyme reaction注:A:CO2罐,B:制冷机,C:高压泵,D:热电偶,E:数显电热套,F:超临界反应罐,G:搅拌器,H:背压调节器,P:压力表。
1.2 实验方法
1.2.1 南极磷虾磷脂酰胆碱的制备 采用乙醇提取法,将南极磷虾粉与乙醇以1∶6 (g/mL)的比例混合搅拌均匀,摇床180 r/min,50 ℃,提取5 h。接下来进行滤膜抽滤至澄清透明,真空浓缩上述提取的南极磷虾油得南极磷虾磷脂,接下来按1∶3 (g/mL)的比例加入冷丙酮,脱油处理(每次20 min),振摇,然后静置分层,温度维持在0 ℃以下至上层丙酮液澄清,倒去上层丙酮,用氮气吹除残余的丙酮,获得纯度较高的南极磷虾磷脂酰胆碱。将上述样品再用乙醇溶解,添加氧化铝,加入量为原料的10%(g/g),搅拌吸附,抽滤至澄清透明,真空浓缩后,再次使用冷丙酮脱油、脱色等,最终得精制磷脂酰胆碱(PC)[11]。
1.2.2 固定化 将PLA2酶液及等体积的缓冲液(0.033 mol/L Tris-HCl,0.01 mol/L CaCl2,pH8.0)混合,然后加入活化后的D380,置于在200 r/min,25 ℃下摇床振荡吸附12 h;收集过量的酶液,用于树脂的蛋白吸附量的测定。随后真空干燥(45 ℃,3 h)并在4 ℃下储存待用[12]。
1.2.3 超临界CO2体系中的酶促反应 酶催化反应使用本实验室自组装的超临界装置,将游离DHA和磷脂酰胆碱按1∶6 (m/m)比例混合,置于摇床上混匀后,与固定化PLA2封闭在反应罐中,迅速密封反应釜,打开CO2罐和进出口阀门吹扫空气,维持5 s。注意进出口阀门在排空气时不能开太大,否则会将反应底物随着气流吹出。打开加热开关,待温度达到预设温度时,打开加压。达到预设压力后,停止加压,关闭CO2罐。打开搅拌,设置转速,开始反应。反应停止后,缓慢降压,从物料口回收反应产物。
1.2.3.1 不同压力下的酶催化反应 温度50 ℃,反应时间7 h,转速400 r/min,15%固定化酶添加量,固定化酶分别在10、12、14、16、18、20 MPa下反应。反应结束后,回收样品,然后将反应混合物溶解在氯仿/甲醇(2∶1,V/V)溶液中,取微量溶液薄层色谱(TLC)展开,展开剂氯仿∶甲醇∶水(65∶25∶4,V/V/V)。从TLC板上回收对应于PC的条带,提取并甲基化,然后进行色谱分析[13-14]。
1.2.3.2 不同温度下的酶催化反应 压力12 MPa,转速400 r/min,15%固定化酶添加量,反应时间7 h,酶水解温度分别为30、35、40、45、50、55、60 ℃。反应结束后分离纯化方法参照1.2.3.1。
1.2.3.3 不同固定化酶添加量下的酶催化反应 在50 ℃的温度下,固定化PLA2的添加量(添加量(%)=固定化酶重量/总底物重量×100)为5%、10%、15%、20%、25%、30%,压力12 MPa,旋转速度400 r/min,反应进行7 h,反应结束后分离纯化方法参照1.2.3.1。
1.2.3.4 不同反应时间下的酶催化反应 在50 ℃,12 MPa和400 r/min下进行反应,加入的PLA2的量为15%。酶水解时间分别为3、4、5、6、7、8、9 h,反应结束后分离纯化方法参照1.2.3.1。
1.2.4 分析方法
1.2.4.1 树脂的蛋白吸附量和固定化磷脂酶活力测定 树脂的蛋白吸附量定义为初始酶液中的蛋白量及过量酶液中的蛋白量的差值与固定化使用的树脂量(mg/g)的比值。测定方法为考马斯亮蓝法,称取一系列牛血清蛋白(BSA)标准溶液,分别加入5 mL考马斯亮蓝溶液,振荡摇匀在25 ℃下静置2 min,测定吸光度,然后绘制BSA标准曲线[15]。
酶活力定义为:在一定条件下1 min水解磷脂产生1 μmol的游离脂肪酸所需要的酶量为一个磷脂酶活力单位(U/g),测定方法参照李响[16]等人。固定条件如下:0.033 mol/L Tris-HCl,0.01 mol/L CaCl2,pH8.0,吸附温度25 ℃,吸附时间12 h,固定载体D380[17]。
1.2.4.2 磷脂酰胆碱含量测定 自制南极磷虾磷脂酰胆碱含量测定根据韩轶等人[18]的方法改进。取100 mg自制磷脂酰胆碱和相应的标准品溶于氯仿配制成一定浓度的磷脂酰胆碱溶液,准备110 ℃活化1 h的硅胶板,将磷脂酰胆碱氯仿溶液用此硅胶板进行层析。标准品溶液与样品溶液点于同一硅胶板,配制好展开剂氯仿∶甲醇∶水(65∶25∶4,V/V/V)后,转移至层析缸里饱和0.5 h达到平衡即可使用[18]。硅胶板下端留出1.5 cm的距离,点样直径3 mm左右为宜,待展开剂移动至硅胶板距离上边缘1 cm处结束层析。取出硅胶板,避光干燥后,放入碘缸内,密封。升华的碘蒸汽遇到磷脂酰胆碱后,显出黄色的斑点。通过磷脂酰标准品的Rf值为样品定性。快速将磷脂酰胆碱的斑点从硅胶板刮下,使用钼蓝比色法测定其中的磷含量,再通过转换系数换算成相应的磷脂酰胆碱的含量,磷脂的换算系数为26.31[19]。
计算公式为:
1.2.4.3 样品中脂肪酸含量的测定 从硅胶板刮下的磷脂酰胆碱的斑点用氯仿溶解,0.22 μm滤膜过滤后用氮气小心吹干,得到磷脂酰胆碱纯品。甲酯化方法和气相色谱条件参照Xi等人[20]的方法,之后使用气相色谱-火焰离子化检测器(GC-FID)对样品进行脂肪酸分析。
气相色谱条件为:RTX-WAX石英毛细管柱(30 m);进样口温度260 ℃,检测器温度260 ℃,进样量1 μL,分流比1∶15;载气为高纯氮气;升温程序:60 ℃,1 min;10 ℃/min升温至190 ℃,2 ℃/min升温至236 ℃后保持2 min[20]。
根据37种脂肪酸甲酯混标的保留时间来确定样品中脂肪酸组成,通过外标法计算出不同脂肪酸甲酯的相应因子,从而对样品中的DHA进行定量分析。
DHA含量(mol%)=[样品中的DHA含量(mol)/样品中的脂肪酸总量(mol)]×100
反应完成后,将酶促反应产物从取样口排出,滤膜过滤后氮气保护,冷冻保存,脂肪酸分析方法同1.2.4.3,磷脂酰胆碱得率计算公式如下:
1.3 数据处理
所有实验重复三次,采用Origin 8.5和Excel 2013作图。
2 结果与分析
2.1 树脂的蛋白吸附量和固定化磷脂酶活力
BSA标准曲线如图2所示。

图2 BSA标准曲线Fig.2 Standard curve of BSA solution
从图2可以看出蛋白的含量与吸光度呈现线性关系,R2=0.9981,线性方程为:Y=5.365x-0.0191。
经计算,PLA2的树脂蛋白吸附量为66.23 mg/g,酶活为568.13 U/g,该固定化酶酶活表现良好,可以用于接下来的酶促反应。
2.2 磷标准曲线
横坐标为磷含量,纵坐标为吸光度,绘制标准曲线,如图3。磷的含量与吸光度呈良好的线性关系,R2=0.9991,线性方程为:Y=7.2116X+0.0054。
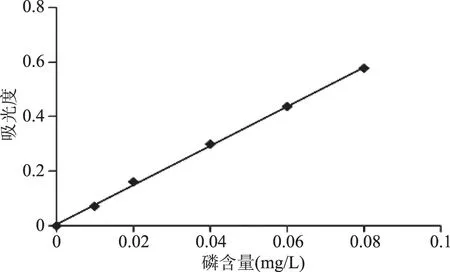
图3 磷标准曲线Fig.3 Standard curve of the phosphorus content
通过换算,得出精制的南极磷虾磷脂酰胆碱含量达到90.8%,可见分离纯化方法可靠。纯化后的南极磷虾磷脂酰胆碱的纯度高于市售大豆磷脂酰胆碱的纯度(80%左右),这对接下来的反应是十分有利的。
2.3 反应压力的影响
如图4所示,最佳酶解压力为12 MPa,此时样品中DHA的含量最高,为59.3 mol%。当压力低于12 MPa时,DHA含量呈增加的趋势,但是当压力高于12 MPa时,DHA的含量反而降低,压力10 MPa时的DHA含量高于14 MPa时的含量,在20 MPa时磷脂酰胆碱中DHA的含量仅为36.6 mol%。然而磷脂酰胆碱的得率却呈现与此相反的趋势,在12 MPa时磷脂酰胆碱的得率最低,而20 MPa时得率最高。这可能是因为磷脂酰胆碱在PLA2催化下的酸解反应与其在超临界环境中的水解反应有一定内在的联系,当条件对酸解反应有利时,水解反应也会加剧。
超临界CO2流体的溶剂化能力可以根据反应性能来定制,压力通过直接改变反应物的溶解度或反应常数来影响反应速率[21-22]。在超临界环境中由于较高的流体密度,物质的溶解度随着压力的增加而增加。此时,反应速率随着压力增加而增加。因此,在压力比较低时,压力增加对于酶促反应是有利的,但在超过一定阈值之后,可能反应的活化能增加也可能是酶在高压下失水过多,导致酶构象发生改变,而逐步丧失活性。

图4 压力对DHA含量和PC得率的影响Fig.4 Effects of pressure on DHA contents and yields of PC
2.4 反应温度的影响
如图5所示,PLA2的活性在55 ℃达到最大值61.1 mol%。这一结果与其他研究结论一致,即在恒定压力下温度升高可以激活酶[23],温度升高,流体的传质速率和扩散系数增加,使得酶与底物可以进行充分有效的接触[24]。55 ℃为最佳酶分解温度,继续升温,DHA含量缓慢下降,这与酶活性受到高温影响有关。
PC得率在55 ℃也同样发生了明显转折,温度高于55 ℃时,PC得率不再增加反而为迅速降低。温度升高,使磷脂酰胆碱稳定性降低,且此时体系内水分活度增加,这些都会加剧它的PC的水解。
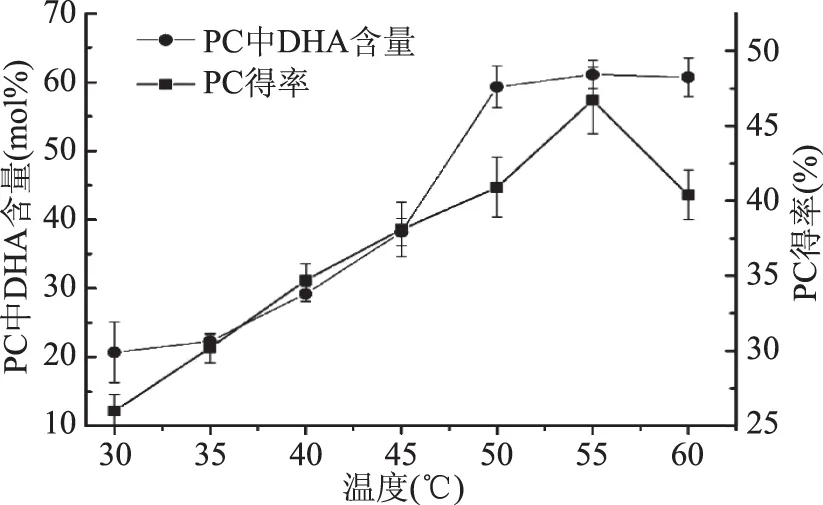
图5 温度对DHA含量和PC得率的影响Fig.5 Effects of temperature on DHA contents and yields of PC
2.5 固定化酶添加量的影响
如图6所示,在低添加量时,增加酶剂量带来更高的DHA含量。当酶添加量为15%时,DHA的含量达到最大值59.3 mol%,为最佳添加量。在一定范围内,磷脂酶的浓度越大,活性中心越多,底物与酶的活性中心结合的概率越大,反应速度也会越快;但酶相对于底物接近饱和时,浓度对反应速度的影响减小,当酶浓度过于饱和时,DHA的含量变现为下降,因为酶浓度的增加导致水解也随之增加。

图6 固定化酶添加量对DHA含量和PC得率的影响Fig.6 Effects of immobilised enzyme to total substrates ratio on DHA contents and yields of PC
而固定酶添加量从5%增加到30%时,PC得率下降了30%,这极有可能是因为加酶量增加导致水解副反应增加。
2.6 反应时间的影响
反应时间越长,结合在磷脂酰胆碱上的酰基供体越多,然而长时间的反应也可导致酰基迁移等一些副反应增加,PC得率逐渐下降,如图7所示,反应时间6 h为最佳酶解温度,此时DHA的含量达到最大值59.6 mol%,之后呈现下降的趋势。另外朱珊珊[25]在使用PLA1进行催化合成富含共轭亚油酸磷脂的实验中反应进行72 h后共轭酸含量才达到27.6 mol%,说明超临界作为该反应的介质有明显的优势。

图7 反应时间对DHA含量和PC得率的影响Fig.7 Effects of time on DHA contents and yields of PC
2.7 改性磷脂的脂肪酸组成
在酶促反应之前,原料磷脂酰胆碱上的主要脂肪酸是肉豆蔻酸(C14∶0=6.4 mol%),棕榈酸(C16∶0=19.7 mol%),油酸(C18∶1n-9=8.9 mol%),EPA(C20∶5n-3=22.2 mol%)和DHA(C22∶6n-3=17.3 mol%)。与原料相比,在最优的超临界反应条件下,改性磷脂酰胆碱的上述脂肪酸含量有所降低,但是其中EPA从22.2 mol%略微增加至24.0 mol%,DHA的含量从17.3 mol%上升至62.3 mol%。这说明超临界反应介质中在PLA2催化下DHA成功地结合到磷脂酰胆碱上了。
注:每个分析都重复三次,结果取平均值。
3 结论
使用PLA2在超临界CO2体系中催化磷脂酰胆碱的Sn-2位脂肪酸水解,使游离DHA结合到磷脂酰胆碱的Sn-2位制备高DHA含量的DHA-PC,并研究了酶添加量、时间、温度和压力参数对该工艺的影响。得到最佳酶分解条件分别为:固定化PLA2的添加量15%(占总底物),时间为6 h,温度为55 ℃,压力为12 MPa。在此条件下,南极磷虾磷脂酰胆碱中DHA的含量从17.3 mol%(原料)上升至62.3 mol%,说明固定化PLA2可用于高DHA含量DHA-PC的制备实验中,且在超临界CO2体系中有较好的催化活性。
此外,磷脂酶的作用机制是复杂的。有很多因素影响酶发挥作用,这些影响因素相互作用,表现出协同或拮抗作用。例如,据报道,底物和产物的在体系中的浓度取决于压力/温度组合,并且物质在超临界CO2中的溶解度的增加是随着温度的升高实现的[26]。因此,进一步的实验研究将涉及多因素相互作用对该酶催化反应的影响。
[1]Guo Z,Vikbjerg A F,Xu X. Enzymatic modification of phospholipids for functional applications and human nutrition[J]. Biotechnology Advances,2005,23:203-259.
[2]张思瑾. 太平洋磷虾磷脂提取及磷脂酰胆碱的分离纯化研究[D]. 青岛:中国海洋大学,2015.
[3]Hosokawa M,Shimatani T,Kanada T,et al. Conversion to docosahexaenoic acid-containing phosphatidylserine from squid skin lecithin by phospholipase D-mediated transphosphatidylation[J]. Journal of Agricultural and Food Chemistry,2000,48(10):4550.
[4]孙甜甜. 高品质南极磷虾虾油工业化生产技术研究[D]. 青岛:中国海洋大学,2013.
[5]Ulven S M,Kirkhus B,Lamglait A,et al. Metabolic effects of krill oil are essentially similar to those of fish oil but at lower dose of EPA and DHA,in healthy volunteers[J]. Lipids,2011,46(1):37.
[6]Lin T J,Chen S W,Chang A C. Enrichment of n-3 PUFA contents on triglycerides of fish oil by lipase-catalyzed trans-esterification under supercritical conditions[J]. Biochemical Engineering Journal,2006,29(29):27-34.
[7]Lin T J,Chen S W. Enrichment of n-3 polyunsaturated fatty acids into acylglycerols of borage oil via lipase-catalyzed reactions under supercritical conditions[J]. Chemical Engineering Journal,2008,141(1):318-326.
[8]Penci M C,Constenla D T,Carelli A A. Free-fatty acid profile obtained by enzymatic solvent-free hydrolysis of sunflower and soybean lecithins[J]. Food Chemistry,2010,120(1):332-338.
[9]Kamat S,Critchley G,Beckman E J,et al. Biocatalytic synthesis of acrylates in organic solvents and supercritical fluids:III. Does carbon dioxide covalently modify enzymes[J]. Biotechnology & Bioengineering,1992,40(1):158-166.
[10]Garcia,Hugo S,Kim,et al. Enrichment of lecithin with n-3 fatty acids by acidolysis using immobilized phospholipase A1[J]. Grasas Y Aceites,2008,59(4):368-374.
[11]张潇予. 南极磷虾磷脂酰胆碱的提纯[D]. 济南:山东师范大学,2012.
[12]Egger D,Wehtje E,Adlercreutz P. Characterization and optimization of phospholipase A2catalyzed synthesis of phosphatidylcholine[J]. Biochimica Et Biophysica Acta,1997,1343(1):76-84.
[13]Kim I H,Garcia H S,Jr C G H. Phospholipase A-catalyzed synthesis of phospholipids enriched in polyunsaturated fatty acid residues[J]. Enzyme & Microbial Technology,2007,40(5):1130-1135.
[14]Kim I H,Garcia H S,Hill C G. Synthesis of Structured Phosphatidylcholine Containing n-3 PUFA Residues via Acidolysis Mediated by Immobilized Phospholipase A1[J]. Journal of the American Oil Chemists’ Society,2010,87(11):1293-1299.
[15]Vikbjerg A F,Mu H,Xu X. Synthesis of structured phospholipids by immobilized phospholipase A2catalyzed acidolysis[J]. Journal of Biotechnology,2007,128:545-554.
[16]李响. 磷脂酶A1的固定化及其催化合成DHA/EPA型磷脂的研究[D]. 广州:华南理工大学,2015.
[17]Kim J,Lee C S,Oh J,et al. Production of egg yolk lysolecithin with immobilized phospholipase A2[J]. Enzyme & Microbial Technology,2001,29(10):587-592.
[18]韩轶,周扬,赵永芳. 卵磷脂的提纯、鉴定及应用[J]. 氨基酸和生物资源,2001,23:28-31.
[19]胡小中,温光源,龙金林. 磷脂分析检测技术研究进展[J]. 中国油脂,2003,28:41-44.
[20]Xi X,Feng X,Shi N,et al. Immobilized phospholipase A1-catalyzed acidolysis of phosphatidylcholine from Antarctic krill(Euphausiasuperba)for docosahexaenoic acid enrichment under supercritical conditions[J]. Journal of Molecular Catalysis B Enzymatic,2016,126:46-55.
[21]Dufour E,Hervé G,Haertle T. Hydrolysis ofβ-lactoglobulin by thermolysin and pepsin under high hydrostatic pressure[J]. Biopolymers,2004,35(5):475-483.
[22]Gross M,Auerbach G,Jaenicke R. The catalytic activities of monomeric enzymes show complex pressure dependence[J]. Febs Letters,1993,321(2-3):256-260.
[23]Almeida M C,Rui R,Maia C,et al. Novozym 435 Activity in Compressed Gases. Water Activity and Temperature Effects[J]. Enzyme & Microbial Technology,1998,22(6):494-499.
[24]Peres C,Harper N,Silva M D R G D,et al. Effect of zeolites on lipase catalyzed esterification in nonaqueous media[J]. Enzyme & Microbial Technology,2005,37(1):145-149.
[25]朱珊珊. 磷脂酶A1的固定化及催化合成富含共轭亚油酸磷脂的研究[D]. 广州:华南理工大学,2011.
[26]Fornari T,Stateva R P. High Pressure Fluid Technology for Green Food Processing[M]. Springer International Publishing,2015.
CatalyticsynthesisofDHA-PCwithhighDHAcontentsbyphospholipaseA2insupercriticalCO2system
LIZhen-zhen,XUFei-yue,HANYu-qian*,LINHong,FENGXiao-mei
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
TS218
A
1002-0306(2017)18-0085-06
2017-04-05
李珍珍(1990-),女,在读硕士研究生,研究方向:食品加工与功能食品,E-mail:lixueping0628@163.com。
*通讯作者:韩玉谦(1962-),男,博士,教授,从事超(亚)临界方面的研究,E-mail:hanyuqian@ouc.edu.cn。
国家自然科学基金(31071541);长江学者与创新研究团队发展计划(TRT1188)。
10.13386/j.issn1002-0306.2017.18.017

