脂多糖调控Notch信号通路作用于人牙髓干细胞增殖、分化、凋亡的实验研究
项海东 李浩渤 陈惠珍
(河北医科大学第二医院口腔内科,石家庄 050000)
脂多糖调控Notch信号通路作用于人牙髓干细胞增殖、分化、凋亡的实验研究
项海东 李浩渤 陈惠珍
(河北医科大学第二医院口腔内科,石家庄 050000)
目的探讨脂多糖调控Notch信号通路对人牙髓干细胞增殖、分化、凋亡的影响及机制。方法从牙髓组织中分离出人牙髓干细胞(hDPSCs),CCK8实验检测0、0.1、1、10 μg/ml的脂多糖处理hDPSCs 1、3、5、7 d后细胞的增殖情况;RT-PCR检测1 μg/ml的脂多糖处理hDPSCs 0、3、7、14、21 d后矿化相关基因ALP、DSPP、DMP1的mRNA表达情况;流式细胞仪检测1 μg/ml的脂多糖处理hDPSCs 0、7、14、21 d后的细胞凋亡情况;Western blot检测Cleaved caspase3、Notch1、Hes1的蛋白表达。结果不同浓度的脂多糖刺激hDPSCs 1、3、5 d后细胞的增殖均无显著差异,培养至第7天时,0.1、1、10 μg/ml的脂多糖组细胞的增殖均显著低于0 μg/ml的脂多糖组(P<0.01);脂多糖处理hDPSCs 3 d时ALP、DSPP、DMP1的mRNA表达与对照组比较差异均无统计学意义(P>0.05),7、14、21 d时ALP、DSPP、DMP1的mRNA表达均显著高于对照组(P<0.01);脂多糖处理hDPSCs 7、14、21 d时细胞的凋亡率及Cleaved caspase3、Notch1、Hes1蛋白表达均显著高于对照组(P<0.01),21 d时ALP、DSPP、DMP1的mRNA表达及细胞凋亡率和Cleaved caspase3、Notch1、Hes1蛋白表达均有下降趋势。结论脂多糖可降低hDPSCs的增殖,促进其矿化和凋亡,其机制与激活Notch信号通路有关。
脂多糖;Notch信号通路;人牙髓干细胞;增殖;分化;凋亡
干细胞是一种具有自我更新和多向分化潜能的细胞,可分为成体干细胞和胚胎干细胞,牙髓干细胞(Dental pulp stem cells,DPSCs)是成体干细胞的一员,是口腔医学研究的热点,具有很强的增殖潜能,在体外适当诱导下能向成脂、成骨/成牙、成神经等方向分化,对于牙髓组织的重建及修复损伤等有重要影响[1,2]。细菌内毒素脂多糖(Lipopolysacchar-ide,LPS)是革兰氏阴性菌主要的致病因子,在间充质干细胞的分化及增殖中有重要作用[3]。有研究显示,高剂量的脂多糖能抑制牙髓细胞分化为牙本质细胞,并诱导牙周细胞及牙髓细胞的凋亡,在牙髓损伤时脂多糖也会刺激牙髓组织中的牙髓干细胞,而目前脂多糖对牙髓干细胞的生物学特性及机制的研究尚不清楚[4,5]。因此,本研究从牙髓组织中分离出牙髓干细胞,研究脂多糖对其增殖、凋亡、分化的影响及机制,以期为牙髓损伤修复的机制提供理论基础。
1 材料与方法
1.1材料 MEM培养基、青链霉素、胰蛋白酶、胎牛血清均购自美国Gibco公司;脂多糖购自美国Invivogen公司;反转录试剂盒及RT-PCR试剂盒购自日本TaKaRa;RNA提取试剂盒购自美国Omega;BCA试剂盒、CCK8试剂盒;Annexin V-FITC凋亡试剂盒均购自碧云天生物技术研究所;Cleaved caspase3、Notch1、Hes1单克隆抗体及辣根过氧化物标记的二抗均购自美国Abcam公司;实时定量PCR仪购自美国Applied Biosystems;CO2细胞培养箱购自美国SIM公司;倒置显微镜购自日本OLYMPUS;酶标仪、电泳凝胶图像分析系统、聚丙烯酰胺凝胶电泳仪均购自Bio-Rad公司。
1.2方法
1.2.1hDPSCs的分离培养 经患者知情同意后,从河北医科大学第二医院口腔颌面外科门诊收集18~24岁患者因阻生新鲜拔除或正畸减数的新鲜健康恒牙,用含有青链霉素双抗的PBS洗涤离体牙2次后,牙齿表面灭菌后取出牙冠,分离牙髓,用小剪刀将牙髓组织剪成1.0 mm×1.0 mm×1.0 mm的小块,1 000 r/min离心5 min,弃掉上清,按照1∶1比例加入0.4%的dispase酶和0.3%的Ⅰ型胶原酶,37℃消化1 h,1 000 r/min离心5 min,吹打单细胞团块形成单细胞悬液,过70 μm滤筛,1 000 r/min离心 5 min,20%的PBS洗涤细胞1次,细胞沉淀用高糖DMEM培养基(含20%的胎牛血清)重悬,接种于培养瓶中培养,每3 d换液1次,显微镜观察细胞的生长状态,收集对数生长期的培养上清备用,细胞生长密度达到80%~90%时,用2.5 g/L的胰蛋白酶消化后传代。
1.2.2脂多糖对hDPSCs增殖的影响 取生长至对数期的hDPSCs,用2.5 g/L的胰蛋白酶消化细胞,调整细胞浓度为2×103个/孔,以每孔200 μl接种于96孔细胞培养板中,培养1、3、5、7 d,每个时间点又分为0、0.1、1、10 μg/ml的脂多糖处理,用含有10%的胎牛血清的MEM培养基刺激hDPSCs,每3 d换液1次,各组细胞培养到指定时间后,每孔加入10 μl的CCK-8溶液,置于37℃,5%CO2培养箱孵育2 h,酶标仪在490 nm波长处测定并记录各组的吸光度(A)。
1.2.3脂多糖对hDPSCs矿化相关基因ALP、DSPP、DMP1表达的影响 实验分为两组,即对照组和1 μg/ml的脂多糖处理组,每组设置0、3、7、14、21 d五个时间点。将生长至对数期的第四代hDPSCs制成单细胞悬液,以2×105的密度接种于6孔细胞培养板中,按照实验分组进行矿化诱导,矿化诱导至相应时间后,根据细胞蛋白试剂盒说明提取细胞中的总RNA,根据逆转录试剂盒说明将总RNA反转录为cDNA。根据NCBI数据库中公布的人mRNA序列设计目的基因 ALP、DSPP、DMP1及内参基因GAPDH的RT-PCR定量引物。所有引物由上海生工生物工程有限公司合成。引物序列:ALP上游引物:5′-CCACGTCTTCACATTTGGTG-3′,下游引物:5′-AGACTGCGCCTGGTAGTTGT-3′;DSPP上游引物:5′-TGGAGACAAGACCTCCAAGAGTGA-3′,下游引物:5′-TGCTGGGACCCTTGAATTTCTATTC-3′;5′-AGA-CTGCGCCTGGTAGTTGT-3′;DMP1上游引物:5′-TGG-GGATTATCCTGTGCTCT-3′,下游引物:5′-GCTGTCACTGGGGTCTTCAT-3′。GAPDH引物序列:上游引物:5′-AAGAGTGGGTTTAAGTGGAAGGCT-3′,下游引物:5′-GAAGATGGTGATGGGATTTC-3′。PCR反应参数:A:预变性95℃ 10 min;B:变性95℃ 10 s;退火60℃ 15 s,延伸72℃ 20 s,共40个循环温度:72℃ 15 min。4℃终止反应。每个样品设置3个重复,取均值采用2-ΔΔCt法对数据进行相对定量分析。
1.2.4脂多糖对hDPSCs凋亡的影响 实验分为两组,即对照组和1 μg/ml的脂多糖处理组,每组设置7、14、21 d三个时间点。收集按照分组培养至对数期的hDPSCs,预冷的PBS洗涤细胞后,再用结合缓冲液各洗涤细胞1次,离心,弃上清,加入400 μl的结合缓冲液重悬细胞,取细胞悬液加入5 μl的PI和 Annexin-V-FITC,充分混匀后置于37℃条件下避光静置20 min,再加400 μl结合缓冲液,上机,流式细胞仪检测细胞凋亡率。
1.2.5脂多糖对Cleaved caspase3、Notch1、Hes1的蛋白表达的影响 实验分为两组,即对照组和1 μg/ml的脂多糖处理组,每组设置7、14、21 d三个时间点。取按照分组培养至对数期的hDPSCs,提取细胞中的蛋白,二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒检测提取的蛋白质量。配置12%分离胶及5%的浓缩胶,按照1∶1比例将蛋白样品与上样缓冲液充分混匀,置于100℃煮沸变性10 min,缓慢冷却后进行分装,置于-80℃冰箱中保存。取变性蛋白进行聚丙烯酰氨凝胶电泳(SDS-PAGE)分离,电泳结束后依次PVDF转膜、5%的脱脂奶粉封闭、一抗孵育( Notch1、Hes1按1∶500稀释,GAPDH按1∶1 000稀释),4℃孵育过夜、二抗孵育(辣根过氧化物酶标记的羊抗鼠IgG,1∶1 000稀释),37℃ 孵育1 h,洗膜3次,ECL发光剂显影,自动凝胶成像系统采集图像。以GAPDH作为内参,分析Notch1、Hes1的蛋白表达水平。
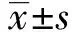
2 结果
2.1脂多糖降低hDPSCs增殖 CCK8实验检测0、0.1、1、10 μg/ml的脂多糖处理1、3、5、7 d后的细胞增殖情况,结果显示,不同浓度的脂多糖刺激hDPSCs 1、 3、5 d后细胞的增殖均无显著差异,培养至第7天时,0.1、1、10 μg/ml的脂多糖组细胞的增殖均显著低于0 μg/ml的脂多糖处理组(P<0.01)。这说明脂多糖对hDPSCs 的刺激在较短时间内对细胞增殖无明显影响,长时间脂多糖刺激可能引起细胞增殖下降。见图1。
2.2脂多糖促进hDPSCs的矿化相关基因表达 RT-PCR检测1 μg/ml的脂多糖处理hDPSCs 0、3、7、14、21 d后矿化相关基因 ALP、DSPP、DMP1的mRNA表达情况,结果显示,脂多糖处理hDPSCs 3 d时ALP、DSPP、DMP1的mRNA表达与对照组比较均无统计学意义(P>0.05),脂多糖处理hDPSCs 7、14、21 d后ALP、DSPP、DMP1的mRNA表达均显著高于对照组(P<0.01),21 d时ALP、DSPP、DMP1的mRNA表达有下降的趋势。见图2。
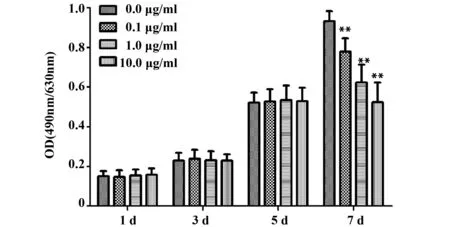
图1 脂多糖对hDPSCs增殖的影响Fig.1 Effect of lipopolysaccharide on proliferation of hDPSCsNote:Compared with the control group 0 g/ml,**.P<0.01.
2.3脂多糖促进hDPSCs的凋亡 流式细胞仪检测1 μg/ml的脂多糖处理hDPSCs 0、7、14、21 d后细胞的凋亡情况,结果显示,7、14、21 d时细胞的凋亡率均显著高于对照组(P<0.01),21 d时细胞凋亡率有下降趋势。见图3。
2.4脂多糖对Cleaved caspase3、Notch1、Hes1的蛋白表达的影响 Western blot检测1 μg/ml的脂多糖处理hDPSCs 0、7、14、21 d后Cleaved caspase3、Notch1、Hes1的蛋白表达情况,结果显示,脂多糖处理hDPSCs 7、14、21 d时Cleaved caspase3、Notch1、Hes1的蛋白表达均显著高于对照组(P<0.01),21 d时Cleaved caspase3、Notch1、Hes1的蛋白表达有下降趋势。见图4。
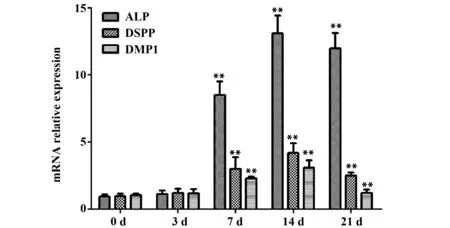
图2 脂多糖对hDPSCs的ALP、DSPP、DMP1表达的影响Fig.2 Effect of lipopolysaccharide on expression of ALP,DSPP and DMP1 in hDPSCsNote:Compared with the control group 0 d,**.P<0.01.

图3 脂多糖对hDPSCs凋亡的影响Fig.3 Effect of lipopolysaccharide on apoptosis of hDPSCsNote:A.Flow cytometry results;B.The apoptosis rate of cell.Compared with the control group 0 d,**.P<0.01.

图4 脂多糖对Cleaved caspase3、Notch1、Hes1蛋白表达的影响Fig.4 Effect of lipopolysaccharide on expression of Cleaved caspase3,Notch1 and Hes1 proteins
3 讨论
近些年来,成体干细胞由于对组织修复和再生的影响受到大量研究者的关注。牙髓干细胞是牙髓组织中存在的一种成体干细胞,同样具有增殖、多向分化及自我更新能力。牙髓干细胞除了能分化为脂肪干细胞和神经干细胞外,还能形成牙本质牙髓样复合体,牙髓样复合体是未来牙再生的第一步,这也说明牙髓干细胞在活髓保存治疗中的重要作用[6]。脂多糖是内毒素主要的致病因素,可直接影响牙髓细胞[7]。研究显示,低浓度的脂多糖能够使牙髓成纤维细胞与基质合成,从而促进细胞的增殖,而高浓度的脂多糖可抑制牙髓细胞增殖及碱性磷酸酶活性[8]。碱性磷酸酶(ALP)是一种磷酸单酯水解酶,参与骨、牙齿等的再生、代谢、形成等过程[9]。牙本质基质蛋白1(DMP1)是一种活性蛋白,参与细胞的成牙及成骨等的分化[10]。牙本质涎蛋白(DSPP)是由成釉细胞和成牙本质细胞分泌,在牙本质形成、牙本质分化及矿化过程中发挥重要作用[11]。本研究检测脂多糖对牙髓干细胞增殖及ALP、DMP1、DSPP的mRNA表达的影响,结果显示,脂多糖能降低牙髓干细胞的增殖及上调ALP、DMP1、DSPP的mRNA表达。
细胞凋亡是细胞功能的一个重要部分,可清除一些特定的细胞,对内环境稳定、生物体的进化及个体的生长发育有重要影响。在牙胚组织、牙源性细胞的发育过程中凋亡也起到了重要作用[12]。研究显示,细胞凋亡可影响牙胚发育过程中的形态及结构[13]。半胱氨酸天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3,Caspase-3)是细胞凋亡过程中的关键蛋白,属于Caspase家族成员,在正常组织中主要以无活性的形式存在,多种凋亡途径最终都会引起Caspase-3的活化,活化的Caspase-3导致细胞以凋亡的形式解体[14,15]。本研究检测脂多糖对牙髓干细胞及Cleaved caspase3蛋白表达的影响,结果显示,脂多糖可诱导牙髓干细胞凋亡及上调Cleaved caspase3蛋白表达。
Notch信号通路是在进化过程中高度保守的一条信号通路,在脊椎动物和无脊椎动物中广泛存在,在细胞的增殖、凋亡、分化等过程中发挥重要作用[16]。随着牙髓干细胞的发现及鉴定,Notch信号通路在牙髓干细胞中的调控作用也得到研究[17]。研究显示,Notch信号通路的激活可降低牙髓干细胞的增殖及分化,在牙齿损伤中也可检测到Notch信号通路的激活[18]。本研究检测Notch信号通路相关蛋白Notch1、Hes1蛋白表达,结果显示,脂多糖可显著上调Notch1、Hes1蛋白表达。 综上所述,脂多糖可通过激活Notch信号通路降低hDPSCs的增殖,促进其矿化和凋亡。该研究为牙髓损伤修复的机制提供了理论基础。
[1] Berger RP,Sun YH,Kulik M,etal.ST8SIA4-dependent polysialylation is part of a developmental program required for germ layer formation from human pluripotent stem cells[J].Stem Cells,2016,34(7):1742-1752.
[2] Gorin C,Rochefort GY,Bascetin R,etal.Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion[J].Stem Cells Translational Med,2016,5(3):392-404.
[3] Hoshino K,Takeuchi O,Kawai T,etal.Pillars article:cutting edge:toll-like receptor 4(TLR4)-deficient mice are hyporesponsive to lipopolysaccharide:evidence for TLR4 as the lps gene product.J Immunol,1999,162:3749-3752[J].J Immunol,2016,197(7):2563-2566.
[4] Kim JH,Woo SM,Choi NK,etal.Effect of platelet-rich fibrin on odontoblastic differentiation in human dental pulp cells exposed to lipopolysaccharide[J].J Endodontics,2017,43(3):433-438.
[5] Chen L,Zheng L,Jiang J,etal.Calcium hydroxide-induced proliferation,migration,osteogenic differentiation,and mineraliz-ation via the mitogen-activated protein kinase pathway in human dental pulp stem cells[J].J Endodontics,2016,42(9):1355-1361.
[6] Niu L,Pei D,Morris M,etal.Mineralogenic characteristics of osteogenic lineage-committed human dental pulp stem cells following their exposure to a discoloration-free calcium aluminosilicate cement[J].Dental Materials,2016,32(10):1235-1247.
[7] Hong TP,Carter MQ,Struffi P,etal.Conjugative type IVb pilus recognizes lipopolysaccharide of recipient cells to initiate PAPI-1 pathogenicity island transfer in Pseudomonas aeruginosa[J].BMC Microbiol,2017,17(1):31.
[8] Feng G,Zheng K,Song D,etal.SIRT1 was involved in TNF-α-promoted osteogenic differentiation of human DPSCs through Wnt/β-catenin signal[J].Vitro Cell Deve Biol-Animal,2016,52(10):1001-1011.
[9] Jansen JC,Timal S,van Scherpenzeel M,etal.TMEM199 deficiency is a disorder of Golgi homeostasis characterized by elevated aminotransferases,alkaline phosphatase,and cholesterol and abnormal glycosylation[J].Am J Human Gene,2016,98(2):322-330.
[10] Al-Jazzar A,Javaheri B,Prideaux M,etal.Dmp1 promoter-driven diphtheria toxin receptor transgene expression directs unforeseen effects in multiple tissues[J].Int J Mol Sci,2016,18(1):29.
[11] Nurrohman H,Saeki K,Carneiro KMM,etal.Repair of dentin defects from DSPP knockout mice by PILP mineralization[J].J Materials Res,2016,31(3):321-327.
[12] Jiao Y,Ma S,Wang Y,etal.N-acetyl cysteine depletes reactive oxygen species and prevents dental monomer-induced intrinsic mitochondrial apoptosis in vitro in human dental pulp cells[J].PLoS One,2016,11(1):e0147858.
[13] Choi HY,Park JH,Jang WB,etal.High glucose causes human cardiac progenitor cell dysfunction by promoting mitochondrial fission:role of a GLUT1 blocker[J].Biomolecules Therap,2016,24(4):363.
[14] 杨文慧,郭 涛,杨 莉,等.体外心脏震波对大鼠心肌梗死后心肌凋亡的影响[J].中国老年学杂志,2016,36(2):265-267.
[15] Huang K,Zhang J,O′Neill KL,etal.Cleavage by caspase 8 and mitochondrial membrane association activate the BH3-only protein bid during TRAIL-induced apoptosis[J].J Biological Chem,2016,291(22):11843-11851.
[16] Wang Z,Li Y,Banerjee S,etal.Down-regulation of Notch-1 and Jagged-1 inhibits prostate cancer cell growth,migration and invasion,and induces apoptosis via inactivation of Akt,mTOR,and NF-B signaling pathways(Retraction of vol 109,pg 726,2010)[J].J Cell Biochem,2016,117(8):1960-1960.
[17] Siew Ching H,Luddin N,Ab Rahman I,etal.Expression of odontogenic and osteogenic markers in DPSCS and SHED:a review[J].Curr Stem Cell Res Ther,2017,12(1):71-79.
[18] AlAmer N,Bondalapati A,Garcia-Godoy F,etal.Osteogenic differentiation of orofacial tissue-derived mesenchymal stem cells-a review[J].Curr Tissue Engineering,2016,5(1):11-20.
[收稿2017-03-27 修回2017-06-03]
(编辑 许四平 刘格格)
Effectsoflipopolysaccharideonproliferation,differentiationandapoptosisofhumandentalpulpstemcellsbyNotchsignalingpathway
XIANGHai-Dong,LIHao-Bo,CHENHui-Zhen.
DepartmentofOralMedicine,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
Objective:To investigate the effects and its mechanism of lipopolysaccharide on the proliferation,differentiation and apoptosis of human dental pulp stem cells by Notch signaling pathway.MethodsHuman dental pulp stem cells(hDPSCs)was isolated from dental pulp tissue;cell proliferation was detected after 0,0.1,1,10 μg/ml treated cells for 1,3,5,7 days by CCK8 test;related mRNA expression ALP,DSPP,DMP1 gene was detected after 1 μg/ml lipopolysaccharide treated hDPSCs for 0,3,7,14,21 day by RT-PCR;cell apoptosis was detected after 1 μg/ml lipopolysaccharide treated hDPSCs for 0,7,14,21 day by flow cytometry.Cleaved caspase3,Notch1,Hes1 protein expression was detected by Western blot.ResultsCell proliferation after different concentrations lipopolysaccharide stimulated hDPSCs for 1,3,5 days had no significant difference,significantly lower at 7 day than 0 μg/ml lipopolysaccharide group(P<0.01).ALP,DSPP,DMP1 mRNA expression lipopolysaccharide treated hDPSCs at 3 day compared with the control group had no statistical significance(P>0.05),significantly higher at 7,14,21 day than control group(P<0.01);cells apoptosis rate and Cleaved caspase3,Notch1,Hes1 protein expression lipopolysaccharide treatment hDPSCs at 7,14 and 21day was significantly higher than the control group(P<0.01);ALP,DSPP,DMP1 mRNA expression and apoptosis rate and Cleaved caspase3,Notch1,Hes1 protein expression at 21 day was a downward trend.ConclusionLipopolysaccharide can decrease the proliferation of hDPSCs and promote its mineralization and apoptosis,which may be related to the activation of Notch signaling pathway.
Lipopolysaccharide;Notch signaling pathway;Human dental pulp stem cells;Proliferation;Differentiation;Apoptosis
R781
A
1000-484X(2017)10-1483-05
10.3969/j.issn.1000-484X.2017.10.009
项海东 (1982年-),男,硕士,主治医师,主要从事牙体牙髓及牙周病研究,E-mail:67556483@qq.com。
及指导教师:陈惠珍(1957年-),女,主任医师,主要从事牙体牙髓、牙周病及口腔黏膜病研究,E-mail:kqchenhuizhen@163.com。

