SO2湿沉降对桑树叶片的形态和其利用光能的影响
王 月,李学鹏,彭鸿旭,朱义勇,张秀丽,孙广玉
(东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
SO2湿沉降对桑树叶片的形态和其利用光能的影响
王 月,李学鹏,彭鸿旭,朱义勇,张秀丽,孙广玉
(东北林业大学生命科学学院,黑龙江 哈尔滨 150040)
以桑树(Morusalba)为材料,用亚硫酸钠和亚硫酸氢钠的混合溶液模拟SO2湿沉降,探讨SO2湿沉降对桑树叶片光合特性的影响。结果表明,与清水对照(CK)相比,100 mmol·L-1SO2湿沉降明显伤害了桑树叶片,表现出叶片失绿发黄、边缘焦枯、含水量下降,细胞皱缩且边缘模糊,气孔数量减少,叶片最大净光合速率显著下降(P<0.05)。在50 mmol·L-1SO2胁迫下,桑树幼苗表现出一定的抗性,叶片边缘略呈焦枯状态,叶色浓绿,内部细胞体积减小,密度增大,气孔数量增多,最大净光合速率下降,光呼吸速率、蒸腾速率和水分利用效率增加。说明桑树叶片可通过调整叶片结构,降低呼吸消耗和增大光呼吸及蒸腾速率来适应50 mmol·L-1SO2胁迫。两种浓度SO2处理的叶绿素荧光与光强的响应参数变化趋势相似,差异不显著(P>0.05),当光强大于400 μmol·mol-1时,实际光化学效率、光化学淬灭系数和电子传递速率随着光强的增加而显著降低(P<0.05),非光化学淬灭系数和非光化学淬灭值均显著增加(P<0.05)。说明SO2湿沉降降低了桑树叶片净光合速率,增强了呼吸消耗,促使叶片早衰。桑树可通过调整叶片自身结构、增加热耗散和提高水分利用效率等多种途径适应SO2胁迫,且对低浓度SO2胁迫表现出抗性。
SO2污染;桑树;扫描电镜;响应曲线;光饱和点;CO2补偿点;光呼吸
SO2是主要的大气污染气体之一,在一定条件下,SO2会氧化而成硫酸雾或硫酸盐气溶胶,是环境酸化的重要前驱物。SO2主要来源于煤、石油富硫化石燃料的燃烧、工业气体的排放和火山喷发等[1]。高浓度的SO2在大气中结合水形成酸雨沉降,使土壤酸化从而间接影响植物生长[2],亦或通过气孔进入植物细胞后在质外体中溶解形成亚硫酸根和亚硫酸氢根离子,然后进入细胞对植物产生伤害[3]。SO2影响到植物的许多关键生理过程,如,叶片细胞膜透性和膜脂过氧化产物增加,保护酶活性增强以抵御SO2胁迫等[3]。SO2湿沉降通过H2S信号转导系统,能够调节植物内储藏物质的动员和活性氧水平,促使植物种子在铝盐胁迫下萌发[4],这可能与硫是构成细胞的大量元素有关,硫是细胞内甲硫氨酸、半胱氨酸、蛋白质的二硫键等重要成分[5]。因此,SO2对植物的作用具有双重性,既有害又有利,而具体的效应阈值因物种不同存有较大差异。
随着城市化进程和工业的快速发展,尤其是汽车数量剧增[6],导致大气中SO2污染源日趋增多,虽然欧盟、美国、英国以及我国都纷纷出台相关政策控制SO2[7],并取得一定的成效,但不能完全解决这一问题。植物具有吸收大气SO2能力,依据吸收利用能力不同,筛选对大气SO2抗性或忍受力强的植物已成研究的焦点。研究发现,茶花(Camelliajaponica)、香樟(Cinnamomumcamphora)、杨梅(Myricarubra)和常春藤(Hederanepalensisvar.sinensis)对SO2具有很强的抗性[8]。桑(Morusalba)树为桑科桑属落叶乔木或灌木,是我国自古以来的重要的经济树种,以往桑叶用于养蚕、根皮入药,而今桑树又被广泛的开发,赋予多项使命,如利用桑果开发饮料和保健品,桑叶作茶饮或功能性食品等,此外桑枝叶具有的营养丰富高于绝大多数传统饲料[9],可作为新型的高蛋白饲料源[10]。近期研究发现,桑树与豆科植物间作可改善盐碱地土壤质量,降低土壤pH,提高植物生产力[11]。因此,桑树不仅是一种重要的经济作物,而且还可以作为一种脆弱生态地植被恢复的先锋树种[12]。随着“东桑西移、南桑北移”政策的实施和开展,桑树(尤其是饲料桑)的种植面积逐年扩大。桑树适应性强、生长快、产量高、品质佳等饲用特性使其在草地农业系统中的开发日益受到重视[13],不但可在农村的路旁、地头、堤坝等零散地栽植,亦可在盐碱、贫瘠和工厂附近荒废地栽植。研究发现,适度酸雨(pH≥4.5)沉降可促进桑树光合作用,有利于桑树生长,原因在于酸雨中含有氮、硫等植物必须大量元素,可促进气孔开度和碳同化[14]。而有研究报道桑树对大气SO2污染具有一定的抵抗能力[15],但其对桑树光合作用的影响研究为数不多,为了探究SO2湿沉降对桑树光合特性的影响,本研究以东北地区广为推广的桑树品种“青龙桑”为材料,采用仪慧兰等[16]的方法,以不同浓度的亚硫酸钠和亚硫酸氢钠的混合溶液,模拟不同浓度的SO2湿沉降对桑树叶片进行喷施,探讨SO2胁迫对桑树叶片形态、亚细胞结构和光合特性的影响机制,其结果可为SO2污染严重地区的城市绿化和退耕还林树种的选择提供一定的参考数据和理论依据。
1 材料与方法
1.1试验材料
试验于2015年5-10月在东北林业大学植物生理实验室进行,供试桑树品种为一年龄实生苗“青龙桑”,种子由黑龙江省蚕业研究所提供,发芽培育后待植株长到10 cm左右移栽到直径12 cm、高15 cm的培养钵中,为保证试验材料的相对一致性,在移植时将桑树幼苗去掉分支和叶片,只保留主根和主茎各2 cm,每钵定植3株,共计90株;培养基质则由草炭土和清洗过的蛭石均匀混合而成。所有桑树均置于相同环境中保证各项生长条件相对一致,待植株长到50 cm左右时选取长势一致的苗木进行处理。
1.2试验处理
根据SO2在中性水溶液中亚硫酸根和亚硫酸氢根离子摩尔浓度之比为3∶1[16],试验采用亚硫酸钠和亚硫酸氢钠按照摩尔浓度3∶1配制的混合溶液模拟SO2湿沉降的污染状态。选取18株长势一致的苗木分为3组,每组6株,分别用浓度为0(CK)、50、100 mmol·L-1的混合溶液进行喷施处理,每3 d喷施一次,为保证桑树叶片完全吸收混合液,喷施时叶片正反面均喷施到液滴聚集下降为止,同时为了防止SO2湿沉降到土壤对根系的影响,喷施时利用塑料将盆表面覆盖。待试验的桑树叶片出现较为明显的胁迫症状后开始测定各项指标。
1.3测定项目和方法
光响应曲线的测定:在天气晴朗的条件下,待测试验苗木先在自然光下诱导1.0~1.5 h,在北京时间09:00-13:00利用Li-6400光合仪的光合测定系统,使用仪器自带光源设定光强梯度为1 800、1 500、1 200、900、600、400、200、100、50、20和0 μmol·(m2·s)-1,按照光强由低到高的顺序分别测定0、50、100 mmol·L-1的模拟SO2湿沉降的亚硫酸钠和亚硫酸氢钠混合溶液处理的桑树完全展开功能叶片的净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs) 等,每组重复测定3次。所得的数据利用Photosynthesis Work Bench程序软件求得Pn-PFD响应曲线以及光补偿点(LCP)、光饱合点(LSP)、表观量子效率(AQY)、光饱合时的净光合速率(Pmax)、暗呼吸速率(Rd)等。
CO2响应曲线的测定:待测苗木先在自然光下诱导1.5 h后,在北京时间09:00-13:00采用开放式气路,温度设为25 ℃,使用Li-6400液化CO2钢瓶提供不同的CO2浓度,设定CO2浓度梯度为1 500、1 200、1 000、800、600、400、300、200、100和50 μmol·mol-1,测定PAR为1 200 μmoL·(mol·s2)-1,按照CO2浓度由低到高的顺序分别测定0、50、100 mmol·L-1模拟SO2湿沉降混合溶液处理的桑树完全展开功能叶片的净光合速率(Pn)。每组重复测定3次。用Photosynthesis Work Bench程序软件求得初始羧化效率(CE)、光呼吸速率(Rp)、最大净光合速率(Amax)、饱和胞间CO2浓度(Ci)和CO2补偿点(Γ)。
叶绿素含量的测定:每组选取质量相同的叶片经剪碎后,加入到适量的80%丙酮浸泡,4 ℃暗处放置72 h,期间多次摇晃,浸提液用分光光度计在663和645 nm处测定吸光值,按照Porra[17]的方法计算叶绿素含量。
叶片含水量的测定:光合测定的叶片取下,直接称量鲜重,后放到80 ℃烘箱烘至恒重,测干重。
含水量=(鲜重-干重)/鲜重×100%。
扫描电镜样品制备:取叶片中部中脉附近的部分,切成2 mm×5 mm的小条,用pH 6.8戊二醛进行固定,并经50%、70%、90%、100%和100%的乙醇系列脱水,然后用100%乙醇∶叔丁醇=1∶1、纯叔丁醇各置换一次。再将样品放入-20 ℃的冰箱冷冻30 min,放入ES-2030(HITACHI)型冷冻干燥仪对样品进行干燥,精密刻蚀喷镀仪镀金后,进行观察拍照。
1.4数据处理方法
运用Excel(2003)和DPS(7.05)软件进行数据统计分析,采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异。
2 结果与分析
2.1SO2湿沉降对桑树叶片形态及叶片表层结构的影响
不同浓度SO2湿沉降处理对桑树叶片形态的影响显著,而且随着溶液浓度升高,叶片边缘萎蔫枯萎面积增大,其中浓度为50 mmol·L-1的处理叶色浓绿程度明显高于另外两个处理(图1);同时,对叶片中部中脉附近表层结构进行扫描电镜的结果显示,该处理的叶片内细胞边缘清晰、体积减小,单位面积内细胞数目增多,气孔密度增多;而浓度为100 mmol·L-1的处理叶色变浅呈黄绿色,细胞边缘模糊,形态上表现为气孔凹陷,保卫细胞皱缩。叶片的腺毛数量及分布在各处理间差异不明显。
2.2SO2湿沉降对桑树叶片叶绿素含量和含水量的影响
随着SO2湿沉降浓度的增加,叶绿素含量增多,50和100 mmol·L-1处理叶片的叶绿素总含量分别较CK高出46.1%(P>0.05)和56.2%(P<0.05),其中,叶绿素a的含量分别较CK高51.2%(P>0.05)和59.5%(P<0.05),叶绿素b的含量分别较CK高31.8%(P>0.05)和46.9%(P<0.05)(图2)。而叶片的含水量也随着SO2湿沉降浓度的增加而下降,50和100 mmol·L-1湿沉降处理叶片的含水量分别较CK低13.2%(P>0.05)和37.4%(P<0.05)。

图1 SO2湿沉降处理浓度对桑树叶片形态及细胞形态和结构的影响Fig. 1 Effect of SO2 wet deposition on morphology and structure of cell of mulberry leaf

图2 SO2湿沉降处理浓度对桑树叶片叶绿素含量和含水量的影响Fig. 2 Effect of SO2 wet deposition on chloroform contents and water contents of mulberry leaves
注: 不同小写字母表示不同SO2处理之间差异显著(P<0.05)。
Note: Different lowercase letters indicate significant difference among different SO2wet deposition treatments at the 0.05 level.
2.3SO2湿沉降对桑树叶片净光合速率的光强和CO2响应曲线
不同浓度模拟SO2湿沉降混合溶液处理的桑树叶片的Pn-PAR曲线有较大差异,在光强低于300 μmol·(m2·s)-1时,且各处理的桑树叶片的Pn无显著差异,即3种处理叶片的光合能力对弱光的利用率相差不大。随着光强的增加, CK的Pn明显大于经过SO2湿沉降处理的Pn,表现为CK>50 mmol·L-1>100 mmol·L-1。在光强超过600 μmol·(m2·s)-1时,随着光强继续增加,100 mmoL·L-1的Pn增幅减小,光响应曲线趋于平缓,而SO2湿沉降的Pn随着光强的增加仍呈明显的增加趋势,光响应曲线继续增长,当光强超过1 000 μmol·(m2·s)-1时,浓度为50 mmol·L-1SO2湿沉降处理的Pn响应曲线也趋于平缓,不再增加。而CK的Pn响应曲线则缓慢上升。不同浓度的模拟SO2湿沉降混合溶液处理的桑树叶片的Pn-Ci曲线差异不大,浓度小于100 mmol·L-1的SO2湿沉降处理的桑树叶片的净光合速率CO2响应曲线变化趋势相似,其Pn值均随着CO2浓度增加呈上升趋势。当CO2浓度低于600 μmol·mol-1时,Pn随着CO2浓度增加近似呈直线增加,随后,随着CO2浓度继续增加,Pn的增加速率逐渐减缓。当CO2浓度达到1 500 μmol·mol-1,Pn曲线渐趋平缓,不再上升。在相同CO2浓度条件下,3个处理的桑树叶片的Pn相差不显著,表明它们的碳同化能力基本相同。此外,当CO2浓度低于100 μmol·mol-1时,3个处理桑树叶片的光合产物积累均为负值,说明桑树叶片对CO2的具有典型的C3植物的特征,CO2的补偿点小于30 μmol·mol-1。

图3 SO2湿沉降处理对桑树叶片的光强和CO2响应曲线的影响Fig. 3 Effect of SO2 wet deposition on Pn-PAR and Pn-Ci curves from mulberry leaves
根据上述光响应曲线得到的表观量子效率(AQY)、暗呼吸速率(Rd)、光补偿点(LCP)、光饱和点(LSP)、最大净光合速率(Pmax)、初始羧化效率(CE)、光呼吸速率(Rp)、最大净光合速率(Amax)、饱和胞间CO2浓度(Cisat)和CO2补偿点(Γ)等光强和CO2响应曲线特征参数(表1),由此得知,浓度为50 mmol·L-1模拟SO2湿沉降处理的桑树叶片的AQY、LSP和Pmax分别较CK 低1.59%(P>0.05)、19.90%(P<0.05)和35.29%(P<0.05),而Rd和LCP分别较CK低48.25%(P<0.05)和45.45%(P<0.05);而浓度为100 mmol·L-1模拟SO2湿沉降混合溶液处理的桑树叶片的AQY、LSP和Pmax分别较CK低17.46%(P>0.05)、45.56%(P<0.05)和40.88%(P<0.05),而Rd和LCP分别较CK高12.28%(P>0.05)和25.76%(P>0.05)。浓度为50 mmol·L-1模拟SO2湿沉降处理的桑树叶片的CE和Rp分别高于CK 7.32%(P>0.05)和9.67%(P<0.05),而Amax、Cisat和Γ则分别低于CK 8.36%(P>0.05)、高于CK 13.77%(P>0.05)和2.08%(P>0.05);浓度为100 mmol·L-1模拟SO2处理的桑树叶片的CE和Rp分别高于CK 87.80%(P<0.05)和49.87%(P<0.05),而Amax、Cisat和Γ分别低于CK 7.91%(P>0.05)、5.32%(P>0.05)和7.61%(P>0.05)。
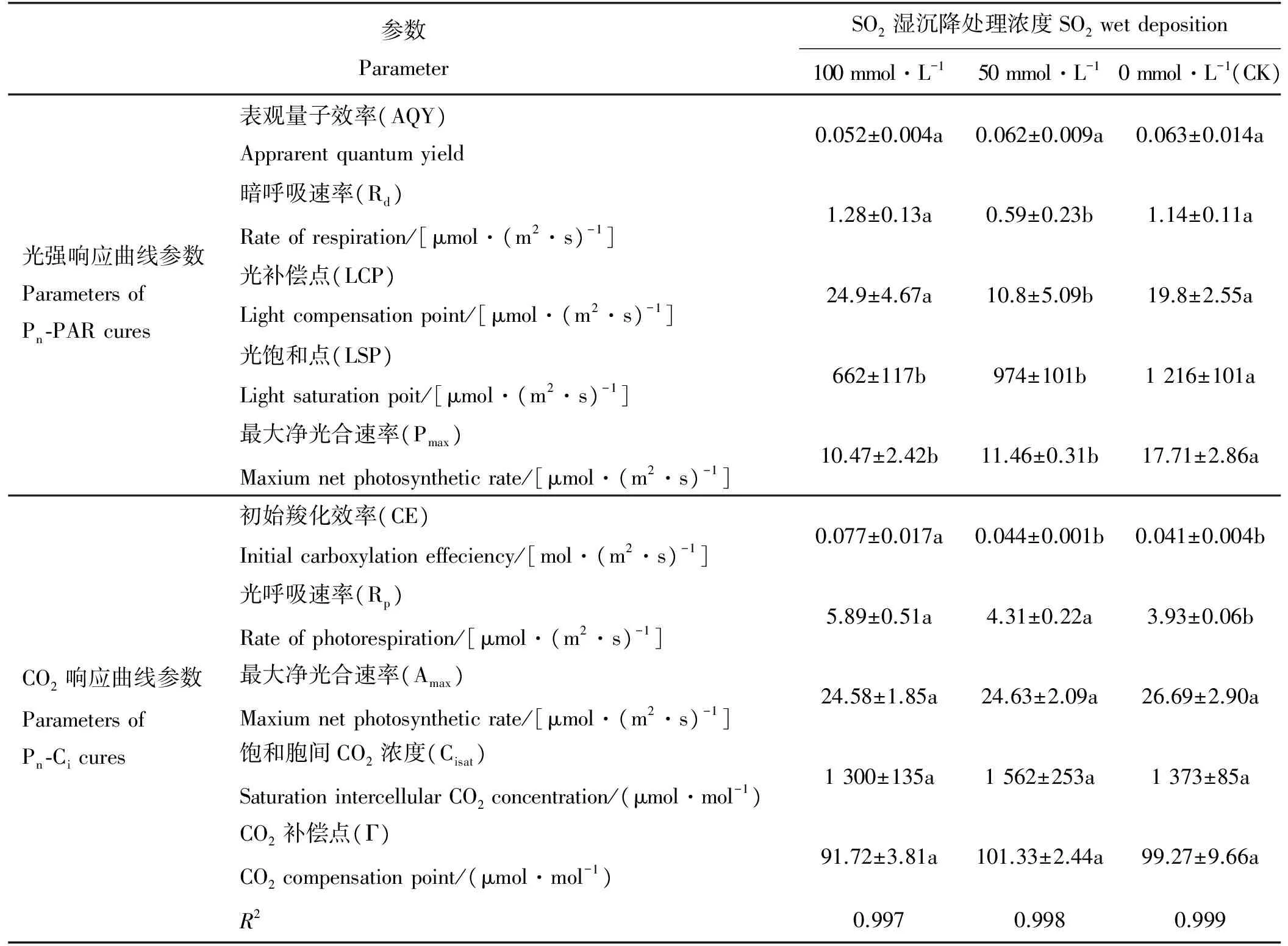
表1 SO2湿沉降处理对桑树叶片光强和CO2响应曲线参数的影响Table 1 Effect of SO2 wet deposition on Pn-PAR and Pn-Ci curves of mulberry leaves.
注:同行不同小写字母表示不同SO2湿沉降处理间差异显著(P<0.05)。
Note: Different lowercase letters indicate significant difference among different SO2wet deposition treatments at the 0.05 level.
不同浓度的SO2湿沉降处理的桑树叶片的胞间CO2浓度(Ci)、气孔导度(Gs)、蒸腾速率(Tr)和水分利用效率(WUE)的光强响应曲线变化不尽相同(图5)。对于Ci光响应曲线,随着光强增加,3个处理均呈先降后升的趋势,在光强小于500 μmol·(m2·s)-1时,浓度为50和100 mmol·L-1的SO2湿沉降混合溶液处理的桑树叶片的Ci均高于CK,但差异不显著,而当光强大于600 μmol·(m2·s)-1时,3个处理的Ci值缓慢增加而趋于稳定;而Gs光响应曲线,随着光强增加3个处理均呈上升的趋势,浓度为50 mmol·L-1和CK的SO2湿沉降处理的桑树叶片的Gs差异不显著(P>0.05),但均显著高于浓度为100 mmol·L-1(P<0.01);桑树叶片的Tr和Vpdl的光响应曲线趋势在不同SO2处理间差异显著,其中100 mmol·L-1>CK>50 mmol·L-1,在光强小于400 μmol·(m2·s)-1时3个处理上升均比较缓慢,随着光强增加,CK处理的叶片的增幅明显增大,而100和50 mmol·L-1SO2湿沉降处理的桑树叶片的Tr值则上升幅度略小;而CK和50 mmol·L-1SO2湿沉降处理的桑树叶片的Vpdl值的光响应曲线变化幅度不大,两者差异不显著(P>0.05),但均显著小于100 mmol·L-1的值(P<0.05)。对于WUE光响应曲线,在光强小于500 μmol·(m2·s)-1时,3个处理的WUE均随光强迅速增加,但光强超过500 μmol·(m2·s)-1后,WUE逐渐趋于稳定,当光强超过1 200 μmol·(m2·s)-1后,WUE又有所降低,就整体而言,CK和50 mmol·L-1SO2湿沉降液处理的桑树叶片的WUE差异不显著(P>0.05),但均显著高于100 mmol·L-1(P<0.05)。
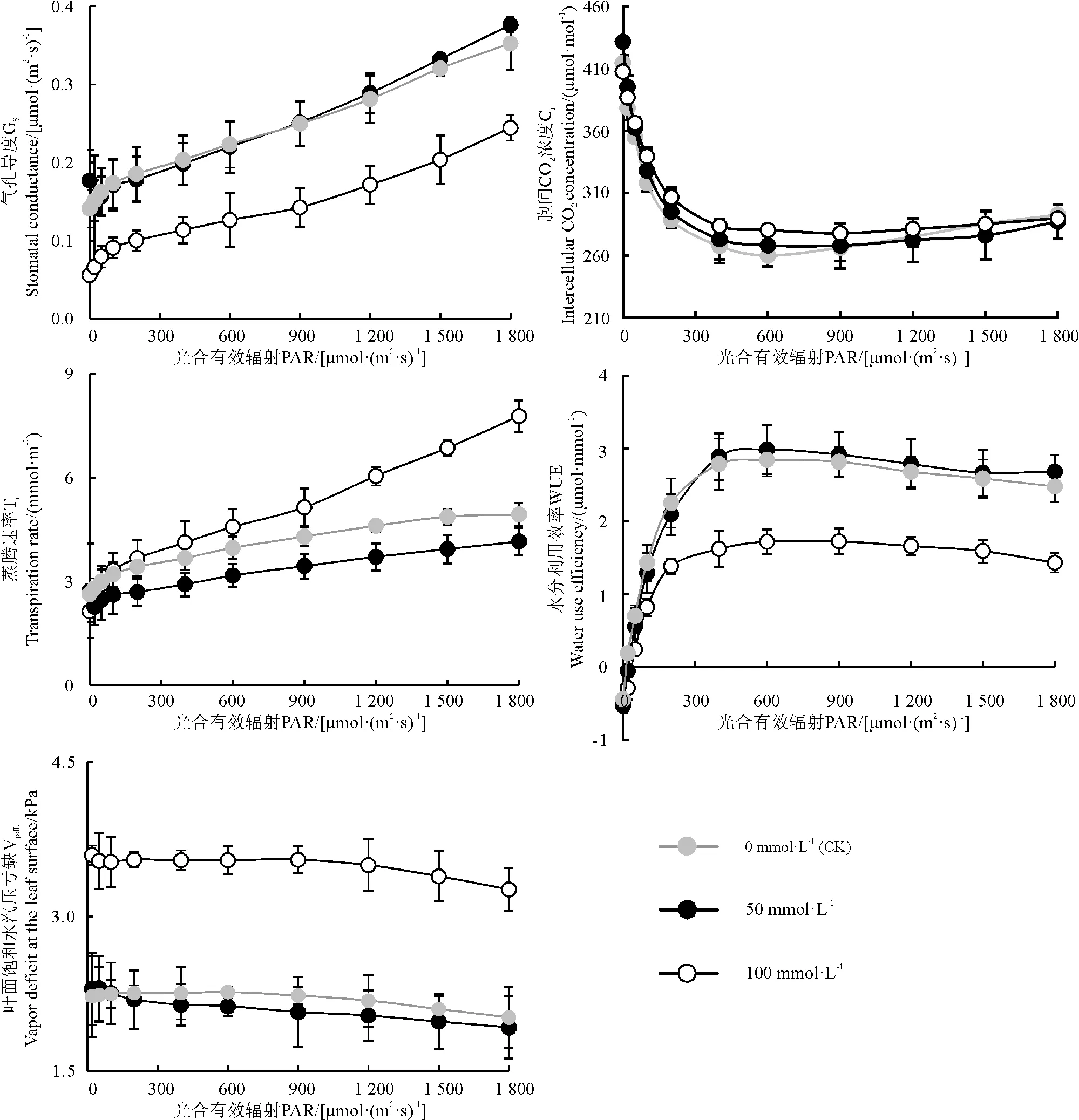
图4 SO2湿沉降处理度对桑树叶片光合气体交换参数的光响应曲线的影响Fig. 4 Effect of SO2 wet deposition on parameters of photo gas exchange response PAR of mulberry leaves
3 讨论与结论
光合作用是植物赖以生存和生长的基础,植物的光合作用受到多种条件的影响,本研究主要探究SO2湿沉降对桑树光合特性的影响,因此用两组浓度较高的亚硫酸钠和亚硫酸氢钠混合溶液模拟SO2湿沉降。同时,对不同浓度的模拟SO2湿沉降进行pH测定,发现它们的pH差异非常小且都接近中性,所以模拟SO2湿沉降混合液对桑树生长产生生理效应主要为浓度效应。在本研究中,模拟SO2湿沉降处理桑树叶片出现焦枯的症状,这与窦宏伟等[15]采用SO2熏蒸桑树试验结果相一致;而叶绿素含量易受外界环境因子的影响,进而影响叶片的光合性能,敖红和张羽[18]发现,模拟SO2湿沉降处理的云杉(Piceakoraiensis)叶片的叶绿素含量明显下降,而在本研究中,桑树叶片中叶绿素含量随着SO2湿沉降浓度的增加而增加,而叶片的含水量显著下降,根据叶片颜色即(CK翠绿,50 mmol·L-1深绿,100 mmol·L-1黄绿),推断高浓度SO2湿沉降处理(100 mmol·L-1),叶片叶绿素含量上升的主要原因是由叶片含水量下降导致的。结合光响应曲线可以推测出高浓度的混合溶液对桑树有一定的胁迫作用。扫描电镜观察结果显示,浓度为50 mmol·L-1处理的叶片内细胞密度增加,气孔增多,同样有研究发现随着盐浓度提高,植物气孔数目增多,同样水稻(Oryzasativa)在盐胁迫下气孔密度增加[19],有人认为这是植物在逆境下具有调整外部结构适应能力的表现[20],但菠菜(Spinaciaoleracea)和草莓 (Fragaria×ananassa)在盐胁迫下叶片气孔密度降低[21-22],这可能是由于物种间的差异性所致。
模拟SO2湿沉降对桑树叶片光强响应曲线及其参数的具有显著影响,当光照强度高于300 μmol·(m2·s)-1各处理间净光合速率差异随着光强的增大而显著。表观量子效率反映植物叶片对光强尤其是弱光的利用能力[23],用SO2湿沉降处理的桑树叶片的表观量子效率均低于对照组,说明其对光响应较敏感,叶片细胞内与吸收和转换光能有关的色素蛋白复合体可能较少[24],尽管浓度为50 mmol·L-1SO2湿沉降处理桑树叶片叶色深绿,叶绿素含量增加,但最大净光合速率在一定程度上也反映植物对光能的利用能力及生产有机物的能力,最大净光合速率明显低于对照组。光补偿点和光饱和点是衡量植物利用光合作用的重要指标,该浓度处理桑树叶片的光补偿点光饱和点显著低于对照组,说明它们对强光的忍受能力较弱,暗呼吸速率显著低于对照组,说明桑树叶片通过降低呼吸消耗及增强利用弱光的能力来适应SO2胁迫。环境光强一旦过高,就会引起光抑制,这可能是导致最大净光合速率下降的主要原因[25];但利用弱光的能力增强,且低光强下积累有机物较快,这也是该浓度处理,桑树叶片叶色浓绿的主要原因。而浓度为100 mmol·L-1SO2湿沉降处理的桑树叶片的光饱和点下将而光补偿点上升,即利用弱光和强光的能力均下降,同时,最大净光合速率显著减低,暗呼吸速率增大,气孔导度和水分利用效率显著降低,而蒸腾速率和叶片表面水汽压亏缺显著上升,说明高浓度(100 mmol·L-1)SO2湿沉降处理的桑树叶片光合性能受到严重抑制的原因在于叶片中水分的匮乏。
各浓度模拟SO2湿沉降对桑树叶片CO2响应曲线及其参数的影响差异不显著,在CO2浓度相同条件下,3个浓度的桑树叶片的净光合速率值间无差异,浓度为100 mmol·L-1模拟SO2湿沉降对桑树叶片的初始羧化效率显著高于对照组,初始羧化效率能够反映了1,5-二磷酸核酮糖羧化酶(Rubisco)的含量以及活性[26],说明高浓度的SO2湿沉降可提高桑树叶片Rubisco的活性,而光呼吸速率同样增加,表明其叶片在高浓度SO2湿沉降桑树叶片可以通过光呼吸消耗过剩光能来减轻这种不利条件对叶片的伤害,有利于保护光合系统和维持较高光合速率。最大净光合速率反映了植物叶片的光合电子传递和磷酸化的活性[24],饱和胞间CO2浓度反映了植物利用高CO2浓度的能力,CO2补偿点是植物净光合速率为零时的CO2浓度,此时光合同化与呼吸消耗速率相等[25],而饱和胞间CO2浓度和CO2补偿点则要低于CK。由此可知,高浓度的SO2湿沉降引起桑树叶片光合能力下降的原因还在于碳同化能力下降。
本研究表明SO2湿沉降对桑树光合特性有明显影响,表现在对相关生理功能及细胞结构两个方面,浓度为50 mmol·L-1SO2湿沉降处理各项指标与对照组差别不显著,当SO2湿沉降的浓度达到100 mmol·L-1时与对照组有显著差别,表明桑树对SO2胁迫具有一定的抗性,可以通过调节外部结构和内部代谢途径来适应SO2胁迫,所以桑树可以作为SO2轻中度污染区的“先锋树种”来吸收空气中的SO2,减轻环境污染。
References:
[1] Lang C,Pokpo J,Wirtz M,Hell R,Herschbach C,Krevzwieser J,Zennenberg H,Mendel R,Hansch C.Sulphite oxidase as key enzyme for protecting plants against sulphur dioxide.Plant Cell & Environment,2007,30(4):447-455.
[2] Rydval M,Wilson R.The impact of industrial SO2pollution on north bohemia conifers.Water,Air,& Soil Pollution,2012,223(9):5727-5744.
[3] Teklehaimanot Z.Physiological Plant Ecology:Ecophysiology and stress physiology of functional groups.Forestry,2003,77(4):365-366.
[4] 张军,李素清,狄晓艳,武冬梅.山西工矿区土壤二氧化硫与多环芳烃复合污染对小麦种子萌发和幼苗生长的影响.生态毒理学报,2012,7(6):646-656.
Zhang J,Li S Q,Di X Y,Wu D M.Effects of combined pollution of SO2and PAHs on seed germination and growth of wheat seedlings in Shanxi industrial and mining area.Asian Journal of Ecotoxicolog,2012,7(6):646-656.(in Chinese)
[5] Kokl J D,Stulen I,Castro A,Durenkamp M,Koralewska A.Pathways of plant sulfur uptake and metabolism:An overview.Landbauforschung Volkenrode,2005,283:5-13.
[6] 史韵.广东省机动车排气检测监控管理系统应用研究.广州:华南理工大学硕士学位论文,2011.
Shi Y.Case study of Guangdong provincial vehicle emission detecting monitoring and management system.Master Thesis.Guangzhou:South China University of Technology,2011.(in Chinese)
[7] 程金灿.吉林省“十二五”期间大气污染物减排潜力分析研究.长春:东北师范大学硕士学位论文,2012.
Cheng J C.Research on the potentiality of air pollution discharge reduction during 12th five year period in Jilin Province.Master Thesis.Changchun:Northeast Normal University,2012.(in Chinese)
[8] 陈卓梅,李庆荣,杜国坚.浙江省42种园林绿化植物对SO2气体的抗性及吸收能力研究.浙江林业科技,2007,27(6):29-32.
Chen Z M,Li Q R,Du G J.Study on resistance and absorption capacity of SO2gas from 42 landscaping plants in Zhejiang Province.Journal of Zhejiang Forestry Science and Technology,2007,27(6):29-32.(in Chinese)
[9] 袁云香.桑葚在食品加工中的应用.食品工业,2013,34(2):171-173.
Yuan Y X.The application of mulberry on the food processing.The Food Industry,2013,34(2):171-173.(in Chinese)
[10] 黄自然,杨军,吕雪娟.桑树作为动物饲料的应用价值与研究进展.蚕业科学,2006,32(3):377-385.
Huang Z R,Yang J,Lyu X J.The utilization and development of mulberry as animal forage.Science of Sericulture,2006,32(3):377-385.(in Chinese)
[11] 张会慧,赵莉,许楠,朱文旭,李鑫,岳冰冰,孙广玉.间作模式下桑树与大豆叶片的光合日变化特点.经济林研究,2011,29(1):21-26.
Zhang H H,Zhao L,Xu N,Zhu W X,Li X,Yue B B,Sun G Y.Diurnal variation of photosynthesis in leaves of soybean and mulberry in intercropping mode.Nonwood Forest Research,2011,29(1):21-26.(in Chinese)
[12] 秦俭,何宁佳,黄先智,向仲怀.桑树生态产业与蚕丝业的发展.蚕业科学,2010,36(6):984-989.
Qin J,He N J,Huang X Z,Xiang Z H.Development of mulberry ecological industry and sericulture.Science of Sericulture,2010,36(6):984-989.(in Chinese)
[13] 张秀丽,张倩倩,许天修,凌飞,孙广玉.施用化肥和农家肥缓解盐碱地桑树光合午休PSⅡ光抑制.草业科学,2015,32(5):745-753.
Zhang X L,Zhang Q Q,Xu T X,Ling F,Sun G Y.Amelioration of chemical and organic fertilizer on photo-inhibition of PSⅡ at photosynthetic noon-break in mulberry leaves grew in saline-sodic soil.Pratacultural Science,2015,32(5):745-753.(in Chinese)
[14] 胡月,张倩,孙东彬,孙雨薇,张秀丽,孙广玉.模拟酸雨对桑树叶片光合日变化的影响.草业科学,2015,32(11):1862-1870.
Hu Y,Zhang Q,Sun D B,Sun Y W,Zhang X L,Sun G Y.Effects of simulated acid rain on diurnal changes of mulberry(Morusalba) photosynthesis.Pratacultural Science,2015,32(11):1862-1870.(in Chinese)
[15] 窦宏伟,周菲,谢清忠,王维乐,高绘菊,王彦文.SO2胁迫对桑树部分生理生化特性的影响.蚕业科学,2010,36(1):126-131.
Dou H W,Zhou F,Xie Q Z,Wang W L,Gao H J,Wang Y W.Effects of SO2stress on several physiological and biochemical properties of mulberry trees.Science of Sericulture,2010,36(1):126-131.(in Chinese)
[16] 仪慧兰,孟紫强,杜建红.亚硫酸氢钠对大蒜有丝分裂周期的影响.山西大学学报(自然科学版),2001,24(3):262-264.
Yi H L,Meng Z Q,Du J H.The influence of sodium bisulfite for mitotic cycle of garlic.Journal of Shanxi University(Natural Science Edition),2001,24(3):262-264.(in Chinese)
[17] Porra R J.The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophylls a and b.Photosynthesis Research,2002,73(1):149-156.
[18] 敖红,张羽.亚硫酸钠和亚硫酸氢钠混合液对2种云杉某些生理指标影响的比较.植物生理学报,2007,43(2):259-263.
Aohong,Zhang Y.Comparison on effects of mixed liquid of Na2SO3and NaHSO3on some physiological indexes of two spruces.Plant Physiology Communications,2007,43(2):259-263.(in Chinese)
[19] 赵姝丽,陈温福,马殿荣,赵飞.盐胁迫对水稻叶片气孔特性的影响.北方水稻,2006(6):26-29.
Zhao S L,Chen W F,Ma D R,Zhao F.Effects of salt stress on stomatal characteristics of rice leaves.North Rice,2006(6):26-29.(in Chinese)
[20] 沈禹颖.三种盐生境植物叶表的扫描电镜观察(简报).草业学报,1997,6(3):32-36.
Shen Y Y.Scanning electron microscope observation on leaf surface of three species of salt habitats.Acta Prataculturae Sinica,1997,6(3):32-36.(in Chinese)
[21] Downten W J,Grant W J,Robinson S P.Photosynthetic and stomatal responses of spinach leaves to salt stress.Plant Physiology,1985,78(1):85-88.
[22] Turhan.Growth and stomatal behaviour of two strawberry cultivars under long-term salinity stress.Turkish Journal of Agriculture & Forestry,2007,31(1):55-61.
[23] 童方平,徐艳平,宋庆安,龙应忠,易霭琴,李贵.湿地松优良半同胞家系光和CO2响应曲线特征参数的变异规律.南京林业大学学报(自然科学版),2009,33(1):54-58.
Tong F P,Xu Y P,Song Q A,Long Y Z,Yi A Q,Li G.The variance rule of character parameters responding to light and CO2of slash pine’s half-sib.Journal of Nanjing Forestry University(Natural Science Edition),2009,33(1):54-58.(in Chinese)
[24] 宋庆安,李昌珠,童方平,易霭琴.光皮树优良无性系光合生理特性对光强的响应.湖南林业科技,2008,35(6):3-6
Song Q A,Li C Z,Tong F P,Yi A Q.Response of photosynthetic physiological characteristics of superior clones of cornus silsoniana Wanager to light intensity.Hunan Forestry Science & Technology,2008,35(6):3-6.(in Chinese)
[25] 刘高慧,李昆,孙永玉,侯锐,闫红.齿瓣石斛光合特性研究.林业科学研究,2014,27(2):265-269.
Li G H,Li K,Sun Y Y,Hou R,Yan H.Study of photosynthetic characteristics ofDendrobiumdevonianum.Forest Research,2014,27(2):265-269.(in Chinese)
[26] Coste S,Roggy J C,Imbert P,Born C,Bonal D,Dreyer E.Leaf photosynthetic traits of 14 tropical rain forest species in relation to leaf nitrogen concentration and shade tolerance.Tree Physiology,2005,25(9):1127-1137.
EffectofSO2wetdepositiononmorphologyandlightenergyutilizationinmulberryleaves
Wang Yue, Li Xue-peng, Peng Hong-xun, Zhu Yi-yong, Zhang Xiu-li, Sun Guang-yu
(College of Life Science, Northeast Forest University, Harbin 150040, Heilongjiang, China)
In order to explore the effects of SO2wet deposition on the photosynthetic characteristics of leaves of mulberry seedlings, we exposed leaves to simulated SO2wet deposition treatments. Two SO2concentrations (100 and 50 mmol·L-1) were applied. The results showed that compared to 0 mmol·L-1SO2wet deposition (CK), the 100 mmol·L-1treatment clearly damaged mulberry leaves. A wide range of effects were present in treated leaves: chlorosis; leaf blade edges withering; cell shrinkage; indistinct cell edges; decreased stomatal numbers; decreased leaf water content; reduced maximum net photosynthetic rate; significantly reduced light compensation point and light saturation point; and significantly high rates of dark respiration, photorespiration, and transpiration. Overall, light use efficiency by the mulberry leaves was reduced by the 100 mmol·L-1SO2treatment. In mulberry leaves treated with 50 mmol·L-1SO2, the following effects were seen: leaf blade margins were slightly withered; cell volumes were less than those in leaves treated with 100 mmol·L-1SO2; leaves were dark green; leaf water content decreased slightly; cell volume decreased, but cell density increased; stomatal numbers increased; light compensation point, light saturation point, dark respiration, CO2compensation point, and water use efficiency decreased; the maximum net photosynthetic rate decreased; however, photorespiration and transpiration rates increased. We conclude that the mulberry could adjust to the treatment by reducing respiration consumption and increasing photorespiration and transpiration rates to adapt to the 50 mmol·L-1SO2stress. The curve parameters of chlorophyll fluorescence in response to light were similar between the two SO2concentrations stress. The actual photochemical efficiency, photochemical quenching coefficient, and electron transfer rate decreased with the increase in light intensity; these values were significantly lower than those of CK in photon flux density conditions over 400 μmol·mol-1. Meanwhile, photochemical quenching coefficient and photochemical quenching were significantly higher than those of CK. Mulberry, therefore, has some resistance to SO2stress through adapting leaf structures and modifying heat dispersion.
SO2pollution; mulberry; scanning electron microscope; light saturation point; CO2compensation point; chlorophyll fluorescence; photorespiration
Zhang Xiu-li E-mail:xlz619@yeah.net
10.11829/j.issn.1001-0629.2016-0609
王月,李学鹏,彭鸿旭,朱义勇,张秀丽,孙广玉.SO2湿沉降对桑树叶片的形态和其利用光能的影响.草业科学,2017,34(10):2080-2089.
Wang Y,Li X P,Peng H X,Zhu Y Y,Zhang X L,Sun G Y.Effect of SO2wet deposition on morphology and light energy utilization in mulberry leaves.Pratacultural Science,2017,34(10):2080-2089.
S888.1;Q944
A
1001-0629(2017)10-2080-10
2016-12-12
2017-02-24
中央高校基本科研业务费专项资金(2572017CA21);黑龙江省青年科学基金(QC2016018);国家自然科学基金(C160704)
王月(1994-),女,黑龙江肇东人,在读硕士生,研究方向为植物生理生态学。E-mail:2807866840@qq.com
张秀丽(1980-),女,吉林舒兰人,讲师,博士,研究方向为植物生理生态学。E-mail:xlz619@yeah.net
(责任编辑 张瑾)
全国优秀农业期刊、中国核心期刊(遴选)数据库收录期刊
欢迎订阅2018年《中国种业》
《中国种业》是由农业部主管,中国农业科学院作物科学研究所和中国种子协会共同主办的全国性、专业性、技术性种业科技期刊。
刊物目标定位:以行业导刊的面目出现,并做到权威性、真实性和及时性。覆盖行业范围:大田作物、蔬菜、花卉、林木、果树、草坪、牧草、特种种植、种子机械等,信息量大,技术实用。
读者对象:各级种子管理、经营企业的领导和技术人员,各级农业科研、推广部门人员,大中专农业院校师生,农村专业户和广大农业生产经营者。
月刊,大16开,每期20元,全年240元。国内统一刊号:CN11-4413/S,国际标准刊号:ISSN1671-895X,全国各地邮局均可订阅,亦可直接汇款至编辑部订阅,挂号需每期另加3元。

邮发代号:82-132
中国种业编辑部QQ群:115872093微信公众号:中国种业编辑部

