新型基于吖啶酯平台的乙型肝炎病毒表面抗原全自动管式化学发光定量检测试剂的建立和评价
赵辉,温顺华,李丽华,赖燕晖,翁祖星,孙旭东
新型基于吖啶酯平台的乙型肝炎病毒表面抗原全自动管式化学发光定量检测试剂的建立和评价
赵辉,温顺华,李丽华,赖燕晖,翁祖星,孙旭东
100012 北京,中国医科大学航空总医院检验科(赵辉);361022 厦门万泰凯瑞生物技术有限公司(温顺华、李丽华、赖燕晖、翁祖星、孙旭东)
拟建立一种新型基于吖啶酯平台的乙型肝炎病毒表面抗原全自动管式化学发光定量检测试剂。基于自主研发的全自动化学发光免疫检测系统,通过抗体配对筛选,体系调整等方法建立 HBsAg 全自动化学发光定量检测试剂,并与罗氏试剂进行定量相关性比较,使用不同亚型标本进行评价。研发的 HBsAg 定量检测试剂定量范围为 0 ~250 IU/ml,与罗氏试剂检测临床标本具有良好的一致性(2= 0.9794),对国家参考品中的灵敏度参考品检测结果均符合国家标准,试剂对不同亚型的检测性能良好,在 0.05 ~ 250 IU/ml 范围内具有很好的线性(= 0.9990),试剂对国家参考品中的准确度参考品检测结果符合国家标准,稀释 400 倍检测的可报告上限为100 000 IU/ml,批内精密度均小于 10%,批间精密度小于 15%。该研发的试剂具有良好的检测性能,具有广阔的应用前景。
乙型肝炎表面抗原; 试剂盒,诊断; 发光测定法
乙型肝炎病毒(hepatitis B virus,HBV)感染是导致全球每年超过 100 万人死亡的全球性公共卫生问题[1]。在我国,1 ~ 59 岁人群中乙型肝炎病毒表面抗原(hepatitis B surface antigen,HBsAg)阳性率达 5.1% ~ 6.9%,约有8000 万 HBV 携带者[2]。乙型肝炎病毒表面抗原是乙型肝炎病毒的外膜结构蛋白,HBsAg 在 HBV 感染者血清中以三种颗粒形式存在,Dane 颗粒、小球形颗粒和管型颗粒。
自 1967 年首次发现以来,HBsAg 从最初作为慢性乙型肝炎(chronic hepatitis B,CHB)病毒感染的定性诊断指标逐渐发展为目前广泛应用的定量检测指标[3-4]。最初,研究人员发现血液中 HBsAg 水平与肝细胞核中病毒复制模板共价闭合环状(ccc)DNA 具有一定的相关性[5]。在随后的研究中,又发现血清中 HBsAg 水平可以很好地反映治疗应答,监测 HBsAg 水平有助于鉴别聚乙二醇干扰素(PEG-IFN)或核酸类似物治疗无应答的患者,同时可对病人的精细化治疗提供有效信息[6-7]。全自动化学发光检测系统具有灵敏度高、定量范围宽、自动化等优势。但目前 HBsAg 定量检测市场大部分被跨国公司如罗氏、雅培等垄断。本研究基于自主研发的全自动化学发光免疫检测系统研发出 HBsAg 定量检测试剂并进行了相关评价。
1 材料与方法
1.1 材料
1.1.1 生物活性材料 抗 HBsAg 抗体共 8 株,来自厦门万泰沧海生物技术有限公司;HBsAg 突变株 WT、G119R、P120T、C124Y、I126S、Q129R、S136P、C139R、T140I、P144A、G145A、G145R、M204U、M204I、吖啶酯和临床血清样本均来自厦门大学国家传染病与疫苗工程技术研究中心;表面抗原国家参考品来自国家临检中心;WHO HBsAg 标准(2th,NIBSC code00/588)来自英国国家生物制品检定所(NIBSC);磁微粒购自美国 Merck 公司。
1.1.2 主要试剂 乙肝表面抗原定量检测试剂盒(化学发光微粒子免疫检测法)购自美国 Abbott GmbH & Co.KG 公司;乙肝表面抗原定量检测试剂盒(电化学发光法)购自德国 Roche 诊断有限公司。
1.1.3 仪器 Caris200 全自动管式化学发光免疫分析仪及其配套耗材购自厦门优迈科医学仪器有限公司;Berthold Sirius 单管式化学发光检测仪购自德国 Berthold Technologies 公司。
1.2 方法
1.2.1 样本检测 样本的检测严格按照试剂盒操作说明书进行。
1.2.2 磁微粒包被 磁微粒用 50 mmol/L pH 值为 5.0 的 MES 缓冲液洗涤 2 次后加入新配制的EDC 溶液活化 30 min,用 MES 缓冲液洗涤 2 次,加入抗体混匀后 37 ℃反应 3 h,包被结束后用 MES 缓冲液洗涤,并用包含 1% 酪蛋白的磷酸盐缓冲液重悬,置于 4 ℃保存。
1.2.3 吖啶酯标记 取 50 μg 抗体加入到 300 μl 50 mmol/L pH 值为 8.0 的磷酸盐缓冲液中,并加入 5 μl 5 mmol/L 的吖啶酯溶液(吖啶酯用甲基甲酰胺配制),混匀后室温避光反应 30 min;加入甘氨酸溶液终止反应 30 min,最后用 20 mmol/L pH 值为 7.4 的磷酸盐缓冲液 4 ℃透析,去除游离吖啶酯。
1.2.4 单管式化学发光免疫检测 向微孔板中依次加入样本 50 μl、浓度为 0.4 mg/ml 包被了抗体的磁微粒 50 μl,混匀后 37 ℃反应 15 min,通过磁分离系统集磁并对微孔板用洗液清洗 2 次,随后加入 100 μl 按 1:200 稀释的吖啶酯标记抗体,37 ℃反应 10 min,清洗 4 次,将反应孔中的磁微粒转移至透明试管中,用单管式化学发光检测仪检测发光值。
1.2.5 全自动管式化学发光免疫分析仪检测 将制备好的磁微粒试剂和吖啶酯分别分装置于 Caris200 全自动管式化学发光免疫分析仪配套的试剂瓶中,并装载至仪器上,设置检测参数并确认相关配套实验耗材数量。将样本装载至仪器配套样本架中,上机进行全自动检测。
2 结果
2.1 抗 HBsAg 抗体配对的筛选
将获得的 8 株抗 HBsAg 抗体分别标记吖啶酯和磁微粒,进行交叉配对。采用单管式化学发光免疫分析仪检测 1 份 HBsAg 阳性样本和 1 份 HBsAg 阴性样本,计算各配对阳性样本检测 RLU 值和阴性样本检测 RLU 值的比值(P/N)。结果如图 1 所示,除了 Ab-7 外,其他抗体包被的磁微粒与 Ab-1 标记的吖啶酯 P/N 比值均较好,此外,Ab-6 对 Ab-4 和 Ab-2、Ab-2 对 Ab-4 和 Ab-3 也具备较好的反应性。因此,选择 Ab-2、Ab-3、Ab-4、Ab-5、Ab-6 和 Ab-8 对 Ab-1,Ab-6 对 Ab-4 和 Ab-2,以及 Ab-2 对 Ab-4 和 Ab-3 检测 HBsAg 突变株 WT、G119R、P120T、C124Y、I126S、Q129R、S136P、C139R、T140I、P144A、G145A、G145R、M204U、M204I,评价各配对对突变株的反应性。结果如图 2 所示,Ab-3、Ab-4、Ab-6 和Ab-8 对 Ab-1 检测突变株的能力较其他配对好,且对突变株的检测能力能够互补,因此选择Ab-3、Ab-4、Ab-6 和 Ab-8 对 Ab-1 进行试剂的建立。

P/N 3500.00 3000.00 2500.00 2000.00 1500.00 1000.00 500.00 0MB Ab-1MB Ab-2MB Ab-3MB Ab-4MB Ab-5MB Ab-6MB Ab-7MB Ab-8 SAE Ab-1 SAE Ab-2 SAE Ab-3 SAE Ab-4 SAE Ab-5 SAE Ab-6 SAE Ab-7 SAE Ab-8
Figure 1 Comparison of different antibodies pair for sample detection

P/N 30.0 20.0 10.0 0 WT G119R P120T C124Y I126S Q129R S136P C139R T140I P144A G145A G145R M204U M204I HBsAg 突变体HBsAg mutants
Figure 2 Comparison of different antibodies for detection of HBsAg mutants
2.2 试剂性能评价
定量免疫检测试剂的关键分析性能指标主要包括线性范围、可报告范围、准确度、精密度、灵敏度等项目。在本研究中,各项分析性能的评估均参照《体外诊断试剂分析性能评估系列指导原则》进行分析评价。

2.2.2 线性 采用全自动化学发光免疫分析仪检测标准品梯度稀释至250、100、50、10、5、1、0.5、0.1、0.05 IU/ml 制备成的样本,以浓度值的对数为横坐标,检测 RLU 值的对数为纵坐标,进行线性拟合,= 0.9990,表明试剂在 0.05 ~ 250 IU/ml 的范围内具有很好的线性。
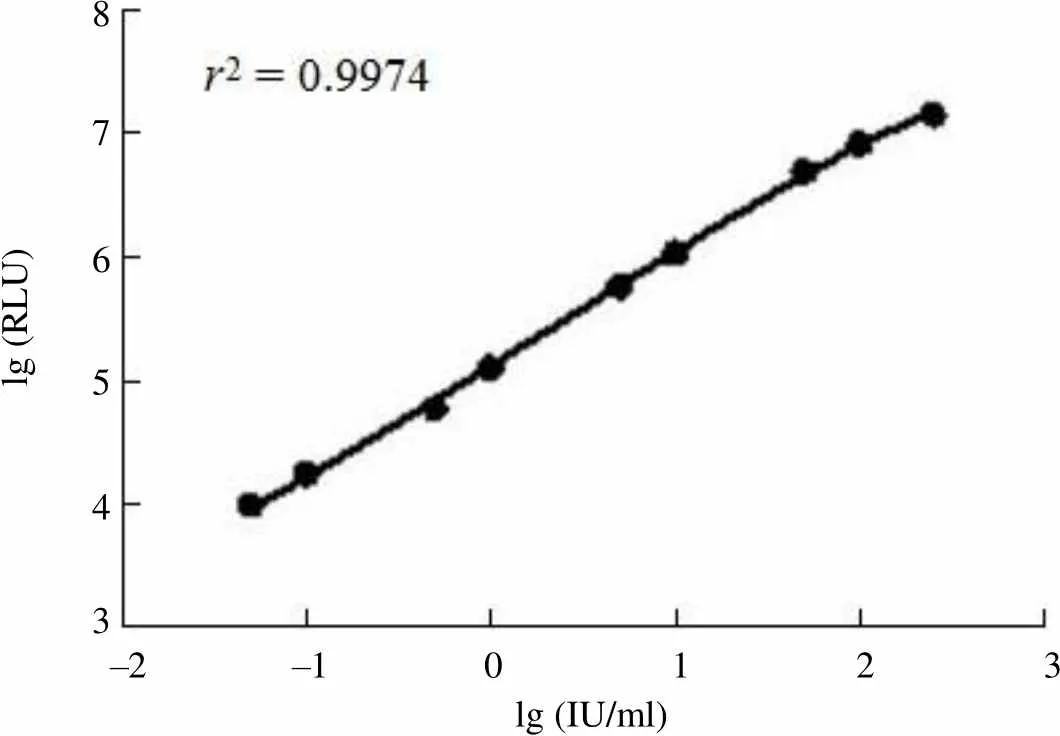
lg (RLU)8 7 6 5 4 3 –2 –1 0 1 2 3 lg (IU/ml)
Figure 3 Dose-response curve of the assay
2.2.3 可报告高限 选取 3 个不同浓度的高值样本(设为 H1、H2、H3),使用全自动化学发光免疫分析仪进行自动稀释检测,使自动稀释后的样本浓度接近于线性范围的上 1/3 区域内,并记录稀释倍数。重复检测高值样本 3 次,检测结果如表 1 所示,高浓度样本采用全自动化学发光免疫分析仪进行自动稀释 400 倍检测时,还原浓度与理论浓度的偏差(%)为–6.86%,在 ± 10% 范围内,因此本研究中建立的 HBsAg 定量检测试剂可采用仪器进行自动稀释 400 倍检测,可报告上限为 100 000 IU/ml。
2.2.4 准确度 准确度是衡量定量检测试剂检测准确性的一个重要指标,用本研究建立的试剂联合全自动管式化学发光免疫检测仪自动检测国家参考品,对 8 份国家参考品的检测结果与理论浓度的相对偏差均在 ± 15% 范围内,试剂的准确度符合国家标准要求(表 2)。

表 1 可报告高限分析结果

表 2 准确度检测结果

表 3 试剂对不同亚型的检测能力分析
2.2.5 试剂对不同 HBsAg 亚型的检测灵敏度 用本研究制备的试剂采用全自动管式化学发光免疫分析仪检测国家参考品中的灵敏度参考品 adr 亚型(0.05、0.1、0.2 IU/ml)、adw 亚型(0.05、0.1、0.2 IU/ml)和 ay 亚型(0.1、0.2、0.4 IU/ml)。结果如表 3 所示,本研究研制试剂对国家参考品中的灵敏度参考品检测结果均符合国家标准,试剂对不同亚型的检测性能良好。
2.2.6 试剂精密度 制备 3 批试剂采用全自动管式化学发光免疫分析仪分别检测精密度参考品 CV1(0.5 IU/ml)和 CV2(100 IU/ml),每份精密度参考品平行检测 10 次,计算测定值的平均值和标准差(SD),按照公式CV = SD/平均值 × 100% 计算批内和批间 CV。结果显示 3 批试剂的批内及批间精密度良好(表 4)。

表 4 试剂精密度评价
2.3 与国际主流产品的比较
对收集的 861 份样本同时用罗氏公司生产的乙型肝炎病毒表面抗原定量测定试剂盒(电化学发光法)和本研究的试剂进行检测,结果如表 5 和图 4 所示,制备试剂与罗氏检测结果的阳性符合率为 99.5%、阴性符合率为 99.5%,考核试剂对罗氏的定量相关性值为 0.989,线性拟合斜率为 0.997,接近于 1,截距接近于 0,考核试剂与罗氏试剂检测结果的定量相关性好。对检测结果与罗氏试剂不符的样本采用雅培公司生产的乙型肝炎病毒表面抗原检测试剂盒(化学发光微粒子免疫检测法)进行检测确认,结果如表 6 所示,检测不符样本均为低浓度样本,且罗氏、雅培以及本试剂三者之间检测结果均有一定的差异,可能是不同厂家试剂所用配对抗体的识别表位之间存在差异引起的。
3 讨论
自 1965 年第一次发现 HBsAg 以来,HBsAg 一直作为 HBV 感染的主要标志[8]。而最近的研究则更多的关注于 HBsAg 商业化定量检测试剂在 HBsAg 作为生物标志物用于 CHB 病人治疗和预后判定中的可靠性[9]。有研究证明,HBeAg 阳性病人在接受 PEG-IFN 治疗后,如果 12 周后 HBsAg 定量水平小于 1500 IU/ml,则预警 HBeAg 可发生血清学转化,而 HBsAg 浓度大于20 000 IU/ml,则预警患者对治疗无应答[10-11]。在接受 PEG-IFN 治疗的 HBeAg 阴性患者中,如果 HBsAg 水平无降低且 HBV DNA 下降小于 2 lg IU/ml,则可认为患者对治疗无应答,可停止治疗[12]。HBsAg定量检测已被数个国际治疗指南推荐用于临床应用[13]。

表 5 考核试剂与对比试剂检测结果比较

考核试剂 lg (IU/ml)Examine reagent lg (IU/ml)6 5 4 3 2 1 0 1 2 3 4 5 6 Roche lg (IU/ml)
Figure 4 Correlation analysis of the assay and Roche
由于 HBsAg 具有众多突变和亚型,因而 HBsAg 检测试剂对于不同突变和亚型的检测能力在很大程度上影响着试剂的整体性能。在试剂建立时,限于单克隆抗体识别表位的单一性,如果采用一株单抗进行包被以捕获不同的 HBsAg 突变株和不同亚型是不可行的,因而选用多株识别表位不同的单抗共同作为包被原料以最大限度地降低突变株漏检是最优方案。在本研究中是通过大量抗体配对的筛选和抗体配对对 HBsAg 突变株能力的检测分析,筛选获得 5 株 HBsAg 抗体用于 HBsAg 定量检测试剂的建立,其中 Ab-3、Ab-4、Ab-6 和 Ab-8 共同用于磁微粒包被,Ab-1 用于吖啶酯的标记以增加对不同 HBsAg 突变株的捕获能力。建立的 HBsAg 定量检测试剂在 0 ~250 IU/ml 浓度范围内具备很好的剂量反应曲线。通过与同类产品——罗氏公司生产的乙型肝炎病毒表面抗原定量检测试剂盒(电化学发光法)进行同步比较评估对 861 份样本的检测能力,发现与对比试剂相比,考核试剂检阳性样本和阴性样本的符合率均为 99.5%,考核试剂与罗氏试剂的定量相关性值达到 0.989,所研制试剂与罗氏试剂具备很好的一致性。同时评估了试剂对不同 HBsAg 亚型的检测能力,所研制试剂对国家参考品中的不同亚型灵敏度参考品的检测均符合国家标准。试剂批内和批间精密度均较好。

表 6 差异样本分析
本研究所研发出的 HBsAg 定量检测试剂具有良好的检测性能,可以替代国外进口产品在大部分临床单位使用,为降低医疗检测成本,提高我国医疗器械产业经济效益提供重要的技术手段。
[1] Kane M. Global programme for control of hepatitis B infection. Vaccine, 1995, 13 Suppl 1(1):S47-S49.
[2] Zhang W, Ji Z, Wang L, et al. A meta-analysis of HBsAg-positive rate among general Chinese populations aged 1--59 years. Infect Dis (Lond), 2015, 47(12):878-888.
[3] Chen CH, Lee CM, Wang JH, et al. Correlation of quantitative assay of hepatitis B surface antigen and HBV DNA levels in asymptomatic hepatitis B virus carriers. Eur J Gastroenterol Hepatol, 2004, 16(11): 1213-1218.
[4] Chan HL, Wong VW, Tse AM, et al. Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response. Clin Gastroenterol Hepatol, 2007, 5(12):1462- 1468.
[5] Werle-Lapostolle B, Bowden S, Locarnini S, et al. Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivoxil therapy. Gastroenterology, 2004, 126(7): 1750-1758.
[6] Brunetto MR, Moriconi F, Bonino F, et al. Hepatitis B virus surface antigen levels: a guide to sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B. Hepatology, 2009, 49(4): 1141-1150.
[7] Moucari R, Korevaar A, Lada O, et al. High rates of HBsAg seroconversion in HBeAg-positive chronic hepatitis B patients responding to interferon: a long-term follow-up study. J Hepatol, 2009, 50(6):1084-1092.
[8] Blumberg BS, Sutnick AI, London WT. Hepatitis and leukemia: their relation to Australia antigen. Bull N Y Acad Med, 1968, 44(44):1566- 1586.
[9] Chan HL, Thompson A, Martinot-Peignoux M, et al. Hepatitis B surface antigen quantification: why and how to use it in 2011 - a core group report. J Hepatol, 2011, 55(5):1121-1131.
[10] Piratvisuth T, Marcellin P, Popescu M, et al. Hepatitis B surface antigen: association with sustained response to peginterferon alfa-2a in hepatitis B e antigen-positive patients. Hepatol Int, 2013, 7(2):429- 436.
[11] Sonneveld MJ, Rijckborst V, Boucher CA, et al. Prediction of sustained response to peginterferon alfa-2b for hepatitis B e antigen-positive chronic hepatitis B using on-treatment hepatitis B surface antigen decline. Hepatology, 2010, 52(4):1251-1257.
[12] Rijckborst V, Hansen BE, Ferenci P, et al. Validation of a stopping rule at week 12 using HBsAg and HBV DNA for HBeAg-negative patients treated with peginterferon alfa-2a. J Hepatol, 2012, 56(5):1006-1011.
[13] Liaw YF, Leung N, Kao JH, et al. Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2008 update. Hepatol Int, 2008, 2(3):263-283.
Development and evaluation of a fully-automatic chemiluminescence hepatitis B surface antigen quantification assay
ZHAO Hui, WEN Shun-hua, LI Li-hua, LAI Yan-hui, WENG Zu-xing, SUN Xu-dong
Department of Laboratory, Aviation General Hospital of China Medical University, Beijing 100012, China (ZHAO Hui); Xiamen Innodx Biotech Co. Ltd., Xiamen 361022, China (WEN Shun-hua, LI Li-hua, LAI Yan-hui, WENG Zu-xing, SUN Xu-dong)
Hepatitis B virus (HBV) infection is one of the most important public health issues in China. HBV surface antigen (HBsAg) is the leading hallmark for diagnosis of HBV infection. In the past few years, quantitative assays for HBsAg detection has been widely used in HBsAg as a biomarker for prognosis and treatment responses in CHB patients. We aim to develop a fully-automatic chemiluminescence assay for HBsAg quantification.In this study, based on our independently developed fully-automatic chemiluminescence system previously, we developed a HBsAg quantification assay through screening of antibodies and optimization of reaction systems, and compared the detection results with Roche, and further evaluated the samples with different subtypes.The assay showed a quantification range of 0 - 250 IU/ml, and matched well with Roche (2= 0.9794). In addition, the assay performed well in detecting the national panel and samples with different subtypes. The assay had a good linearity (= 0.9990) among the range of 0.05 - 250 IU/ml, and the detection results of national reference samples meet the requirement of national standard. The upper-limit of report is 100 000 IU/ml when the samples were diluted by 400 times. The intra-assay accuracy is lower than 10% and inter-assay accuracy is lower than 15%.A fully-automatic chemiluminescence HBsAg assay is developed with potential application.
Hepatitis B surface antigens; Reagent kits, diagnostic; Luminescent measurements
WEN Shun-hua, Email: shunhua.wen@innodx.com
10.3969/j.issn.1673-713X.2017.05.004
温顺华,Email:shunhua.wen@innodx.com
2017-06-06

