NiTi(110)表面氧原子吸附的第一性原理研究∗
刘坤 王福合 尚家香
1)(首都师范大学物理系,北京 100048)
2)(北京航空航天大学材料科学与工程学院,北京 100191)
NiTi(110)表面氧原子吸附的第一性原理研究∗
刘坤1)王福合1)†尚家香2)
1)(首都师范大学物理系,北京 100048)
2)(北京航空航天大学材料科学与工程学院,北京 100191)
(2017年5月29日收到;2017年7月26日收到修改稿)
第一性原理,NiTi合金,二氧化钛,表面能
1 引 言
近等原子比NiTi合金因具有优异的形状记忆效应、高阻尼性能、良好的耐腐蚀性以及综合力学性能好等优点,已被广泛用于航空、航天、电子等领域[1,2];同时NiTi形状记忆合金又因具有优良的生物相容性、高抗疲劳性等优点被视为很好的生物医学材料[3,4].作为结构材料应该提高NiTi合金的抗氧化性能,但作为生物医学材料,为了抑制合金在体液的长期作用下溶出有毒的Ni离子,需在NiTi表面形成致密的氧化层,因此,对NiTi表面氧化机制进行研究具有重大意义.
为了进一步提高形状记忆合金NiTi的综合性能,在表面生成较为理想的氧化膜,以降低Ni离子溶出释放的速率,进而有效提高生物相容性,为此人们做了大量实验研究[5−18].人们分别通过表面涂层方法[5]、等离子注入[6−10]、阳极氧化[11]、去合金化[12]、表面低温氧化[13]和表面高温氧化[14−18]等方式对NiTi合金表面进行处理,增强其表面的抗腐蚀性,降低Ni离子的释放.大量的实验研究了在大气环境下热处理温度对NiTi表面氧化的影响[14−18],结果发现表面氧化与温度密切相关.当温度较低(300—500°C)时,表面未形成结晶的TiO2[14−16];当温度为600°C时,Firstov等[14]发现表面形成锐钛矿相TiO2的氧化层;Gu等[15,16]发现表面氧化层是锐钛矿相和金红石相TiO2的混合,当温度为800°C时,表面形成以金红石相TiO2为主的氧化层;Undisz等[17]在540°C温度下对NiTi合金进行热处理,结果发现表面分三层,最外层为含少量金属镍的TiO2层,第2层为无镍的纯TiO2层,第3层为富镍的Ni3Ti层.总体而言,所有NiTi表面氧化实验结果[13−18]都表明在NiTi表面氧化过程中最外层为TiO2层,然后为富镍层,最后为正常的NiTi体结构.但对最外层TiO2的形成机制有多种提法.Chu等[18]提出在NiTi表面氧化初期Ti首先氧化形成氧化钛,而Ni保持不变,接着Ti原子向外扩散而氧原子向内扩散形成TiO2向外生长,而富Ni层向内生长.Mändl和Lindner[9]提出Ti原子从体内向表面扩散与氧原子在表面形成TiO2;而不久后同一研究小组又提出在氧化过程中Ti离子不动与氧原子形成TiO2,而Ni离子向体内扩散在TiO2下方形成Ni层[10].
在理论研究方面,Nolan和Tofail[19]利用密度泛函理论(DFT)计算了氧分子在NiTi(110)吸附行为,发现氧分子吸附后即解离为氧原子,Ti原子被解离的氧原子拉离表面并形成很强的Ti—O键;Nigussa和Støvneg[20]利用DFT研究了K掺杂前后NiTi表面氧化问题,发现氧原子最喜欢吸附的位置为两个Ti原子之间的桥位,掺K后使表面更易形成TiO2;Liu等[21]基于DFT计算了氧原子在NiTi(100)表面的吸附和扩散行为,计算结果表明,当氧化温度较低时在表面会优先形成TiO,而在高温下表面仅有金红石二氧化钛形成;Li等[22]利用第一性原理计算研究了氧原子在NiTi(110)表面的吸附,计算结果表明,当氧原子在NiTi(110)吸附时,氧原子与Ti原子的相互作用明显比与Ni原子的相互作用强,因此随着吸附氧原子覆盖度的增加,表面层中Ti原子反位表面体系的能量更低,由此可能导致Ti原子在表面的偏析,并优先在表面形成钛的氧化层.在材料的实际氧化过程中,一旦给定一块材料,其金属原子数不再变化,Ni和Ti原子的配比也不再变化,而只是由于氧原子的吸附和扩散引起局部金属原子占位的变化.为了探究给定NiTi合金的氧化过程,我们在保持Ni和Ti原子等比的情况下,构建了不同的NiTi(110)反位缺陷体系模型,并利用第一性原理的方法计算研究氧原子在各NiTi(110)反位缺陷体系中的吸附行为,进一步理解NiTi表面的氧化过程.
2 理论方法与模型
NiTi合金的母相结构是奥氏体B2相结构,所属的空间群为Pm-3m(221),Ni原子和Ti原子在[111]方向交替排列.优化计算得到的晶格常数为a=b=c=3.005 Å,这与实验结果(a=b=c=3.015 Å)[23]和此前采用第一性原理计算的结果[20−22]一致.为了探究NiTi合金表面的氧化过程,我们构建了包含7层原子与15 Å真空层的c(2×2)单胞模型来模拟计算,在保证体系中总的Ni原子和Ti原子等比下,构建了一系列反位缺陷体系iExcjk,如1Exc12,2Exc12,2Exc13和2Exc23等,其中i表示体系中Ti原子与Ni原子发生交换的个数,j和k分别表示发生交换的Ni原子和Ti原子所在的层数,无缺陷体系用Perfect表示,各体系的结构模型如图1所示.
本文计算采用基于DFT的维也纳从头算模拟程序包VASP[24]进行第一性原理计算,采用缀加投影平面波赝势[25]对离子实与价电子之间的相互作用势进行描述,电子交换关联能采用广义梯度近似中的PW91方法[26].经测试,选取400 eV作为平面波的截断能量.在弛豫计算过程中,对上面的四层原子进行自由弛豫以模拟材料的表面结构,而底部三层原子固定在体材料中原子的位置来模拟材料体结构对表面的影响.在自洽计算过程中,以每个原子所受的力小于0.01 eV/Å和总能量小于0.001 eV为收敛标准.

图1 (网刊彩色)NiTi(110)表面模型侧视图 (a)无缺陷体系(Perfect);(b)表面第1层中一个Ni原子与第2层中一个Ti原子交换所形成反位的体系(1Exc12);(c)表面第1层中的2个Ni原子与第2层中2个Ti原子交换所形成反位的体系(2Exc12);(d)表面第1层中2个Ni原子与第3层中2个Ti原子交换所形成反位的体系(2Exc13);(e)表面第2层中2个Ni原子与第3层中2个Ti原子交换所形成反位的体系(2Exc23);其中黑色(蓝色)和浅灰色小球分别代表Ti原子和Ni原子Fig.1.(color online)Side view of NiTi(110)surface slab models:(a)Perfect;(b)1Exc12;(c)2Exc12;(d)2Exc13;(e)2Exc23.The Ti and Niatoms are represented by dark(blue),light grey balls.
为了研究氧原子吸附的稳定性,定义氧原子平均吸附能(Ea)为

式中,ENiTi(110),EO-NiTi(110)和EO2分别表示干净体系、吸附氧原子后体系和自由氧分子的能量,n表示单胞中吸附氧原子的个数.根据氧原子平均吸附能Ea的定义,氧原子在某一位置的平均吸附能越低,说明氧原子在该位置的吸附越稳定.
随着氧原子覆盖度的变化,各体系的相对稳定性由表面能决定.由于在弛豫过程中,上面的四层原子进行自由弛豫来模拟材料表面结构,而底部三层原子固定在体材料中原子的位置来模拟材料体结构对表面的影响.因此,为了计算上表面的表面能,首先要计算出所用slab模型下表面的表面能γ0,其计算公式为
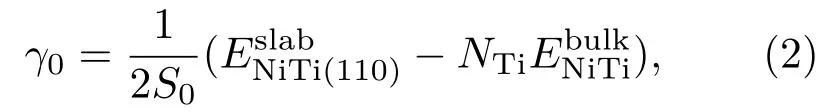
其中S0是体系的表面积,表示未弛豫slab体系的总能量,为NiTi体材料中一个原胞的总能量,NTi是slab体系中Ti原子的数目.
则上表面能(γ)可以通过如下计算得到:
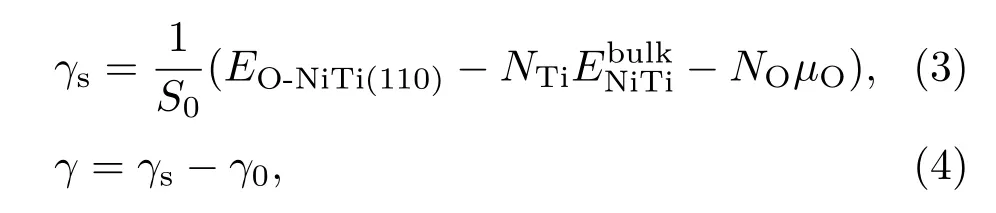
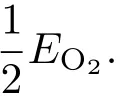
3 计算结果与讨论
3.1 氧原子的稳定吸附位置
主要研究了氧原子覆盖度从零增加到两个单层(monolayer,ML)时,氧原子在NiTi(110)各反位缺陷表面体系的吸附情况.其中氧原子覆盖度(θ)定义为吸附氧原子数与金属基底单层中金属原子总数之比.根据以前的计算结果[22],氧原子吸附在富Ti区域更稳定,因此,氧原子在表面附近比较稳定的可能吸附位置如图2所示,T表示由表面2个Ti原子与1个Ni原子所构成的三原子洞位,而F表示由表面2个Ti原子与2个Ni原子所构成的四原子洞位,且FN(FT)位于第2层Ni(Ti)原子的正上方,Oct是由最近邻两个Ni原子和四个Ti原子构成的八面体间隙中心位置.当氧原子覆盖度大于0.25 ML时,相对于纯Perfect体系,表面上的部分Ti原子因与吸附O原子相互作用较强而被拉离第1层,进而形成新的一层,这样就可能存在更多的氧原子吸附位置,如富Ti环境的五面体间隙中心位置(P)和六面体间隙位置(H),其中P是由第2层的两个Ti原子和第3层的两个Ti原子、一个Ni原子构成的五面体间隙中心位置,H是由第1,2层各两个Ti原子和第3层的一个Ti原子构成的六面体间隙中心位置.当氧原子覆盖度较大时,单胞内多个氧原子的吸附位置将是这几种吸附位置的组合.
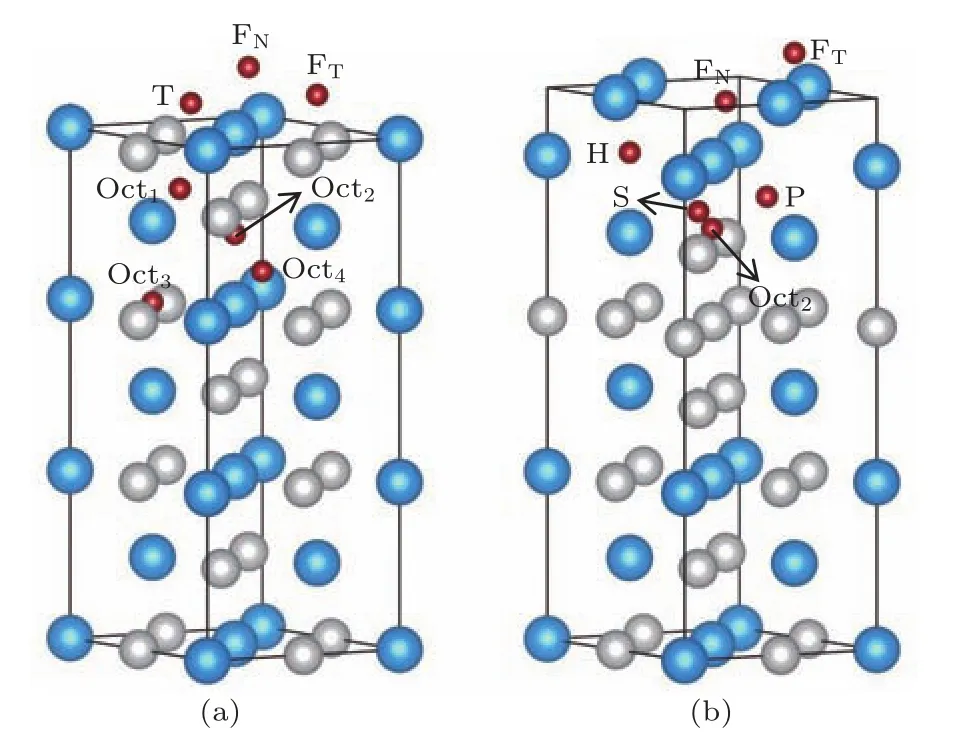
图2 (网刊彩色)氧原子在(a)Perfect和(b)2Exc13体系中可能稳定吸附位置的立体结构示意图,其中蓝色、浅灰色和红色小球分别代表Ti原子、Ni原子和O原子Fig.2.(color online)Side view of(a)Perfect and(b)2Exc13 surface slab models with stable oxygen sites.The Ti,Ni and O atoms are represented by blue,light grey and red balls.
作为参考,首先计算了氧原子在无缺陷表面体系(Perfect)的吸附情况,计算结果列于表1,部分氧原子吸附位置组合的构型如图3所示.当氧原子覆盖度为0.25 ML时,氧原子吸附在表面上三原子洞位T时最稳定,其氧原子吸附能为−5.05 eV;当氧原子覆盖度为0.5 ML时,相距较远的三原子洞位组合T1T2是最稳定的吸附位置组合,由于吸附氧原子之间的排斥作用[22],其氧原子平均吸附能与氧原子覆盖度为0.25 ML时相比升高0.22 eV;当氧原子覆盖度为0.75 ML时,由表面上的三原子洞位T1T2和表面下的八面体中心位置Oct2构成的组合T1T2Oct2是最稳定的吸附位置,此时的氧原子平均吸附能为−4.47 eV,但其仅比氧原子均在表面上的FNFNFT低0.08 eV,考虑到氧原子吸附在Oct2位之前需要穿越表面第1层,氧原子可能更容易吸附在FNFNFT;当氧原子覆盖度为1.0 ML时,最稳定吸附位置组合T1T2FTOct2的氧原子平均吸附能为−4.13 eV,次稳定位置组合为T1T2T2FT,二者氧原子平均吸附能相差0.21 eV,则这两种可能吸附位置组合之间也存在竞争关系;氧原子吸附在位置组合FNFNFTFT时,其表面上的Ti原子与最近邻O原子的键长R(Ti—O)分别为1.82和2.13 Å,其键角∠O—Ti—O的大小分别为111.1°和172.5°,与表2中所列的TiO2常见相的结构参数相比,其结构与金红石相TiO2[27]相似;当氧原子覆盖度为1.50 ML时,最稳定的吸附位置组合是FNFNFTFTOct2Oct4,其氧原子平均吸附能为−3.90 eV,氧原子吸附在FNFNFTFTHH位置组合时的吸附能为−3.27 eV,其表面第1层的Ti原子与最近邻O原子的键长R(Ti—O)分别为1.84 Å,2.15 Å和2.16 Å,其键角∠O—Ti—O大小分别为88.7°,109.4°和157.8°,其结构比较符合铌铁矿相TiO2[28,29]的结构,然而,FNFNFTFTHH的氧原子吸附结构没有FNFNFTFTOct2Oct4稳定.
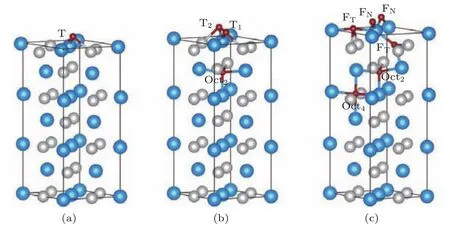
图3 (网刊彩色)氧原子吸附于Perfect体系时,覆盖度分别为(a)0.25 ML,(b)0.75 ML和(c)1.5 ML最稳定吸附位置组合的侧视图,各小球的标识同图2Fig.3.(color online)Side view of the atomic structures for the most stable oxygen atoms adsorbed on the Perfect surface with the oxygen coverage of(a)0.25 ML,(b)0.75 ML,and(c)1.5 ML.The meaning of balls is same as that in Fig.2.

表1 不同覆盖度时氧原子在Perfect表面附近不同吸附位置氧原子的平均吸附能Ea(eV)Table 1.The calculated average adsorption energies Eaper oxygen atom(in eV)in the Perfect surfaces for different adsorption sites at different oxygen atom coverages.

表2 金红石、锐钛矿、板钛矿和铌铁矿相二氧化钛的键长R(Ti—O)(Å)和键角∠O—Ti—O(°)Table 2.The bond length(in Å)and bond angle(in(°))of rutile,anatase,brookite and columbite phase TiO2.
将本文的计算结果与前人计算结果进行了对比.Nigussa和Støvneg[20]研究氧原子在NiTi(110)表面吸附时以岩盐结构的TiO和金红石结构的TiO2中氧原子的相对位置为参考,仅在保持高对称性的条件下进行了计算,他们给出氧原子最喜欢吸附的位置为两个Ti原子之间的桥位(相当于本文的四原子洞位FT).他们的计算所给出氧原子覆盖度分别为0.5 ML和1.0 ML时的稳定结构分别对应本文的FTFT和FNFNFTFT,由表1可以看出这两种位置组合并不是最稳定的,特别是当覆盖度较低(0.5 ML)时,比最稳定的T1T2组合平均每个氧原子高出1.36 eV.与Nolan和Tofail[19]以及Li等[22]的结果相比,本文所得氧原子在表面上的最稳定吸附位置与文献结果基本一致.但我们考虑了氧原子在表面下的吸附,由表1可以看出当覆盖度高于0.75 ML时氧原子在表面上、下同时吸附时比全在表面上吸附更加稳定.所有的DFT理论计算结果[19,20,22]均表明在NiTi(110)表面吸附时,氧原子与Ti原子的相互作用比Ni的强,氧原子吸附后表面Ti原子位置升高,Ni原子位置下降(如图3所示),因此,由于氧原子吸附可能引起表面出现Ti原子反位缺陷.
计算了氧原子在2Exc12反位缺陷体系中的吸附情况,由模型图1(c)可以看出,该体系的表面第1层全为Ti原子,而第2层全为Ni原子.计算结果列于表3,部分氧原子吸附位置组合的构型如图4所示.
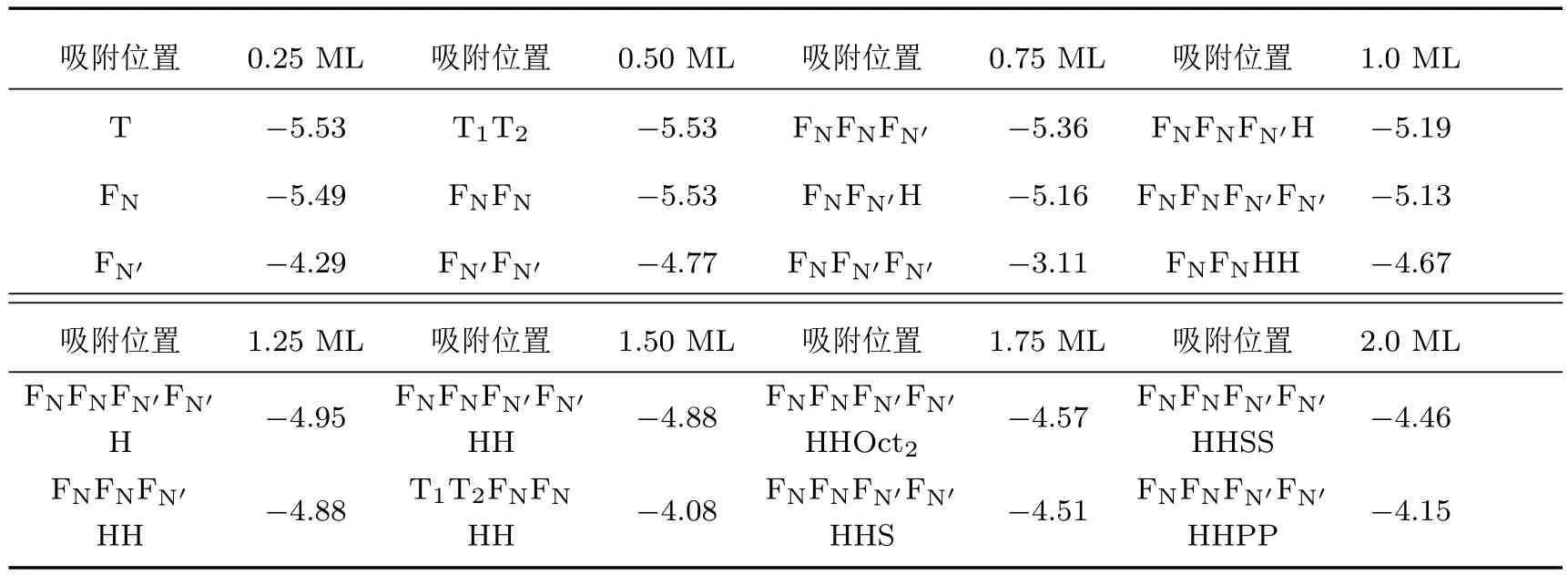
表3 不同覆盖度时氧原子在2Exc12表面附近不同吸附位置氧原子的平均吸附能Ea(eV)Table 3.The calculated average adsorption energies Eaper oxygen atom(in eV)in the 2Exc12 surfaces for different adsorption sites at different oxygen atom coverages.
当氧原子覆盖度为0.25 ML时,由表面上三个Ti原子构成的三原子洞位T是最稳定的吸附位置,其氧原子吸附能为−5.53 eV;当氧原子覆盖度为0.5 ML时,三原子洞位组合T1T2和四原子洞位组合FNFN均是最稳定的吸附位置,其氧原子平均吸附能均为−5.53 eV;当氧原子覆盖度为0.75 ML时,三原子洞位T组合变得不再稳定,而最稳定氧原子吸附位置组合为FNFNFN′,其平均每个氧原子吸附能为−5.36 eV;当氧原子覆盖度为1.0 ML时,最稳定的氧原子吸附位置FNFNFN′H和FNFNFN′FN′氧原子平均吸附能分别为−5.19 eV和−5.13 eV,由于其平均氧原子吸附能相差较小,FNFNFN′FN′和FNFNFN′H两种吸附有竞争关系;当氧原子覆盖度为1.5 ML时,氧原子吸附位置组合FNFNFN′FN′HH是最稳定的氧原子吸附位置,其氧原子平均吸附能为−4.88 eV,表面第1层的Ti原子与最近邻O原子的键长R(Ti—O)分别为1.85,2.12和2.20 Å,键角∠O—Ti—O大小分别为90.1°,108.7°和149.7°,其结构与铌铁矿相TiO2结构近似;当氧原子覆盖度为2.0 ML时,氧原子吸附在FNFNFN′FN′HHSS时最稳定(S是由表面第2层2个Ti原子和1个Ni原子构成三角形的中心位置),其氧原子平均吸附能为−4.46 eV,表面第1层的Ti原子均形成类似铌铁矿相TiO2结构,这样表面就形成了二氧化钛层,Ni原子在二氧化钛层下方富集,这和实验观察结果一致.
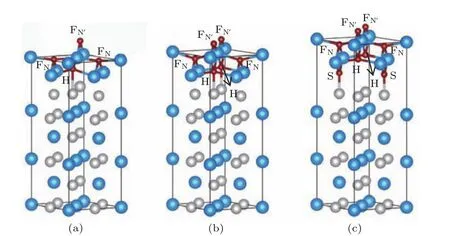
图4 (网刊彩色)氧原子吸附于2Exc12反位缺陷体系时,覆盖度分别为(a)1.0 ML,(b)1.5 ML和(c)2.0 ML最稳定吸附位置组合的侧视图;各小球的标识同图2Fig.4.(color online)Side view of the atomic structures for the most stable oxygen atoms adsorbed on the 2Exc12 surface with the oxygen coverage of(a)1.0 ML,(b)1.5 ML,and(c)2.0 ML.The meaning of balls is same as that in Fig.2.
接着计算了氧原子在2Exc13反位缺陷体系中的吸附,由模型图1(d)可以看出,该体系的表面第1层全为Ti原子,而第3层全为Ni原子.计算结果列于表4,部分氧原子吸附位置组合的构型如图5所示.当氧原子覆盖度为0.25 ML时,与Perfect和2Exc12体系相比,三原子洞位变得不再稳定,而四原子洞位FN成为最稳定的氧吸附位置,其氧原子吸附能为−5.81 eV;当氧原子覆盖度为0.50 ML时,氧原子吸附在四原子洞位组合FNFN时最稳定,其氧原子平均吸附能为−5.59 eV;当氧原子覆盖度为0.75 ML时,最稳定的氧原子吸附位置是表面上FN和表面下的六面体中心位置H的组合FNFNH,其氧原子平均吸附能为−5.41 eV;当氧原子覆盖度为1.0 ML时,最稳定吸附位置组合FNFNFTH的氧原子平均吸附能为−5.32 eV,其他相对稳定位置组合的吸附能与最稳定吸附位置组合相差无几,故此时可能出现几种吸附构型的竞争;当氧原子覆盖度为1.5 ML时,最稳定的吸附位置组合是FNFNFTFTHH,其氧原子平均吸附能为−5.16 eV,其表面上第1层的Ti原子与最近邻O原子的键长R(Ti—O)分别为1.84,2.19,2.17 Å,其键角∠O—Ti—O大小分别为86.5°,109.5°和156.7°,其结构与铌铁矿相TiO2结构相似;当氧原子覆盖度为2.0 ML时,最稳定的吸附位置组合FNFNFTFTHHPP的氧原子平均吸附能为−4.70 eV,其表面上第1层的Ti原子与最近邻O原子的键长R(Ti—O)分别为1.84,2.12和2.13 Å,其键角∠O—Ti—O大小分别为80.3°,112.7°和154.0°,其结构同样和铌铁矿相TiO2结构相似,当氧原子吸附在FNFNFTFTHHSS位置组合时,其氧原子平均吸附能为−4.53 eV,第1层Ti原子同样与近邻O原子形成铌铁矿相TiO2结构,而第2层的Ti原子与最近邻O原子的键长R(Ti—O)分别为1.97,2.04和2.13 Å,其键角∠O—Ti—O大小分别82.7°,94.8°和177.3°,这与金红石相TiO2结构相似,这样氧原子的吸附使得表面上的Ti原子都形成了二氧化钛,进而形成一层由铌铁矿相和金红石相TiO2的混合的二氧化钛层,二氧化钛层下是富集的Ni原子.2Exc13反位缺陷体系在高氧原子覆盖度下形成了不同相的二氧化钛,这可能是实验发现不同处理温度会形成不同二氧化钛的原因.

图5 (网刊彩色)氧原子吸附于2Exc13反位缺陷体系时,覆盖度分别为(a)1.0 ML,(b)1.5 ML和(c)2.0 ML最稳定吸附位置组合的侧视图,各小球的标识同图2Fig.5.(color online)Side view of the atomic structures for the most stable oxygen atoms adsorbed on the 2Exc13 surface with the oxygen coverage of(a)1.0 ML,(b)1.5 ML,and(c)2.0 ML.The meaning of balls is same as that in Fig.2.
另外,还计算了氧原子在只交换部分原子如1Exc12反位缺陷体系中的吸附,由模型图1(b)可以看出,该体系的表面第1层有三个Ti原子和Ni原子,而第2层有三个Ni原子和一个Ti原子.计算结果表明,当氧原子覆盖度为0.25 ML时,氧原子吸附在由三个Ti原子构成的三原子洞位时最稳定,其氧原子吸附能为−5.70 eV;当氧原子覆盖度为0.5和0.75 ML时,三原子洞位的组合仍是氧原子最稳吸附位置;当氧原子覆盖度为1.5 ML时,最稳定氧原子吸附位置组合FNFNFTFTHH的氧原子平均吸附能为−4.26 eV,但并未形成与TiO2类似的结构.
最后,计算了氧原子在2Exc23反位缺陷体系中的吸附,由模型图1(e)可以看出,该体系的表面第2层全为Ti原子,而第3层有全Ni原子.计算结果表明,当氧原子覆盖度为0.25 ML时,三原子洞位是其最稳定的氧原子吸附位置,其氧原子吸附能为−4.85 eV;当氧原子覆盖度为0.75 ML时,氧原子吸附在T1T2Oct1和FNFNFT时的氧原子平均吸附能分别为−4.44 eV和−4.24 eV;当氧原子覆盖度为2.0 ML时,氧原子吸附在FNFNFTFTHHOct2Oct2时最稳定,且表面形成了近似铌铁矿相TiO2的结构.
将上述不同模型中不同覆盖度下最稳定吸附位置组合的吸附能进行横向对比可以绘出如图6所示的氧原子平均吸附能变化曲线.从图6可以看出,随着氧原子覆盖度的增加,各体系的氧原子平均吸附能均呈上升趋势,这表明氧原子吸附的稳定性随氧原子覆盖度的增大呈减弱趋势,这主要是因为吸附氧原子之间有排斥作用,且随着覆盖度的增加,吸附氧原子之间的距离减小,排斥作用增强.总的看来,凡是把第1层中Ni原子交换替代成Ti原子,形成Ti原子反位时,氧原子平均吸附能均降低,这主要是因为氧原子与Ti原子的相互作用比Ni原子的强,所以,当有氧原子吸附时,Ti原子可能会受吸附氧原子的影响而向外扩散,与表层中的Ni换位形成表面Ti偏析,而Ni原子可能向表面下扩散,形成富Ni层.对比氧原子在2Exc12和2Exc13两种反位缺陷体系的吸附,可以发现氧原子在2Exc13中的吸附均比2Exc12中更稳定,这表明氧原子吸附的稳定性与表面Ti原子的富集程度有很大的关联性,体系表面Ti原子富集程度越高,氧原子的吸附稳定性越高,因此氧原子的吸附可能使得表面下的Ti原子更容易与表面下的Ni原子换位,从而在表面优先氧化Ti原子形成TiO2,而Ni原子向下扩散,在氧化层下形成富Ni层,这可能是实验上观察到NiTi合金氧化表现为表层为二氧化钛和Ni原子富集的原因.
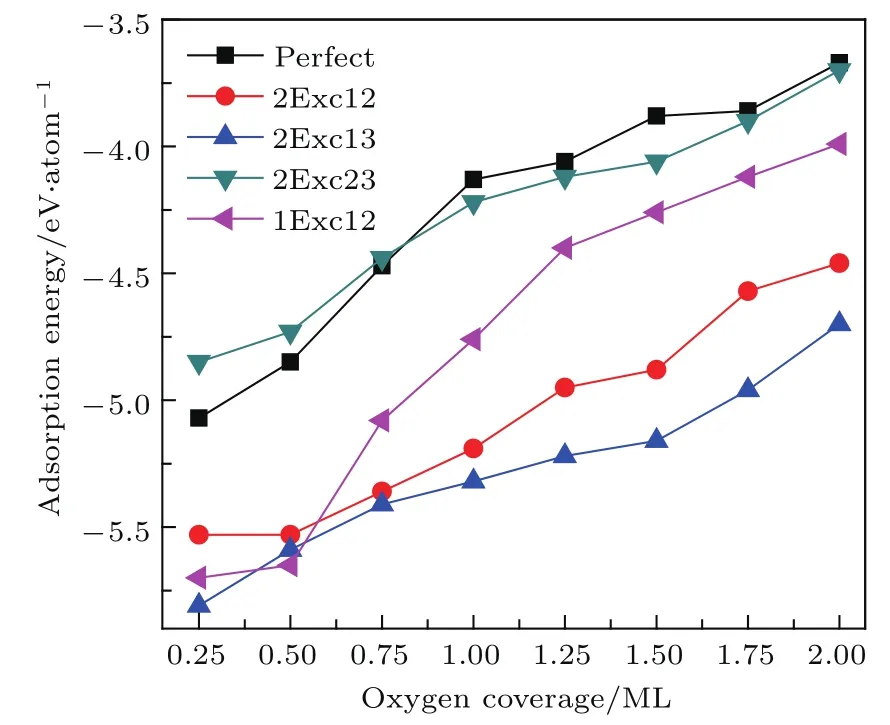
图6 (网刊彩色)氧原子分别吸附于Perfect,1Exc12,2Exc12,2Exc13和2Exc23表面最稳定位置时,氧原子平均吸附能随氧覆盖度的变化Fig.6.(color online)The changes of the calculated average adsorption energy Eafor oxygen atoms adsorbed in the Perfect,1Exc12,2Exc12,2Exc13 and 2Exc23 surfaces with the oxygen coverage.Only the Eaof each surface with oxygen atoms on the most stable adsorption sites are plotted.
3.2 表面稳定性分析
为了研究在不同温度和氧分压下一块NiTi材料表面吸附氧化情况,在保持整个体系Ni和Ti原子数等比的条件下,首先计算了不同覆盖度时氧原子吸附在各表面体系最稳定位置组合的表面能,在富氧的条件(µO=−4.91 eV)下所得结果列于表5.基于表5,根据表面能公式计算了不同环境条件,即不同氧化学势下各表面体系的表面能,比较各个体系的相对稳定性.相对比较稳定结构的表面能随氧原子化学势的变化如图7所示.从图7可以看出,当氧的化学势小于−9.95 eV,即贫氧时,无氧原子吸附的Perfect体系最稳定;当氧的化学势为−9.95—−9.35 eV时,氧原子覆盖度为0.75 ML的1Exc12反位缺陷体系最稳定,此时由于氧原子的吸附使得部分Ti原子从表面下第2层上升到表面与第1层中的Ni原子交换形成更稳定的表面结构;当氧的化学势大于−9.35 eV时,即富氧时,2Exc13反位缺陷体系最稳定,此时由于氧原子的吸附使得表面下第3层的全部Ti原子与第1层中的全部Ni原子交换所形成的表面结构最稳定;对于2Exc13反位缺陷体系,随着氧的化学势的增大,氧原子覆盖度越高的体系越稳定,这表明2Exc13反位缺陷体系的稳定性随氧原子覆盖度的增大而增强.
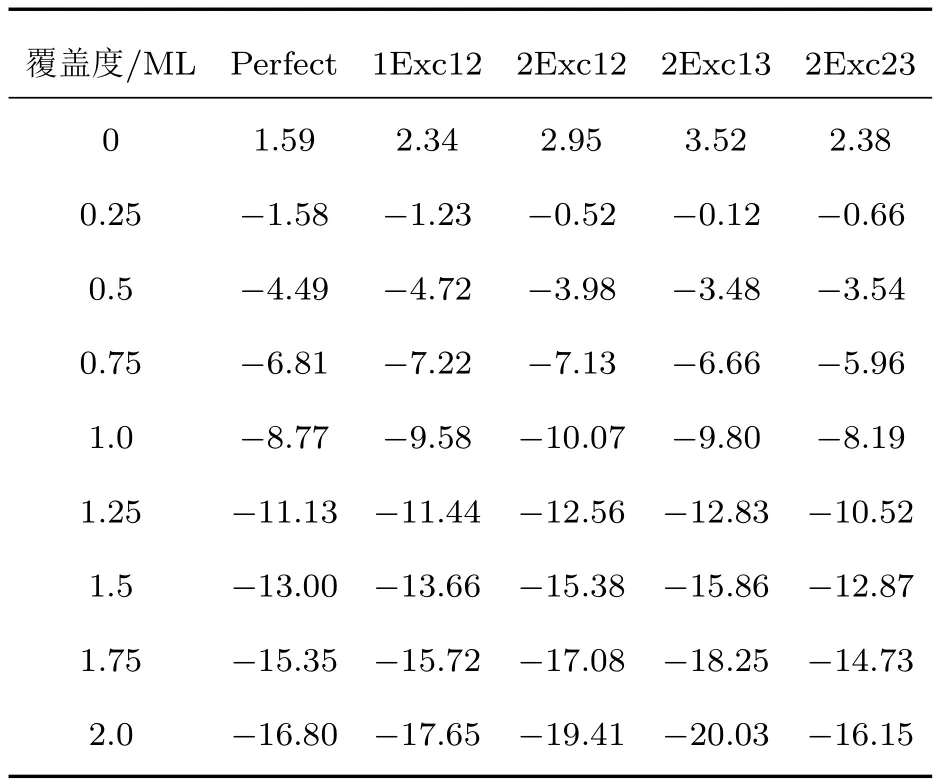
表5 在富氧环境(µO=−4.91 eV)下,氧原子在不同覆盖度(0≤θ≤2.0 ML)时吸附各表面体系最稳定位置组合的表面能(J/m2)Table 5.The calculated surface energies(in J/m2)of the most stable oxygen atoms adsorbed different NiTi(110)surface systems in different oxygen atoms coverage(0≤θ≤2.0 ML)under O-rich condition(µO=−4.91 eV).
为了更好地与实验结果对比,计算了在不同实验环境下氧的化学势.氧的化学势可以通过实验温度T和氧分压P的关系式获得,其公式[30]如下:
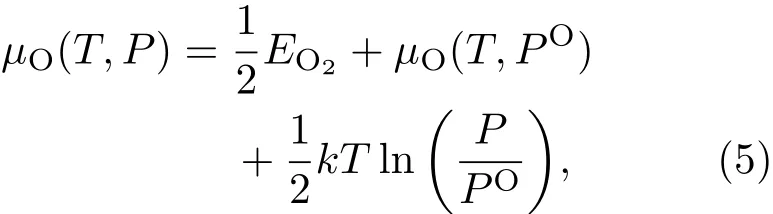
其中EO2是单个孤立氧分子的总能量;在温度T和氧分压为PO时的化学势用µO(T,PO)表示,可以通过实验数据[31]获得.根据(5)式计算参考文献[17]中实验条件为T=813.15 K,P=2.343×10−3mbar(1 bar=105Pa)时的氧化学势为=−6.81 eV.而在室温(T=300 K)和一个标准大气压(P=0.213 bar)的环境下,计算得到氧的化学势为=−5.20 eV.在这两种条件(如图7中的两条竖直虚线所示)下,2Exc13体系最稳定,也就是说此时均形成氧原子覆盖度为2.0 ML、第1层中全部Ni原子与第3层中全部Ti原子交换的氧化表面.由此,在文献[17]的实验环境和一个标准大气压及室温的条件下,均由于氧原子的吸附引起Ti原子在表面偏析,进而氧化形成二氧化钛层,并在二氧化钛层下方形成富Ni层的表面结构.
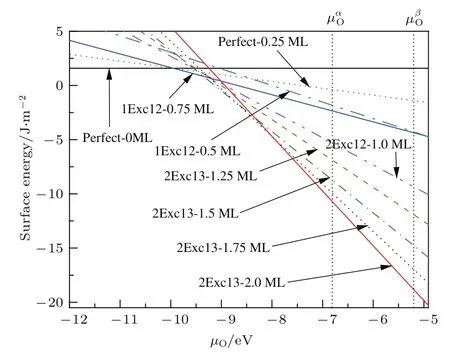
图7 (网刊彩色)不同覆盖度时氧原子吸附在各表面体系最稳定位置组合的表面能随氧的化学势变化图,图中标注有和的两条竖直虚线分别表示在温度为813.15 K及P=2.343×10−3mbar实验条件[17]和室温为T=300 K及一个大气压条件下氧的化学势Fig.7.(color online)The surface energies of the most stable oxygen atoms adsorbed surfaces as a function of the chemical potential of oxygen(µO).The vertical dashed line labelled by ()represents the chemical potential of oxygen at the experimental conditions:T=813.15 K and P=2.343× 10−3mbar in reference 15(room temperature T=300 K and a standard atmosphere pressure).
要想形成上述稳定的表面,必然会涉及O,Ti和Ni原子在表面附近的扩散.我们利用climbingimage nudge elastic band方法初步计算了覆盖度为0.125 ML时在无缺陷(110)表面氧原子从表面上三原子洞位T向表面下八面体中心Oct2和从Oct2向更深的八面体中心Oct3(位置参见图2(a))的扩散路径.氧原子从表面上T位置扩散到表面下Oct2的扩散能垒为2.11 eV,而从Oct2扩散到更深的Oct3的扩散能垒为0.34 eV[32].因此,在低覆盖度下氧原子从表面上向表面下的扩散比较困难,一旦氧原子扩散到表面下,氧原子的扩散就会变得相对容易.在高覆盖度下氧原子如何扩散?而Ti和Ni原子在吸附氧原子的作用下怎样换位扩散等问题仍需进一步深入研究.
3.3 表面原子结构分析
由上述讨论可知,2Exc13反位缺陷体系随着氧的化学势的增大逐渐变得更加稳定,为了研究氧原子吸附对表面结构的影响,计算了2Exc13反位缺陷体系氧原子吸附后表面Ti原子高度的变化,表6列出了2Exc13体系在不同覆盖度下氧原子吸附在最稳定位置时第1层Ti原子的高度变化情况.为了方便比较,选取无氧原子吸附Perfect表面体系第1层中Ni原子作为参考,计算了氧原子吸附后表面第1层中金属原子相对于该Ni原子的相对高度Z,并定义了平均褶皱度为:
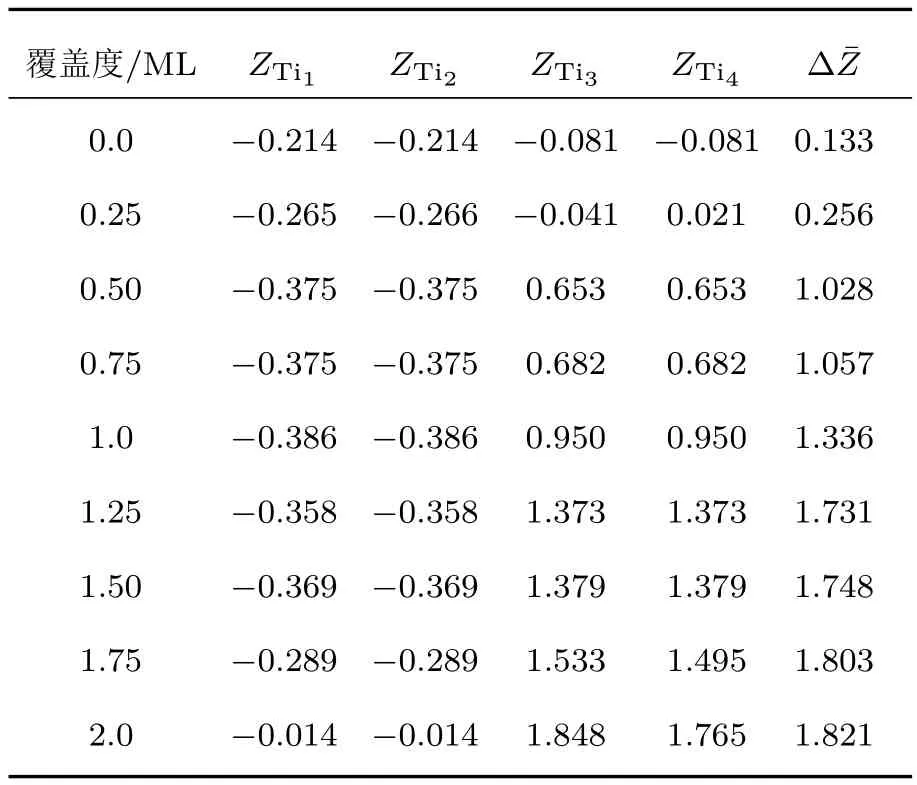
表6 在不同氧原子覆盖度下,氧原子吸附于2Exc13表面体系最稳定位置时的原子结构参数(Å),其中Ti3和Ti4为与Ni原子发生交换的Ti原子,而Ti1和Ti2原子为表面第1层中原有的Ti原子Table 6.The calculated structure parameters(in Å)for oxygen atoms adsorbed on 2Exc13 surfaces at the most stable sites with different oxygen atom coverages.Ti3and Ti4are the exchanged Tiatoms from the third layer,Ti1and Ti2are the original Tiatoms in the first layer.
从表6可以看出,当表面体系无氧原子吸附时,2Exc13反位缺陷体系的褶皱度为0.719 Å,而Perfect体系的褶皱度为0.339 Å,这表明表面第1层中2个Ni原子与第3层中2个Ti原子交换对2Exc13反位缺陷体系表面结构的形成影响较大,这也是表5中2Exc13反位缺陷体系在无氧原子吸附时表面能最高的原因.当氧原子的覆盖度为0.25 ML时,表面第1层中Ti原子的高度与无氧原子吸附时相比变化不大(小于0.1 Å);当氧原子覆盖度为0.50 ML时,与第3层中Ni原子交换的Ti3和Ti4原子迅速升高,而原来处于本层的Ti1和Ti2原子的高度略有下降;当氧原子覆盖度在0.50—1.50 ML时,Ti3和Ti4原子高度随着覆盖度的增大而升高,而Ti1和Ti2原子高度变化不大;当氧原子覆盖度为1.25 ML,褶皱度为1.73 Å,而Perfect表面体系第1层和第2层的层间距为1.94 Å.这表明氧原子的吸附导致2Exc13反位缺陷体系表面的Ti3和Ti4原子被拉离了表面,并使得原表面第1层的Ti原子分离形成两层;当氧原子覆盖度为1.75—2.0 ML时,表面的Ti原子高度均增大.氧原子覆盖度为2.0 ML时,吸附位置组合FNFNFTFTHHPP表面第1层的Ti3和Ti4原子与O原子形成了类铌铁矿相TiO2结构;吸附位置组合FNFNFTFTHHSS表面第1层的Ti3和Ti4原子与O原子同样形成了类铌铁矿相TiO2结构,Ti1和Ti2原子与O原子形成了类金红石相TiO2结构;这两种氧原子吸附结构均在TiO2层下方出现Ni原子富集.2Exc13反位缺陷体系在高氧原子覆盖度下形成了不同相的二氧化钛,这可能是实验发现不同处理温度会形成不同二氧化钛的原因.
4 结 论
为了研究更为实际的给定NiTi合金的氧化机制,我们在保持体系中所含Ni和Ti原子数等比的条件下构建了各种NiTi(110)反位缺陷体系,并利用DFT方法计算研究了其氧化吸附行为,得到如下结论.
对于无缺陷的Perfect体系,当氧原子覆盖度θ≤0.5 ML时,表面上的三原子洞位是氧原子最稳定的吸附位置;当氧原子覆盖度为0.75 ML时,表面上的三原子洞位和表面下的八面体中心位置所构成的组合T1T2Oct2是最稳定的吸附位置,表面上的四原子洞位组合FNFNFT与其有竞争关系;当氧原子覆盖度大于1.0 ML,除了吸附表面上的三原子洞位、四原子洞位外,氧原子还吸附在表面下的八面体间隙中心位置和六面体间隙中心位置;对于反位缺陷体系,当氧原子覆盖度较高(θ≥1.5 ML)时,2Exc12反位缺陷体系表面的Ti原子氧化形成铌铁矿相二氧化钛层,2Exc13反位缺陷体系表面的氧化层是铌铁矿相和金红石相二氧化钛的混合,且二氧化钛层下方均有Ni原子富集.
NiTi(110)表面反位缺陷体系的稳定性与氧原子吸附多少和周围环境中氧的化学势直接相关.在富氧的条件下,表面形成二氧化钛的2Exc13反位缺陷体系最容易形成,由此表明因氧原子与Ti原子的作用强于Ni原子导致Ti原子在表面偏析,形成二氧化钛层,而Ni原子在其下方富集,这就是实验观察到NiTi表面氧化会形成二氧化钛的原因.为了进一步理解NiTi表面氧化机理,氧化过程中Ni,Ti和O的扩散值得进一步研究.
[1]Ma L,Wang X,Shang J X 2014Acta Phys.Sin.63 233103(in Chinese)[马蕾,王旭,尚家香 2014物理学报63 233103]
[2]Wu H L,Zhao X Q,Gong S K 2008Acta Phys.Sin.57 7794(in Chinese)[吴红丽,赵新青,宫声凯2008物理学报57 7794]
[3]Geng F,Shi P,Yang D Z 2005J.Funct.Mater.36 11(in Chinese)[耿芳,石萍,杨大智 2005功能材料36 11]
[4]Wang Y X,Zhang X N,Sun K 2006Chin.J.Rare Metals30 385(in Chinese)[王蕴贤,张小农,孙康 2006稀有金属30 385]
[5]Starosvetsky D,Gotman I 2001Biomaterials22 1853
[6]Li Y,Zhao T,Wei S,Xiang Y,Chen H 2010Mater.Sci.Eng.C30 1227
[7]Tan L,Dodd R A,Crone W C 2003Biomaterials24 3931
[8]Zhao T,Li Y,Xiang Y,Xiang Y,Zhao X,Zhang T 2011Surf.Coat.Technol.205 4404
[9]Mändl S,Lindner J K N 2006Nucl.Instr.Meth.Phys.Res.B249 355
[10]Lutz J,Lindner J K N,Mändl S 2008Appl.Surf.Sci.255 1107
[11]Bernard S A,Balla V K,Davies N M,Bose S,Bandyopadhyay A 2011Acta Biomater.7 1902
[12]Hassel A W,Neelakantan L,Zelenkevych A,Ruh A 2008Corros.Sci.50 1368
[13]Sun T,Wang M,Lee W C 2011Mater.Chem.Phys.130 45
[14]Firstov G S,Vitchev R G,Kumar B,Blanpain B,Humbeeck J V 2002Biomaterials23 4863
[15]Gu Y W,Tay B Y,Lim C S,Yong M S 2005Biomaterials26 6916
[16]Gu Y W,Tay B Y,Lim C S,Yong M S 2005Appl.Surf.Sci.252 2038
[17]Undisz A,Schrempel F,Wesch W,Rettenmayr M 2012J.Biomed.Mater.Res.100A 1743
[18]Chu C L,Wu S K,Yen Y C 1996Mater.Sci.Eng.A216 193
[19]Nolan M,Tofail S A M 2010Biomaterials31 3439
[20]Nigussa K N,Støvneg J A 2010Phys.Rev.B82 245401
[21]Liu X,Guo H M,Meng C G 2012J.Phys.Chem.C116 21771
[22]Li Y C,Wang F H,Shang J X 2016Corros.Sci.106 137
[23]Kibey S,Sehitoglu H,Johnson D D 2009Acta Mater.57 1624
[24]Kresse G,Furthmüller J 1996Phys.Rev.B54 11169
[25]Blöchl P E 1994Phys.Rev.B50 17953
[26]Perdew J P,Chevary J A,Vosko S H,Jackson K A,Pederson M R,Singh D J,Fiolhais C 1993Phys.Rev.B48 4972
[27]Zhang C,Farhat Z N 2009Wear267 394
[28]Diebold U 2003Surf.Sci.Rep.48 53
[29]Muscat J,Swamy V,Harrison N M 2002Phys.Rev.B65 224112
[30]Reuter K,Scheffler M 2001Phys.Rev.B65 035406
[31]Bergermayer W,Schweiger H,Wimmer E 2004Phys.Rev.B69 195409
[32]Liu K,Wang F H 2016Mater.Protect.49 65(in Chinese)[刘坤,王福合 2016材料防护 49 65]
PACS:68.43.Bc,68.35.Dv,68.35.Md,68.55.Ln DOI:10.7498/aps.66.216801
*Project supported by the National Natural Science Foundation of China(Grant No.51371017).
†Corresponding author.E-mail:wfh-phy@cnu.edu.cn
First-principles study on the adsorption of oxygen at NiTi(110)surface∗
Liu Kun1)Wang Fu-He1)†Shang Jia-Xiang2)
1)(Department of Physics,Capital Normal University,Beijing 100048,China)
2)(School of Materials Science and Engineering,Beihang University,Beijing 100191,China)
d 29 May 2017;revised manuscript
26 July 2017)
NiTialloys with equiatomic compositions have been widely used as structural materials in aerospace,aviation and other fields due to their shape memory effects and good mechanical performances.At the same time,they are considered as excellent biomedical materials for their biocompatibilities and high fatigue resistances.As structural materials,the oxidation resistance of NiTialloy should be improved.However,as biomedical materials,the formation of dense TiO2layers on the surface of NiTialloy is required to suppress the release of Niions in body liquid.As a result,it is of great significance to study the oxidation mechanism of NiTialloy.
In this work,while the total number of Ti is kept the same as that of Niatoms in the whole system,a series of defectedc(2×2)-NiTi(110)surfaces with antisite of Ti are constructed to further understand the oxidation mechanism of NiTialloy.The adsorption of oxygen atom at the NiTi(110)surface is investigated by the first-principles calculations.The calculated results show that the stability of the oxygen adsorption is strongly related to the enrichment of Tiatoms on the surface.The higher the enrichment of Tiatoms on the surface,the stronger the adsorption of oxygen atoms is.When the coverage of oxygen is high enough,the adsorption of oxygen atoms on the surface could cause the antisite of Tiatoms on the surface by the exchange of Niatoms in the first layer with Tiatoms in other layers.Under the O-rich conditions(µO≥−9.35 eV),it is the most stable that the oxygen atoms adsorbed on Ti antisite surface,with the whole Niatoms in the first surface layer exchanged with the whole Tiatoms in the third surface layer.With the increase of the adsorbed oxygen atoms on the surface,the heights of Tiatoms in the surface layers are raised by the adsorption of oxygen.The TiO2layer is formed by the expansive growth,while Niatoms are enriched beneath the TiO2.As a result,the reason why the TiO2layer is formed on the NiTialloy surface in the experimental conditions is well explained.
first-principles calculation,NiTialloy,TiO2,surface energy
为了研究给定的NiTi的表面氧化过程,在保持体系中Ni和Ti原子总数相等的条件下,构建了一系列Ti原子在表面反位的c(2×2)-NiTi(110)缺陷体系,并利用第一性原理计算研究了氧原子在各种NiTi(110)反位缺陷体系的吸附行为以及表面形成能.计算结果表明:吸附氧原子的稳定性与表面Ti原子的富集程度有很大的关联性,体系表面Ti原子富集程度越高,氧原子吸附的稳定性越高;当覆盖度较高时,由于氧原子的吸附,可使Ni和Ti原子在表面出现反位.在富氧条件(µO≥−9.35 eV)下,氧原子在表面第1层中的全部Ni原子与第3层全部Ti换位的反位缺陷体系上的吸附最稳定,此时随着氧原子的吸附,表面上的Ti原子升高,导致向上膨胀生长形成二氧化钛层,且在其下方形成富Ni层,由此可合理地解释实验上发现NiTi合金氧化形成二氧化钛层的可能原因.
10.7498/aps.66.216801
∗国家自然科学基金(批准号:51371017)资助的课题.
†通信作者.E-mail:wfh-phy@cnu.edu.cn
©2017中国物理学会Chinese Physical Society

