一种淡红侧耳多糖的制备工艺
田有秋, 武奔月, 谢广杰, 吴 昊, 贾金霞, 束 旭, 王昱沣,*
(1.南京农业大学 食品科学技术学院, 江苏 南京 210095;2.南京工业大学 生物与制药工程学院, 江苏 南京 211800)

一种淡红侧耳多糖的制备工艺
田有秋1, 武奔月1, 谢广杰1, 吴 昊2, 贾金霞1, 束 旭1, 王昱沣1,*
(1.南京农业大学 食品科学技术学院, 江苏 南京 210095;2.南京工业大学 生物与制药工程学院, 江苏 南京 211800)
研究了淡红侧耳多糖的提取工艺条件,并对其进行脱色脱蛋白处理。以单因素实验为基础,采用响应曲面法优化多糖的提取条件;选用大孔阴离子交换树脂D315脱色、Sevage法脱蛋白。建立的淡红侧耳多糖较佳提取工艺条件为提取温度95 ℃,提取时间3.9 h,固液比(g∶mL)1∶30.6,在此条件下淡红侧耳多糖的平均得率为13.44%;D315的脱色率为81.37%,多糖保留率为82.21%;Sevage法蛋白脱除率为61.39%,多糖保留率为93.29%。经响应面优化及脱色脱蛋白处理,可获得得率高且色素蛋白含量低的淡红侧耳多糖。
淡红侧耳; 多糖; 优化; 脱色; 脱蛋白
淡红侧耳隶属担子菌门伞菌纲伞菌目侧耳科侧耳属[1],别名桃红侧耳、红平菇。其色鲜味美,且具有蟹香[2];蛋白质、粗纤维含量丰富,分别为22.55%、32.40%,且富含维生素和氨基酸[3]。淡红侧耳子实体多糖是淡红侧耳的重要活性成分,具有抗氧化等活性[4]。目前国内外对淡红侧耳的研究主要集中在菌丝体多糖[5-7]、深层发酵[8]、驯化栽培[9-11]、产漆酶活性[12]、营养成分分析[13-16]以及采用原生质体技术选育优良菌株[17-19]等方面。
淡红侧耳作为一种兼食用、药用及观赏的食用菌正在逐步被人们所接受,研究其深加工有利于拓宽淡红侧耳的商业用途及推广价值。本研究建立其子实体多糖的较佳提取工艺,并对其进行脱色脱蛋白,为淡红侧耳多糖的进一步研究和应用提供依据。
1 材料与方法
1.1 材料与试剂
淡红侧耳,购于广东银新现代农业股份有限公司;无水乙醇,分析纯,国药集团化学试剂有限公司;硫酸和苯酚,分析纯,南京化学试剂有限公司;丙酮和无水乙醚,分析纯,上海凌峰化学试剂有限公司。
1.2 仪器与设备
RHP- 400型打粉机,浙江永康市荣浩工贸有限公司;HH-2型数显恒温水浴锅,上海维诚仪器有限公司;TDZ5-WS型低速离心机,长沙湘智离心机仪器有限公司;RE-5299型旋转蒸发器,上海亚荣生化仪器厂; EU-2600R型紫外可见分光光度计,上海昂拉仪器有限公司;冷冻干燥机,北京博医康实验仪器有限公司。
1.3 实验方法
1.3.1工艺流程
取淡红侧耳子实体干品250.0 g,用清水洗净,室温自然干燥后,于80 ℃烘箱中烘干;置于打粉机中粉碎2 min。取2.0 g细粉,以蒸馏水为溶剂,按设定条件(固液比、提取温度、提取时间)进行多糖提取。将提取后的混合液进行离心(转速为5 000 r/min,时间为10 min),收集上清液,于旋转蒸发器中(45 ℃)浓缩至约20 mL。将3倍体积的95%乙醇加入到浓缩液中(边加边搅拌),得茶褐色絮状沉淀,于4 ℃冰箱中静置12 h。将无水乙醇、丙酮、无水乙醚依次加入到醇沉液中,进行抽滤,重复此操作3次,抽滤完成后得灰白色粗多糖,置于干燥器中备用。将粗多糖用蒸馏水复溶,在设定条件下脱色、脱蛋白;将脱色、脱蛋白后的多糖液旋蒸浓缩至约20 mL,去离子水透析24 h后,于真空冷冻干燥机中冻干,得子实体粗多糖。
1.3.2多糖的提取工艺优化
1.3.2.1 单因素实验
固定3 h和85 ℃的提取条件,研究固液比(g∶mL)1∶20,1∶30,1∶40,1∶50,1∶60(即淡红侧耳粉末质量与蒸馏水体积的比例)对得率的影响;固定1 ∶30和85 ℃ 的提取条件,研究时间1,2,3,4 h对得率的影响;固定1∶30和3 h的提取条件,研究温度75,80,85,90,95 ℃对得率的影响。
1.3.2.2 响应面试验
通过分析单因素实验结果,分别选择固液比、提取温度以及提取时间的某一水平作为响应面试验的中心点,进行响应面试验。
1.3.2.3 多糖含量测定和得率计算
以葡萄糖为标准品,采用苯酚硫酸法,在490 nm处测定吸光度,并以吸光度对葡萄糖质量浓度进行回归分析,得回归方程y=0.015 4x-0.005 6(R2=0.999 4);将淡红侧耳粗多糖用蒸馏水复溶,稀释至0.05 mg/mL,测定吸光度,根据标准曲线计算多糖的质量浓度C。按式(1)计算多糖得率。

(1)
式(1)中,C为多糖的质量浓度,mg/mL;V为粗多糖的稀释后体积,mL;M为提取所用淡红侧耳粉的质量,g。
1.3.3多糖的脱色
选用大孔阴离子交换树脂D315对多糖进行动态脱色。按较佳提取条件制备粗多糖,配制1 mg/mL的粗多糖溶液;将大孔树脂湿法装柱,分别考察上样流速10,30,50,70 mL/h对脱色率和多糖保留率的影响;选取较佳上样流速,考察上样体积对脱色率和多糖保留率的影响。
在450 nm下,分别测定多糖溶液脱色前后的吸光度,按式(2)计算脱色率,式(3)计算多糖保留率。

(2)

(3)
式(2)中,A为吸光度值;式(3)中,m为多糖的质量,mg。
1.3.4多糖的脱蛋白
采用Sevage法对脱色后的多糖溶液进一步脱蛋白。将多糖溶液与Sevage试剂按4∶1(体积比)混合,于磁力搅拌器中混匀30 min,5 000 r/min离心后,静置于分液漏斗中,收集上层溶液,重复上述步骤,直至中间层无变性蛋白产生,测定脱蛋白率和多糖保留率。
以牛血清白蛋白为标准品,采用考马斯亮蓝G-250法,在595 nm处测定吸光度,并以吸光度对蛋白质质量浓度进行回归分析,得回归方程y=0.005x-0.021 5(R2=0.991 4);取脱蛋白后的多糖溶液,稀释至0.1 mg/mL,测定吸光度,根据标准曲线计算蛋白质含量,按式(4)计算蛋白脱除率,式(3)计算多糖保留率。

(4)
式(4)中,m为蛋白质的质量,mg。
1.4 数据处理
实验数据为3次重复实验的均值;SAS 8.0进行显著性分析(p<0.05),Design-Expert 7.1.6进行响应面分析,Orgin 8.0作图。
2 结果与分析
2.1 单因素实验结果分析
2.1.1固液比对多糖得率的影响
在提取温度85 ℃、提取时间3 h的条件下,研究不同固液比对多糖得率影响的实验结果,见图1。

不同小写字母表示不同固液比之间在p<0.05水平上有显著性差异。图1 固液比与多糖得率的关系Fig.1 Effect of solid-liquid ratios on extraction yield of polysaccharide
由图1可知,固液比为1∶50时的多糖得率与1∶60 g/mL时的得率相比无显著性差异(p>0.05),但与1∶20,1∶30,1∶40时的得率相比差异显著;固液比1∶20,1∶30,1∶40之间的得率差异显著(p<0.05)。当固液比较低时,淡红侧耳细粉与水不能充分混合,使多糖得率较低;当固液比从1∶20变化到1∶40时,得率从4.28%增加到9.88%;固液比继续增加,多糖得率开始下降,可能原因是旋蒸时损失了一部分多糖,也可能是在水浴浸提过程中,多糖由于不均匀吸热而溶解不完全所致[20],因此1∶40为多糖提取的较佳固液比。
2.1.2提取温度对多糖得率的影响
在固液比1∶30、提取时间3 h的条件下,研究不同提取温度对多糖得率影响的实验结果,见图2。

不同小写字母表示不同提取温度之间在p<0.05水平上有显著性差异。图2 提取温度与多糖得率的关系Fig.2 Effects of temperature on extraction yield of polysaccharide
由图2可知,提取温度为80, 85, 95 ℃时的多糖得率之间无显著性差异(p>0.05),但与75 ℃和95 ℃时的得率相比差异显著(p<0.05)。温度从75 ℃升高到90 ℃时,多糖得率逐渐增加;继续升高到95 ℃时,得率从90 ℃时的11.26%下降到10.54%,这可能是部分多糖在高温下结构被破坏所致。因此90 ℃为较佳提取温度。
2.1.3提取时间对多糖得率的影响
在固液比1∶30、提取温度85 ℃的条件下,研究不同提取时间对多糖得率影响的实验结果,见图3。
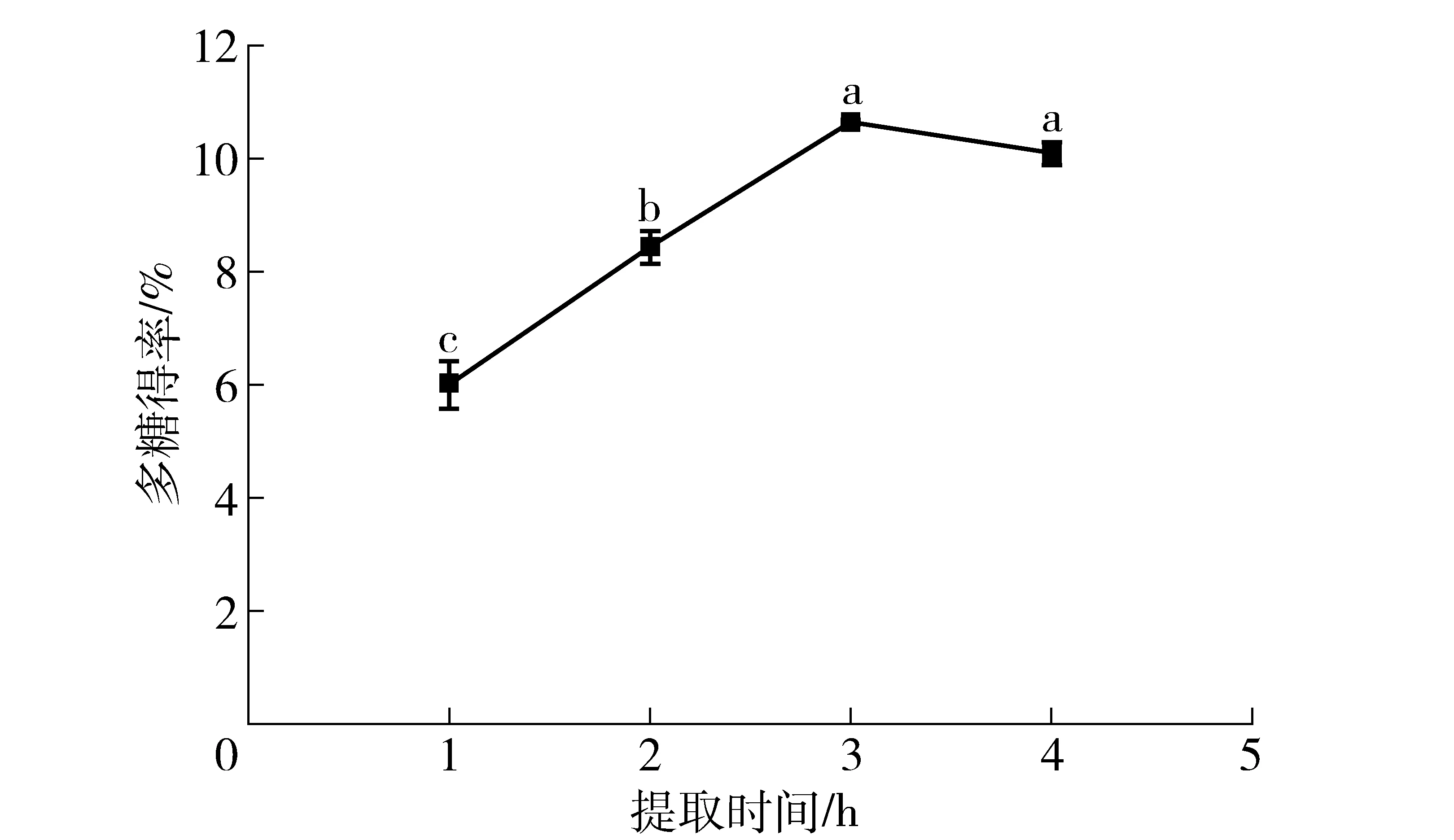
不同小写字母表示不同提取时间之间在p<0.05水平上有显著性差异。图3 提取时间与多糖得率的关系Fig.3 Effects of time on extraction yield of polysaccharide
由图3可知,提取时间为3 h和4 h时的多糖得率之间无显著性差异(p>0.05),但与1 h和2 h时的得率相比差异显著(p<0.05)。提取时间少于3 h时,随时间增加的同时,多糖得率持续增加;3 h时达到10.66%;4 h时,得率下降到10.10%,可能由于提取时间过长部分多糖的结构遭到破坏,导致得率变低。因此3 h为多糖提取的较佳提取时间。
2.2 响应面试验结果分析
2.2.1响应面试验设计方案及数据分析
对单因素实验结果进行分析,将1∶40,90 ℃,3 h作为固液比、提取温度和提取时间在响应面试验中的中心点,进行三因素三水平的响应面优化试验,以多糖得率为响应值。利用Design-Expert 7.1.6对实验结果进行分析,见表1。
2.2.2回归方程及方差分析
通过对表1中多糖得率数据进行分析,可得回归方程:R=6.34+0.011A+0.37B+0.070C-0.17AB-0.32AC+0.24BC-0.24A2-0.28B2-0.33C2,可通过此方程来预测多糖得率。
由方差分析结果可知,模型p<0.000 1,且相关系数R=0.997 1,说明回归模型极显著;失拟项p=0.221 9>0.05,说明失拟项不显著,即得率的实际值高度拟合于经软件计算所得的预测值。
由各因素及其交互项的p值,可得其对多糖得率的影响程度大小。其中因素A即固液比的p=0.546 5>0.05,说明固液比对多糖得率影响不显著;因素C即提取时间的p=0.005 6<0.01;交互项AB的p=0.000 2<0.01;其余各项的p值均小于0.000 1,即影响显著。所以,对各因素及交互项影响多糖得率的程度由大到小依次为:B,AC,BC,A2,B2,C2,AB,C,A。由于各交互项和二次项均对多糖得率有影响且影响显著,说明各因素并不是单一影响着得率的大小,而是存在着交互作用。
2.2.3验证实验结果分析
利用Design-Expert 7.1.6软件分析可得,淡红侧耳多糖的较佳提取条件为提取时间3.91 h,固液比1∶30.62,提取温度95 ℃;理论最大得率为13.28%。为了方便实验操作,将其修改为:提取时间3.9 h,固液比1∶30.6,提取温度95 ℃;在此条件下进行3次重复实验,得率均值为13.44%,与理论值仅相差1.19%,说明实验建立的模型较准确。

表1 响应面试验设计与结果
2.3 多糖脱色条件的确定
2.3.1上样流速对脱色效果的影响
不同上样流速对多糖脱色率和保留率影响的实验结果,分别见图4和图5。

图4 上样流速与脱色率的关系Fig.4 Effect of sample loading flow rates on decolorization rate
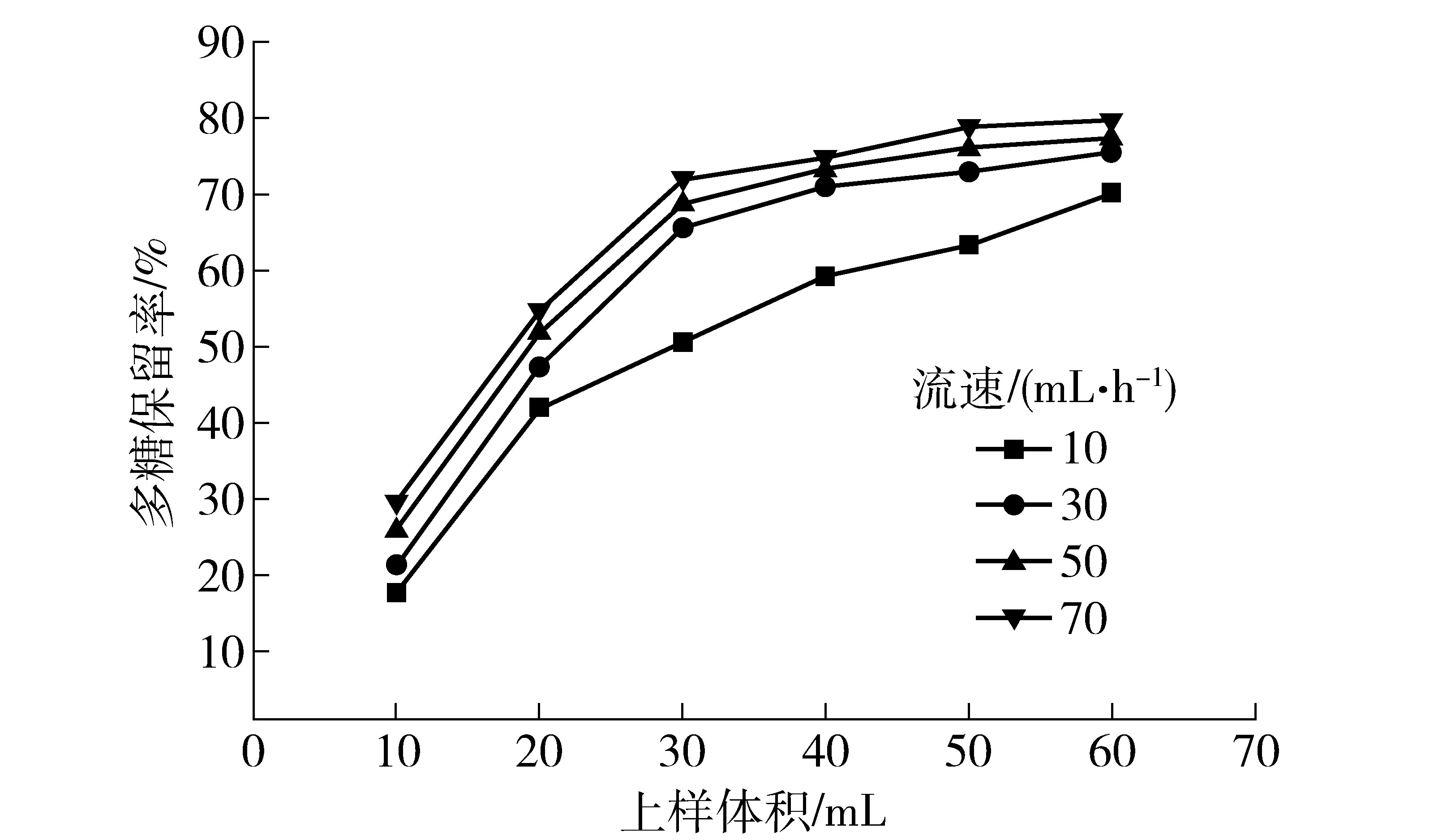
图5 上样流速与多糖保留率的关系Fig.5 Effect of sample loading flow rates on polysaccharide retention rate
由图4和图5可以看出,在同一上样体积下,上样流速越快,多糖的脱色率越小,而多糖保留率越大。这是由于流速越快,多糖与树脂接触越不充分所致。综合脱色率和多糖保留率两个指标,选择30 mL/h作为上样流速。
2.3.2上样体积对脱色效果的影响
在上样流速为30 mL/h的条件下,不同上样体积对多糖脱色率和保留率影响的实验结果,见图6。
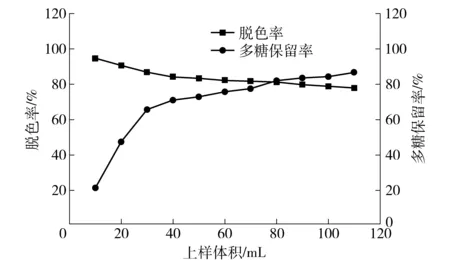
图6 上样体积与脱色效果的关系Fig.6 Effect of sample loading amounts on decolorization effect
如图6,随着上样体积的不断增加,脱色率逐渐降低,而多糖保留率则逐渐增加。当上样体积为80 mL时,脱色率为81.37%,多糖保留率为82.21%;上样体积继续增加时,脱色率继续降低,而且多糖保留率增加不明显,所以选取80 mL为较佳上样体积。大孔树脂在脱色的同时也能脱蛋白,在上样流速30 mL/h、上样体积80 mL的条件下,蛋白质的脱除率为76.68%。
2.4 多糖脱蛋白条件的确定
经大孔阴离子交换树脂D315脱色后,多糖的蛋白含量为5.62%。为进一步降低蛋白含量,在此基础上,采用Sevage法继续脱蛋白,经5次处理后,蛋白脱除率达61.39%,多糖保留率为93.29%,此时的蛋白含量仅为2.17%。
3 结 论
多糖的得率受多种条件的影响,综合考虑了固液比,提取温度和提取时间,通过单因素实验及响应面试验对淡红侧耳多糖的提取工艺条件进行了优化。结果显示,经响应面试验优化提取条件后,多糖得率可以达到13.44%,较大地提高了多糖的得率。多糖中色素和蛋白质的存在不仅会使多糖的纯度降低,还会阻碍多糖的进一步研究,经大孔树脂脱色后,多糖的脱色率为81.37%,保留率为82.21%,多糖由茶褐色变为接近无色;脱色的同时还可脱除部分蛋白,经Sevage法继续脱蛋白后,多糖中的蛋白含量仅为2.17%。本实验研究结果有利于对淡红侧耳多糖的深入研究及工业化生产提供依据。
[1] 李传华, 曲明清, 曹晖, 等. 中国食用菌普通名名录[J]. 食用菌学报, 2013, 20(3): 50-72.
LI C H, QU M Q, CAO H, et al. List of common edible fungi in China[J]. Acta Edulis Fungi, 2013, 20(3): 50-72.
[2] 杨淑云, 羿红, 谢福泉, 等. 红平菇菌丝生物学特性研究[J]. 菌物学报, 2007, 26(s): 81-85.
YANG S Y, YI H, XIE F Q, et al. Studies on the biological characteristics of mycelia ofPleurotusostreatus[J]. Mycosystema, 2007, 26(s): 81-85.
[3] 迟全勃, 施鹏飞, 王伟青, 等. 红平菇和平菇的营养比较与分析[J]. 北京农业职业学院学报, 2015, 29(3): 16-19.
CHI Q B, SHI P F, WANG W Q, et al. Comparison and analysis of nutrition betweenPleurotusdjamorandPleurotusostreatus[J]. Journal of Beijing Vocational College of Agriculture, 2015, 29(3): 16-19.
[4] 刘智会, 池玉杰. 红平菇菌株 H 1多糖提取工艺及其功能分析[J]. 东北林业大学学报, 2008, 36(3): 55-56.
LIU Z H, CHI Y J. Extraction technique of polysaccharide fromPleurotusdjamorisolate H1 and its function [J]. Journal of Northeast Forestry University, 2008, 36 (3): 55-56.
[5] 罗茂春, 林标声, 林跃鑫. 光质对红平菇菌丝体和子实体生长发育的影响[J]. 食品工业科技, 2012, 33(8):188-190.
LUO M C, LIN B S, LIN Y X. Effect of light quality on the growth and development of the mycelium and fruit body ofPleurotusdjamor[J]. Science and Technology of Food Industry, 2012, 33 (8):188-190.
[6] 王谦, 杨立华, 刘玉霞. 桃红侧耳液体培养及其多糖的抗氧化活性研究[J]. 食用菌, 2005(3): 10-11.
WANG Q, YANG L H, LIU Y X. Study on liquid culture and antioxidant activity of polysaccharides fromPleurotusdjamor[J]. Edible Fungi, 2005(3): 10-11.
[7] ZHANG J J, MENG G Y, ZHANG C, et al. The antioxidative effects of acidic-, alkalic-, and enzymatic-extractable mycelium zinc polysaccharides byPleurotusdjamoron liver and kidney of streptozocin-induced diabetic mice[J]. BMC Complementary and Alternative Medicine, 2015, 15: 440.
[8] 竹文坤, 贺新生. 红平菇发酵工艺条件研究[J]. 食用菌, 2010(2): 13-14.
ZHU W K, HE X S. Study on fermentation conditions ofPleurotusdjamor[J]. Edible Fungi, 2010(2): 13-14.
[9] 张沿江, 吴金玉, 孙艳辉, 等. 红平菇高产栽培技术[J]. 食用菌, 2009(8): 34-35.
ZHANG Y J, WU J Y, SUN Y H, et al.High yield cultivation techniques ofPleurotusdjamor[J]. Edible Fungi, 2009(8): 34-35.
[10] 熊芳, 朱坚, 邓优锦, 等. 红平菇培育条件和栽培技术研究[J]. 江西农业大学学报, 2011, 33(5): 1006-1011.
XIONG F, ZHU J, DENG Y J , et al. The determination ofPleurotusdiamoragronomic characters[J]. Acta Agriculturae Universitatis Jiangxiensis, 2011, 33(5): 1006-1011.
[11] 刘明广, 张新红, 龚雪梅, 等. 玉米秸秆栽培红平菇试验[J]. 中国食用菌, 2015, 34(1): 37-39.
LIU M G, ZHANG X H, GONG X M, et al. Test onPleurotusdiamorsubstitude cultured by corn straw[J]. Edible Fungi of China, 2015, 34(1): 37-39.
[12] MATA G, HEMANDEZ D M M , ANDREU L G I, et al. Changes in lignocellulolytic enzyme activites in sixPleurotusspp. strains cultivated on coffee pulp in confrontation withTrichodermaspp. [J]. World Journal of Microbiology and Biotechnology, 2005, 21(2): 143-150.
[13] 林标声, 江彬, 陈志涛, 等. 红平菇的生长特性及其子实体营养成分分析[J]. 河南大学学报, 2012, 42(2): 192-197.
LIN B S, JIANG B, CHEN Z T, et al. Analysis of the growth characters and fruit body nutrition composition ofPleurotusdjamor[J]. Journal of Henan University, 2012, 42(2): 192-197.
[14] 韩珍琼, 任飞, 贺新生. 碳源和氮源对红平菇菌丝体营养成分的影响[J]. 食品工业, 2015, 36(12): 172-175.
HAN Z Q, REN F, HE X S. Effect of carbon and nitrogen sources on the nutritional component ofPleurotusdjamormycelium [J]. Food Industry, 2015, 36(12): 172-175.
[15] PHISUT N, TEERARAT I, PHANTIPHA C. Proximate compositions, nonvolatile taste components and antioxidant capacities of some dried edible mushrooms collected from Thailand[J]. Food Measure, 2015(9): 259-268.
[16] RODRIGUES D M F, FREITAS A C, ROCHA-SANTOS T A P, et al. Chemical composition and nutritive value ofPleurotuscitrinopileatusvarcornucopiae,P.eryngii,P.salmoneostramineus,PholiotanamekoandHericiumerinaceus[J]. Journal of Food Science and Technology, 2015, 52(11): 6927-6939.
[17] 邱景芸, 吴月嫦, 廖汉泉, 等. 凤尾菇和桃红平菇种间原生质体电融合获杂种菌株[J]. 生物工程学报, 1995, 11(2): 162-166.
QIU J Y, WU Y C, LIAO H Q, et al.PleurotusdjamorandPleurotusrhodophyllusinterspecific hybrid strains by protoplast fusion[J]. Chinese Journal of Biotechnology, 1995, 11(2): 162-166.
[18] 王谦, 刘玉霞, 张渊, 等. 原生质体技术选育桃红侧耳优良菌株[J]. 菌物学报, 2006, 25(1): 83-87.
WANG Q, LIU Y X, ZHANG Y, et al. Applied studies on selection of high qualityPleurotusdjamorstrains by protoplast technology[J]. Mycosystema, 2006, 25(1): 83-87.
[19] PALANIAPPAN S, SEETHARAMAN R, ANAM G B, et al. Improving biological efficiency ofPleurotusstrain through protoplast fusion betweenP.ostreatusvar.floridaandP.djamorvar.roseus[J]. Food Science and Biotechnology, 2015, 24(5): 1741-1748.
[20] 王金玺, 包振伟, 刘笑, 等. 响应曲面法优化平菇多糖提取工艺[J]. 中国酿造, 2013, 32(4): 108-112.
WANG J X, BAO Z W, LIU X, et al. Optimization of polysaccharides extraction process fromPleurotusostreatusby response surface methodology[J]. China Brewing, 2013, 32(4): 108-112.
StudyonPreparationTechnologyofPolysaccharidefromPleurotusdjamor
TIAN Youqiu1, WU Benyue1, XIE Guangjie1, WU Hao2, JIA Jinxia1, SHU Xu1, WANG Yufeng1,*
(1.CollegeofFoodScienceandTechnology,NanjingAgricultureUniversity,Nanjing210095,China;2.CollegeofBiotechnologyandPharmaceuticalEngineering,NanjingUniversityofTechnology,Nanjing211800,China)
In this study, the extraction of polysaccharides fromPleurotusdjamorand its decolorization and deproteinization were investigated. The optimal extraction conditions were obtained by RSM. Macroporous anion exchange resin D315 was used to decolorize polysaccharides and moreover Sevage method was adopted to deproteinize it. The optimum extraction conditions were as followed: temperature 95 ℃, time 3.9 h, and the solid-liquid ratio 1∶30.6 (g∶mL). Under these conditions, the yield was 13.44 %. Decoloration rate of D315 was 81.37% and polysaccharide retention rate was 82.21%. While the deproteinization rate was 61.39% and polysaccharide retention rate was 93.29%.Pleurotusdjamorpolysaccharide with a high yield and a low content of pigment and protein could be obtained by the established extraction process, decolorization and deproteinization together.
Pleurotusdjamor; polysaccharides; optimization; decolorization; deproteinization
10.3969/j.issn.2095-6002.2017.05.012
2095-6002(2017)05-0072-06
田有秋,武奔月,谢广杰,等. 一种淡红侧耳多糖的制备工艺[J]. 食品科学技术学报,2017,35(5):72-77.
TIAN Youqiu, WU Benyue, XIE Guangjie, et al. Study on preparation technology of polysaccharide fromPleurotusdjamor[J]. Journal of Food Science and Technology, 2017,35(5):72-77.
TS201.2
A
2017-05-11
江苏省自然科学基金资助项目(SBK2017020717);江苏省科技项目苏北科技专项(BN2015071);江苏省产学研前瞻新项目(BY2014005-07)。
田有秋,女,硕士研究生,研究方向为食品科学与工程;
*王昱沣,男,副教授,博士,主要从事生物工程和食品科学方面的研究工作,通信作者。
(责任编辑:李 宁)

