转炉钒渣中锰的浸出行为研究
彭 浩,刘作华,陶长元
(1. 长江师范学院 化学化工学院,重庆 408102;2. 重庆大学 化学化工学院,重庆 400030)
冶金
转炉钒渣中锰的浸出行为研究
彭 浩1,2,刘作华2,陶长元2
(1. 长江师范学院 化学化工学院,重庆 408102;2. 重庆大学 化学化工学院,重庆 400030)
转炉钒渣中锰的含量为6.82%,是一种低品位锰资源。实验研究了转炉钒渣中锰的浸出行为,分析了相关实验参数对锰浸出行为的影响。研究发现,在反应条件为硫酸浓度10%,反应温度90℃,反应时间120 min,反应液固比4:1 mL/g时,锰的浸出率可达到76.02%。引入电场不会影响锰的浸出行为,但硫酸亚铁的加入则会降低了锰的浸出率。反应过程中会生成大量的CaSO4,会像膜一样包裹在转炉钒渣表面,阻碍反应的进行。
转炉钒渣;锰;浸出;电场
0 前 言
锰是一种重要的战略金属,广泛应用于冶金、航天、化工等部门的关键基础材料之一[1-2]。随着我国钢铁及有色金属工业的发展,从低品位氧化锰矿、大洋多金属锰结核等锰矿资源中回收锰已成为一条重要途径,并逐渐受到全球的关注。
由于各种锰矿物相组成以及锰存在形态的差异,锰的浸出方式也不一样。软锰矿浸出工艺一直是国内外锰矿加工的重要研究内容,主要包括还原焙烧-酸浸出工艺和直接还原浸出工艺[3]。目前,湿法还原法主要有硫酸亚铁直接浸出法、二氧化硫浸出法、双氧水直接浸出法、有机还原剂浸出法、微生物浸取法等[4-9]。
转炉钒渣是含钒铁水在提钒过程中经氧化吹炼得到的尾渣,其中富含大量的锰、铁、钒、硅等元素,其主要作为提钒原料[10-15]。本文以转炉钒渣作为低品位锰资源,采用硫酸作为浸取剂,研究了硫酸浓度、反应温度、反应时间和反应液固比等因素对锰浸出率的影响。
1 实验材料和方法
1.1实验材料
实验所用转炉钒渣为钙化焙烧后转炉钒渣,将转炉钒渣干燥后研磨,并在0.075 mm(200目)过筛得到实验样品。
采用X射线荧光光谱技术(XRF)分析转炉钒渣元素组成,结果如表1所示。同时采用采用X射线衍射仪(XRD)分析转炉钒渣的物相组成,结果如图1所示。从图1中可以看出在转炉钒渣中部分Mn以可溶性的MnSO4形式存在,易于被浸出。
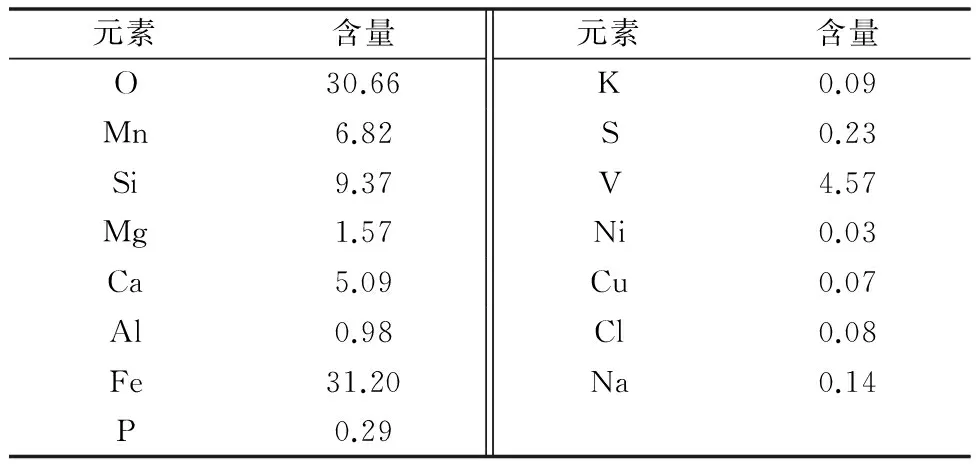
表1 转炉钒渣成分(质量分数)/%

图1 转炉钒渣XRD图谱
1.2实验方法
将配好的H2SO4溶液按照一定的液固比加入到烧杯中,将该烧杯放置在恒温水浴锅中加热。当温度上升到指定温度后,将称好的转炉钒渣加入到烧杯中搅拌反应。当反应完后采用真空过滤得到滤液和滤渣,滤渣烘干待用。采用分光光度法测定滤液中锰含量,并根据下式计算浸出率。
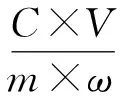
(1)
式中η——锰的浸出率;
C——滤液中锰的浓度,g/L;
V——滤液体积,L;
m——转炉钒渣质量,g;
ω——转炉钒渣中锰的含量。
2 结果与讨论
2.1硫酸浓度的影响
浸出过程中硫酸的浓度是影响锰的溶解浸出的一个重要因素。一般来说,锰的溶解度会随着酸浓度的增大而增大,但浸出过程中酸量过大会增大对设备的腐蚀,增加维护费用,同时也会增加溶液中杂质的含量。实验设计了不同硫酸浓度对锰浸出率的影响,其他实验条件为:反应液固比4∶1 mL/g,反应温度90℃,反应时间120 min。实验结果如图2所示。

图2 硫酸浓度对锰浸出率的影响
从图2所示结果可以看到:随着硫酸浓度的增加,锰的浸出率也会随之增加。反应开始时,转炉钒渣中的锰化合物与硫酸反应,以硫酸锰的形式溶解浸出,锰的浸出率随着硫酸浓度的增加而增加。当硫酸浓度超过10%后,锰的浸出率增加幅度减小,因为随着硫酸浓度的增加,转炉钒渣中的钙盐会与硫酸反应生成大量具有高粘度和吸附性的硫酸钙晶体,会阻碍反应的进行。因此选择10%作为硫酸的最佳反应浓度。
2.2反应温度的影响
实验研究了浸出过程中反应温度对锰浸出率的影响。设计温度分别为30,45,60,75,95℃,其他条件分别为反应时间120 min,硫酸浓度10%,反应液固比4∶1 mL/g。实验结果如图3所示。
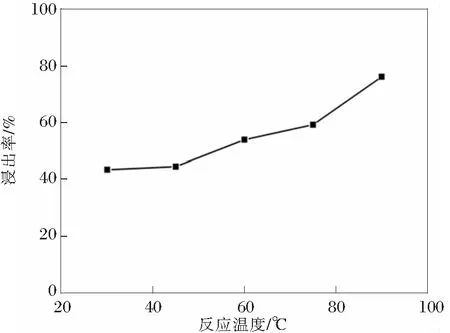
图3 反应温度对锰浸出率的影响
锰的浸出过程的实质是转炉钒渣中锰的溶解浸出的过程,该溶解过程的反应速度主要由扩散定律决定。温度是影响扩散过程的重要因素,浸出过程中温度越高,反应体系的扩散阻力越小,锰的溶解速率加快,同时锰的溶解度也逐渐增加。所以随着反应温度的升高,锰的浸出率逐渐增加。但温度过高会增加能耗,故选择90 ℃为最佳反应温度。
2.3反应时间的影响
反应时间是浸出过程中的重要参数,工业上要求尽可能短的时间内产出尽可能多的产品,以产生更多的经济效益,图4所示结果为反应时间对锰浸出率的影响。其他反应条件为:反应温度90℃,反应液固比4∶1 mL/g,硫酸浓度10%。
从图4中可以发现:适当的延长反应时间可以提高锰的浸出率。当反应时间为120 min时,锰的浸出率达到最高为76.01%。随着反应时间的延长,转炉钒渣与硫酸充分接触,锰的浸出率逐渐增加。但随着反应时间的继续延长,反应生成的大量硫酸钙会慢慢黏附在转炉钒渣表面,且会吸附溶液

图4 反应时间对锰浸出率的影响
中可溶性的锰离子,从而降低锰的浸出率。故选择120 min作为最佳反应时间。
2.4液固比的影响
实验研究了浸出过程中液固比对锰浸出率的影响。液固比分别设计为2∶1,3∶1,4∶1,5∶1,6∶1 mL/g,其他条件分别为反应时间120 min,硫酸浓度10%,反应温度90℃。实验结果如图5所示。
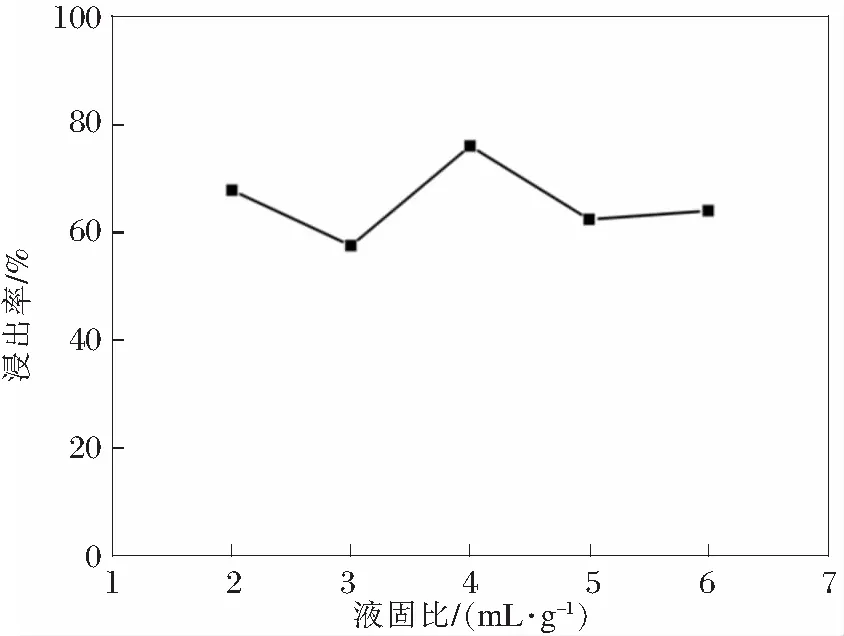
图5 液固比对锰浸出率的影响
从图5中可以看到:液固比的改变会改变锰的浸出率。反应过程中液相体积的大小会影响反应体系的粘度和有价组分的溶解度,同时工业废水的排放也制约了滤液的体积,因此在反应过程中液相体积不能太大。根据图5所示结果,选择4∶1 mL/g作为反应的最佳液固比。
2.5还原剂的影响
陶长元等[16]在研究软锰矿中锰的浸出时发现电场和硫酸亚铁可以作为还原剂强化锰的浸出行为,提高锰的浸出率。实验研究了电流密度和硫酸亚铁用量对锰浸出率的影响,结果如图6和图7所示。电场的引入对锰的浸出行为几乎没有影响,而硫酸亚铁的加入则降低了锰的浸出率。
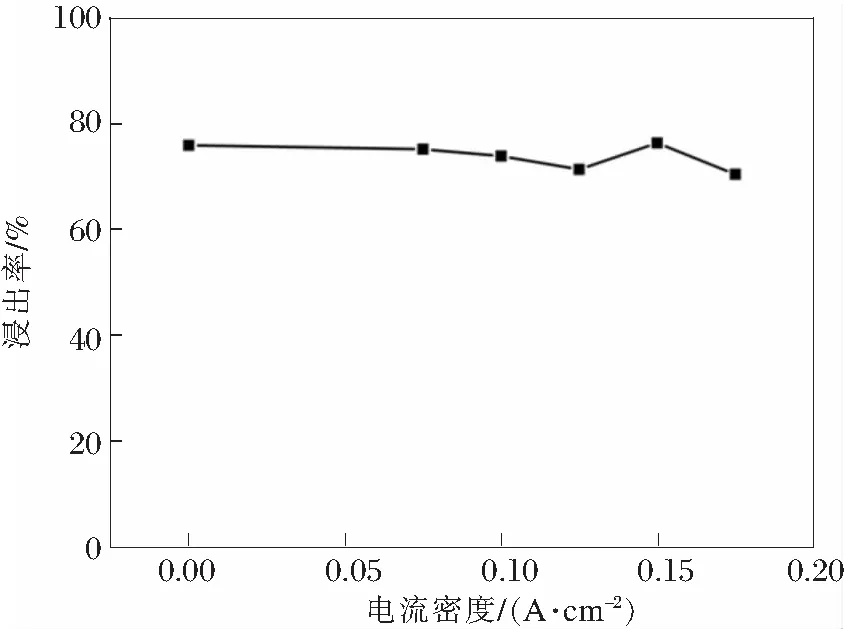
图6 电流密度对锰浸出率的影响
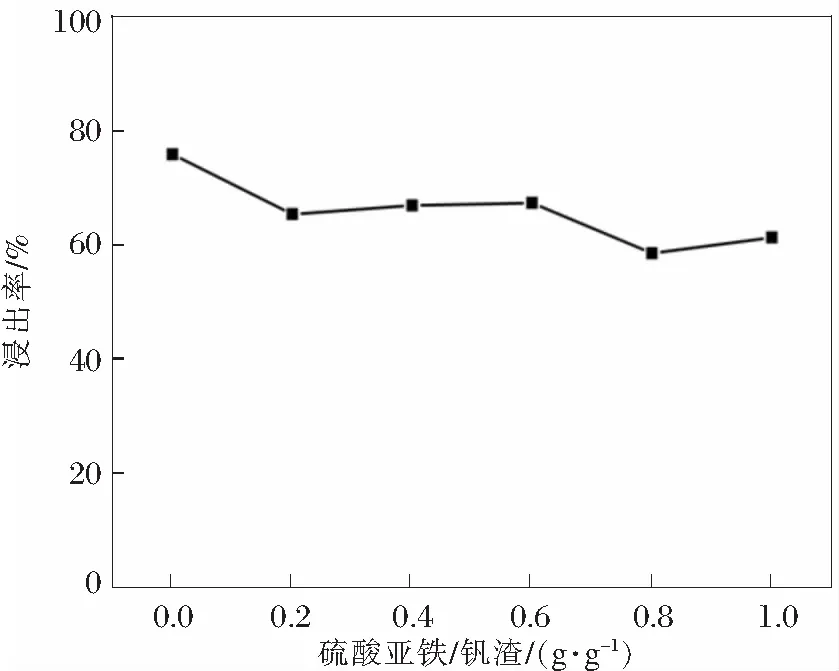
图7 硫酸亚铁用量对锰浸出率的影响
2.6物相分析
采用X射线粉末衍射仪(XRD)分析反应后滤渣的物相组成,结果如图8所示。反应前,转炉钒渣主要物相为FeVO4,Ca3(VO4)2,Fe2O3和MnSO4,与硫酸反应后,可溶性的MnSO4溶解在硫酸溶液中,物相特征峰消失。Ca3(VO4)2变成难溶的CaSO4,FeVO4溶解在硫酸溶液中,转炉钒渣中部分未被氧化的低价钒、铬氧化物(Cr(III)V(III)O3)也裸露出来。
转炉钒渣在反应前主要以块状或球状形式存在(图9a),反应过程中生成的大量CaSO4则像膜一样包裹在转炉钒渣外层(图9b),阻碍了反应的进一步发生。

图8 反应后滤渣XRD图谱

图9 反应前后转炉钒渣SEM图
3 结 论
1)转炉钒渣中含有6.82%的锰元素,可以作为一种低品位锰资源进行利用。
2)以硫酸作为浸取剂,转炉钒渣中大量可溶性的锰会溶出,浸出率高达76.01%。反应的最佳条件为:硫酸浓度10%,反应温度90℃,反应时间120 min,反应液固比4∶1 mL/g。
3)电场和硫酸亚铁作为还原剂无法强化锰的浸出行为,加入硫酸亚铁会降低锰的浸出率。
4)反应过程中生成的硫酸钙会像膜一样包裹在转炉钒渣的表面,阻碍反应的进行。
[1] Osterholz H, Simon H, Beck M, et al. Impact of diatom growth on trace metal dynamics (Mn, Mo, V, U)[J]. J Sea Res, 2014(87): 35-45.
[2] Kahal L, Zaoui A, Ferhat M. Magnetic and half-metallic properties of MPo (M=Ti, V, Cr, Mn, Fe) compounds [J]. Journal of Applied Physics, 2009(105): 20-24.
[3] 粟海锋, 孙英云, 文衍宣, 等. 废糖蜜还原浸出低品位软锰矿[J]. 过程工程学报, 2007(7): 1089-1093.
[4] 满瑞林, 常伟, 吴奇, 等. 燕麦秸秆还原浸出低品位软锰矿及其动力学[J]. 中国有色金属学报, 2014(24): 2158-2163.
[5] 李军旗, 史连军, 金会心, 等. 软锰矿吸收SO2气体制取硫酸锰的实验研究[J]. 贵州工业大学学报, 2003(32): 4-8.
[6] 韩效钊, 朱艳芳, 姚卫棠, 等. 软锰矿吸收SO2制备碳酸锰[J]. 矿冶工程, 2003(23): 51-53.
[7] 张小云, 田学达. 纤维素还原低含量软锰矿制备硫酸锰[J]. 精细化工, 2006(23): 195-197.
[8] 卢友志, 卢国贤, 明宪权, 等. 有机物还原氧化锰工艺研究进展[J]. 湿法冶金, 2015, 34, 5.
[9] 谢红艳, 王吉坤, 杨世诚, 等. 从软锰矿中湿法浸出锰的研究进展[J]. 中国锰业, 2011, 29, 5-12.
[10] Wang, S Z, Zheng, S, Wang, Y, et al. Electrochemical decomposition of vanadium slag in concentrated NaOH solution[J]. Hydrometallurgy, 2015, 151, 51-55.
[11] Peng H, Liu Z, Tao C. Selective leaching of vanadium from chromium residue intensified by electric field[J]. Journal of Environmental Chemical Engineering, 2015(3): 1252-1257.
[12] Liu Z, Nueraihemaiti A, Chen M, et al. Hydrometallurgical leaching process intensified by an electric field for converter vanadium slag[J]. Hydrometallurgy, 2015, 155, 56-60.
[13] 邓志敢, 魏昶, 李兴彬, 等. 钒钛磁铁矿提钒尾渣浸取钒[J]. 中国有色金属学报, 2012, 22, 1770-1777.
[14] Tavakoli M R, Dreisinger D B. Separation of vanadium from iron by solvent extraction using acidic and neutral organophosporus extractants[J]. Hydrometallurgy, 2014, 141, 17-23.
[15] Chen D, Zhao H, Hu G, et al. An extraction process to recover vanadium from low-grade vanadium-bearing titanomagnetite[J]. Journal of hazardous materials, 2015, 294, 35-40.
[16] Zhang X, Liu Z, Fan X, et al. Optimization of reaction conditions for the electroleaching of manganese from low-grade pyrolusite[J]. International Journal of Minerals, Metallurgy and Materials, 2015, 22, 1121-1130.
Manganese'sLeachingfromVanadiumSlaginConverter
PENG Hao1,2, LIU Zuohua2, TAO Changyuan2
(1.CollegeofChemistryandChemicalEngineering,YangtzeNormalUniversity,Chongqing408102,China; 2.CollegeofChemistryandChemicalEngineering,ChongqingUniversity,Chongqing400030,China)
Converter vanadium is of a low grade source of Mn, which consists of 6.82 %. The effects of parameters on the leaching efficiency of Mn, including sulfuric acid concentration, reaction temperature, reaction time, liquid-to-solid, are all studied. The results show that the leaching efficiency of Mn is 76.02% under the optimal conditions: sulfuric acid concentration of 10%, with reaction temperature of 90℃, liquid-to-solid of 4∶1 mL/g. The addition of FeSO4would decrease the leaching efficiency of Mn while electric field cannot. The formation of CaSO4during the leaching process would absorb on the surface of vanadium slag to block the pore channel, which was bad for filtration process.
Converter vanadium slag; Mn; Leaching; Electric field
2017-07-24
国家科技支撑计划项目(2015BAB17B00);国家自然科学基金(51274261)。
彭浩(1990-),男,湖北监利人,博士,讲师,研究方向:资源化工,手机:15123031643,E-mail:cqupenghao@126.cocm;通讯作者:陶长元(1963-),男,江苏盐城人,教授,博导,研究方向:资源化工,E-mail:taocy@cqu.edu.cn.
TF792
A
10.14101/j.cnki.issn.1002-4336.2017.05.028

