临床酵母样真菌实验室检查
王瑶,徐英春
(北京协和医院检验科,北京 100730)
临床酵母样真菌实验室检查
王瑶,徐英春
(北京协和医院检验科,北京 100730)
酵母样真菌是一类以单细胞形式存在的真菌,临床上重要的酵母样真菌多属于子囊菌门和担子菌门。精准的实验室诊断是实现精准临床诊疗的前提和基础。该文介绍了酵母样真菌的实验室检查方法及临床应用,包括基于培养的检查方法,如菌落形态、镜下形态、显色培养基、芽管形成试验、生化反应、DNA测序和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)菌落鉴定;以及非培养检查方法,包括标本直接镜检、组织病理、抗原检测、核酸检测和MALDI-TOF MS对临床标本的直接检测等,并分析各方法性能特点。
酵母样真菌;鉴定;形态学;核酸检测;基质辅助激光解吸电离飞行时间质谱
酵母样真菌是真菌的一种生长形式,为单细胞,多数通过芽生产孢,少数通过丝裂产孢。大多数医学上重要的酵母样真菌属于子囊菌门或担子菌门。
临床重要的子囊菌门酵母样真菌主要包括念珠菌属(Candidasp.)、地霉属(Geotrichumsp.)、Saprochaetesp.和酵母属(Saccharomycessp.),担子菌门酵母样真菌主要包括隐球菌属(Cryptococcussp.)、毛孢子菌属(Trichosporonsp.)、马拉色菌属(Malasseziasp.)和红酵母属(Rhodotorulasp.)[1]。本文介绍了常用的临床酵母样真菌实验室检查方法。
1 基于培养的检查方法
1.1菌落形态 多数酵母样真菌生长较快,培养2~3 d即可进行观察,少数慢生长真菌需要延长培养时间。观察酵母样菌落时应注意菌落大小、形态、颜色,不同菌种在不同的培养基、培养温度和生长时间下,菌落形态可能发生变化。
大部分念珠菌在沙氏葡萄糖培养基(SDA)上呈白色或奶油样菌落,白念珠菌(C.albicans)在菌落边缘常呈放射状(图1A),尤其在血平板上常见,克柔念珠菌(C.krusei)在SDA和血平板上菌落干燥扁平。隐球菌荚膜较厚的菌落常表现为黏液型(图1B),而荚膜较窄的菌落类似念珠菌(图1C)。毛孢子菌属菌落初始为光滑奶油样,随菌龄增长变为皱褶样或脑回样(图1D)。地霉属菌落较干,可产生棉絮样气生菌丝。Saprochaetesp.菌落呈膜状,有黏性(图1E)。马拉色菌属需要在有油脂的培养基上,32~35 ℃湿润环境培养2周,菌落表面光滑或粗糙,边缘有隆起的皱褶,质地柔软或松脆。红酵母属菌落呈红色或粉红色(图1F)。
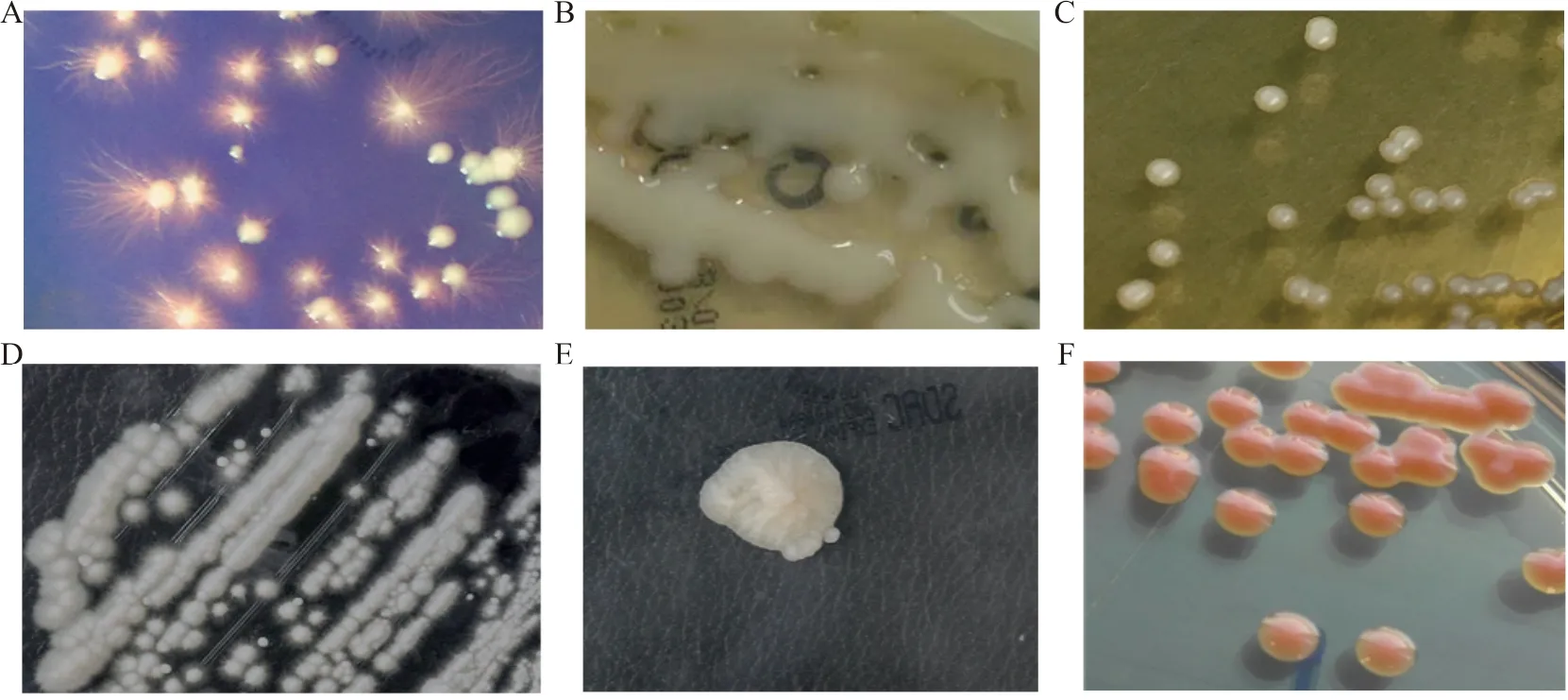
注:A,白念珠菌SDA 35 ℃培养5 d;B,黏液型新型隐球菌SDA 35 ℃培养5 d;C,非黏液型新型隐球菌SDA 35 ℃培养5 d;D,阿萨希毛孢子菌SDA 28 ℃培养5 d;E,S.capitatus(原头状地霉)SDA 28 ℃培养5 d;F,粘红酵母SDA 28℃培养3 d。
图1 酵母样真菌菌落形态
1.2菌落镜下形态 酵母样真菌通过KOH或生理盐水湿片镜检或染色镜检,可进行菌落镜下形态观察,革兰染色通常呈革兰阳性,着色不均;过碘酸染色呈现红色;乳酸酚棉蓝染色呈蓝色。常见的酵母样真菌菌落镜下特点如下。
1.2.1念珠菌属 大部分念珠菌镜下可见假菌丝和芽生孢子,但光滑念珠菌(C.glabrata)不产生假菌丝,仅有孢子结构。在玉米粉琼脂(CMA)上室温培养24~48 h,白念珠菌可见芽生孢子、厚壁孢子、真菌丝和假菌丝(图2A);克柔念珠菌假菌丝很长且极少分枝,芽生孢子少见;热带念珠菌(C.tropicalis)在假菌丝分隔处或分隔间出芽(图2B);季也蒙念珠菌(C.guilliermonddi)芽生孢子成链,假菌丝稀少;葡萄牙念珠菌(C.lusitaniae)假菌丝特征性弯曲,在分隔处出芽;近平滑念珠菌(C.parapsilosis)假菌丝较长且微弯、在分隔处出芽[2]。
1.2.2白地霉(G.candidum) CMA上仅可见关节孢子(图2C)。
1.2.3原头状地霉(Saprochaetecapitatus) 镜下可见有隔真菌丝,菌丝断裂成关节孢子(图2D)。
1.2.4酿酒酵母(Saccharomycesserevisiae) 细胞呈圆形、卵形、椭圆形至腊肠形等多种形态,有或无假菌丝,在Fowell′s醋酸盐琼脂室温培养2~5 d可促进子囊产生,内含1~4个子囊孢子。
1.2.5隐球菌属 初代培养菌落墨汁染色镜检,有时可见较窄的荚膜,次代培养通常没有荚膜。极少数情况下,可观察到有性期的锁状联合结构。
1.2.6毛孢子菌属 镜下可见关节孢子、真假菌丝和芽生孢子(图2E),不同菌种关节孢子形态略有差别,可呈桶状、柱状至椭圆形,白吉利毛孢子菌(T.beigelii)可见附着孢,皮瘤毛孢子菌(T.inkin)可见鹿角样菌丝[3]。
1.2.7马拉色菌属 油镜下可见卵圆形、球形或圆柱形厚壁孢子,多为单极出芽(图2F),也可见合轴出芽,芽颈成领圈样。
1.2.8红酵母属 粘红酵母(R.glutinis)细胞呈圆形或卵形,深红酵母(R.rubra)细胞呈现短卵形或柱形,在CMA上可形成假菌丝,不形成子囊孢子[3]。
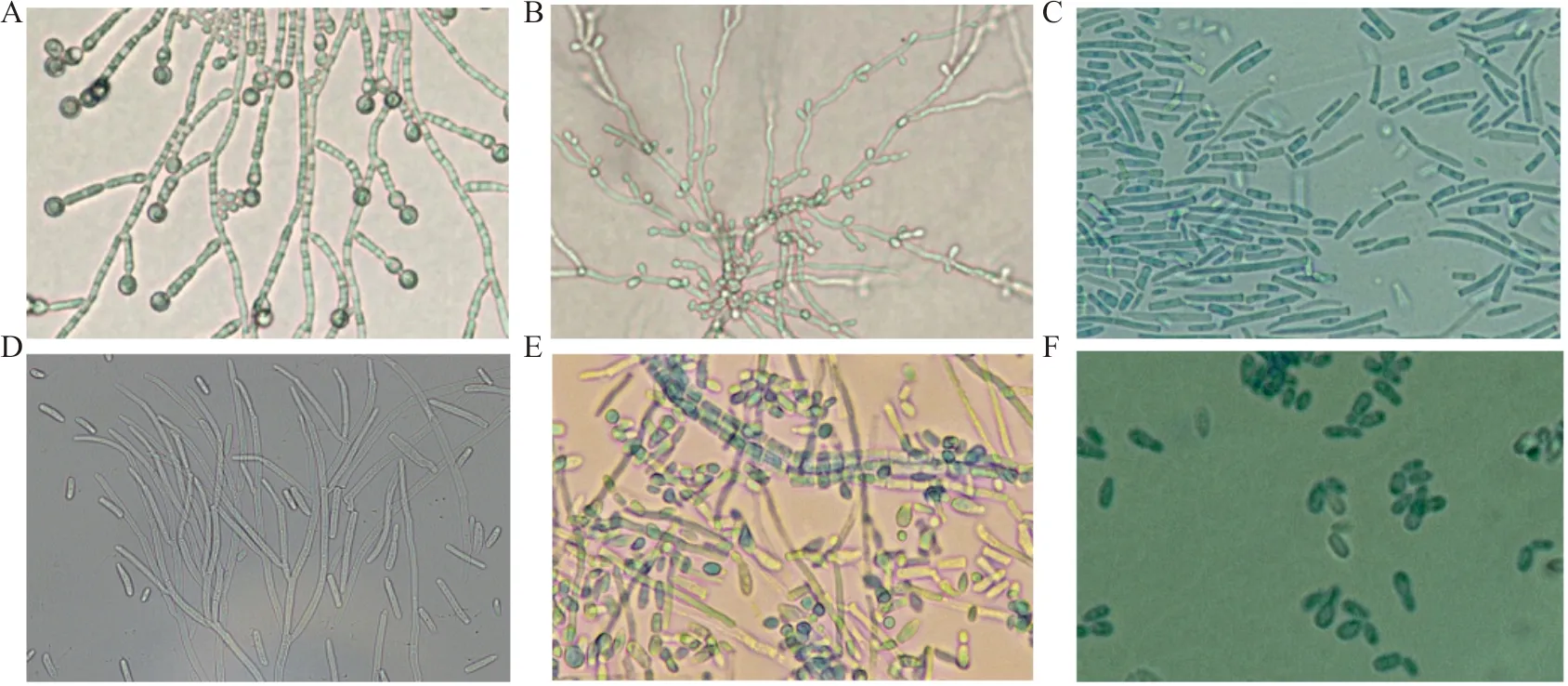
注:A,白念珠菌CMA菌落直接镜检;B,热带念珠菌CMA菌落直接镜检;C,白地霉菌落涂片乳酸酚棉蓝染色;D,S.capitatus菌落涂片KOH湿片;E,阿萨希毛孢子菌菌落涂片乳酸酚棉蓝染色;F,糠秕马拉色菌菌落涂片乳酸酚棉蓝染色。
图2 酵母样真菌菌落涂片镜下形态(×400)
1.3显色培养基 显色培养基主要用于鉴别常见念珠菌,不同品牌显色培养基呈现的典型颜色不同,温育时间和温度会对菌落颜色产生重要影响。以科玛嘉念珠菌显色培养基为例,要求在30~37 ℃培养48 h进行判读,白念珠菌呈翠绿色,热带念珠菌呈铁蓝色或蓝灰色,光滑念珠菌菌落中心呈紫色,克柔念珠菌呈粉色,菌落干燥扁平、边缘模糊有微毛刺[4]。不典型的颜色和菌落形态均不能判定,少数上述菌种菌落也不典型。都伯林念珠菌(C.dubliniensis)呈蓝绿色或深绿色,多数可通过在45 ℃不能生长与白念珠菌进行鉴别,但也有少数白念珠菌在45 ℃不能生长。显色培养基的另一个优势,是可以帮助判定标本中是否存在混合的酵母样真菌。
1.4芽管形成试验 芽管试验可以快速鉴定白念珠菌,但并非所有白念珠菌都是阳性,部分菌种尤其是热带念珠菌可以产生假阳性。都伯林念珠菌也是芽管阳性。芽管试验中,白念珠菌假菌丝与芽生孢子连接处并不缩窄,而热带念珠菌在该处有明显缩窄[2]。
1.5生化反应
1.5.1尿素酶试验 产生尿素酶的酵母样真菌能够分解尿素产氨,升高pH值,使酚红指示剂由琥珀色变为桃红色。通常子囊菌门尿素酶阴性,而担子菌门尿素酶阳性[2]。除解脂耶氏酵母(Yarrowialipolytica)和部分克柔念珠菌外,几乎其他分离自临床标本的念珠菌属均为尿素酶阴性。
1.5.2快速海藻糖试验 快速海藻糖试验是临床与实验室标准化研究所(CLSI)指南M35-A2[5]推荐的光滑念珠菌鉴定方法。部分菌种可产生假阳性,但可结合芽管试验阴性、不水解麦芽糖进行分析。SDA和显色琼脂上的菌落适合进行海藻糖试验,而血琼脂上的白念珠菌和热带念珠菌可产生假阳性[2]。
1.5.3酚氧化酶试验 新型隐球菌(C.neoformans)和格特隐球菌(C.gattii)产生酚氧化酶,可通过含有咖啡酸的底物进行检测,作为隐球菌筛查或鉴定试验。将新型隐球菌和格特隐球菌接种于鸟籽琼脂(birdseed agar),培养2~5 d内变为深棕色。也可使用咖啡酸纸片进行快速酚氧化酶试验,如快速试验阴性但仍可疑隐球菌,应进一步鉴定[2]。
1.5.4糖同化试验 糖同化试验是检测酵母样真菌在有氧的条件下,是否能够利用某种特定碳水化合物作为唯一碳源。不同糖同化试验组合可将酵母样真菌鉴定到种,在Wickerham-Burton方法的基础上,Barnett等[6]和Kurtzman等[7]建立了相应的参考方法。通常需要将糖同化试验与发酵试验等其他反应结合在一起分析,但很难通过这一方法区分某一复合体中的具体菌种。
1.5.5糖发酵试验 糖发酵试验阳性的酵母样真菌能产生二氧化碳和乙醇,因而菌株产气,有助于鉴定念珠菌属、隐球菌属、红酵母属中糖发酵试验阴性的菌种[2]。
1.5.6硝酸盐试验 硝酸盐同化试验是检测酵母样真菌能否将硝酸盐作为唯一氮源,有助于鉴定隐球菌属、红酵母属和毕赤酵母属。硝酸盐还原试验有助于鉴定隐球菌[2]。
1.5.7商品化鉴定系统 基于不同生化反应进行组合,商品化鉴定系统可以将大多数临床常见酵母样真菌鉴定到种属水平。API 20C和ID32C(法国生物梅里埃公司)是临床微生物室最常使用的手工和半自动鉴定试剂盒,全自动鉴定系统酵母样真菌鉴定卡包括Vitek 2系统的YST酵母菌鉴定卡(法国生物梅里埃公司)和凤凰鉴定系统的YEAST ID真菌鉴定卡(美国BD公司)。自动化鉴定系统较手工或半自动鉴定系统鉴定准确性更高,尤其是对于非念珠菌属。值得注意的是,部分系统鉴定对一些不常见菌种鉴定准确性低,如无名念珠菌(C.famata)、季也蒙念珠菌[8]和罗伦隐球菌(C.laurentii)[9]等。
1.6分子生物学方法
1.6.1DNA测序 DNA测序技术越来越多地应用于不常见或未知菌种的鉴定中,常用的真菌鉴定DNA靶位包括rDNA内转录间隔区(ITS)、基因内间隔区(IGS)、28S rRNA D1/D2区、β-微管蛋白和钙调蛋白基因。其中最常使用的是ITS区,但当部分菌种在ITS区的序列差异仅为几个核酸时,其分辨能力就不足以进行鉴别;对于ITS区种内差异大于1.5%的菌种,也不足以获得可信的鉴定结果[1]。通常ITS和IGS区可以区分大部分酵母样真菌,D1/D2区可以帮助鉴别关系密切的菌种,但部分关系密切的菌种需要选择多个序列进行鉴别,如新型隐球菌/格特隐球菌复合体。
基因序列比对的参考数据库也非常重要。GenBank数据库虽然最为常用,但在真菌菌种序列方面存在部分错误。一些基于准确鉴定的真菌菌种所建立的真菌DNA数据库,具有非常重要的参考价值,包括GenBank RefSeq数据库(https://www.ncbi.nlm.nih.gov/refseq/)、人类与动物真菌国际学会(ISHAM)ITS数据库(http://its.mycologylab.org/)和MycoBank数据库(http://www.mycobank.org/)等。此外也有商品化DNA序列分析系统可用于真菌鉴定,如MicroSeq D2大亚基 rDNA序列分析系统(美国ABI公司)和SmartGene 真菌系统(瑞士SmartGene公司)。为确认菌种鉴定结果,尤其应注意DNA序列分析结果应与形态学及表型鉴定相符合。
1.6.2基于菌株的基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser-desorption/ionization time-of-flight mass spectrometry, MALDI-TOF MS) MALDI-TOF MS的基本原理是,样品与基质形成共结晶,在脉冲激光作用下分子离子化,具有不同质荷比(m/z)的离子经质量分析器测定得到分子量。对微生物的鉴定主要基于同一菌种中高度保守的核糖体蛋白(相对分子质量为2 000~20 000)的差异,利用已知菌种建立数据库,将测得谱图与数据库比对获得鉴定结果[10-11]。目前Bruker Biotyper MS(德国布鲁克公司)和 Vitek MS(法国生物梅里埃公司)均能对临床分离的常见酵母样真菌进行较为准确的鉴定,基于中国侵袭性真菌监测网(CHIF-NET)2012至2013年度所收集41个种2 683株酵母样真菌的评价,以分子测序结果为对照方法,两个系统的鉴定准确率分别为98.8%和95.4%[12]。
2 非培养检查方法
2.1标本直接镜检 采集病变部位标本制片,观察镜下真菌孢子及菌丝特点,可以对真菌有无及其种属进行初步判定。最常用的染色方法包括KOH湿片、生理盐水湿片和革兰染色,常见的镜点特征及其种属判定与前文所述菌落涂片镜下特点一致。
制备皮屑、甲屑等浅部标本KOH湿片时,在火焰上快速通过2~3次轻微加热有助于消化蛋白并使角化组织透明。派克墨水染色主要用于马拉色菌镜检,可见厚壁、圆形或卵圆形孢子,单极出芽,芽颈较宽;菌丝粗短,弯曲或弧形,一端较钝。
墨汁染色是隐球菌镜检的特异性方法,脑脊液和呼吸道标本镜检可见透明荚膜(图3A),其他染色方法镜下也可观察到荚膜结构,但敏感性低于墨汁染色。除阴阳性判断外,镜下菌量多少及是否可见出芽对临床诊断和治疗评价也有重要意义。
六胺银染色(GMS)通过将银离子沉积在胞壁上,把真菌染成黑色轮廓,背景呈淡绿色(图3B),较革兰染色更易识别且形态更加清晰,对于珍贵的组织标本建议采用该方法。
钙荧光白染色通过荧光染料非特异地与真菌胞壁几丁质结合,在紫外光下真菌呈浅蓝或绿色(图3C),具有较高的敏感性。荧光抗体染色则可针对不同真菌种属进行特异性染色。

注:A,脑脊液甩片墨汁染色新型隐球菌镜下形态;B,痰涂片六胺银染色白念珠菌镜下形态;C,皮屑湿片钙荧光白染色糠秕马拉色菌镜下形态。
图3 标本直接镜检镜下形态
2.2组织病理 组织病理是诊断真菌感染的金标准,应与微生物学检查密切结合。碘酸-希夫(PAS)染色可使真菌染成鲜红色,GMS染色也可用于组织病理使真菌呈黑色,Gridley染色将真菌染成暗蓝或玫瑰红色、组织深蓝色、背景黄色,黏蛋白卡红染色可将组织中隐球菌染成特异性鲜红色[3]。
2.3抗原检测
2.3.1隐球菌荚膜多糖抗原(cryptococcal polysaccharide-capsule antigen, CRAG) 隐球菌病可以通过检测血清和脑脊液标本中CRAG进行诊断,其滴度还可用于治疗监测和患者预后判断。世界卫生组织推荐,HIV阳性未进行抗逆转录病毒治疗(ART-naïve)的成人患者,如CD4+<100个/μL,应常规进行CRAG筛查,阳性者应进行抗真菌抢先治疗,以防止隐球菌病发生[13]。CRAG检测方法包括乳胶凝集法、酶联免疫法和免疫侧向层析法(LFA)。目前美国IMMY公司的LFA敏感性最高,可覆盖血清型A、B、C和D型隐球菌,其敏感性较乳胶凝集法高5倍以上,其检测敏感性和特异性在血清标本中分别为98%和100%,在脑脊液标本中分别为92%和100%[14]。
2.3.21,3-β-D-葡聚糖(G试验) 1,3-β-D-葡聚糖是真菌细胞壁的重要组成成分,除外隐球菌属的大部分酵母样真菌都可以通过G试验进行检测,该试验被欧洲癌症研究和治疗组织/侵袭性真菌感染协作组和美国国立变态反应和感染病研究院真菌病研究组(European Organization for the Research and Treatment of Cancer/Mycoses Study Group, EORTC/MSG)共识纳入为侵袭性真菌感染拟诊的间接微生物学标准之一[15]。由于1,3-β-D-葡聚糖没有国际标准物质,不同厂家的试剂盒均使用自己的参考范围进行结果评价。对于非粒细胞缺乏念珠菌血症或念珠菌腹腔感染患者,不同临床研究中其敏感性范围为51%~100%,特异性范围为59%~98.4%,阳性预测值为59.3%~98.4%,阴性预测值为57.3%~98.7%[1]。一些含有葡聚糖成分的物质可能导致G试验假阳性,如透析用纤维素膜、免疫球蛋白、清蛋白、手术患者大量纱布暴露等;一些细菌感染病例及静脉使用阿莫西林-克拉维酸患者也有G试验假阳性报告[1]。
2.4核酸检测 已有许多研究评价了从体液或组织中直接检测真菌DNA,以诊断侵袭性念珠菌病的方法,包括使用传统PCR、巢式PCR、定量real-time PCR、多重PCR等技术。一些研究显示核酸扩增方法较血培养有更高的敏感性,且能提供更加快速的诊断,对于提早开始抗真菌治疗、改善患者预后及降低死亡率有重要意义。不同研究使用血标本通过PCR检测侵袭性念珠菌病的敏感性和特异性范围分别为80%~100%和90%~100%。需要强调的是,实验室必须对标本处理、保存、DNA提取和检测等全程标准化,并采取严格的防污染措施[1]。
一些基于核酸扩增和杂交技术的商品化系统,也可用于真菌检测。LightCycler SeptiFast Test M(罗氏公司)通过ITS PCR和熔解曲线分析,可以从全血中检测5种念珠菌和烟曲霉(Aspergillusfumingatus)。Luminex xTAG多重PCR(加拿大Luminex分子诊断公司)通过多重PCR与液相芯片技术相结合,可以检测阳性血培养中的23种真菌[2]。T2磁共振(T2MR)(美国T2Biosystems公司)通过将核磁共振光谱与PCR相结合,进行全血标本中5种常见念珠菌检测,包括白念珠菌、光滑念珠菌、克柔念珠菌、近平滑念珠菌和热带念珠菌,检测限为1~3个细胞/mL,检测特异性为99.4%,平均阴性报告时间为4.2 h[16]。
肽核酸-荧光原位杂交(PNA-FISH)(美国AdvanDx公司)通过探针杂交方法,可在90 min内通过不同颜色的荧光标记,鉴别阳性血培养标本中白念珠菌/近平滑念珠菌、光滑念珠菌/克柔念珠菌和热带念珠菌。其二代方法QuickFISH BC可以在30 min内直接鉴定阳性血培养中的白念珠菌、光滑念珠菌和近平滑念珠菌,敏感性和特异性分别为99.7%和98%[17]。Affirm VPⅢ系统(美国BD公司)通过杂交方法,可直接检测阴道分泌物中是否存在念珠菌属、阴道加德纳菌和阴道滴虫,进行常见阴道炎病原快速诊断。
2.5基于临床标本的MALDI-TOF MS MALDI-TOF MS可用于部分临床标本中微生物的直接检测,目前研究较多的是阳性血培养和尿标本,脑脊液或其他无菌体液的直接检测报道较少。阳性血培养标本的预处理非常重要[18],已报道的方法包括裂解-差速离心法、裂解-滤膜吸附法、分离胶促凝管法和短时间培养法等。尿标本中菌浓度>105CFU/mL时,直接使用MALDI-TOF MS鉴定符合率可高达90%以上。但如果标本中含有2种以上病原菌,通常鉴定能力不足[10]。
3 结语
精准的实验室检查,是实现真菌感染的精准诊疗的前提和基础。循证医学数据表明,准确、早期的病原真菌实验室诊断,有利于尽早开始靶向性抗真菌治疗,对改善患者预后、降低死亡率有显著作用。酵母样真菌的实验室检查,应将经典的形态学、生化反应等方法与血清学、分子生物学等方法相结合,尤其应推广和应用MALDI-TOF MS等简便、快速、准确的新型检测技术,实现优势互补,进一步提高我国临床微生物实验室真菌检测能力和诊断水平。
[1]Zhang SX, Wiederhold NP. Yeasts[J]. Microbiol Spectrum, 2016, 4(4):DMIH2-0030-2016.
[2]Jorgense JH, Pfaller MA, Carrroll KC,etal. Mannual of clinical microbiology[M]. 11th ed. Washington, DC: ASM Press,2015.
[3]王端礼. 医学真菌学--实验室检验指南[M]. 北京:人民卫生出版社,2005.
[4]中华人民共和国国家卫生和计划生育委员会.WS/T 497-2017.侵袭性真菌病临床实验室诊断操作指南[S]. 北京:中国标准出版社,2017:10.
[5]Clinical and Laboratory Standards Institute. Abbreviated identifiction of bacteria and yeast; Approved guideline-second edition. CLSI document M35-A2[S].Wayne, PA: CLSI,2008.
[6]Barnett JA, Payne RW, Yarrow D. Yeasts: characteristics and identification[M]. 2rd ed. Cambridge, United Kingdom:Cambridge University Press,2000.
[7]Kurtzman CP, Fell JW, Boekhout T. The Yeasts, A taxonomic study[M]. 5th ed. New York, USA:Elsevier
[8]Castanheira M, Woosley LN, Diekema DJ,etal.Candidaguilliermondiiand other species ofCandidamisidentified asCandidafamata: assessment by vitek 2, DNA sequencing analysis, and matrix-assisted laser desorption ionization-time of flight mass spectrometry in two global antifungal surveillance programs[J]. J Clin Microbiol, 2013,51(1):117-124.
[9]Xiao M, Fan X, Chen XX,etal. Misidentification of a rare species,Cryptococcuslaurentii, by commonly used commercial biochemical methods and matrix-assisted laser desorption ionization-time of flight mass spectrometry systems: challenges for clinical mycology laboratories[J]. J Clin Microbiol, 2016,54(1):226-229.
[10]中国临床微生物质谱共识专家组. 中国临床微生物质谱应用专家共识[J].中华医院感染学杂志,2016,26(10):2149-2152.
[11]中国临床微生物质谱共识专家组. 中国临床微生物质谱应用专家共识(续)[J].中华医院感染学杂志,2016,26(11):2641-2648.
[12]Wang H, Fan Y, Kudinha T,etal. A comprehensive evaluation of the Bruker Biotyper MS and Vitek MS matrix-assisted laser desorption ionization-time of flight mass spectrometry systems for identification of yeasts, part of the national China Hospital Invasive Fungal Surveillance Net (CHIF-NET) Study, 2012 to 2013[J].J Clin Microbiol,2016,54(5):1376-1380.
[13]Vidal JE, Toniolo1 C, Paulino A,etal. Asymptomatic cryptococcal antigen prevalence detected by lateral flow assay in hospitalised HIV-infected patients in São Paulo, Brazil[J]. Trop Med Int Health, 2016, 21(12):1539-1544.
[14]Nalintya E, Kiggundu R, Meya D. Evolution of cryptococcal antigen testing: what is new?[J]. Curr Fungal Infect Rep, 2016,10(2):62-67.
[15]De Pauw B, Walsh TJ, Donnelly JP,etal. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group[J]. Clin Infect Dis, 2008, 46(12):1813-1821.
[16]Mylonakis E, Clancy CJ, Ostrosky-Zeichner L,etal. T2 magnetic resonance assay for the rapid diagnosis of candidemia in whole blood: a clinical trial[J]. Clin Infect Dis, 2015, 60(6):892-899.
[17]Abdelhamed AM, Zhang SX, Watkins T,etal. Multicenter evaluation ofCandidaQuickFISH BC for identification ofCandidaspecies directly from blood culture bottles[J]. J Clin Microbiol, 2015, 53(5):1672-1676.
[18]尚军,李修远,王丽赟,等. 优化差速离心法在血培养报警瓶MALDI-TOF MS细菌鉴定中的应用[J]. 临床检验杂志,2016,34(12):913-918.
2017-09-10)
(本文编辑:刘群)
10.13602/j.cnki.jcls.2017.10.10
王瑶,1981年生,女,助理研究员,硕士,研究方向:细菌和真菌流行病学及耐药机制,临床感染性疾病病原诊断。
徐英春,E-mail: xycpumch@139.com。
R446.5
A

