牦牛乳酪蛋白酶解物对H2O2诱导的氧化损伤HepG2细胞蛋白羰基含量及抗氧化酶活性的影响
吴相佚,刘斯,宋馨然,李天歌,姜岩世,毛学英*
1(中国农业大学 食品科学与营养工程学院,北京,100083) 2(西藏高原之宝牦牛乳业股份有限公司,西藏 拉萨,850000)
牦牛乳酪蛋白酶解物对H2O2诱导的氧化损伤HepG2细胞蛋白羰基含量及抗氧化酶活性的影响
吴相佚1,刘斯1,宋馨然1,李天歌1,姜岩世2,毛学英1*
1(中国农业大学 食品科学与营养工程学院,北京,100083) 2(西藏高原之宝牦牛乳业股份有限公司,西藏 拉萨,850000)
为探究牦牛乳酪蛋白酶解物缓解氧化应激损伤的作用,利用过氧化氢(H2O2)建立氧化损伤细胞模型,以细胞蛋白质羰基含量及超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、过氧化氢酶(catalase, CAT)的活性为指标评价牦牛乳酪蛋白酶解物的活性。结果表明,利用酶解物处理H2O2损伤的HepG2细胞,能够缓解H2O2诱导的蛋白质羰基含量升高,并增加细胞内SOD、CAT、GSH-Px的活性,从而提高机体抗氧化能力,缓解H2O2引发的氧化应激状态。研究证明,牦牛乳酪蛋白酶解物具有缓解氧化应激损伤的作用,为牦牛乳资源的进一步开发利用及乳源活性肽应用于抗氧化功能食品提供了依据。
牦牛乳酪蛋白酶解物;氧化损伤;抗氧化酶
由于细胞呼吸和能量代谢,人体内时刻发生着有氧氧化,在细胞中产生活性氧分子(reactive oxygen species, ROS),如超氧阴离子和羟自由基。当细胞受到内外环境的刺激后,ROS增多,从而破坏了机体氧化和抗氧化系统之间的平衡,最终导致氧化应激[1]。研究发现,氧化应激是导致机体衰老和与衰老相关疾病的根本原因,并能够引发多种疾病,如动脉粥样硬化、高血压、糖尿病等[2]。因此,对氧化应激的防治成为近年来研究的热点。
牦牛乳具有丰富的营养成分以及无污染、纯天然等优点,具有巨大的生产潜力和广阔的发展空间。然而,牦牛乳资源并未得到充分的开发利用,其中60%的乳及乳制品用于当地牧民消费,牧民将其加工成“酥油、糌粑、曲拉” 等特色乳制品,产品附加值低[3-4]。牦牛乳中约80%的蛋白质是酪蛋白,利用商业化蛋白酶酶解牦牛乳酪蛋白,可以得到多种活性生物肽,如阿片肽、酪啡肽、免疫调节肽、抗氧化肽等[5-8],从而增加牦牛乳酪蛋白的附加产值。
目前关于酪蛋白及其酶解物抗氧化活性的研究仅限于其体外清除自由基能力的评价,利用细胞模型研究关于酪蛋白及其酶解物对氧化应激损伤的保护作用尚未见报道。因此,本研究以牦牛乳酪蛋白为研究对象,探讨其酶解物对HepG2细胞氧化损伤的保护作用,为研究乳源性生物活性肽在调节氧化应激反应方面的应用提供参考。
1 材料与方法
1.1材料与试剂
HepG2(人肝癌细胞),购自北京协和医院;牦牛乳酪蛋白(西藏高原之宝牦牛乳业股份有限公司);MEM高糖培养基(HyClone);胎牛血清(Bioin);青链霉素双抗溶液(100×)、非必须氨基酸(100×)、0.25%胰蛋白酶(含EDTA)(Gbico);木瓜蛋白酶(P3250-25G,Sigma)、MTT(0793-1G, Amrecso)、DEPC、DMSO(细胞培养级)、BCA蛋白测定试剂盒(天根生化科技)、SOD、GSH-Px、CAT试剂盒(南京建成生物工程研究所);DCFH-DA、DNPH(Sigma)。
1.2仪器与设备
MCO-17AC二氧化碳培养箱,日本Sanyo公司;SCIENTZ-ⅡD 细胞超声破碎仪,宁波新芝生物科技股份有限公司;iMarkTMMicroplate Reader 酶标仪,美国Bio-rad公司; UV-2600 紫外可见分光光度计,尤尼柯(上海)仪器有限公司。
1.3方法
1.3.1 HepG2细胞培养
细胞贴壁面积达到80%~90%时开始传代,弃去培养基后用1 mL PBS冲洗残留培养液,加入1 mL 0.25%胰蛋白酶消化,结束后加入2 mL新鲜培养基不断吹打平皿底壁使细胞均匀分散重悬,接种到新的培养瓶中继续培养。取对数生长期的细胞用于实验。
1.3.2 蛋白质羰基含量测定
参考贡慧等[9]的方法。蛋白溶液离心去除上清液,加入1.5 mL 2,4-二硝基苯肼的HCl溶液,25 ℃避光反应1 h,每15 min振荡1次,空白组中加入不含2,4-二硝基苯肼的HCl溶液。反应后加入2 mL TCA溶液,于8 000 r/min离心5 min,弃上清液,沉淀用1 mLV(乙醇)∶V(乙酸乙酯)=1∶1的混合液清洗,8 000 r/min 离心15 min,重复3 次。清洗结束后,弃清洗液,加入250 μL 6 mol/L 盐酸胍溶液振荡,37 ℃水浴60 min,使蛋白质重新溶解。于370 nm波长下测定吸光值。
1.3.3 细胞过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性的测定
取对数生长期的细胞,消化后接种,培养24 h后分为:
空白组:正常细胞;
模型组:细胞+ H2O2(H2O2浓度为400 μmol/L);
实验组:细胞+ H2O2+0.5 mg/mL样品;细胞+ H2O2+1.0 mg/mL样品;细胞 + H2O2+2.0 mg/mL样品(H2O2浓度为400 μmol/L)。
细胞培养12 h后,模型组提前加入不同浓度的样品50 μL 预孵2 h,取出去除上清液后,再在培养基中加入50 μL H2O2和不同浓度样品,同其他组继续培养12 h后,超声破碎细胞1 min,测定CAT、SOD和GSH-Px指标,操作按照试剂盒说明书进行。
1.3.4 数据统计
结果表示为平均值±标准差。统计分析均采取版本为17.0的SPSS软件(SPSS Inc., Chicago, 1L)进行。当多组数据间进行显著性分析时,使用单因素方差分析(one way ANOVA)伴随Duncan多重比较,当plt;0.05认为具有显著性差异。
2 结果
2.1诱导HepG2细胞损伤所需H2O2浓度的确定
为确定氧化应激损伤条件,HepG2细胞分别用不同浓度的H2O2(50、100、200 、400 、800 μmol/L)处理0、3、6、12 h。MTT检测结果显示,随着H2O2浓度增加,HepG2细胞存活率逐渐降低(如图1),呈浓度依赖效应。与处理0小时相比,当H2O2浓度为400 μmol/L,HepG2细胞处理6 h时,细胞存活率为(53.91±4.63)%(plt;0.05);当H2O2浓度为800 μmol/L时,细胞存活率仅为(29.57±1.45)%。说明800 μmol/L的H2O2对细胞有明显的毒性作用。出于时间和效率的考虑,后续实验以400 μmol/L H2O2处理6 h为建模条件,进一步探讨牦牛乳酪蛋白酶解物对HepG2的保护作用。
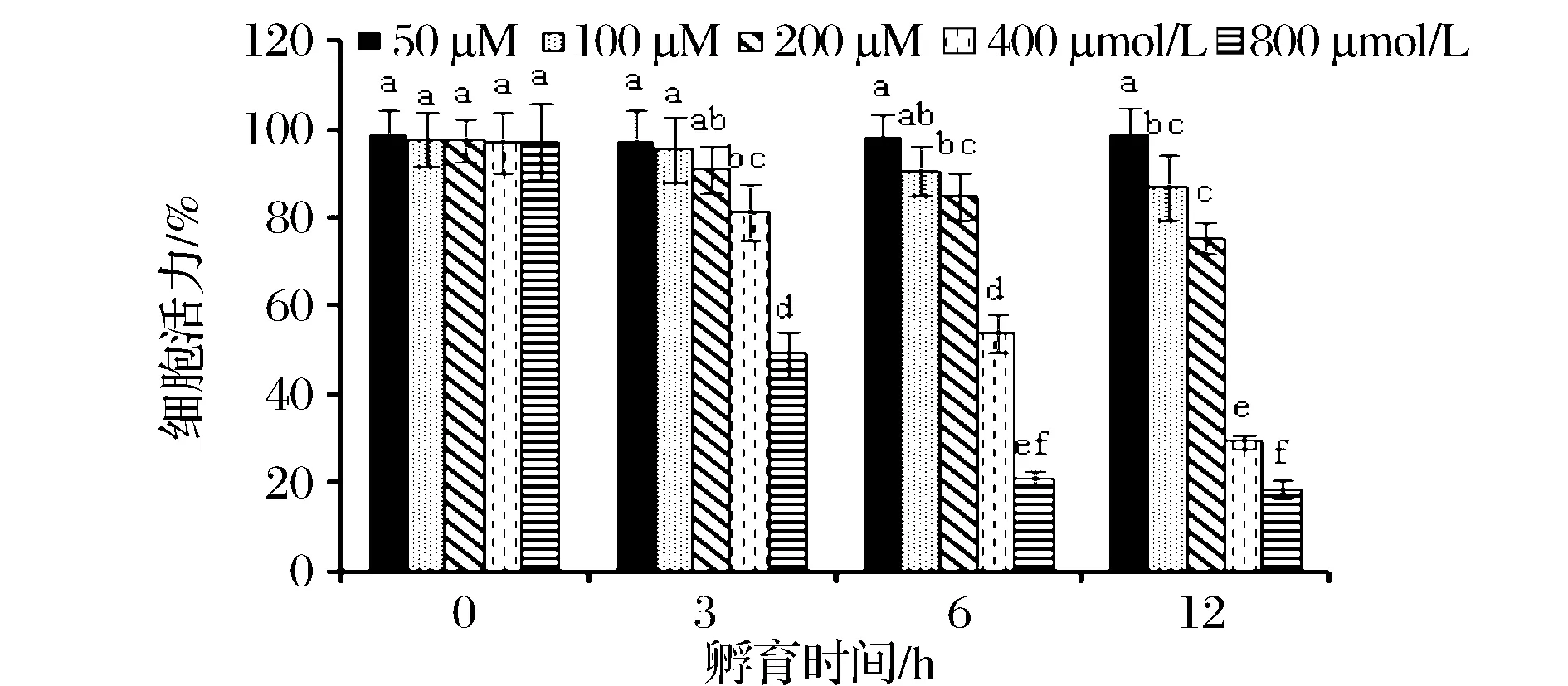
图1 H2O2对细胞存活率的影响Fig.1 Effect of H2O2 on the viability of HepG2 cells
2.2牦牛乳酪蛋白酶解物对H2O2诱导的HepG2细胞蛋白羰基含量的影响
细胞氧化损伤可由蛋白质羰基含量表征。如图2所示,与正常对照组相比,H2O2可显著诱导HepG2细胞蛋白质氧化损伤(plt;0.05),H2O2损伤组细胞内蛋白质羰基含量从(33.54±1.28) nM/mg pro上升到(65.33±2.08) nM/mg pro。而牦牛乳酪蛋白酶解物在H2O2前干预细胞显著抑制了H2O2诱导的蛋白羰基增多;与H2O2损伤组相比,随着牦牛乳酪蛋白酶解物干预浓度升高,H2O2损伤的细胞内蛋白质羰基含量显著降低(plt;0.05),并且呈现浓度依赖效应。结果表明LAH可以缓解H2O2诱导的蛋白质氧化损伤。
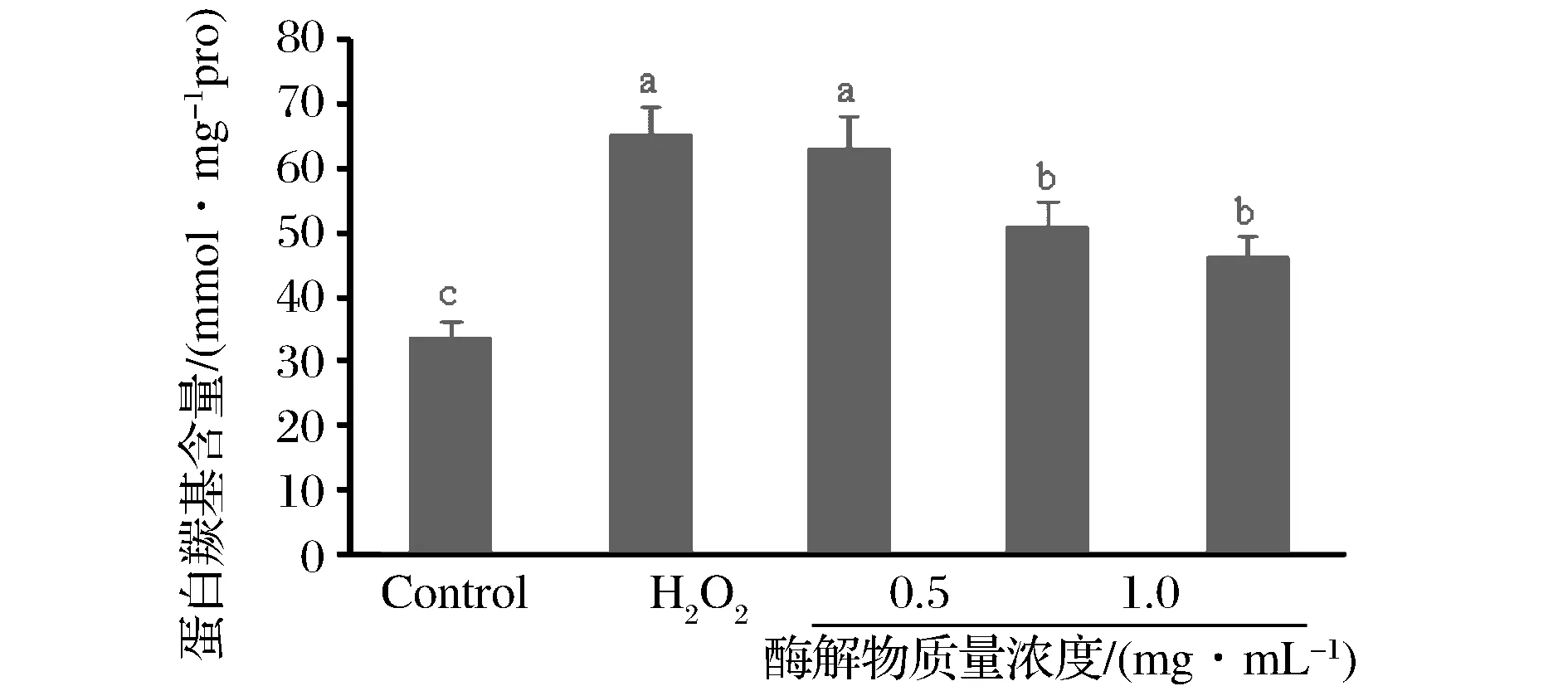
图2 牦牛乳酪蛋白酶解物对H2O2诱导HepG2细胞蛋白质羰基含量的影响Fig.2 Effect of yak milk casein hydrolysates on the protein carbonyl content of H2O2-induced HepG2 cells
2.3牦牛乳酪蛋白酶解物对H2O2诱导的HepG2细胞CAT活力的影响
过氧化氢酶(CAT)可催化体内氧自由基O2-·歧化反应生成的H2O2分解为H2O和O2,从而清除细胞内产生的H2O2,对机体有重要的保护作用[10]。牦牛乳酪蛋白酶解物对细胞CAT活性检测结果见图3。由表3可以看出,与空白组对比,模型组CAT活性明显降低(plt;0.05);与模型组对比,牦牛乳酪蛋白酶解物处理的细胞CAT活性显著升高(plt;0.05)并呈现浓度依赖效应。

图3 牦牛乳酪蛋白酶解物对CAT活性的影响Fig.3 Effect of yak milk casein hydrolysates on the activity of CAT
2.4牦牛乳酪蛋白酶解物对H2O2诱导的HepG2细胞SOD活性的影响
超氧化物歧化酶(SOD)是重要的机体内抗氧化酶之一,SOD通过清除体内过多的氧自由基延缓机体衰老、提高机体免疫力并增强对疾病的抵抗力[11]。由图4可知,模型组的SOD活性明显低于空白组(plt;0.05);经牦牛乳酪蛋白酶解物处理后,细胞内SOD活性明显高于模型组(plt;0.05)并呈现浓度依赖效应。
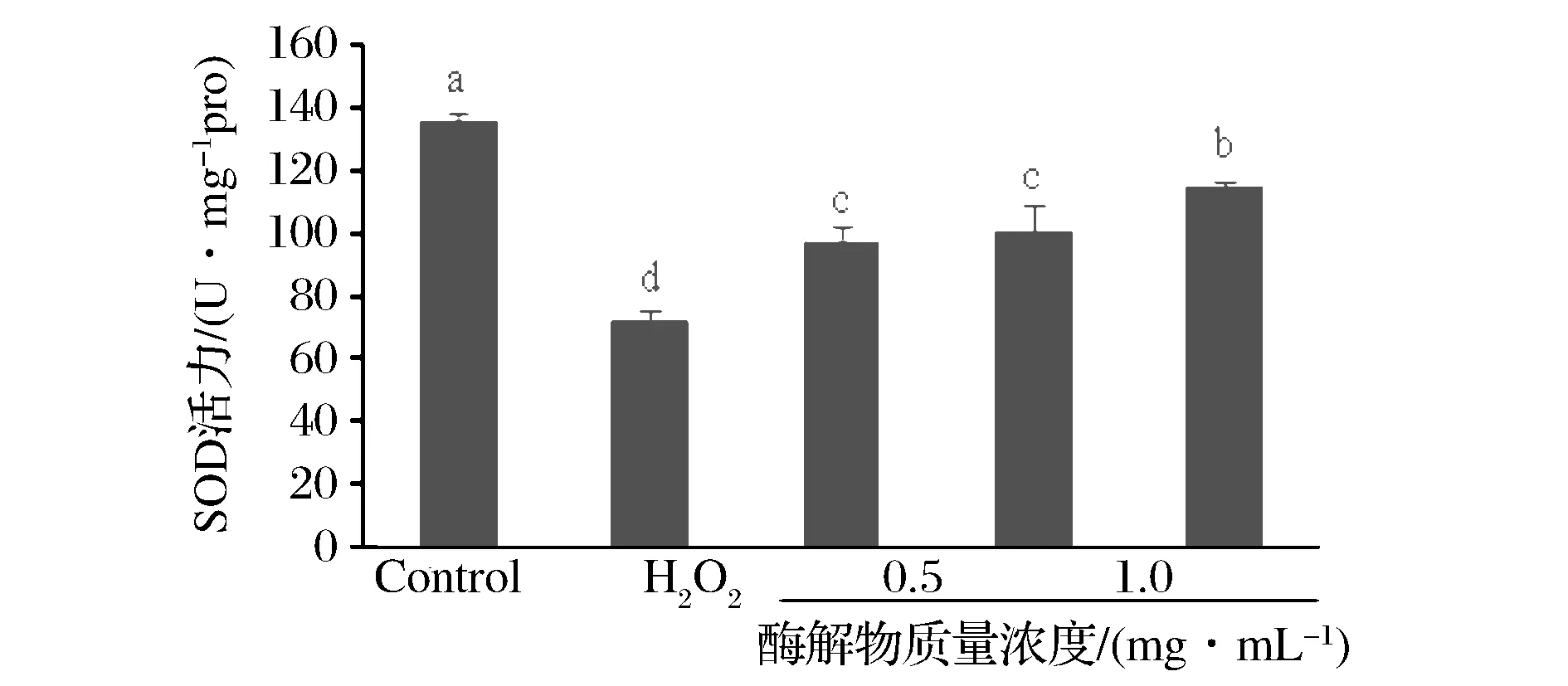
图4 牦牛乳酪蛋白酶解物对SOD活力的影响Fig.4 Effect of yak milk casein hydrolysates on the activity of SOD
2.5牦牛乳酪蛋白酶解物对H2O2诱导的HepG2细胞GSH-Px活性的影响
谷胱甘肽过氧化物酶 (GSH-Px)是广泛存在于机体内的一种重要的过氧化物分解酶,可以清除细胞代谢过程中产生的过多的羟自由基和过氧化物,减轻细胞膜的过氧化作用[12]。由图5可知,与空白组相比,模型组GSH-Px活性明显降低(plt;0.05);经牦牛乳酪蛋白酶解物处理后细胞内GSH-Px明显升高(plt;0.05),且呈浓度依赖效应。
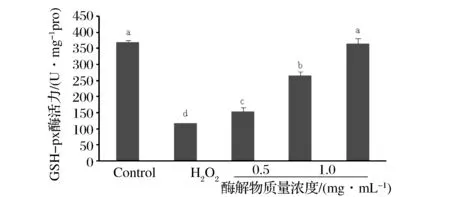
图5 牦牛乳酪蛋白酶解物对GSH-Px活力的影响Fig.5 Effect of yak milk casein hydrolysates on the activity of GSH-Px
3 讨论
氧化应激是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤,在代谢综合症中起着重要作用,它是肥胖、糖尿病、脂质沉积、慢性炎症等发生、发展的重要介导因素[13-14]。H2O2是一种重要的活性氧,其本身并不具有自由基的性质,但它极易透过细胞膜,引发脂质氧化、导致生物大分子损伤,是建立细胞氧化损伤的常用物质之一,广泛用于成骨细胞、神经细胞、血管内皮细胞、肝细胞等细胞模型中[15]。由于HepG2细胞具有与人正常肝细胞相同的功能,并完全表达肝细胞中的抗氧化酶及解毒酶,因此在探究外源化学物及天然抗氧化物质的细胞保护作用中常作为一种良好的细胞模型[16]。
越来越多证据表明,当活性氧的产生过量时,其会超过SOD、GSH-Px、CAT等保护性酶的保护作用,细胞膜磷脂、细胞蛋白、DNA和酶的氧化导致细胞呼吸的中止而引起细胞的凋亡[17]。乳蛋白是一种常见的优质蛋白质,国内外研究者们已利用酶解、发酵等方式从酪蛋白和乳清蛋白中提取得到具有抗氧化活性的生物肽。天然乳源性抗氧化肽具有天然、安全、易吸收、副作用小等特点[18]。许多研究已表明体内体外条件下不同蛋白酶解物及肽类对肝脏氧化损伤具有保护作用,可以提高肝组织及肝细胞中的抗氧化酶活力,清除过量ROS的生成,降低脂质过氧化损伤水平[19]。酪蛋白酶解物具有较强的Fe2+螯合能力、羟自由基和ABTS自由基清除能力[17,20-21],适量的酪蛋白酶解物能够提高小鼠血浆和肝脏GSH-Px活性及肝脏SOD活性[22]。酪蛋白木瓜蛋白酶酶解物通过类蛋白反应改善后,其产物具有更高的DPPH、羟自由基清除能力和还原力,且酶解物能够对H2O2或半乳糖胺所致大鼠肝细胞氧化应激损伤有显著改善作用,降低脂质过氧化损伤水平[23]。牛乳酪蛋白碱性蛋白酶酶解物经过滤分级后得到的低分子量组分能够通过增加肝细胞抗氧化酶活力及改善细胞凋亡来缓解H2O2诱导的HepG2细胞氧化应激损伤[24]。研究发现,炎症诱导小鼠补充乳源性小肽后,小鼠体内肝脏抗氧化酶的酶活显著提高[25]。此外,乳源活性肽由于氨基酸组成种类不同和顺序不同,具有不同的生理活性,如Leu-Leu-Met肽具有免疫调节作用,含巯基的肽类还具有抗氧化、捕获自由基的作用。LI 等[26]从山羊奶酪蛋白酶解物中分离鉴定出5种新型抗氧化肽,其肽段组成分别为Val-Tyr-Pro-Phe,Phe-Gly-Gly-Met-Ala-His,Phe-Pro-Tyr-Cys-Ala-Pro,Tyr-Val-Pro-Glu-Pro-Phe,Tyr-Pro-Pro-Tyr-Glu-Thr-Tyr,具有良好的自由基清除能力、Fe2+结合能力及降低脂质过氧化水平的能力。由此可知,酪蛋白源活性肽具有平衡细胞内自由基生成及缓解氧化损伤的能力[27-28]。基于此结论,我们进一步采用细胞模型的生物评价方法,利用H2O2诱导HepG2细胞氧化损伤来评价牦牛乳酪蛋白酶解物缓解肝细胞氧化应激损伤的活性。
本研究结果显示,牦牛乳酪蛋白酶解物可以缓解H2O2所致的细胞存活率下降和细胞内抗氧化酶活性的降低,这可能是由于酪蛋白糖巨肽经酶解后,产生许多短肽,这些短肽的抗氧化作用大量淬灭了H2O2在细胞内经代谢产生的氧自由基,阻止了自由基对细胞膜的脂质过氧化损伤,保护了细胞膜的同时,胞内抗氧化系统可能也因此受到保护。
综上所述,本部分研究表明,牦牛乳酪蛋白酶解物可通过增加细胞存活率、缓解蛋白质氧化损伤,显著抑制H2O2对HepG2细胞的损害,缓解H2O2对HepG2细胞活性的降低,发挥细胞保护效应。
4 结论
本研究证明牦牛乳酪蛋白酶解物具有良好的抗氧化活性。利用0.5~2.0 mg/mL 牦牛乳酪蛋白酶解物孵育细胞能够显著减轻蛋白质氧化损伤水平和抗氧化酶降低程度,从而发挥对HepG2细胞氧化应激损伤的保护作用,为研究乳源性生物活性肽对调节氧化应激反应方面的应用提供参考。
[1] 冉茂良,高环,尹杰,等.氧化应激与DNA损伤[J].动物营养学报,2013,25(10):2 238-2 245.
[2] 刘少敏,周文琦,李婷,等.不同乳酸菌抗氧化能力的比较与分析[J].中国乳品工业,2015,43(8):8-12.
[3] 宋佳佳,白涵瑜,王倩.牦牛乳酪蛋白酶解产物二肽基肽酶-IV抑制活性和特性分析[J].乳业科学与技术,2015,38(1):1-4.
[4] 周小玲,郝力壮.青藏高原牦牛乳产业的发展基础和前景[J].中国奶牛,2012,20:41-44.
[5] 阮晓慧,韩军岐,张润光,等.食源性生物活性肽制备工艺、功能特性及应用研究进展[J].食品与发酵工业,2016,42(6):248-253.
[6] 毛学英,南庆贤,李莹辉,等.酪蛋白酶解产物对小鼠脾 T 淋巴细胞体外增殖作用的影响[J].营养学报,2004,26(2):116-118.
[7] 杜伟,王恬.乳源性生物活性肽对新生IUGR仔猪肝脏抗氧化功能的影响[J].畜牧与兽医,2007,39(11):12-14.
[8] 高扬,唐祎,钱蕙佶,等.乳源性小肽QEPV的抗衰老功能研究[J].中国乳品工业,2015,43(9): 4-7.
[9] 贡慧,史智佳,陈文华,等.关于几种蛋白氧化后羰基含量的对比研究[J].化学试剂,2014,36(11):1 014-1 016,1 035.
[10] 黄权利,施明华,蔡荣湘.隐性乳房炎乳汁中体细胞和病原菌及酶间的相关性[J].浙江农业大学学报,1995,21(3):243-246.
[11] 迟玉杰,王明丽,孙艳红.SOD对人体的营养保健作用[J].中国乳品工业,2000,28(4):28-29.
[12] 安耀荣,朱向东,王燕.抗衰益智胶囊对实验性老年痴呆病大鼠脑组织中SOD、CAT活性及MDA含量的影响[J].中医研究,2009,22(6):13-15.
[13] 韩飞,周孟良.过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立[J].食品科学,2011,32(5):55-57.
[14] SKALICKY J,MUZAKOVA V,KANDAR R,et al.Evaluation of oxidative stress and inflammation in obese adults with metabolic syndrome[J].Clinical Chemistry and Laboratory Medicine,2008,46(4):499-505.
[15] ZOROV D B,FILBRURN C R,KLOTZ L,et al.Reactive oxygen species (ROS)-induced ROS release: A new phenomenon accompanying induction of the mitochondrial permeability transition in cardiac myocytes[J].The Journal of Experimental Medicine,2000,192(7):1 001-1 014.
[16] LEE M,KIM J,UTSUKI T,et al.Cytoprotective effects of phlorofucofuroeckola isolated fromEckloniastoloniferaagainst tacrine-treated HepG2 cells[J].Fitoterapia,2012,83(6):1 060-1 067.
[17] 刘志东,郭本恒,曲映红等.酪蛋白酶解物的抗氧化活性[J].天然产物研究与开发,2008,20:19-23.
[18] 包显颖,陈丽,倪姮佳等.抗氧化多肽研究及其应用前景[J].生命科学,2016,28(9):998-1 005.
[19] SUN Y,PAN D,GUO Y,et al.Purification of chicken breast protein hydrolysate and analysis of its antioxidant activity[J].Food and Chemical Toxicology,2012,50(10):3 397-3 404.
[20] 陈敏,敖静,李博.分子量对酪蛋白多肽抗氧化活性的影响[J].食品工业科技,2012,33(9):95-99.
[21] 李志成,蒋爱民,熊清权,等.山羊乳酪蛋白酶解物制备及体外抗氧化活性研究[J].食品科学,2011,32(23):82-86.
[22] 胡文琴,王恬,周岩民,等.酪蛋白酶解物对小鼠抗氧化酶活性的影响[J].营养学报,2005,27(1):54-57.
[23] ZHAO X,FU Y,YUE N.Invitrocytoprotection of modified casein hydrolysates by plastein reaction on rat hepatocyte cells[J].CYTA-Journal of Food,2014,1(12):40-47.
[24] XIE N,WANG C,AO J,et al.Non-gastrointestinal-hydrolysis enhances bioavailability and antioxidant efficacy of casein as compared with itsinvitrogastrointestinal digest[J].Food Research International,2013,51(1):114-122.
[25] 周婕慧,金赢凯,徐海红,等.生物活性肽的抗炎功能及其对氧化应激的调节作用[J].中国乳品工业,2014,42(3):4-6;14.
[26] LI Z,JIANG A,YUE T,et al.Purification and identification of five novel antioxidant peptides from goat milk casein hydrolysates[J]. Journal of Dairy Science,2013,96(7):4 242-4 251.
[27] 邱隽,王小雪,李琳,等.乳蛋白活性肽的延缓衰老作用研究[J].中国公共卫生,2002,18(3):312-313.
[28] PENG X,KONG, B,YU H,et al.Protective effect of whey protein hydrolysates against oxidative stress in d-galactose-induced ageing rats[J].International Dairy Journal,2004,34(1):80-85.
EffectofyakmilkcaseinhydrolysatesonproteincarbonylcontentandactivityofantioxidantenzymesofoxidativedamagedHepG2cellsinducedbyH2O2
WU Xiang-yi1, LIU Si1, SONG Xin-ran1, LI Tian-ge1, JIANG Yan-shi2, MAO Xue-ying1*
1(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China) 2(Treasure of Plateau Yak Dairy Co.,Ltd, Lhasa 850000, China )
To evaluate the antioxidative activity of yak milk casein hydrolysatesinvitro, HepG2 cells were treated with H2O2to establish the oxidative model. The protein carbonyl content and the activity of SOD, GSH-Px and CAT of HepG2 cells pretreated with yak milk casein hydrolysates were measured to analyze the antioxidative activity of yak milk casein hydrolysates. The results showed that pretreatment with yak milk casein hydrolysates significantly alleviated the increase of protein carbonyl content induced by H2O2and increased the activity of SOD, CAT and GSH-Px, suggesting the antioxidative capacity of yak milk casein hydrolysates in vitro. The results suggested that yak milk casein hydrolysates possessed protective effects against H2O2-induced oxidative damage in HepG2 cells, which provided a basis for the further utilization of yak milk resources and for the application of the bioactive peptides as antioxidant functional foods.
yak milk casein hydrolysates; oxidative damage; antioxidant enzyme
10.13995/j.cnki.11-1802/ts.015087
本科(毛学英教授为通讯作者,E-mail:maoxueying@cau.edu.cn)。
国家大学生科研创新项目计划;北京市奶牛产业创新团队(BAIC06-2017);国家自然科学基金(31371753)
2017-07-03,改回日期:2017-08-03

