钙蒸气对氢化脱氢钛粉还原脱氧行为的影响
蒋明祥,肖琪瑶,李瑞迪,周立波,袁铁锤
钙蒸气对氢化脱氢钛粉还原脱氧行为的影响
蒋明祥,肖琪瑶,李瑞迪,周立波,袁铁锤
(中南大学粉末冶金研究院,长沙410083)
以金属钙在高温下生成的钙蒸气作为还原剂,对氧含量(质量分数,下同)为0.56%的氢化脱氢钛粉进行脱氧,然后分别用稀盐酸和蒸馏水充分洗涤,过滤干燥后得到脱氧钛粉。通过X射线衍射(XRD)、扫描电镜(SEM)、能谱分析(EDS)和氮氧含量分析等手段,分析与表征粉末的物相组成、形貌和元素组成,研究还原温度和时间对脱氧效果的影响,并对钛粉的脱氧行为进行研究。结果表明,钛粉脱氧主要通过还原反应和原子间的扩散进行。还原温度与还原时间对脱氧钛粉的氧含量影响较大。在相同条件下,随还原温度升高,钛粉的氧含量降低,但当温度超过1273 K时氧含量略有增加;最佳还原工艺为1273 K温度下保温2 h,钛粉氧含量从0.56%降至0.14%,粉末颗粒形貌和粒度未发生明显变化。脱氧钛粉在室温下于空气中放置60 d,其氧含量变化不大。
钙蒸气;钛粉;脱氧;氧含量;还原温度
钛及钛合金具有高强度、低密度以及优异的抗腐蚀性能和生物相容性,已成为航空航天、生物医学器件以及国防工业等领域的重要材料[1−4]。钛粉通常是指尺寸小于1 mm的钛颗粒,是制备钛和钛合金以及烟花、电子靶材等材料的重要原料[5−6]。氧是固溶在钛中的一种间隙型元素,也以氧化物的形式存在于钛表面。氢化脱氢法是目前工业化生产钛粉的主要方法,所制备的钛粉氧含量普遍偏高,不能满足低氧含量((O)<0.2%)的需求,钛粉中过高的氧含量会严重影响钛制品的物理性能和力学性能[7−9]。近年来,通过金属钙对TiO2进行还原脱氧来制备低氧含量钛粉的研究发展迅速。日本Kyoto大学的ONO等[10]设计了一种钙热还原电解槽,以TiO2为阴极,石墨作为阳极,于CaCl2熔盐中进行电解来制备钛粉。OKABE等[11]研究了预制备成型工艺(preform reduction process, PRP),以TiO2为原料,CaCl2为添加剂,通过高温下形成的钙蒸气还原TiO2粉末,再经后续处理得到纯度为99%的钛粉。SONG等[12]详细分析了PRP工艺的热力学原理和反应条件,研究表明,在1373 K和1473 K温度下制得钛粉的氧含量高于1273 K下所得钛粉的氧含量,反应温度提升并不能有效提高还原脱氧效率。自Okabe提出PRP工艺以来,主要的研究都集中在利用金属钙和CaCl2对TiO2粉末进行还原[13],通过金属钙对氧含量较高的钛粉进行直接还原脱氧的研究较少。OH等[7, 14]尝试了在高于钛的β相转变温度下,采用钙蒸气作为还原剂直接还原含氧钛粉,得到氧含量小于0.1%的钛粉,但对脱氧反应机理及脱氧条件的研究不够完善。本研究利用钙蒸气对氧含量为0.56%的氢化脱氢钛粉进行还原脱氧,以降低钛粉的氧含量,分析钛粉脱氧机理,并研究还原温度和保温时间对脱氧效果的影响,为钛粉的脱氧提供理论依据。
1 实验
1.1 原料
本实验所用氢化脱氢钛粉的平均粒径约为28 μm,其主要杂质元素含量列于表1;金属钙颗粒由天津市科密欧化学试剂有限公司生产,Ca含量(质量分数)>99%。

表1 原料钛粉的主要杂质元素含量
1.2 设备
脱氧过程选用ZF−RN17型井式真空反应炉进行加热(炉内真空度可达1×10−2Pa,升温速率为5~15 K/min)。采用特制的外螺纹密封的脱氧反应器,反应装置示意图如图1所示。脱氧反应器为不锈钢材质,其内部堆叠放置上下2个不锈钢坩埚,下方坩埚用来装载金属钙颗粒,上方坩埚用来装载原料钛粉。上方坩埚的底部设有筛网,高温下生成的钙蒸气可通过筛网而原料钛粉无法掉落,钙蒸气作为还原剂对钛粉进行脱氧,在整个反应过程中钛粉和钙颗粒不直接接触,可有效防止金属钙颗粒对钛粉的污染。

图1 钛粉脱氧装置示意图
1.3 实验步骤
按照(Ti):(Ca)≈1:1的比例称取原料钛粉和金属钙颗粒。将金属钙颗粒置于下方坩埚底部,将原料钛粉置于上方坩埚的筛网上,然后将2个坩埚堆叠放入反应器中,将反应器各部分密封组装好后放入真空反应炉内,密封炉体。抽真空至炉内压力小于5×10−2Pa后开始加热,待系统升温至指定温度后保温一段时间,反应结束后,系统自然冷却至室温。将高温还原后的产物取出并充分研磨破碎成细粉末(以下简称为还原产物)。将还原产物用质量分数为4%的稀盐酸、蒸馏水充分酸洗浸出,过滤后将滤渣置于真空干燥箱中于343 K下干燥24 h,即得到脱氧后的钛粉(以下简称为脱氧钛粉)。
1.4 分析与测试
采用Rigaku D/max 2550VB+转靶X射线衍射仪(X-Ray Diffraction)对原料钛粉、还原产物与脱氧钛粉进行物相分析(扫描区间为20°~80°)。用LECO- TCH600 型氮、氧、氢分析仪检测粉末中主要杂质元素的含量。用美国FEI公司的Quanta FEG 250型场发射扫描电镜观察粉末的形貌,并用其附带的EDS能谱仪对粉末表面元素进行定性分析。
2 结果讨论
2.1 脱氧可行性
2.1.1 热力学分析
钙蒸气对钛粉进行脱氧还原的过程,是以金属钙在高温下生成的钙蒸气作为还原剂,通过气固反应还原钛粉表面的TiO2。密闭反应器中未加入海绵钛等传统除氧剂,其残留的氧氮等原子可能在高温下与钛发生反应从而污染原料,故本实验中加入的金属Ca过量,在还原脱氧开始前,Ca便与O2和N2反应从而净化炉内空气。因此,在高温还原过程中密闭容器内主要发生以下反应:
3Ca(s)+N(g)=CaN(s) (1)
2Ca(s)+O(g)=2CaO(s) (2)
TiO(s)+2Ca(g)=Ti(s)+2CaO(s) (3)
根据热力学软件HSC Chemistry得到反应过程中各物质的热力学参数,通过热力学公式计算出式(1)~(3)所示反应的吉布斯自由能随温度的变化,如图2所示。由图可知,1700 K温度以下这3个反应的吉布斯自由能均为负值,反应都能自发进行。随温度升高,这3个反应的ΔG都逐渐增大,这表明升高温度并不能有效促进脱氧反应的进行。脱氧试验中加入过量的金属钙颗粒,有利于在到达脱氧温度前炉内真空和钙蒸气的形成。通过图2可推测,在达到钙的熔化温度(1115 K)前,钙与氧气和氮气的反应均已完成。

图2 式(1)~ (3)所示反应的吉布斯自由能随温度的变化
2.1.2 饱和蒸气压
为进一步分析容器内Ca蒸气的形成以及炉内残留的O2、N2对试验结果的影响,查阅钙饱和蒸气压及其常数表[15],得到钙在不同温度下的饱和蒸气压计算公式为:

同时,通过查阅热力学常数,计算系统中的Ca-O2和Ca-N2体系的饱和蒸气压与温度的关系为:

将相关数据代入式(4)和(5),得到密闭容器内Ca蒸气、O2和N2的蒸气压与温度的关系,如图3所示。由图可知,温度在1200 K以内时,Ca随温度升高变化不大;当温度升到1200 K时,Ca随温度升高迅速上升,表明此时有大量钙蒸气生成。在到达钛的β相转变温度(1155 K)前,O2和N2的饱和蒸气压几乎为零,满足Ca>>O2+N2,即密闭体系内主要为Ca蒸气,有效促进反应(3)的进行。这表明在脱氧前,容器内残留的氧气和氮气已经与金属钙反应完全,容器内的压力近似为金属钙的饱和蒸气压,保证了系统的真空度和TiO2还原脱氧过程的进行。
综合以上热力学分析与饱和蒸汽压计算结果,为保证脱氧效果,选取1 273 K为最低还原温度,同时选取2 h为初始保温时间进行钛粉的脱氧试验。
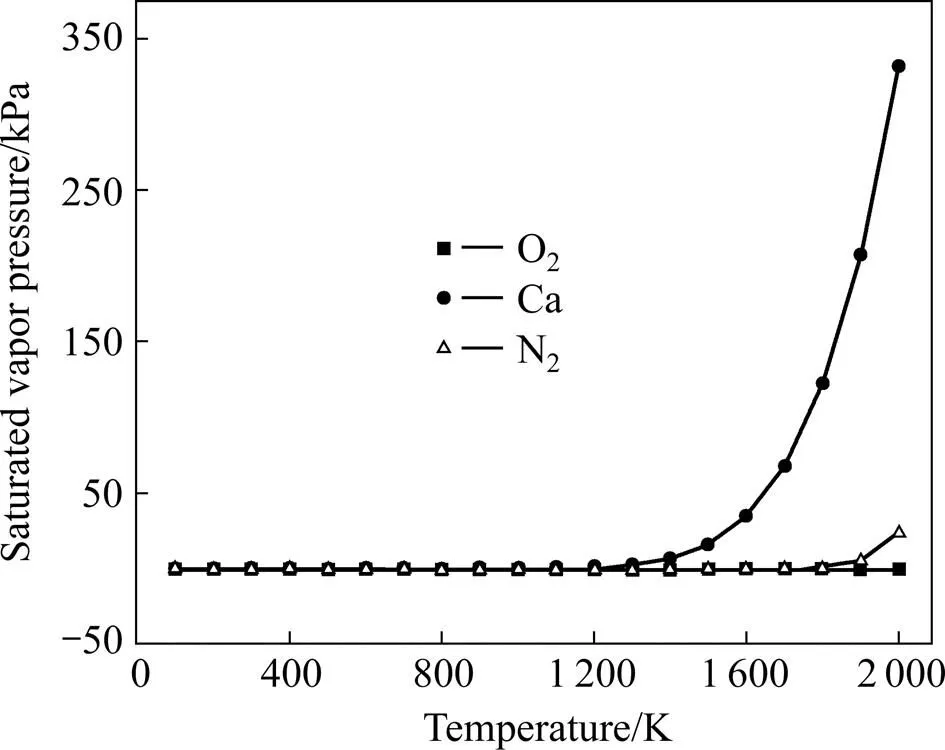
图3 密闭容器内Ca、N2和O2饱和蒸气压随温度的变化
2.2 物相组成
图4所示为1273 K温度下保温2 h得到的还原脱氧各阶段粉末(原料钛粉、还原产物和脱氧钛粉)的XRD谱。由图可见,原料钛粉、还原产物和脱氧钛粉的XRD谱差别不大,(100)、(002)和(101)晶面的特征衍射峰较强且峰形尖锐,与PDF卡片中的Ti(44-1294)的标准图谱相吻合,表明这3种粉末均具有较高的结晶度,且为密排六方晶系的α-Ti。还原产物的XRD谱中未发现CaO等中间产物的特征峰。主要原因可能是CaO等中间产物的量较少而XRD的检测精度有限。由此可知,在整个还原过程中不会引入大量的其它杂质,钛粉氧含量的变化对粉末颗粒的晶体结构影响不大,钛粉的物相趋于稳定。

图4 原料钛粉、还原产物与脱氧钛粉的XRD谱
2.3 形貌与元素组成
图5所示为原料钛粉、1273 K温度下保温2 h所得到的还原产物与脱氧钛粉的SEM形貌。从图5(a)和(b)可见,原料钛粉颗粒为不规则形状,分布较均匀,颗粒表面有少量杂质。从图5(c)和(d)可知,钛粉经高温还原后得到的还原产物,其颗粒表面附着物增多,几乎布满每个颗粒的表面。这主要是因为高温还原后,生成CaO等中间产物附着在颗粒表面。而由图5(e)和(f)可见还原产物经过稀盐酸、蒸馏水充分酸洗浸出后,粉末表面较洁净,表面附着物等杂质基本被清洗干净,颗粒的形状和大小与原料钛粉相差不大。这表明脱氧过程不会使钛粉的表面形貌发生显著改变。
图6所示为还原产物和脱氧钛粉表面的EDS分析图。从图6(a)和(b)可知,还原产物表面存在来自于还原剂的Ca元素,粉末颗粒表面的主要氧化物为CaO,而其它少量杂质可能由于EDS的精度问题无法标定。由图6(c)和(d)可知,脱氧钛粉颗粒表面较洁净,EDS图中基本都是Ti元素的特征峰。这表明CaO等杂质在酸洗水洗过程中基本被除去,保证了脱氧钛粉的纯度。

图5 原料钛粉、还原产物与脱氧钛粉的SEM形貌(T=1273 K, t=2 h)
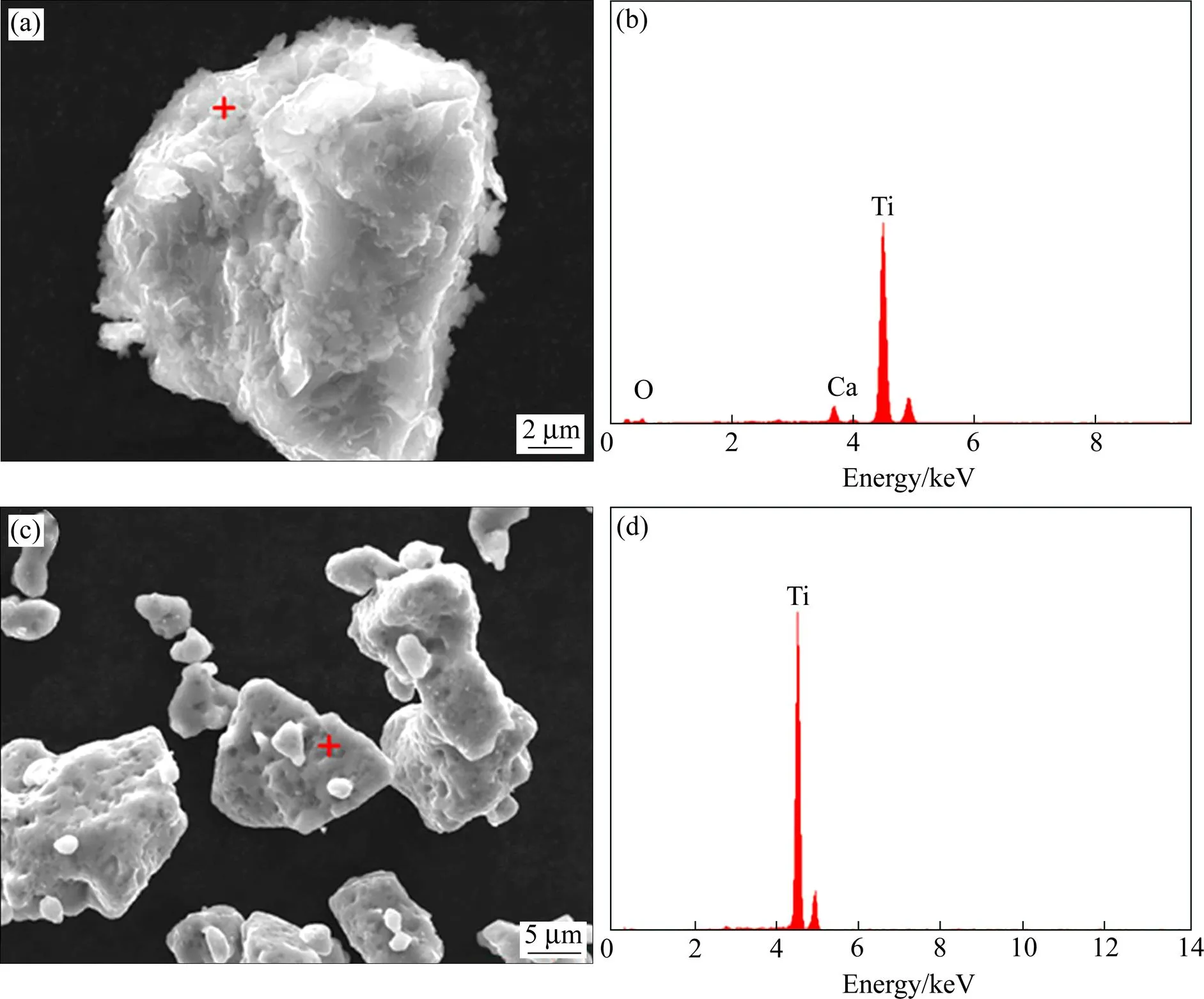
图6 还原产物与脱氧钛粉表面的EDS分析(T=1273 K, t=2 h)
2.4 粉末脱氧机理
表2所列为原料钛粉在1273 K温度下保温2 h所得到的还原产物与脱氧钛粉的氧元素与氮元素含量。由表可知,原料钛粉经过高温还原后,氧、氮含量大幅增加。这是因为在升温过程中,密闭容器里的钙还原原料钛粉中的TiO2,也与容器内残留的氧气和氮气发生反应,形成相应的化合物附着在钛粉表面。在对还原产物进行后续处理后,这些杂质被除去。相比于原料钛粉,脱氧钛粉的氧含量减少75%。
钛粉中的氧原子,一部分以间隙原子的形式固溶在钛粉晶格内,另一部分是以二氧化钛氧化膜的形式存在于粉末颗粒表面。钛粉表面的氧原子可通过还原反应除去,而脱除固溶在钛粉晶格中的氧原子的最佳驱动力是原子间的扩散[7]。根据钛的自扩散Arrhenius图[16],升高温度可加速钛中氧原子的扩散,特别是当温度升高至1155 K时,钛从HCP结构的α-Ti转变为BCC结构的β-Ti,此时固溶在钛粉晶格内的氧原子向颗粒表面的扩散速度显著增加,有利于脱氧的进行。因此,整个含氧钛粉的脱氧过程可解释如下:反应开始前,钛颗粒表面和钛晶格内部的氧的浓度保持平衡。当加热到一定温度后,钙逐渐熔化生成钙蒸气,钙蒸气从坩埚底部上升与钛粉表面的TiO2氧化膜发生还原反应,将氧原子从TiO2中置换出来形成CaO附着在钛粉表面上。当钛表面和钛晶格内部的氧形成浓度差后(内>表面),钛晶格内固溶的氧原子向表面扩散,从而使得钛晶格内的氧含量降低,这部分扩散到表面的氧原子优先与Ca发生反应生成CaO附着在钛颗粒表面上,钛表面和钛晶格内的氧原子的脱除循环进行。由于加入的金属钙颗粒相对于钛粉中的氧是过量的,因此可保证整个反应持续进行。高温下钛也从HCP结构转换为BCC结构,有效地加速反应扩散过程,从而加速脱氧过程。反应脱除的氧原子以钙氧化物的形式存在,通过后续处理得以去除。
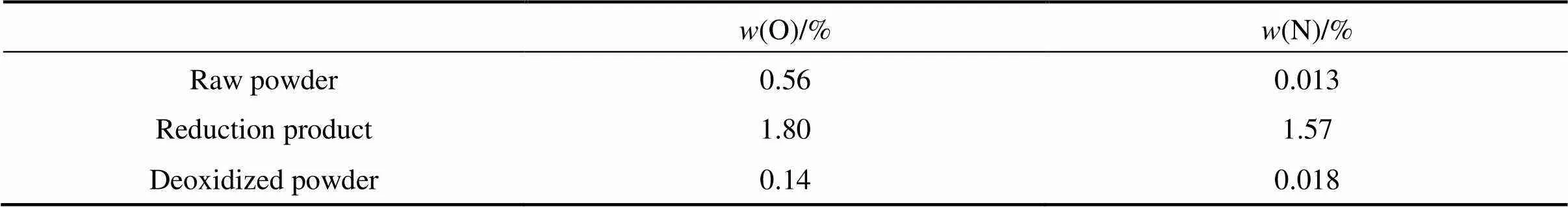
表2 还原脱氧各阶段粉末的氧氮含量(T=1273 K, t=2 h)
2.5 还原温度
表3所列为不同还原温度下保温2 h得到的脱氧钛粉的氧氮含量。由表可见,随还原温度从1173 K逐渐升高至1273 K,钛粉的氧含量逐渐降低,脱氧效果提高。这是因为升高温度,扩散过程加快,促进脱氧反应的进行。相比于1273 K下进行的还原实验,当还原温度升高至1323 K后,最终得到的钛粉氧含量升高,脱氧效果降低。这是因为还原反应为放热反应,反应体系中还原温度越高越不利于反应的进行;而且在过高的温度下钛粉极易与新引入的氧气等杂质发生反应而影响脱氧效果。随温度升高,脱氧钛粉的氮含量变化不大。故控制还原温度在1273 K较合适。

表3 不同还原温度下所得脱氧钛粉的氧、氮含量(t=2 h)
2.6 保温时间
表4所列为在1273 K下保温不同时间得到的脱氧钛粉的氧、氮含量。可见在一定范围内延长保温时间可有效提高脱氧效果,钙蒸气还原钛粉的过程在2 h内基本完成。继续延长保温时间,最终所得脱氧钛粉的氧含量变化不大。且长时间处于高温下,钛粉更容易与因气密性等原因引入的氧气等杂质发生反应,降低脱氧钛粉的纯度。随保温时间延长,脱氧粉末的氮含量变化不大。故控制保温时间在2 h较合适。

表4 不同保温时间所得脱氧钛粉的氧氮含量(T=1273 K)
2.7 钛粉的稳定性
表5所列为原料钛粉与1273 K下保温2 h所得到的脱氧钛粉在室温下放置于空气中一定时间后的氧含量。由表可见,随着放置时间延长,原料钛粉和脱氧钛粉的氧含量都变化不大。这是因为在常温下,钛粉表面极易形成由TiO2组成的氧化膜,它在大气介质中非常稳定,能对钛粉起到很好的保护作用,防止钛粉被进一步氧化;只有在温度达到1073 K以上时,氧化膜才会分解而失去保护作用[17]。因此,通过钙蒸气脱氧制得的脱氧钛粉性质稳定,在常温下可保持较长时间不被明显氧化。
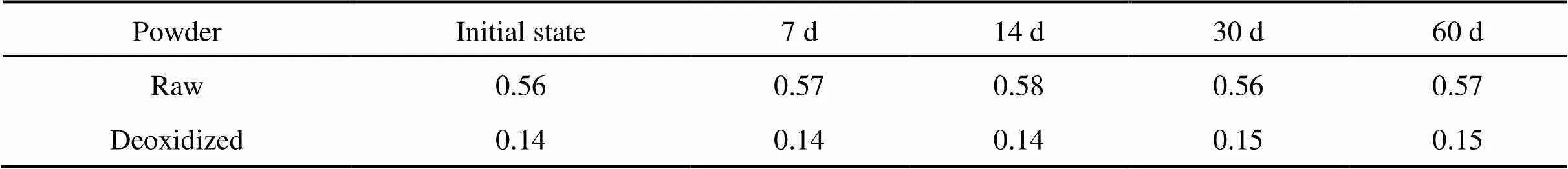
表5 原料钛粉和脱氧钛粉放置于空气中一段时间后的氧含量
3 结论
1) 利用金属钙在高温下生成的钙蒸气对氧含量为0.56%的氢化脱氢钛粉进行还原脱氧,脱氧过程主要依靠还原反应和原子间的扩散进行;还原温度和时间对脱氧效果影响较大,较佳的还原工艺为:在真空中于1273 K温度下保温2 h,还原产物经后续处理后可得到氧含量0.14%的脱氧钛粉,其形貌、粒径和物相组成与原料钛粉差别不大。
2) 常温下将脱氧钛粉放置于空气中一段时间,其氧含量不会明显增加,通过钙蒸气脱氧得到的钛粉易于保存。
[1] 刘美凤, 郭占成. 金属钛制备方法的新进展[J]. 中国有色金属学报, 2003, 13(5): 1238−1245. LIU Meifeng, GUO Zhancheng. New development of technologies for producing titanium metal[J]. The Chinese Journal of Nonferrous Metals, 2003, 13(5): 1238−1245.
[2] BHOWMIK S, BENEDICTUS R, POULIS J A, et al. High- performance nanoadhesive bonding of titanium for aerospace and space applications[J]. International Journal of Adhesion and Adhesives, 2009, 29(3): 259−267.
[3] IBRAHIM K M, MHAEDE M, WAGNER L. Mechanical characterization of cp-Ti produced by investment casting[J]. Transactions of Nonferrous Metals Society of China, 2011, 21(8): 1735−1740.
[4] WANG F, CUI W, PAN B, et al. Normalised fatigue and fracture properties of candidate titanium alloys used in the pressure hull of deep manned submersibles[J]. Ships and Offshore Structures, 2014, 9(3): 297−310.
[5] 洪艳, 曲涛, 沈化森, 等. 氢化脱氢法制备钛粉工艺研究[J]. 稀有金属, 2007(3): 311−315. HONG Yan, QU Tao, SHEN Huasen, et al. Titanium production through hydrogenation and dehydrogenation process[J]. Chinese Journal of Rare Metals, 2007(3): 311−315.
[6] 万贺利, 徐宝强, 戴永年, 等. 钙热还原法制备钛粉过程的研究[J]. 功能材料, 2012, 43(6): 700−703, 707. WAN Heli, XU Baoqiang, DAI Yongnian, et al. Research progress on preparation of titanium powders by calciothermic reduction[J]. Journal of Functional Materials, 2012, 43(6): 700−703, 707.
[7] OH J M, KWON H, KIM W, et al. Oxygen behavior during non-contact deoxidation of titanium powder using calcium vapor[J]. Thin Solid Films, 2014, 551(2): 98−101.
[8] OKABE T H, OISHI T, ONO K. Preparation and characterization of extra-low-oxygen titanium[J]. Journal of Alloys and Compounds, 1992, 184(1): 43−56.
[9] WILLIAMS J C, SOMMER A W, TUNG P P. The influence of oxygen concentration on the internal stress and dislocation arrangements in α titanium[J]. Metallurgical Transactions, 1972, 3(11): 2979−2984.
[10] ONO K, SUZUKI R O. A new concept for producing Ti sponge: calciothermic reduction[J]. JOM, 2002, 54(2): 59−61.
[11] OKABE T H, ODA T, MITSUDA Y. Titanium powder production by preform reduction process (PRP)[J]. Journal of Alloys and Compounds, 2004, 364(1/2): 156−163.
[12] SONG M H, HAN S M, MIN D J, et al. Diffusion of oxygen in β-titanium[J]. Scripta Materialia, 2008, 59(6): 623−626.
[13] 万贺利, 徐宝强, 戴永年, 等. 钙热还原二氧化钛的钛粉制备及其中间产物CaTiO3的成因[J]. 中国有色金属学报, 2012, 22(7): 2075−2081. WAN Heli, XU Baoqiang, DAI Yongnian, et al. Preparation of titanium powders by calciothermic reduction process of titanium dioxide and formation cause of intermediate CaTiO3[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(7): 2075−2081.
[14] OH J M, LEE B K, SUH C Y, et al. Preparation method of Ti powder with oxygen concentration of<1000 ppm using Ca[J]. Powder Metallurgy, 2012, 55(5): 402−404.
[15] 戴永年, 杨斌. 有色金属材料的真空冶金[M]. 北京: 冶金工业出版社, 2000: 20−24. DAI Yongnian, YANG Bin. Vacuum Metallurgy of Nonferrous Metal Materials[M]. Beijing: Metallurgical Industry Press, 2000: 20−24.
[16] LIU Z, WELSCH G. Literature survey on diffusivities of oxygen, aluminum, and vanadium in alpha titanium, beta titanium, and in rutile[J]. Metallurgical and Materials Transactions A, 1988, 19(4): 1121−1125.
[17] PEDEMONTE M M, VISINTIN A, CAPPARELLI A L. Study of a photostable thin films of TiO2on titanium[J]. International Journal of Hydrogen Energy, 2010, 35(11): 6069−6073.
(编辑 汤金芝)
Effect of calcium vapor on deoxidation behavor of hydrogenation-dehydrogenation titanium powder
JIANG Mingxiang, XIAO Qiyao, LI Ruidi, ZHOU Libo, YUAN Tiechui
(Powder Metallurgy Research Institute, Central Sounth University, Changsha 410083, China)
Using calcium vapor produced at high temperature as reducing agent, titanium powder with oxygen content of 0.56% was reduced through pickling and washing, and the deoxidized titanium powder was obtained after filtration and drying. The phase structure, morphologies and phase composition of the powders products were characterized by XRD, SEM, EDS and oxygen/nitrogen analyzer. The effects of reduction temperature and holding time on the deoxidation behavior were studied. The results show that, deoxidation of titanium powder is dominated by reduction reaction and diffusion between atoms. Deoxidation effect is strongly affected by reaction temperature and holding time. Oxygen content of deoxidized titanium powder decreases with increasing reduction temperature, while it increases slightly when the temperature is above 1 273 K. The optimal reaction condition is reduction at 1273 K for 2 h and the oxygen content of titanium powder decreases from 0.56% to 0.14% after subsequent procedures. The sizes and morphologies shapes of the particles change little. The oxygen content of deoxidized titanium powder shows little variation after exposuring to air for 60 days.
calcium vapor; titanium powder; deoxidation; oxygen content; reduction temperature
TG146.23
A
1673-0224(2017)05-643-07
国家自然科学基金资助项目(51474245, 51571214);湖南省科技计划资助项目(2015GK3004, 2015JC3006);国家重点研发计划资助项目(2016YFB1100101);中南大学贵重仪器设备开放共享基金资助项目(CSUZC2015030)
2016−12−19;
2017−05−03
袁铁锤,教授,博士。电话:13327312560;E-mail: tiechuiyuan@csu.edu.cn

