不同处理条件对红蓼种子萌发的影响
, , , , (河北科技师范学院园艺科技学院, 河北 秦皇岛 066000)
不同处理条件对红蓼种子萌发的影响
汪洋,刘玉艳,刘晓薇,张国君,岳国忠
(河北科技师范学院园艺科技学院, 河北 秦皇岛 066000)
以红蓼(PolygonumorientaleL.)种子为试验材料,研究不同药剂和不同水温浸种、不同储藏方式对红蓼种子萌发的影响。结果表明:红蓼种子在0.5 g/mL浓度的NaOH下浸泡45 min发芽率最高,达99.63%;综合NaOH浓度及处理时间,在0.3~0.5 g/mL范围,浸泡45 min可以使红蓼种子发芽快而整齐,发芽率高。低温贮藏可以打破红蓼种子休眠,室外地表自然放置发芽率较高,达19.93%,显著高于常温保存。红蓼种子浸种2 h后吸水速度最快,24 h达吸水高峰;60 ℃温水浸种24 h发芽效果好于其他水温,发芽率达26.67%;70 ℃处理种子失去生活力。萘乙酸、吲哚乙酸处理红蓼种子效果不显著。种皮硬度及休眠是影响红蓼种子发芽的主要原因。
红蓼; 种子萌发; NaOH; 温度; 储藏条件
红蓼(PolygonumorientaleL.)为蓼科蓼属一年生草本植物。又名东方蓼、狗尾巴花、游龙等,夏秋开花,花期长,花序穗状,顶生或腋生,粉红或玫瑰红色。适应性很强[1-2],除西藏外,广布于全国各地,为常见野生观赏植物,栽植于庭院供观赏,可作插花材料[3],也广泛地用于园林绿化,尤其是滨水绿化[2,4]。红蓼全草、根、花、果实等均可入药[5],此外,红蓼是一种营养丰富、风味独特,叶、芽两用的高档野生蔬菜,我国曾以红蓼种子出口日本,主要食其幼苗,近几年随着人们生活水平的提高,对它的需求量也迅速增加[6]。
红蓼种子黑色种皮坚硬,有蜡质角质层,具光泽,生产中发芽率低,整齐度差。曹桂荣等[7]用GA3和NAA处理、许桂芳等[8]利用剪口及浓硫酸处理红蓼种子,吴月琴[6]研究了温度和储藏时间对红蓼种子发芽的影响。目前生产中的红蓼种子催芽时间较长、程序复杂。本试验旨在探讨红蓼种子的发芽特性,找出破除红蓼种子发芽困难的有效方法,为其生产和应用提供参考。
1 材料与方法
1.1 试验材料
成熟的红蓼种子秋季采集于河北科技师范学院园艺科技学院试验站。将采收的新鲜种子于实验室内风干1周后,挑选新鲜、饱满、无霉变、无虫蛀的优质种子,入袋室温保存备用[9]。
1.2 试验方法
1.2.1 红蓼种子千粒重测定
用百粒法进行测定。从纯净种子中随机抽取100粒为1组,共取8组,即为8个重复,分别称取各组的重量,然后计算平均千粒重。
1.2.2 NaOH对红蓼种子发芽的影响
将红蓼种子分别置于浓度为0.10,0.30,0.50 g/mL的 NaOH溶液中,浸泡时间分别为15,30,45 min,共9个处理,清水浸种为对照。处理后将种子用蒸馏水冲洗干净,然后置于培养皿中做发芽培养。
1.2.3 不同贮藏条件对红蓼种子发芽的影响
于12月将种子分别置于0 ℃冰箱、室内常温、园林试验站室外地表自然放置3种环境条件下,2个月后进行种子发芽试验。
1.2.4 不同水温浸种对红蓼种子发芽的影响
将红蓼种子分别用常温、40,50,60,70 ℃水浸泡,在0,10,24,26 h时分别称重,作种子吸水曲线,并获得种子吸水高峰的浸种时间为24 h。然后将未处理红蓼种子在不同温度的水中浸泡24 h后进行种子发芽试验。
1.2.5 萘乙酸,吲哚乙酸处理对红蓼种子发芽的影响
将红蓼种子用浓度为50,100,200 mg/L的萘乙酸,10、30、50 mg/L的吲哚乙酸分别处理8,16,24 h。清水处理为对照。然后进行种子发芽试验。
将处理后的种子用清水冲洗后,用浓度为0.3%的高锰酸钾溶液浸泡30 min消毒。然后将种子置于直径为9.0 cm的培养皿中,每个培养皿30粒种子,每个处理3次重复。放入人工气候箱中25 ℃发芽培养。种子萌发以胚根长度等长于种子本身长度为标准,每天记录发芽种子数,每个处理有1粒种子发芽为该种子发芽始期,当连续7 d不发芽时统计发芽率[10]。
发芽率、发芽势的计算公式如下:
发芽势(%)=发芽高峰期发芽种子总数/供试种子总数×100%;
发芽率(%)=发芽种子总数/供试种子总数×100%;
试验结果用DPS软件进行方差分析。
2 结果与分析
2.1 红蓼种子的形态特征与种子千粒重
红蓼种子为瘦果,近扁圆形,果皮黑色、有光泽且坚硬。
经过计算得出红蓼种子的千粒重为32.35 g。
2.2 NaOH处理对红蓼种子发芽的影响
2.2.1 NaOH处理对红蓼种子发芽率、发芽势的影响
表1显示,NaOH处理均促进了红蓼种子的萌发,发芽率均高于对照,在0.1~0.5 g/mL浓度范围内,同一浓度处理时间越长促进萌发的作用越强。0.5 g/mL浓度浸泡45 min条件下红蓼种子发芽率最高,达99.6%,显著高于0.3 g/mL浸泡45 min处理,极显著地高于包括对照在内的其它处理;0.3 g/mL浸泡45 min处理的发芽率显著或极显著高于除0.5 g/mL浸泡45 min处理外的其它处理。发芽势的变化趋势与发芽率类似,0.5 g/mL浸泡45 min处理的发芽势极显著高于所有其它处理,其次,0.5 g/mL浸泡30 min、0.3 g/mL浸泡45 min处理的发芽势又高于另外其它处理。
综合以上结果,红蓼种子在0.5 g/mL NaOH处理45 min下种子发芽率最高,达到99.6%,发芽快而整齐。本方法处理红蓼种子其适宜的浓度应为0.3~0.5 g/mL,浸泡45 min。
表1 NaOH处理对红蓼种子发芽的影响

NaOH浓度(g/mL)处理时间(min)发芽率(%)发芽势(%)0.115 5.44dC 4.32dCD30 4.32dC 2.18deD45 6.74dC 5.18dCD0.315 18.45dC 13.74cC30 16.57dC 6.67cdCD45 87.32bAB 40.96bB0.515 4.33dC 3.33deD30 62.88cB 34.19bB45 99.63aA 85.59aAck15 3.33dC 3.33deD30 3.33dC 3.33deD45 3.33dC 3.33deD
2.2.2 NaOH处理对红蓼种子发芽进程的影响
图1表明,不同的NaOH浓度及不同时间处理对红蓼种子发芽影响不同,其中0.5 mg/mL浸泡45 min处理下的红蓼种子在第3、第4天时几乎全部发芽,其次是0.5 mg/mL浸泡30 min处理、0.3 mg/mL浸泡45 min处理、0.3 mg/mL浸泡30 min处理第6天迅速发芽并达发芽高峰;0.3 mg/mL浸泡15 min处理第8天达发芽高峰;以上处理发芽越快发芽高峰时的发芽率越高。其它处理种子发芽数较少。在第8天各处理基本停止发芽。

图1 NaOH处理对红蓼种子发芽进程的影响
2.3 不同贮藏条件对红蓼种子发芽的影响
2.3.1 不同贮藏条件对红蓼种子发芽率、发芽势的影响
表2显示,红蓼种子在不同储藏条件下发芽率差异极显著,试验站室外地表自然放置其发芽率极显著高于0 ℃冰箱处理、常温放置,0 ℃冰箱处理其发芽率极显著高于常温放置;试验站室外地表自然放置其发芽势极显著高于0 ℃冰箱处理、常温放置。但室外放置处理的发芽率仅为19.93%,促进发芽的效果不是很明显。
表2 不同贮藏条件对红蓼种子发芽率、发芽势的影响

处理发芽率发芽势发芽始期(d)试验站室外地表自然放置19.93aA14.41aA40℃冰箱处理8.82bB4.32bB4常温放置(ck)3.33cC3.33bB6
2.3.2 不同储藏条件处理对红蓼种子发芽进程的影响
图2表明,3种储藏方式红蓼种子发芽始期不同,发芽速度、整齐度均不同。冰箱保存与室外放置的种子于第4天开始发芽,常温保存的种子于第6天开始发芽;室外放置的种子每天的发芽数高于冰箱中贮存种子,冰箱贮存种子高于常温保存的种子。三者比较,以试验站室外地表自然放置效果较好,发芽率较高,发芽较快。
2.4 不同温度浸种处理对红蓼种子发芽的影响
2.4.1 不同温度浸种处理对红蓼种子吸水的影响
由图3可知,不同水温浸种种子吸水规律基本一致,前2 h吸水速度最快,2~10 h种子吸水速度也较迅速,在10~24 h之间,种子吸水缓慢,到达24 h时各处理基本均达吸水高峰,之后吸水缓慢直至停止。其中70 ℃水浸泡的种子吸水值最大,其次依次是60,40,50 ℃、常温。
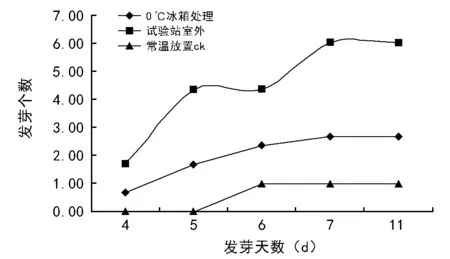
图2 不同贮藏方法对红蓼种子发芽进程的影响

图3 不同温度水处理红蓼种子吸水曲线
2.4.2 不同温度浸种处理对红蓼种子发芽率、发芽势的影响
由表3可知,在40~60 ℃范围内,随温度升高红蓼种子发芽率、发芽势逐渐升高。其中60 ℃浸种处理红蓼种子,其发芽率极显著高于40,50,70 ℃、常温处理,50 ℃处理显著高于40 ℃和常温处理;40,50 ℃和常温处理发芽势差异不显著。温水浸种处理中60 ℃处理发芽率(26.67%)最高,70 ℃浸泡下的红蓼种子不萌发,估计是高温破坏了种子生活力。
表3 不同温度浸种处理对红蓼种子发芽率、发芽势的影响

处理 发芽率 发芽势发芽始期(d)40℃ 2.18cBC 1.49bBC550℃ 8.82bB 4.32bB560℃ 26.67aA 15.16aA570℃ 0dC 0cCck 3.33cB 3.33bB5
2.4.3 不同温度浸种处理对红蓼种子发芽进程的影响
由图4可知,除70 ℃处理种子未见萌发外,其它处理红蓼种子在第5天开始发芽,第9天基本停止;每天种子发芽数从高到低依次为60 ℃>50 ℃>40 ℃>常温。

图4 不同水温浸种对红蓼种子萌发进程的影响
2.5 萘乙酸,吲哚乙酸处理对红蓼种子发芽率的影响
2.5.1 萘乙酸,吲哚乙酸处理对红蓼种子发芽率、发芽势的影响
由表4可知,不同处理对红蓼种子发芽影响不同,在NAA 50~100 mg/L、IAA 30 mg/L浓度范围内,随时间的延长发芽率、发芽势逐渐升高。不同药剂不同浓度处理时间相同对红蓼种子发芽的影响不同。NAA 50 mg/L 24 h、NAA 100 mg/L 24 h处理红蓼种子发芽率极显著高于其他处理和对照;IAA 10 mg/L 8 h处理、NAA 100 mg/L 16 h处理显著高于8,16 h,对照。NAA 100 mg/L 24 h处理的发芽势高于所有对照,NAA 50 mg/L 24 h、NAA 100 mg/L 24 h、NAA 100 mg/L 16 h、IAA 10 mg/L 8 h处理发芽势高于所有对照。
表4 萘乙酸、吲哚乙酸处理对红蓼种子发芽的影响

处理浓度(mg/L)处理时间(h)发芽率(%)发芽势 (%) 萘乙酸508 0.37dB0.3741cB16 0.37dB0.3741cB24 11.06aA5.4355abAB1008 0.37dB0.3741cB16 5.44abAB5.4355abAB24 10.78aA7.7094aA2008 0.37dB0.3741cB16 1.49bcdB1.4908bcAB24 0.37dB0.3741cB吲哚乙酸108 6.39aAB5.182abAB16 4.32abcdAB3.3333abcAB24 4.32abcdAB4.32abcAB308 0.37dB0.3741cB16 0.37dB0.3741cB24 0.76cdB0.7559bcAB508 0.37dB0.3741cB16 4.32abcdAB3.3333abcAB24 2.18bcdAB2.1819abcABck08 0.37dB0.3741cB016 0.37dB0.3741cB024 1.49bcdB1.4908bcAB
总之,在本试验浓度及处理时间范围内,NAA、IAA处理对红蓼种子发芽率影响不大。
2.5.2 萘乙酸,吲哚乙酸处理对红蓼种子发芽进程的影响
由图5可知,NAA 50 mg/L 8 h、NAA 50 mg/L 16 h、NAA 50 mg/L 24 h、NAA 100 mg/L 8 h、NAA 100 mg/L 16 h、NAA 100 mg/L 24 h、NAA 200 mg/L 8 h、NAA 200 mg/L 24 h、IAA 50 mg/L 8 h、IAA 50 mg/L 24 h、IAA 10 mg/L 8 h、IAA 10 mg/L 16 h、IAA 10 mg/L 24 h、IAA 30 mg/L 8 h、IAA 30 mg/L 16 h、IAA 30 mg/L 24 h在第4天开始萌发,ck 16 h、NAA 200 mg/L 16 h、IAA 50 mg/L 16 h第6天开始萌发,ck 24 h第7天开始萌发;除NAA 100 mg/L 16 h、ck 24 h第7天达发芽高峰外,其他处理后的种子于第6天到达发芽高峰,发芽高峰时发芽种子数从高到低依次为10、8、6、5、4、3、2、1,第7天基本上发芽结束。


图5 NAA和IAA处理对红蓼种子萌发进程的影响
3 小结与讨论
曹桂荣等报道,处于深休眠的红蓼种子经磋磨,浸胀后,GA3可以打破红蓼种子的休眠,其中以浓度为1.5 mg/L的效果最为显著,浓度过高或过低效果均不理想[7]。许桂芳等报道,种皮障碍也是红蓼种子休眠的主要原因之一,剪口和浓硫酸可以破除红蓼种子的深休眠[8],其中98%浓硫酸处理3 min能迅速破除种皮障碍[6]。本试验利用NaOH处理红蓼种子能显著提高发芽率,发芽快而整齐,其中以0.5 g/mL处理种子45 min效果最佳。而用温水浸种也可提高种子的发芽率,因此本试验进一步证明红蓼种子种皮坚硬,透水性差是影响其发芽的主要原因。
低温环境贮藏利于红蓼种子的萌发,这与红蓼种子休眠有关[12]。试验中低温贮藏后的种子萌发率虽高于对照,但萌发率不高,因此需要进一步研究红蓼种子低温处理温度、时间对其休眠的影响。
萘乙酸,吲哚乙酸对打破红蓼种子休眠作用不大[13-14]。至于其他处理药剂及处理时间对红蓼种子萌发情况的影响还有待进一步研究。
[1]杨俊岗,陈德凡,杨建伟,等.红蓼种子繁种技术[J].中国种业,2004(4):42-48.
[2]文慧慧,陈明林,张自生.二型花柱植物红蓼的繁殖生物学研究[J].草业学报,2015,24(11):155-161.
[3]金波.常用花卉图谱[M].北京:中国农业出版社,1998,7.
[4]杨思琪,吉文丽,张杨,等.基于景观生态学的带状公园植物景观美学研究[J].北方园艺,2012(20):67-70.
[5]杨志云,秦民坚,钱士辉.红蓼研究进展[J].中国野生植物资源,2008,27(1):11-15.
[6]吴月琴.红蓼种子的发芽特性[J].上海农业科技,2001(5):76-77.
[7]曹桂荣,王健荣.GA3打破红蓼种子深休眠的试验[J].植物生理学通报,1996,32(6):426-427.
[8]许桂芳,刘明久,席世丽,等.破除红蓼种子休眠研究初报[J].种子,2005,24(1):24-25.
[9]马文宝,许戈,姬慧娟,等.珍稀植物梓叶槭种子萌发特性初步研究[J].种子,2014,33(12):87-90.
[10]杜利霞,李青丰,刘义.不同贮藏时间对牧草种子萌发特性的影响[J].中国草地,2005,27(1):17-21.
[11]陈艳伟,韦小丽,杨玄烨,等.珍贵树种木荚红豆硬实种子破除方法研究[J].种子,2015,34(11):37-40.
[12]肖杰,艾辛,梁成亮,等.低温和赤霉素解除大蒜蒜种休眠的效应[J].湖南农业大学学报(自然科学版),2008(3):324-326.
[13]傅强,杨期和,叶万辉.种子休眠的解除方法[J].广西农业生物科学,2003,22(3):230-234.
[14]刘洪见,张旭乐,曾爱平,等.萘乙酸对3种野海棠属植物种子萌发的影响[J].浙江农业科学,2011(1):53-54.
(本栏目责任编辑:周介雄)
Effects of Different Treatments Conditions on the Germination ofPolygonumorientaleL. Seeds
WANGYang,LIUYuyan,LIUXiaowei,ZHANGGuojun,YUEGuozhong
(Hebei Normal University of Science & Technology,College of Horticulture Science and Technology,Qinhuangdao Hebei 066000,China)
With thePolygonumorientaleL. seeds as the experimental materials to study the effects on the seed germination ofPolygonumorientaleL.under different elixir,different temperature water and storage ways.The result indicates that the germination rate of seeds in 0.5 g/mL NaOH for 45 min conditions reach to 99.63% higher than other dispose.Take NaOH concentration and process-time into account,during the concentrationof 0.3-0.5 g/mL,the deal of soaking seeds 45 min makes the seeds germinate quickly,orderly and high germination rate.The deal with low temperature storage two months can breakPolygonumorientaleL.seeds’ dormancy.The seeds placed outside,germination rate reach to 19.93% higher than normal temperature preservation.ThePolygonumorientaleL.seeds after presoaking absorb water quickly in 2 hours and reach to flush after 24 hours.60 ℃ water soak seeds for 24 h,the germination rate reach to 26.67% higher than others.The seeds lose viability after 70 ℃ dispose.But in the experience with NAA and IAA,the effect is not very significant.So these indicate that the skin hardness and dormancy affect the seed germination mainly.
PolygonumorientaleL.; seed germination; NaOH; temperature; storage ways
2017-02-10
吕梁学院自然科学青年基金(ZRQN 201512)。
汪 洋(1983—),女,河北卢龙人;硕士,讲师,研究方向:园林植物应用;E-mail:wangyang9518@163.com。
10.16590/j.cnki.1001-4705.2017.07.051
S 681.9
A
1001-4705(2017)07-0051-05

