褪黑激素抑制NLRP3炎性小体减轻小鼠蛛网膜下腔出血早期脑损伤
毛崇丹 甄恩迪 刘阳阳 张海峰 郝广志 董玉书
(1锦州医科大学沈阳军区总医院研究生培养基地神经外科,辽宁 锦州 121001; 2沈阳军区总医院神经外科,辽宁 沈阳 110016)
·论著·
褪黑激素抑制NLRP3炎性小体减轻小鼠蛛网膜下腔出血早期脑损伤
毛崇丹1甄恩迪1刘阳阳1张海峰2郝广志2董玉书2*
(1锦州医科大学沈阳军区总医院研究生培养基地神经外科,辽宁 锦州 121001;2沈阳军区总医院神经外科,辽宁 沈阳 110016)
目的探讨褪黑素通过调节核苷酸结合寡聚化结构域样受体3炎症复合体(NLRP3)对蛛网膜下腔出血(SAH)后早期脑损伤(EBI)的保护作用和机制。方法建立小鼠颈动脉线穿法SAH模型,分为假手术组、假手术+溶剂组、SAH+溶剂组和SAH+褪黑素组四组,进行SAH出血量评级和小鼠神经功能缺陷评分,脑组织水含量测定脑水肿,伊文思蓝法测定血脑屏障(BBB)通透性,检测脑丙二醛(MDA)和谷胱甘肽(GSH)水平,神经核抗原(NeuN)和末端脱氧核苷酸转移酶介导的dUTP 缺口末端标记测定法(TUNEL)检测神经元存活和死亡率,Western Blot检测脑凋亡相关斑点样蛋白(ASC)、白细胞介素-1β (IL-1β)、核苷酸结合寡聚化结构域样受体3炎症复合体 (NLRP3)、B淋巴细胞瘤-2基因(Bcl2)、前凋亡因子(Bim)和活化的caspase-1蛋白表达,酶联免疫吸附测定(ELISA)脑中细胞因子白介素-1β (IL-1β)和白介素-6 (IL-6)水平。结果槲皮素可以提高SAH小鼠生存率,降低神经功能缺陷评分,减少脑神经元凋亡,提高脑谷胱甘肽(GSH)水平,降低丙二醛(MDA)水平,减轻脑水肿和BBB通透性损害。槲皮素可以降低NLRP3以及细胞凋亡相关斑点样蛋白(ASC)的表达,抑制IL-1β、IL-6的分泌和活化的caspase-1的蛋白表达,并可以增高抗凋亡因子Bcl2的表达,降低凋亡前体因子Bim的表达。结论槲皮素通过抑制NLRP3炎性相关的凋亡来减轻SAH后的EBI。
褪黑素; 蛛网膜下腔出血; 早期脑损伤; 核苷酸结合寡聚化结构域样受体3炎症复合体
近年来研究发现蛛网膜下腔出血(subarachnoid hemorrhage, SAH)后早期脑损伤(early brain injury, EBI)对预后关键,而炎性反应介导的凋亡是其中的重要机制[1]。核苷酸结合寡聚化结构域样受体3炎症复合体(nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing 3, NLRP3)是一种炎性相关分子,促进白介素-1β(interleukin-1β, IL-1β)和白介素-18(interleukin-18, IL-18)的分泌以及凋亡进程,与心血管、神经系统多种疾病相关[2]。褪黑素是松果体分泌的内源性最强效抗炎抗氧化物质,在SAH中也显示出脑保护作用[3]。然而,在SAH的EBI中,褪黑色素是否通过NLRP3来抑制炎症和凋亡,发挥神经保护作用并不清楚,本研究就此问题在动物体内实验做一探索。
材料与方法
一、对象和材料
清洁级体重为26~30 g雄性C57BL/6J小鼠(沈阳军区总医院动物实验中心提供);槲皮素、NLRP3(Sigma-Aldrich);凋亡相关斑点样蛋白(apoptosis-associated specklike, ASC)、白介素-1β(interleukin-1, IL-1β)、B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl2)、前凋亡因子(pro-apoptotic Bc1-2, Bim),活化的caspase-1抗体(Santa Cruz);神经原核原(neuronal nuclear antigen, NeuN)抗体(Millipore)。
二、分组及给药
将小鼠随机分为假手术组、假手术+溶剂组、SAH+溶剂组和SAH+褪黑素组四组,每组8只。槲皮素溶液以150 mg/kg剂量配制,在小鼠SAH模型建立后的2 h,实验组以5 mL/kg的剂量腹腔注射槲皮素,对照组以相同剂量的槲皮素溶剂注射。
三、建立模型
雄性C57BL6/J小鼠用4.6%异氟烷混合气体麻醉。颈部中线切开,暴露右颈总动脉、颈内和颈外动脉,将5-0尼龙线插入颈总动脉,经颈内动脉至Willis环处,有阻力感后再插入3 mm穿破血管致SAH,迅速将尼龙线拔出,缝合皮肤。
四、检测指标
1.SAH分级评估:根据基底池六个层面SAH量[4],分为0、1、2、3分,0分为未见SAH,1分为少量的SAH,2分为基底池血块但尚可见到血管,3分为血块多覆盖血管,总的评分为0~18分。
2.神经功能评分:根据文献的报道[4],评价神经功能,包括四肢运动,上肢、伸展性、攀爬能力、侧面攀附能力和触觉能力6个方面的测试。
3.脑组织水含量检测:先测脑组织的湿重,置于105 ℃干燥环境中48 h,直到重量不再变化,每个脑的水含量测试如下:(湿重-干重)/湿重 × 100%。
4.BBB通透性分析:手术后48 h按4 mL/kg腹腔注射伊文思蓝,取脑,以15 000 r/min离心30 min后将0.5 mL上清液加入等体积50%三氯乙酸,隔夜孵育后再次离心30 min,取上清液,用分光光度计测定620 nm处吸光度值。
5.各组脑组织丙二醛(malondialdehyde, MDA)和谷胱甘肽(glutathione, GSH)水平检测:150 mM的KCl溶液匀浆脑样品用来测定MDA和GSH水平,用试剂盒测定脂质过氧化指标的MDA,以及测定GSH水平。
6.NeuN和TUNEL检测:在IR模型48 h 后深麻小鼠取脑,石蜡包埋,5 μm冠状切片,取背侧海马区域,用兔抗NeuN抗体(1∶100)在4 ℃过夜孵育,在室温下与结合Alexa 488的山羊抗兔抗体(1∶200)处理2 h,TUNEL染色按试剂盒说明进行,细胞存活指数和凋亡指数为蓝染细胞数与总细胞数比率×100%。
7.Western Blot蛋白检测:在SAH模型48 h 后断头处死小鼠,取脑皮层,提取总蛋白和核蛋白,蛋白定量,转膜,脱脂,加入一抗ASC、IL-1β(1∶500),NLRP3、Bcl2、Bim、活化的caspase-1和β-actin(1∶1000)在4 ℃过夜,次日TBST洗脱,加入相应二抗IgG(1∶5000),孵育1 h 后,TBST 洗脱,用ECL化学发光试剂盒在Tanon凝胶图像处理系统显影。
8.细胞因子酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA):IL-1β和IL-6用ELISA试剂盒检测,用酶标仪测定各吸光度值,按曲线方程计算各样本浓度值。
五、统计分析
结 果
一、SAH出血量分级评估及神经功能评分变化
SAH+溶剂组的评估分为13(12~15)分,SAH+褪黑素的评估分为13(11~15)分,两组无显著性差别(P>0.05)(图1A),说明褪黑素治疗并不能改变SAH的出血量分级。假手术组和假手术+溶剂组的神经功能评分相似,但比SAH+溶剂组显著增高(P<0.05),SAH+褪黑素组的神经功能评分比SAH+溶剂组要高(P<0.05)(图1B),说明褪黑素可以减轻SAH导致的神经功能损害。
二、各组脑水肿和BBB通透性变化
SAH+溶剂组的脑组织水含量升高(P<0.05),SAH +褪黑素组比SAH+溶剂组低(P<0.05)(图2A),说明褪黑素有减轻SAH后脑水肿的作用。SAH+溶剂组伊文思蓝含量升高(P<0.05),SAH+褪黑素组比SAH+溶剂组低(P<0.05)(图2B),说明褪黑素有降低SAH后BBB通透性破坏的作用。

图1 各组SAH出血量分级评估及神经功能评分变化
Fig 1 Changes of SAH grades and neurological scores in different groups
A:SAH grade assay; B:The effect of melatonin on neurological scores.
aP<0.05,vsSham group;bP<0.05,vsSham+vehicle group,cP<0.05,vsSAH+vehicle group.
图2 各组脑水肿和BBB通透性变化
Fig 2 Changes of brain edema and BBB permeability in different groups
A:The brain water content assay; B:The Evans blue extravasation assay.
aP<0.05,vsSham group;bP<0.05,vsSham+vehicle group;cP<0.05,vsSAH+vehicle group.
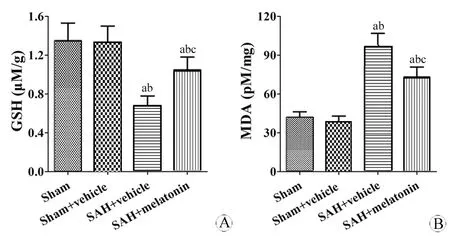
图3 各组脑GSH和MDA水平变化
Fig 3 Changes of brain GSH and MDA levels in different groups
A:The brain GSH level; B:The brain MDA level.
aP<0.05,vsSham group;bP<0.05,vsSham + vehicle group;cP<0.05,vsSAH + vehicle group.
三、各组脑GSH和MDA水平变化
SAH+溶剂组的GSH水平显著降低(P<0.05),SAH+褪黑素组的GSH水平比SAH+溶剂组要高(P<0.05)(图3A)。SAH+溶剂组的MDA水平升高(P<0.05),SAH+褪黑素组MDA水平比SAH+溶剂组低(P<0.05)(图3B)。
四、各组脑神经细胞凋亡和存活率变化
TUNEL阳性细胞率在SAH+溶剂组升高(P<0.05),SAH+褪黑素组比SAH+溶剂组低(P<0.05,图4A、4B),说明褪黑素可降低神经细胞凋亡损害。NeuN阳性细胞率在SAH+溶剂组下降(P<0.05),SAH+褪黑素组比SAH+溶剂组要高(P<0.05,图4C、4D),说明褪黑素可以提高神经细胞存活能力。
五、各组脑NLRP3及凋亡相关分子的蛋白表达变化
NLRP3及其下游分子表达在SAH+溶剂组增高(P<0.05),但在SAH+褪黑素组下降(P<0.05)(图5A~E),说明褪黑素可抑制NLRP3炎性小体等分子表达。
抑制凋亡分子Bcl2蛋白表达在SAH +溶剂组下降(P<0.05),但SAH+褪黑素组,比SAH+溶剂组升高(P<0.05),促进凋亡的分子Bim和caspase-3表达在SAH+溶剂组升高(P<0.05),但在SAH+褪黑素组,比SAH+溶剂组降低(P<0.05)(图5F~I)。
六、各组脑细胞因子IL-1β和IL-6水平变化
与假手术组和假手术+溶剂组相比,SAH+溶剂组的IL-1β和IL-6水平升高(P<0.05),SAH+褪黑素组的IL-1β和IL-6水平比SAH+溶剂组低(P<0.05,图6),说明褪黑素可以抑制炎症相关细胞因子分泌。
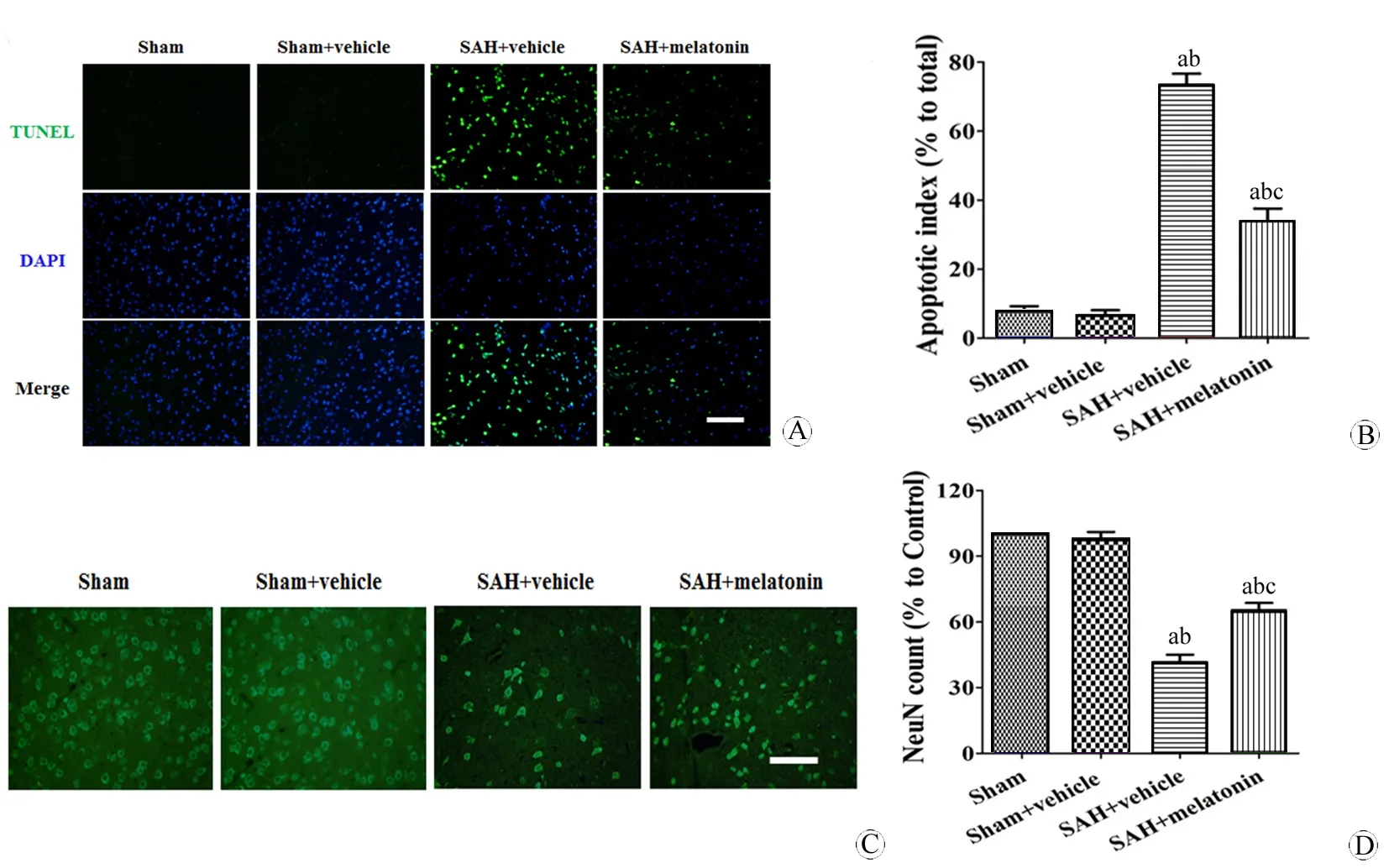
图4 各组脑神经细胞凋亡和存活率变化
Fig 4 Changes of cerebral neuron apoptotic and survival ratio in different groups
A, B:The cerebral neuron apoptotic ratio; C, D:The cerebral neuron survival ratio.
aP<0.05,vsSham group;bP<0.05,vsSham+vehicle group;cP<0.05,vsSAH+vehicle group.
Scale bar=100 μm.
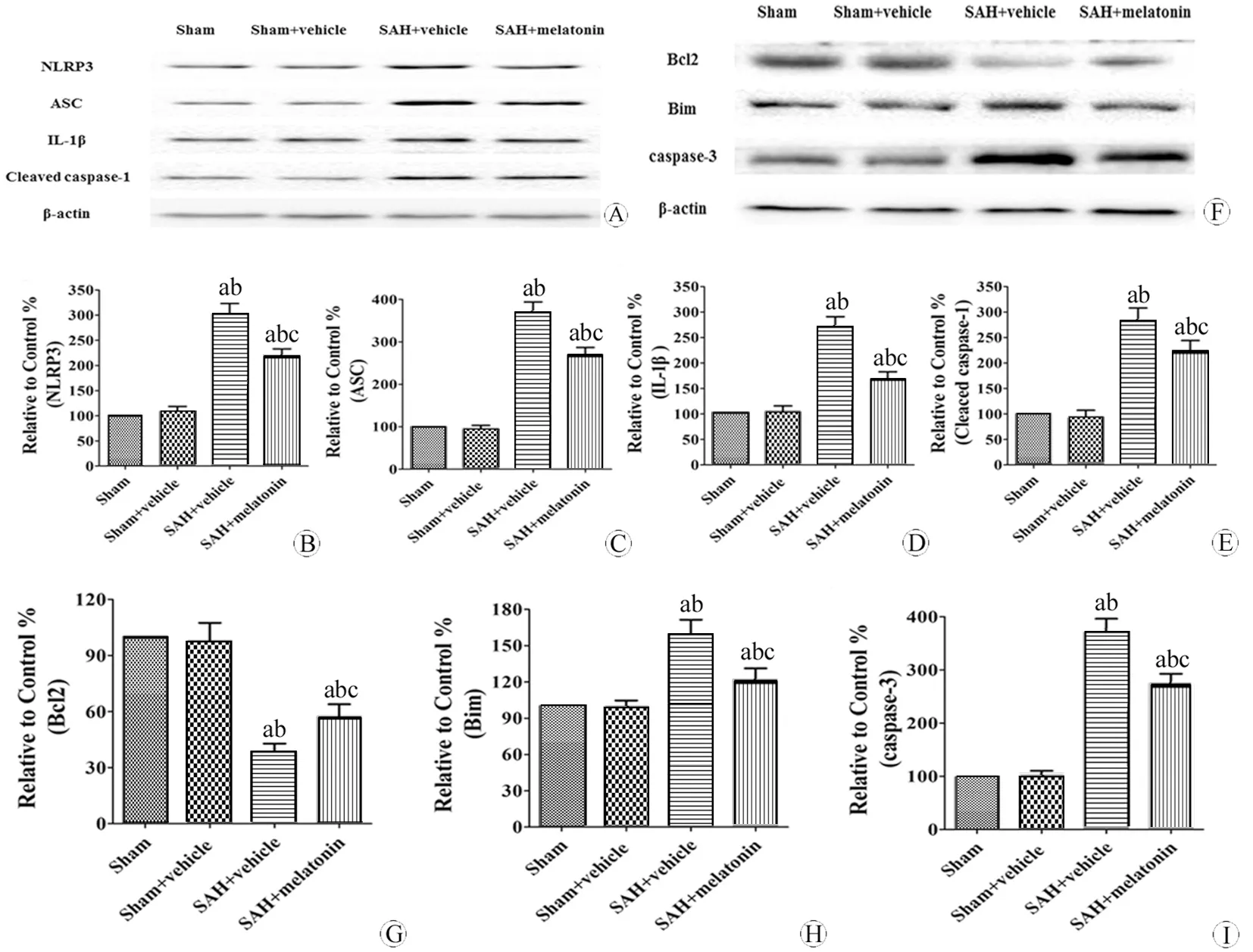
图5 各组脑NLRP3及凋亡相关分子的蛋白表达变化
Fig 5 Changes of cerebral NLRP3 and apoptotic molecules protein expression in different groups
A~E:The cerebral NLRP3, ASC, cleaved caspase-1, and IL-1β protein expression; F~I:The cerebral Bcl2, Bim, and caspase-3 protein expression.
aP<0.05,vsSham group;bP<0.05,vsSham+vehicle group;cP<0.05,vsSAH+vehicle group.

图6 各组脑细胞因子IL-1β和IL-6水平变化
Fig 6 Changes of brain cytokine IL-1 βand IL-6 level in different groups
aP<0.05,vsSham group;bP<0.05,vsSham+vehicle group;cP<0.05,vsSAH+vehicle group.
讨 论
褪黑素除了调节生理节律,还有强大的抗炎抗凋亡作用,并且褪黑素具有易吸收性,可以轻松通过BBB、胎盘等各种形态生理屏障,以及低毒性的特点,在中枢神经系统通过抑制炎症和细胞凋亡,发挥了脑保护作用[5],研究也显示褪黑激素通过抗炎抗氧化机制减轻SAH后脑损害[6]。本研究显示褪黑激素可以提高小鼠SAH后的生存率和神经细胞的存活率,增加脑GSH水平,减少脑神经元凋亡,降低MDA水平,减轻脑水肿和BBB通透性损害,发挥了脑保护作用。
本研究对褪黑素在SAH后发挥脑保护作用的具体分子机制做了进一步探索。NLRP3炎症小体可以促进IL-1β和IL-18的分泌,其激活参与脑膜炎,帕金森病和谷氨酸相关性脑损伤的神经疾病的进展[7],尤其在缺血和出血的脑血管病中,NLRP3炎症小体的激活与脑损伤明显相关,抑制其表达则可以起到神经保护作用。在大脑中动脉闭塞诱导的局灶缺血模型中,下调NLRP3的表达,可以抑制IL-1β的自分泌/旁分泌,减轻脑微血管内皮细胞通透性和小胶质细胞介导的神经毒性,从而减少脑梗死体积和BBB通透性损伤[8]。在脑出血模型中,NLRP3炎症小体通过促进IL-1β分泌和嗜中性粒细胞浸润引发炎症反应,其受抑制或下调后神经功能障碍得到改善[9]。本研究中,我们也发现褪黑素通过抑制NLRP3的激活,下调细胞因子IL-1β和IL-18的表达,从而发挥神经保护的作用。
细胞凋亡是生物体多细胞发生程序性死亡的过程,具有胞体起泡、皱缩、核碎裂、染色质聚集、DNA断裂和mRNA降解的特征性改变,有研究表明,脑出血后血肿周围组织中细胞凋亡率明显增高[10]。抗细胞凋亡是褪黑激素神经保护作用的另一重要方面。在本研究中,褪黑激素也显示出抗SAH后神经细胞凋亡作用,其机制涉及促凋亡分子Bim的抑制和抑凋亡分子Bcl2的激活,在SAH中,NLRP3活化和细胞凋亡导致EBI发生,但褪黑激素可以阻止脑损害进展。然而,NLRP3是否介导细胞凋亡,它与促凋亡分子Bim和抑凋亡分子Bcl2之间的平衡,仍需进一步研究。
1LUCKE-WOLD B P, LOGSDON A F, MANORANJAN B, et al. Aneurysmal subarachnoid hemorrhage and neuroinflammation:a comprehensive review [J]. Int J Mol Sci, 2016, 17(4):497.
2FANN D Y, SANTRO T, MANZANERO S, et al. Intermittent fasting attenuates inflammasome activity in ischemic stroke [J]. Exp Neurol, 2014, 257:114-119.
3ZHANG H M, ZHANG Y. Melatonin:a well-documented antioxidant with conditional pro-oxidant actions [J]. J Pineal Res, 2014, 57(2):131-146.
4ALTAY O, SUZUKI H, HASEGAWA Y, et al. Isoflurane attenuates blood-brain barrier disruption in ipsilateral hemisphere after subarachnoid hemorrhage in mice [J]. Stroke, 2012, 43(9):2513-2516.
5YANG Y, JIANG S, DONG Y, et al. Melatonin prevents cell death and mitochondrial dysfunction via a SIRT1-dependent mechanism during ischemic-stroke in mice [J]. J Pineal Res, 2015, 58(1):61-70.
6丁可, 李桃, 文立利, 等. 褪黑素抑制脑创伤后炎症反应的机制研究 [J]. 中华神经外科疾病研究杂志, 2015, 14 (6):501-504.
7LU M, SUN X L, QIAO C, et al. Uncoupling protein 2 deficiency aggravates astrocytic endoplasmic reticulum stress and nod-like receptor protein 3 inflammasome activation [J]. Neurobiol Aging, 2014, 35(2):421-430.
8YANG F, WANG Z, WEI X, et al. NLRP3 deficiency ameliorates neurovascular damage in experimental ischemic stroke [J]. J Cereb Blood Flow Metab, 2014, 34(4):660-667.
9YANG Z, ZHONG L, XIAN R, et al. MicroRNA-223 regulates inflammation and brain injury via feedback to NLRP3 inflammasome after intracerebral hemorrhage [J]. Mol Immunol, 2015, 65(2):267-276.
10韩玉梁, 鲍刚, 郭世文, 等. 人脑出血后proNGF、sortilin的表达及与细胞凋亡的关系 [J]. 中华神经外科疾病研究杂志, 2015, 14 (6):501-504.
MelatoninrelievedearlybraininjurybyNLRP3pathwayinthemousemodelofsubarachnoidhemorrhage
MAOChongdan1,ZHENEndi1,LIUYangyang1,ZHANGHaifeng2,HAOGuangzhi2,DONGYushu2
1DepartmentofNeurosurgery,GraduateTrainingBaseoftheGeneralHospitalofShenyangMilitaryAreaCommand,JinzhouMedicalUniversity,Jinzhou121001;2DepartmentofNeurosurgery,GeneralHospitalofShenyangMilitaryCommand,Shenyang110016, China
ObjectiveThe protective effects of melatonin against early brain injury (EBI) induced by subarachnoid hemorrhage (SAH) was explored and the potential mechanisms via regulating nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing 3 (NLRP3) inflammasome was elucidated.MethodsMice subjected to SAH model were divided into four groups:Sham group, Sham+vehicle group, SAH+vehicle group and SAH+melatonin group. SAH grade and neurological function scores were assayed. The degree of cerebral edema was evaluated by the water content of brain tissue. The permeability of blood brain barrier was determined by Evas-blue staining method. Malondialdehyde and glutathione were measured. The ratio of surviving and apoptotic neurons were detected by neuronal nuclear antigen (NeuN) and TdT-mediated dUTP nick end labeling (TUNEL) assay. The protein expression of apoptosis-associated speck-like protein containing apoptosis-associated specklike protein (ASC), interleukin-1β (IL-1β), NLRP3, B-cell lymphoma-2 (Bcl2), pro-apoptotic Bc1-2 proteins (Bim) and active caspase-1 was detected by Western Blot. Cytokines IL-1β and interleukin-6 (IL-6) was measured by enzyme linked immunosorbent assay (ELISA).ResultsMelatonin increased survival rate, as well as elevated neurological score, greater survival of neurons, preserved brain glutathione levels and reduced brain edema, malondialdehyde concentrations, apoptotic ratio, and blood brain barrier (BBB) disruption. Melatonin also attenuated the expressions of NLRP3, ASC, cleaved caspase-1, IL-1β, and IL-6; these changes were also associated with an increase in the anti-apoptotic factor (Bcl2) and reduction in the pro-apoptotic factor (Bim).ConclusionMelatonin treatment attenuates the EBI following SAH by inhibiting NLRP3 inflammasome-associated apoptosis.
Melatonin; Subarachnoid hemorrhage; Early brain injury; Nucleotide binding and oligomerization domain-like receptor family pyrin domain-containing 3
1671-2897(2017)16-417-05
R 743.35; R 651.1
A
国家自然科学基金面上项目资助项目(81671313, 81671174);中国博士后科学基金面上项目一等资助项目(2016M592951);辽宁省科学技术计划面上项目资助项目(2015020438)
毛崇丹,硕士研究生,E-mail:1248980726@qq.com
*通讯作者: 董玉书,副教授、副主任医师,博士后,硕士生导师,E-mail:156258128@qq.com
2017-01-10;
2017-03-20)

