沉默P-REX2a对胃癌细胞SGC7901增殖、阿霉素敏感性的影响及其机制
周巧辉,艾耀伟,潘志红,郭明文
(三峡大学人民医院 宜昌市第一人民医院,湖北宜昌443000)
沉默P-REX2a对胃癌细胞SGC7901增殖、阿霉素敏感性的影响及其机制
周巧辉,艾耀伟,潘志红,郭明文
(三峡大学人民医院 宜昌市第一人民医院,湖北宜昌443000)
目的观察沉默P-REX2a对胃癌细胞SGC7901增殖、阿霉素敏感性的影响,并探讨其机制。方法将胃癌细胞SGC7901分为正常培养组(NM组)、阴性对照组(NC组)、干扰组(siRNA组)。NM组正常培养,NC组细胞转染阴性对照序列,siRNA组转染P-REX2a siRNA,转染24 h时采用实时荧光定量PCR法检测各组P-REX2a mRNA,转染24、48、72 h时用MTT法观察各组细胞增殖情况(以OD570表示)。另取胃癌细胞SGC7901同法分组并转染48 h后加入0.3 μmol/L阿霉素培养24 h,用流式细胞术测算各组细胞凋亡率,用Western blotting法检测各组Bcl-2、Bax、PTEN、Akt、p-Akt蛋白,用基于PIP3底物的定磷比色法测定PTEN磷酸酶活性。结果siRNA组P-REX2a mRNA低于NC组、NM组(P均<0.05),转染24、48、72 h时OD570高于NC组、NM组(P均<0.05),加入阿霉素培养后细胞凋亡率高于NC组、NM组(P均<0.05),Bax蛋白表达量、PTEN磷酸酶活性高于NC组、NM组(P均<0.05),Bcl-2、p-Akt蛋白表达量低于NC组、NM组(P均<0.05)。三组PETN、Akt蛋白表达量相比P均>0.05。结论沉默P-REX2a可以抑制胃癌细胞SGC7901增殖,提高胃癌细胞SGC7901对阿霉素的敏感性。这可能是由于沉默P-REX2a可以提高PTEN磷酸酶活性、抑制PI3K/Akt通路活化、抑制Bcl-2表达、促进Bax表达进而促进细胞凋亡
胃癌;P-REX2a;基因沉默;小干扰RNA;阿霉素 ;第10号染色体同源缺失性张力蛋白
胃癌是人类四大恶性肿瘤之一,其病死率位于世界第二[1]。由于早期不易发现,就诊时多已进入中晚期,因此胃癌的预后在较大程度上依赖于辅助化疗。随着分子机制不断深入研究,多种有利的化疗方案已在临床实施或在探索中。传统化疗药物在综合化疗中仍占主要地位,但逐年提高的耐药率导致化疗效率低下。因此,胃癌耐药机制的探索成为当今研究的热点。近年文献[2~5]报道,磷脂酰肌醇3-激酶(PI3K)信号通路在化疗过程中被诱导激活从而导致肿瘤细胞的耐药。PI3K是一种胞内磷脂酰肌醇激酶,可以特异性使肌醇环上的3位羟基磷酸化,使4,5二磷酸磷脂酰肌醇(PIP2)转变为第二信使3,4,5三磷酸磷脂酰肌醇(PIP3),后者将蛋白激酶B(PKB,又称Akt)转移到细胞膜上,并改变Akt的构象使之能被3-磷脂酰肌醇依赖蛋白激酶1/2(PDK1/2)磷酸化和激活,从而传递抗凋亡信号[6]。第10号染色体同源缺失性张力蛋白(PTEN)具有脂质磷酸酶活性,可将膜PIP3的D3 位的磷酸而拮抗PI3K的活化效应[7]。P-REX2a蛋白具有DHPH结构域(与GEF的活性有关),此结构域可直接与PTEN结合,从而抑制PTEN磷酸酶活性,促进PI3K/Akt的活化[8,9]。沉默P-REX2a应该对胃癌细胞的增殖和耐药性产生影响,但是研究甚少。2014年5月~2016年2月,本研究采用siRNA技术沉默胃癌细胞SGC7901中P-REX2a的表达,并观察胃癌细胞SGC7901增殖情况和阿霉素敏感性的变化,以及PTEN/PI3K/Akt调节轴的变化,探讨通过沉默P-REX2a提高胃癌细胞化疗敏感性的可行性及其机制。现报告如下。
1 材料与方法
1.1 细胞与主要试剂 人胃腺癌细胞SGC7901购自上海赛百慷生物技术股份公司。DMEM细胞培养液购自Gibco公司,胎牛血清购自杭州四季青公司,Lipofectamine2000和TRIzol购自Invitrogen公司,逆转录试剂盒与SYBR Premix Ex Taq购自TaKaRa公司。一抗中P-REX2a(ab169027)购自Abcam公司,PTEN(9188P)、Akt(4691P)、p-Akt(S473,4060P)、Bax(2772S)、Bcl-2(2870P)均购自美国CST公司。MTT检测试剂盒购自美国Sigma,阿霉素购自美国Selleckchem公司。AnnexinV-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物公司。GENMED定磷比色法法测定试剂盒购自美国Genmed 公司。siRNA片段定制于由上海吉玛公司,P-REX2a-Homo-883(siRNA)序列为5′-GGCAUCUA-CAGAUGGACAUTT-3′/5′-AUGUCCAUCUGUAGAU-GCCTT-3′。由上海吉玛公司合成。
1.2 胃腺癌细胞SGC7901分组及siRNA转染 人胃腺癌细胞SGC7901细胞贴壁生长,培养用含10%FBS的DMEM培养基培养,培养于37 ℃、5%CO2的细胞培养箱,培养基中加入1%的双抗(青霉素与链霉素),隔天观察、换液1次。取处于对数生长期、状态良好的SGC7901细胞,以每孔2×105个接种于6孔板,置于37 ℃、5%CO2的细胞培养箱。设正常培养组(NM组)、阴性对照组(NC组)、干扰组(siRNA组)。待细胞生长12 h后开始转染,转染前2 h,换为2 mL无血清DMEM培养基。按照Lipofectamine2000说明书操作,转染时RNA与转染试剂的比例为2∶1。
1.3 P-REX2a mRNA检测 转染24 h后收集各组细胞放入1.5 mL EP管中,加入1 mL TRIzol,按TRIzol试剂操作说明书逐步提取总RNA。按照反转录试剂盒说明书操作,在PCR仪中合成cDNA。用cDNA行实时荧光定量PCR,参照试剂盒SYBR qPCR mix(TaKaRa)说明书操作,P-REX2a上游引物序列为5′-TGGGAGGGGTCCAACATCA -3′,下游引物序列为5′-TCTTCAACCGTCTGTGTTTTCTT-3′; GADPH上游引物序列为5′-GCCAAAAGGGTCATCATCTC-3′,下游引物序列为5′-GTAGAGGCAGGGATGATGTTC-3′。PCR反应条件:95 ℃预变性30 s,然后95 ℃ 15 s、55 ℃ 30 s,共重复40个循环。采用2-ΔΔCt法计算P-REX2a mRNA相对表达量。实验重复3次。
1.4 细胞增殖情况观察 采用MTT法。转染24、48、72 h后,每孔分别加入100 μL MTT,37 ℃培养4 h,吸出培养基,加入1 500 μL DMSO,震荡10 min,各取100 μL放入96孔板中,酶标仪在570 nm处测定各孔吸光度值(OD)。每组设5个平行孔,各平行孔取均值,实验重复3次。
1.5 细胞阿霉素敏感性观察 另取胃癌细胞SGC7901同法分组并转染48 h后加入终浓度为0.3 μmol/L的阿霉素继续培养24 h。收集细胞,按照AnnexinV-FITC/PI细胞凋亡检测试剂盒说明书进行操作,加入500 μL Binding Buffer重悬细胞,加入5 μL AnnexinV-FITC混匀,再加入5 μL 碘化丙啶混匀,室温避光反应5~15 min,1 h内流式细胞仪测算细胞凋亡率。
1.6 细胞Bcl-2、Bax、PTEN、Akt、p-Akt蛋白检测 采用Western blotting法。收集1.5中阿霉素处理后的细胞,加入100 μL的RIPA蛋白裂解液冰上裂解30 min,离心取上清,按BCA试剂盒操作说明测定蛋白浓度。用5%浓缩胶与10%分离胶进行SDS-PAGE,恒流转膜,用含5%脱脂奶的TBST溶液室温封闭1.5 h,加一抗4 ℃孵育过夜,取出用TBST洗10 min ,重复3次然后浸入相应二抗室温孵育1 h,TBST液洗3次,化学发光法显影。Image J 软件测算条带灰度值。以β-actin为内参,用目的蛋白条带和β-actin条带灰度值之比表示目的蛋白相对表达量。
1.7 细胞PTEN磷酸酶活性测定 收集1.5中阿霉素处理后的细胞,采用基于PIP3底物的定磷比色法检测PTEN磷酸酶活性。参考GENMED定磷比色法法测定试剂盒说明书操作。
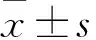
2 结果
2.1 细胞P-REX2a mRNA表达比较 siRNA组、NC组、NM组细胞P-REX2a mRNA相对表达量分别为0.54±0.06、0.96±0.07、1。siRNA组P-REX2a mRNA相对表达量与NC组、NM组相比,P均<0.05。NC组细胞P-REX2a mRNA相对表达量与NM组相比P>0.05。
2.2 各组细胞增殖比较 转染24、48、72 h各组细胞OD570见表1。转染24、48、72 h时siRNA组细胞OD570高于NC组、NM组(P均<0.05),NC组细胞OD570与NM组相比P均>0.05。

表1 转染24、48、72 h各组细胞OD570比较
注:与NC、NM组相比,*P<0.05。
2.3 各组细胞凋亡率比较 siRNA组、NC组、NM组细胞凋亡率分别为(18.54±0.73)%、(17.37±0.33)%、(17.30±0.47)%。siRNA组细胞凋亡率与NC组、NM组相比,P均<0.05。NC组细胞凋亡率与NM组相比P>0.05。
2.4 各组细胞中Bcl-2、Bax、PTEN、Akt、p-Akt蛋白表达比较 各组细胞中Bcl-2、Bax、PTEN、Akt、p-Akt蛋白相对表达量见表2。三组细胞中PTEN、Akt蛋白相对表达量相比P均>0.05。siRNA组细胞Bax蛋白相对表达量高于NC组、NM组(P均<0.05),Bcl-2、p-Akt蛋白相对表达量低于NC组、NM组(P均<0.05)。NC组细胞Bcl-2、Bax、p-Akt蛋白相对表达量与NM组相比P均>0.05。

表2 各组细胞Bcl-2、Bax、PTEN、Akt、p-Akt蛋白相对表达量比较
注:与NC、NM组相比,*P<0.05。
2.5 各组细胞PTEN磷酸酶活性比较 siRNA组、NC组、NM组细胞PTEN磷酸酶活性分别为0.41±0.01、0.30±0.08、0.29±0.06。siRNA组胞PTEN磷酸酶活性与NC组、NM组相比,P均<0.05。NC组细胞PTEN磷酸酶活性与NM组相比P>0.05。
3 讨论
阿霉素是胃癌化疗中的经典药物,近些年被报道出现了耐药。PI3K/Akt信号通路与胃癌阿霉素耐药密切相关[2]。P-REX2a是一种Rac鸟苷酸交换蛋白,可与PTEN直接结合并使其丧失脂质磷酸酶活性,进而导致PIP3的蓄积。在PI3K/Akt信号通路中,PI3K的活化将PIP2 转化为PIP3,PIP3作为第二信使可将Akt进行活化,最终导致细胞增殖分化[8];而PTEN作为一个关键的负向调节因子,具有脂质磷酸酶活性,可将PIP3去磷酸化为PIP2[7]。研究发现,P-REX2a在包括胃癌在内的多种肿瘤中有高表达[8,10],因此,P-REX2a的表达可能促进胃癌细胞增殖分化。由于95%以上的胃癌为胃腺癌,本次实验我们选择中分化的胃腺癌细胞SGC7901进行研究。本研究结果显示,用siRNA沉默P-REX2a基因可以下调胃癌细胞SGC7901中P-REX2a mRNA并抑制细胞增殖,提示P-REX2a的表达促进胃癌的增殖分化。
PI3K/Akt信号通路在化疗过程中常被激活而导致化疗耐药[2~5]。本课题组既往研究证实,在胃腺癌细胞SGC7901中,应用PI3K/Akt通路抑制剂与0.3 μmol/L阿霉素处理24 h时,可观察到显著的凋亡增加以及PI3K/Akt通路蛋白表达的改变[11]。另外,在胃癌细胞中上调PTEN后,可抑制PI3K/Akt通路的异常激活,从而逆转胃癌阿霉素的耐药[12]。因此,P-REX2a参与PTEN/ PI3K/Akt通路的调节,可能参与化疗耐药机制的调节。本研究结果显示,用siRNA沉默P-REX2a基因后再加入0.3 μmol/L阿霉素处理24 h,细胞凋亡率较NC组、NM组明显升高,与此同时凋亡相关蛋白Bax的表达升高,Bcl-2表达下降。这些结果表明P-REX2a可能通过调控Bcl-2、Bax表达影响细胞凋亡,进而参与胃癌细胞的阿霉素耐药。
研究证实,在无PTEN表达的细胞中导入PTEN基因后可减少Akt的活化;若仅有P-REX2a的表达,Akt的活化水平基本不变,但同时高表达PTEN与P-REX2a时,则可检测到Akt在S473与T308位点均被激活[8]。这表明P-REX2a调节PI3K/Akt通路依赖于PTEN。本研究结果显示,与NC、NM组相比,siRNA组细胞PTEN、Akt蛋白表达基本不变,而PTEN脂质磷酸酶活性上升,p-Akt蛋白表达水平降低。提示在化疗过程中沉默P-REX2a的表达可增强PTEN的脂质磷酸酶活性,降低Akt的活化,从而提升化疗效果。
综上所述,沉默P-REX2a可以抑制胃癌细胞SGC7901增殖,提高胃癌细胞SGC7901对阿霉素的敏感性。这可能是由于沉默P-REX2a可以提高PTEN磷酸酶活性、抑制PI3K/Akt通路活化、抑制Bcl-2表达、促进Bax表达进而促进细胞凋亡。未来我们可以通过抑制P-REX2a的表达或使其失活,在一定程度上提升阿霉素对胃癌的综合化疗效果。
[1] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010,127(12):2893-2917.
[2] 艾耀伟,于红刚. PI3K/AKT/MDM2信号通路活化影响胃癌细胞对阿霉素敏感性的实验研究[J].中华肿瘤杂志,2008,30(7):494-497.
[3] Fan QW, Weiss WA. Targeting the RTK-PI3K-mTOR axis in malignant glioma: overcoming resistance[J]. Curr Top Microbiol Immunol, 2010(347):279-296.
[4] Goler-Baron V, Sladkevich I, Assaraf YG. Inhibition of the PI3K-Akt signaling pathway disrupts ABCG2-rich extracellular vesicles and overcomes multidrug resistance in breast cancer cells[J]. Biochem Pharmacol, 2012,83(10):1340-1348.
[5] Zhang Y, Bao C, Mu Q, et al. Reversal of cisplatin resistance by inhibiting PI3K/Akt signal pathway in human lung cancer cells[J]. Neoplasma, 2016,63(3):362-370.
[6] Osaki M, Oshimura M, Ito H. PI3K/Akt pathway: its functions and alterations in human cancer[J]. Apoptosis, 2004,9(6):667-676.
[7] Chalhoub N, Baker SJ. PTEN and the PI3-Kinase Pathway in Cancer[J]. Annu Rev Pathol, 2009(4):127-150.
[8] Fine B, Hodakoski C, Koujak S, et al. Activation of the PI3K Pathway in Cancer Through Inhibition of PTEN by Exchange Factor P-REX2a[J]. Science, 2009,325(5945):1261-1265.
[9] Leslie NR. P-REX2a Driving Tumorigenesisby PTEN Inhibition[J]. Sci Signal, 2009,2(94):68.
[10] Guo B, Liu LY, Yao JY, et al. miR-338-3p suppresses progression of gastric cancer through PTEN-AKT signaling pathways by targeting P-REX2a[J]. Mol Cancer Res, 2014,12(3):313-321.
[11] Yu HG, Ai YW, Yu LL, et al. Phosphoinositide 3-kinase/Akt pathway plays an important role in chemoresistance of gastric cancer cells against etoposide and doxorubicin induced cell death[J]. Int J Cancer, 2008,122(2):433-443.
[12] 付学琼,于皆平,罗和生.PTEN的表达及其在阿霉素诱导胃癌细胞凋亡中的意义[J].中华内科杂志,2010,49(5):422-425.
EffectsofsilencingP-REX2aonproliferationandsensibilitytodoxorubicinofgastriccancercellsSGC7901
ZHOUQiaohui,AIYaowei,PANZhihong,GUOMingwen
(TheFirstPeople′sHospitalofYichang,ChinaThreeGorgesUniversity,Yichang443000,China)
ObjectiveTo observe the effects of silencing P-REX2a on the proliferation and sensibility to doxorubicin of gastric cancer cells SGC7901 and to investigate its mechanism.MethodsSGC7901 cells were randomly divided into the normal group (NM group), negative control group (NC group), and interference group (siRNA group). The cells in the NM group were cultured as normal, the cells in the NC group were transfected with negative control sequences, and cells in the siRNA group were transfected with P-REX2a siRNA. We detected the mRNA of P-REX2a by real-time fluorescent quantitative PCR at 24 h after the transfection. MTT was used to observe cell proliferation in each group (OD570) at 24, 48, and 72 h after the transfection. Some other gastric cancer SGC7901 cells were divided into three groups as before, after 48-hour transfection, they were treated with 0.3 mol/L doxorubicin for 24 h, then we measured the apoptotic rate by using flow cytometry and detected the Bcl-2, Bax, phosphatase and tensin homologue deleted on chromosome 10 (PTEN), Akt, and p-Akt protein by using Western blotting. PTEN phosphatase activity detected by phosphorus PIP3 substrates-based colorimetric method.ResultsP-REX2a mRNA of the siRNA group was lower than that of NC group and NM group (P<0.05), but the OD570was higher than that of the NC group and NM group at 24, 48, and 72 h after the transfection (allP<0.05). After adding doxorubicin, the apoptosis rate was higher in the siRNA group than in the NC group and NM group (P<0.05); the Bax protein expression and phosphatase activity of PTEN was higher but the Bcl-2 and p-Akt protein expression was lower in the siRNA group than in the NC group and NM group (allP<0.05). No significant difference was found in the protein expression of PTEN and Akt between the three groups (bothP>0.05).ConclusionsSilencing P-REX2a can inhibit the proliferation and improve the sensitivity to adriamycin of gastric cancer SGC7901 cells. This may be due to that silencing P-REX2a can improve the phosphatase activity of PTEN, inhibit the activation of PI3K/Akt pathway and the expression of Bcl-2, promote the expression of Bax, and thus promote the apoptosis.
gastric carcinoma; P-REX2a; gene silencing; siRNA; doxorubicin; phosphatase and tensin homologue deleted on chromosome 10 (PTEN)
周巧辉(1989-),女,硕士,医师,主要研究方向:消化道肿瘤的发病机制及治疗。E-mail: zqh19890902@163.com
艾耀伟(1971-),男,博士,主任医师,主要研究方向:消化道肿瘤的发病机制及治疗。E-mail: aiyw2001@sohu.com
10.3969/j.issn.1002-266X.2017.40.005
R735.2
A
1002-266X(2017)40-0018-04
2016-04-10)

