辣椒素对大鼠胃动力的影响及作用机制
徐劲,唐川康,阳凤,王缕,王瑶,彭燕
(西南医科大学附属医院,四川泸州628000)
辣椒素对大鼠胃动力的影响及作用机制
徐劲,唐川康,阳凤,王缕,王瑶,彭燕
(西南医科大学附属医院,四川泸州628000)
目的探讨辣椒素对大鼠胃动力的影响及其作用机制。方法选择SD大鼠160只,随机分为对照组及辣椒素低、中、高剂量组,每组40只。辣椒素低、中、高剂量组分别给予0.01、0.1、0.5 mg/mL的辣椒素溶液灌胃,对照组给予等量辣椒素溶剂灌胃。各组分别于灌胃3天及灌胃1、2、4周,随机取10只,采用核素显像法检测胃半排空时间(t50%)、65 min时胃排空率(GE65 min);处死后剖腹取胃,采用免疫组化二步法检测胃组织辣椒素受体1(TRPV1)、降钙素基因相关肽(CGRP)、P物质(SP)表达。结果辣椒素低、中、高剂量组各时间点较对照组同期t50%有升高趋势,GE65 min有降低趋势,均表现出抑制胃排空作用;辣椒素高、中剂量组各时间点抑制胃排空效果强于辣椒素低剂量组(P均<0.05),辣椒素中、高剂量组抑制胃排空的效果相当(P均>0.05)。辣椒素低、中、高剂量组各时间点胃黏膜TRPV1表达均较对照组同期明显增加(P均<0.05),但辣椒素低、中、高剂量组之间比较差异无统计学意义(P均>0.05)。辣椒素低、中、高剂量组各时间点胃黏膜CGRP表达较对照组有升高趋势;灌胃3天及1周,辣椒素高、中剂量组CGRP表达升高较辣椒素低剂量组更明显(P均<0.05)。灌胃2、4周,辣椒素高、中剂量组胃黏膜CGRP表达显著降低(P均<0.05)。辣椒素低、中、高剂量组各时间胃黏膜SP表达与对照组比较差异均无统计学意义(P均>0.05)。结论辣椒素具有抑制大鼠胃排空作用,且剂量越大,抑制效果越强;随着作用时间延长,辣椒素剂量越大抑制胃排空效果减弱越明显,其原因可能与胃黏膜CGRP大量消耗有关。
功能性胃肠病;胃肠道动力紊乱;辣椒素;辣椒素受体1;降钙素基因相关肽;P物质
辣椒素是辣椒的主要活性成分,可选择性刺激初级传入神经元末梢和细胞膜上的辣椒素受体1(TRPV1),参与胃肠道众多的生理和病理过程。TRPV1阳性神经纤维含有多种神经递质,如降钙素基因相关肽(CGRP)、P物质(SP)等[1]。肠道CGRP主要分布于迷走神经和内脏神经的传入纤维以及胃肠道壁内神经丛,对大部分胃肠运动具有抑制作用,可引起胃排空延迟[2]。SP是速激肽家族的一员,通过对胃平滑肌的直接作用刺激胆碱类神经元和作为非胆碱能神经兴奋性神经递质,加强胃肠道平滑肌的收缩运动[3]。因此认为,胃组织CGRP、SP表达改变可能与辣椒素抑制胃排空作用有关[4]。但目前辣椒素对胃肠道动力的影响及机制争议较大。2015年5月~2016年2月,我们观察了辣椒素对大鼠胃动力及胃组织TRPV1、CGRP、SP表达的影响。现分析结果并报告如下。
1 材料与方法
1.1 材料 健康SD大鼠160只,清洁级,雌雄各半,2月龄,体质量160~180 g,由西南医科大学动物实验中心提供。KS400图像处理系统,德国Zeiss公司;H3000WC型SPECT,德国西门子公司。辣椒素,纯度99%,美国Sigma公司;实验前称取辣椒素1、10、50 mg,分别加入100 mL辣椒素溶剂(10%吐温20 mL+10%酒精1 mL+生理盐水79 mL),充分溶解,获得终浓度为0.01、0.1、0.5 mg/mL的辣椒素溶液。99mTc-DTPA,由西南医科大学核医学科提供;兔抗大鼠TRPV1、CGRP、SP多克隆抗体及生物素标记二抗试剂盒,北京博奥森生物技术有限公司;DAB显色试剂盒,武汉博士德生物工程有限公司。
1.2 动物分组处理 所有大鼠适应性饲养1周,随机分为对照组及辣椒素低、中、高剂量组,每组40只。辣椒素低、中、高剂量组分别给予0.01、0.1、0.5 mg/mL浓度的辣椒素溶液2 mL灌胃,对照组给予等量辣椒素溶剂灌胃。
1.3 相关指标观察 各组分别于灌胃3天及灌胃1、2、4周随机取10只,检测以下指标。
1.3.1 胃半排空时间(t50%)及65 min时胃排空率(GE65 min) 采用核素显像法。①标准餐制备:取99mTc标记的DTPA 1.2 mci,加入12 mL生理盐水,并与12 g芝麻糊混合,振荡10 min,获得每毫升含有99mTc-DTPA 0.1 mci的半固体标准餐。②标准餐灌胃:大鼠禁食24 h、禁水6 h,不禁药,末次灌胃后10 min,标准餐2 mL灌胃。③图像采集:低能通用型准直器参数:能峰140 keV,窗宽20%,矩阵128×128;标准餐灌胃后,将大鼠俯卧位固定于固定器中,使胃和大部分小肠置于探头视野中。灌胃后5、10、15、20 min各采集图像1帧,随后每15 min采集图像1帧,每帧图像采集60 s,连续观察2 h。若2 h内放射性计数尚未下降50%,可继续延长观察时间。④图像处理:CT图像断层融合:采集的CT图像断层数据经OSEM迭代重建后,使用GE专用Functional anatomical fusion融合处理软件与CT图像进行融合,重建横断面、矢状面、冠状面SPECT/CT融合图像,辅助诊断软件设定感兴趣区,获得各时间点全胃内放射性计数,绘制时间-放射性曲线。根据时间-放射性曲线即可获得t50%及胃排空试验第65 min时胃内放射性核素计数,计算65 min时胃排空率(GE65 min)。计算公式:GEt=(Cmax-Ct)/Cmax×100%[GEt为某时点的胃排空率;Cmax为胃区内最大计数率;Ct为某时点的胃内计数率(经衰变校正和衰减校正后)]。
1.3.2 胃体组织TRPV1、CGRP、SP表达 采用免疫组化二步法。胃排空检测完毕后采用3%戊巴比妥钠腹腔麻醉后处死,迅速剖腹取胃。取胃体组织,甲醛固定,石蜡包埋,5 μm厚切片;60 ℃恒温箱烤片过夜,二甲苯脱蜡,梯度乙醇脱水;3%过氧化氢甲醛液室温孵育10 min,PBS冲洗5 min×3次;柠檬酸缓冲液高压蒸煮5 min,自然冷却至室温,PBS冲洗5 min×3次;滴加适量相应一抗(兔抗大鼠TRPV1、CGRP、SP多克隆抗体,稀释效价均为1∶100),4 ℃孵育过夜。次日,PBS冲洗5 min×3次,滴加适量生物素标记的二抗,室温孵育30 min,蒸馏水冲洗3 min,TBST洗膜5 min。DAB显色,苏木素复染,盐酸分化,常规脱水,透明,干燥,中性树脂封片,显微镜下观察。TRPV1、CGRP、SP阳性表达主要位于胞质内,呈黄色颗粒状。光镜下选择切片的阳性区域,随机取3个400倍视野,采用彩色病理图像分析软件测定3个视野内阳性信号的面积和阳性信号平均光密度值,计算阳性指数(PI)。PI=阳性信号面积×阳性信号平均光密度值/测定面积。PI越大,表明TRPV1表达或CGRP、SP释放越多。
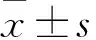
2 结果
2.1 各组不同时间t50%、GE65 min比较 见表1。
2.2 各组胃体组织TRPV1、CGRP、SP表达比较 见表2。

表1 各组不同时间t50%、GE65 min比较
注:与对照组同期比较,*P<0.05;与辣椒素低剂量组同期比较,#P<0.05;与辣椒素中剂量组同期比较,☆P>0.05;与同组灌胃3天比较,△P<0.05;与同组灌胃1周比较,▲P<0.05;与同组灌胃2周比较,▽P<0.05。

表2 各组不同时间胃体组织TRPV1、CGRP、SP表达比较
注:与对照组同期比较,*P<0.05;与辣椒素低剂量组同期比较,#P<0.05;与同组灌胃3天比较,△P<0.05;与同组灌胃1周比较,▲P<0.05;与同组灌胃2周比较,▽P<0.05。
3 讨论
研究发现,辣椒素通过作用于胃肠道黏膜上皮细胞的TRPV1,引发一系列生物学效应,继而促进胃黏膜屏障修复、调节胃肠道动力等[5]。但辣椒素的药理作用特殊,可产生刺激兴奋、感觉阻滞、选择性神经毒性损害和不可逆性细胞破坏四种药理效应。初次或小剂量辣椒素作用于传入神经纤维,可使该神经纤维出现一过性兴奋,释放某些神经递质,并向上级神经元传递信号,即为刺激兴奋效应。当继续或反复使用辣椒素,使兴奋的神经纤维消耗大量递质,导致对刺激无反应,出现脱敏现象,即为感觉阻滞效应。大剂量辣椒素在引起初级刺激兴奋作用后,可引起神经递质的过量释放,导致传入神经纤维受到严重损害,失去其信息传入功能,即为选择性神经毒性损害效应,甚至不可逆性细胞破坏。说明剂量和作用时间不同,辣椒素所表现出的药理效应亦不相同[6~10]。但目前关于辣椒素影响胃动力的量效关系、时效关系尚不完全清楚。
本课题组前期研究发现,1~10 mg/(kg·d)辣椒素灌胃对大鼠胃肠道的敏感性影响较小,故本研究选择0.1、1、5 mg/(kg·d)三种剂量辣椒素灌胃。结果显示,与对照组灌胃同期比较,辣椒素低、中、高剂量组各时间点t50%有升高趋势,GE65 min有降低趋势,均表现出胃排空抑制作用。但不同剂量辣椒素灌胃≤1周所表现出的抑制效果强度不同:辣椒素中、高剂量组抑制胃排空作用强于辣椒素低剂量组,而辣椒素中、高剂量组抑制胃排空效果相当。本课题组前期研究发现,1 mg/(kg·d)辣椒素灌胃1~7天,大鼠内脏化学刺激敏感性逐渐增强,灌胃2周后基本恢复正常[11]。推测辣椒素的药理作用随着时间延长,可能出现耐受,导致药理作用减弱甚至消失。本研究结果显示,随着作用时间延长,辣椒素中剂量组t50%逐渐降低,至灌胃4周,胃排空抑制作用基本消失;辣椒素高剂量组亦随时间延长,抑制胃排空作用逐渐减弱,灌胃2周抑制胃排空作用基本消失。虽然整个实验过程辣椒素低剂量组均表现为胃排空抑制作用,但仍有随着时间延长,抑制效应逐渐减弱的趋势。因此认为,辣椒素的药理效应具有时间及剂量依赖性,与Szolcsanyi[12]报道基本一致。
消化道内有丰富的传入神经纤维和TRPV1分布,约50%的迷走传入神经支配的大鼠胃肠道有TRPV1表达。辣椒素通过传入神经纤维激活胃肠道TRPV1后钙离子通道开放,引起神经元及其纤维释放神经递质,从而调节胃肠道动力。有研究发现,1 mg/(kg·d)辣椒素灌胃不同时间,大鼠胃组织TRPV1表达明显不同[13]。既往研究多在病理条件下观察胃黏膜TRPV1表达改变[14],对长时间使用辣椒素药物本身是否影响TRPV1表达研究较少。本研究结果显示,与对照组灌胃同期比较,辣椒素低、中、高剂量组胃黏膜TRPV1表达均明显增加,但各辣椒素组间比较差异无统计学意义。推测辣椒素可上调正常大鼠胃黏膜TRPV1表达,但与辣椒素剂量和作用时间无关,尚不能确定大鼠胃排空改变与胃黏膜TRPV1上调有关。
胃肠道CGRP主要分布于迷走神经和内脏神经的传入纤维以及胃肠道壁内神经丛,对辣椒素作用敏感。CGRP对大部分胃肠运动起抑制作用,引起胃底纵行肌、胃窦部环形肌松弛,胃内压下降,引起胃排空延迟,抑制胃肠运动。SP广泛分布于肠神经系统和整个胃肠道,可直接作用于平滑肌或间接通过释放乙酰胆碱,引起胃肠平滑肌收缩,促进胃肠道运动。本研究结果显示,辣椒素高剂量组灌胃3天及灌胃1周胃黏膜CGRP表达较对照组明显增加,但灌胃2、4周胃黏膜CGRP表达与对照组比较差异无统计学意义;辣椒素中剂量组灌胃3天及灌胃1、2周胃黏膜CGRP表达较对照组明显增加,而灌胃4周胃黏膜CGRP表达与对照组比较差异无统计学意义;辣椒素低剂量组灌胃3天及灌胃1、2、4周胃黏膜CGRP表达较对照组均有所增加。说明辣椒素引起的大鼠胃黏膜CGRP表达改变可能具有剂量和时间依赖性。推测辣椒素灌胃早期导致大鼠胃黏膜CGRP释放,继而引起胃动力抑制、胃排空减慢,随着时间延长,胃黏膜CGRP消耗,抑制胃动力效应消失。De Winter等[15]研究发现,1.6 mmol/L辣椒素溶液灌胃可降低50%胃肌电活动,明显延迟胃排空;胃灌流液中CGRP含量是SP的100倍,持续CGRP灌注同样可抑制胃肌电活动,而CGRP拮抗剂可抵消辣椒素溶液灌胃所致的胃排空延迟。本研究结果显示,各组胃黏膜SP表达极少,且其表达不受辣椒素灌胃的影响。
综上所述,辣椒素具有抑制大鼠胃排空作用,且剂量越大,抑制作用越强;随着作用时间延长,剂量越大,抑制胃排空效应减弱越明显,其原因可能与胃黏膜CGRP大量消耗有关。
[1] Zalecki M. Extrinsic primary afferent neurons projecting to the pylorus in the domestic pig--localization and neurochemical characteristics[J]. J Mol Neurosci, 2014,52(1):82-89.
[2] 梁杰贤,季文进,洪迅,等.辣椒素受体在肠易激综合征内脏痛觉过敏中的作用[J].热带医学杂志,2006,7(4):342-344.
[3] Liu L, Shang F, Morgan MJ, et al. Cyclooxygenase-dependent alterations in substance P-mediated contractility and tachykinin NK1 receptor expression in the colonic circular muscle of patients with slow transit constipation[J]. J Pharmacol Exp Ther, 2009,329(1):282-289.
[4] Mizuguchi S, Ohno T, Hattori Y, et al. Calcitonin gene-related peptide released by capsaicin suppresses myoelectrical activity of gastric smooth muscle[J]. J Gastroenterol Hepatol, 2005,20(4):611-618.
[5] Spencer NJ, Kerrin A, Singer CA, et al. Identification of capsaicin-sensitive rectal mechanoreceptors activated by rectal distension in mice[J]. Neuroscience, 2008,153(2):518-534.
[6] Evangelista S. Capsaicin receptor as target of calcitonin gene-related peptide in the gut[J]. Prog Drug Res, 2014(68):259-276.
[7] Shibata C, Sasaki I, Naito H, et al. Intragastric capsaicin stimulates motility of upper gut and proximal colon via distinct pathways in conscious dogs[J]. Dig Dis Sci, 1999,44(6):1083-1089.
[8] Lefebvre RA, De Beurme FA, Sas S. Relaxant effect of capsaicin in the rat gastric fundus[J]. Eur J Pharmacol, 1991,195(1):131-137.
[9] Holzer-Petsche U, Seitz H, Lembeck F. Effect of capsaicin on gastric corpus smooth muscle of the rat in vitro[J]. Eur J Pharmacol, 1989,162(1):29-36.
[10] Zittel TT, Meile T, Huge A, et al. Preoperative intraluminal application of capsaicin increases postoperative gastric and colonic motility in rats[J]. J Gastrointest Surg, 2001,5(5):503-513.
[11] 胡蓉,史孝敏,唐川康,等.小剂量辣椒素对大鼠内脏化学刺激敏感性的影响[J].中国新药与临床杂志,2016,35(10):746-750.
[12] Szolcsányi J. Effect of capsaicin on thermoregulation: an update with new aspects[J]. Temperature (Austin), 2015,2(2):277-296.
[13] Geng RH, Gao J, Li Z. TRP superfamily and functional gasrointestinal disorders[J]. Chin J Castroenterol, 2010,15(3):172-174.
[14] Akbar A, Yiangou Y, Facer P, et al. Increased capsaicin receptor TRPV1-expressing sensory fibres in irritable bowel syndrome and their correlation with abdominal pain[J]. Gut, 2008,57(7):923-929.
[15] De Winter BY, Bredenoord AJ, Van Nassauw L, et al. Involvement of afferent neurons in the pathogenesis of endotoxin-induced ileus in mice: role of CGRP and TRPV1 receptors[J]. Eur J Pharmacol, 2009,615(1-3):177-184.
彭燕(E-mail: 1806857826@qq.com)
10.3969/j.issn.1002-266X.2017.40.010
R573
A
1002-266X(2017)40-0035-04
2016-09-04)

