人卵巢癌裸鼠卵巢原位移植瘤模型的构建
詹光熙,彭书敏,美丽古丽·莫合买提,郭晓青*
(1石河子大学医学院,新疆 石河子,832003;2同济大学附属第一妇婴保健院,上海 200040)
人卵巢癌裸鼠卵巢原位移植瘤模型的构建
詹光熙1,彭书敏1,美丽古丽·莫合买提1,郭晓青2*
(1石河子大学医学院,新疆 石河子,832003;2同济大学附属第一妇婴保健院,上海 200040)
为探讨人卵巢癌进展机制的相关研究,构建适宜的体内动物模型。采用慢病毒转染技术,构建稳定过表达绿色荧光报告基因(GFP)的人EOC细胞模型:SKOV3(人卵巢浆液性腺癌细胞株)和ES-2(人卵巢透明细胞癌细胞株);异氟烷吸入麻醉4-6周龄BALB/C(nu/nu)雌性裸鼠,从裸鼠背部正中纵切口进入腹腔,显微多点注射法分别将细胞模型悬液,移植于裸鼠的单侧卵巢,每组6只裸鼠;NightOWL活体成像系统动态观察裸鼠移植瘤生长和转移情况;移植术后4-6周解剖裸鼠,取卵巢和转移瘤组织行HE染色。结果显示,携带GFP的EOC细胞模型SKOV3和ES-2,均可成功构建裸鼠卵巢原位移植瘤模型,裸鼠未发生手术原因死亡,成功率均100%;活体成像系统通过检测GFP的荧光强度和范围,能够动态监测裸鼠移植瘤生长情况;SKOV3细胞模型构建的卵巢癌和转移瘤组织,HE染色观察病理特征符合人卵巢浆液性腺癌;ES-2细胞模型构建的卵巢癌和转移瘤组织,HE染色观察病理特征符合人卵巢透明细胞癌。由此可知,异氟烷吸入麻醉、从背部正中纵切口进入腹腔、显微多点注射法移植携带GFP的EOC细胞模型,能成功构建可动态监测的裸鼠卵巢原位移植瘤动物模型;该动物模型与人卵巢癌生物学特征类似,适宜作为研究人卵巢癌演变进展的体内模型。
卵巢癌;裸鼠;卵巢原位移植瘤模型;显微多点注射法
卵巢癌是致死率最高的妇科恶性肿瘤[1],早期往往缺乏典型临床症状,且没有灵敏的标志物和筛选手段,约超过70%的病人在被确诊时已是疾病晚期,其5年生存率不到30%,极易发生侵袭、转移等生物学特性是导致其预后差、死亡率高的主要因素之一[2]。故深入研究卵巢癌侵袭转移的相关机制尤为重要。Fu等[3]在1993年首次建立了卵巢原位移植瘤裸鼠模型,相比体外细胞模型,该动物模型与人卵巢癌侵袭转移等生物学行为方面更为接近,故在研究卵巢癌相关研究中受到了广泛关注。虽然近年关于该动物模型的构建方法不断更新,但仍存在一定的缺陷。
因此,为探索更好的研究卵巢癌的进展演变的动物模型,本实验构建了携带绿色荧光报告基因(GFP)的人卵巢浆液性腺癌细胞株SKOV3和人卵巢透明细胞癌细胞株ES-2;显微多点注射法构建裸鼠卵巢原位移植瘤模型;借助NightOWL活体成像系统动态观察裸鼠移植瘤的生长和演变;证实该动物模型能较好的模拟人卵巢癌生物学特征,适宜作为研究人卵巢癌演变进展的体内模型。
1 材料与方法
1.1 材料
人卵巢浆液性腺癌细胞株SKOV3和人卵巢透明细胞癌细胞株ES-2均来自上海市第一妇婴保健院中心实验室。10%胎牛血清的RPMI1640培养液于37℃,5%CO2的培养箱中培养。RPMI培养基、PBS及胰酶均购自美国Hyclone公司,胎牛血清购自美国Gibco公司。GFP慢病毒购自上海和元生物技术)有限公司(合同编号:HYFW-lenti-610074HD,病毒滴度:2.55×108)。气体麻醉剂异氟烷购自河北九塔制药有限公司。
BALB/C(nu/nu)裸鼠,雌性,鼠龄4-6周龄,体重14~16 g,SPF(无特定病原体)级,购于同济大学实验动物中心,总共12只。恒温(25±2)℃,恒湿45%~50%,饲养于同济大学实验动物中心的净化空气层流架中。
手术用显微注射器购自瑞士哈美顿(Hamilton)(货号:80386)10 μL,32 G。显微持针镊(MY-R120201),眼睑拉钩(YZB020),精细手术剪(JA2603),圆柄无损伤镊子(MY-140202),眼科镊(JD1040),精细弹簧剪(MY-S121002),Dumont#5 镊 子 (508-1001),Dumont#7镊子(703-0702),以上器材均购自上海牧岩商贸有限公司。7-0外科缝合线购自上海浦东金环医疗用品股份有限公司,活体成像系统 (NightOWLⅡLB 983),影像分析软件(indigo)。
1.2 方法
1.2.1 携带GFP基因细胞系的构建
人卵巢癌细胞株SKOV3和ES-2细胞用含1%双抗、10%FBS RPMI1640培养液在 5%CO2培养箱中培养,待融合度为30%~40%时将带有GFP基因的慢病毒进行转染,病毒加药量(μL)=(细胞数×MOI值/病毒原液滴度)/103。并添加浓度为5ug/mL的感染增强剂Polybrene,病毒感染8 h后观察细胞状态并更换新的全培。转染72 h后置于倒置荧光显微镜下观察报告基因——绿色荧光蛋白(Green Fluorescent Protein,GFP)表达,以监测感染效率。取相同方法对人卵巢癌细胞株进行二次感染。
1.2.2 雌性裸鼠卵巢原位移植瘤的建立
携带GFP基因的SKOV3和ES-2细胞分别对6只雌性裸鼠进行卵巢原位移植。常规消化对数生长期的细胞模型,计数活细胞数量,并调整细胞浓度使每10 μL含1×106个细胞悬液置冰上待用。
异氟烷持续吸入麻醉4-6周龄无胸腺雌性裸鼠,俯卧位,固定四肢,消毒背部皮肤铺无菌洞巾,在裸鼠背部正中纵行剪开长约1 cm皮肤,向左侧牵拉皮肤,暴露左侧腹膜,显微无损伤镊轻轻提起腹膜后剪开进入腹腔,于左肾下极脂肪垫处找到卵巢子宫,显微无损伤镊小心牵拉出子宫卵巢于腹膜外,显微无损伤镊固定卵巢位置,显微注射器于卵巢处多点注射构建的EOC细胞模型悬液共5 μL,将卵巢囊还纳于腹腔,7-0可吸收线缝合关闭腹膜腔,取7-0可吸收缝线间断缝合皮肤,再次消毒皮肤,烤灯照射恢复裸鼠体温,复苏裸鼠,手术结束。将裸鼠送回SPF级环境下饲养,密切观察术后裸鼠的生长情况。
1.2.3 裸鼠卵巢原位移植瘤模型动态观察
裸鼠卵巢原位移植术后1周每日观察裸鼠一般状况、腹部张力及体重变化,进食、大小便、肤色、体重、生活规律等情况,1周后隔日观察。原位移植术后第2-4周,以每周一次的频率通过活体成像系统观察裸鼠卵巢原位移植瘤形成情况;在术后第5-6周,以每3 d一次的频率通过活体成像系统观察裸鼠卵巢原位移植瘤形成情况。
1.2.4 病理学检查
建模后依据裸鼠的一般情况,约4-6周后处死裸鼠;全面解剖裸鼠盆腹腔脏器及双肺组织,记录腹水量及性状;观察肿瘤形成、形态、浸润及转移情况,测量肿瘤体积及重量;无菌条件下留取裸鼠卵巢肿瘤组织,PBS冲洗,取部分组织-80℃冻存备用,另一部分置于中性甲醛液中固定、石蜡切片、HE染色镜下观察其细胞形态、组织学分型、细胞分级等。
2 结果
2.1 构建携带GFP基因的EOC细胞模型
倒置荧光显微镜下观察第1次慢病毒感染后的细胞,24 h可见少量绿色荧光,72h可见绿色荧光最多最亮,感染率约为80%。(图1a)第2次慢病毒感染后72小时,置于倒置荧光显微镜下观察,细胞绿色荧光感染率约为95%。(图1b)
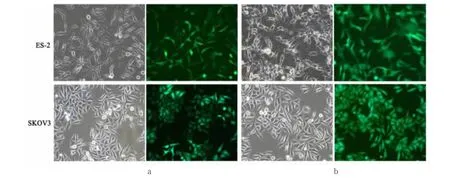
图1 慢病毒两次感染SKOV3和ES-2细胞的感染效率(×200)Fig.1 The infection efficiency of SKOV3 and ES-2 cells infected by lentivirus twice
2.2 雌性裸鼠卵巢原位移植瘤术后的活体成像观察
显微多点注射法完成裸鼠原位移植瘤手术 (图2)12/12只裸鼠在卵巢原位移植后第2周通过活体成像系统下可见肿瘤GFP蛋白的荧光,随着肿瘤的生长,荧光强度逐渐增强,面积逐渐增大。通过活体成像系统观察,两株肿瘤细胞在裸鼠体内的不同时期分别出现了不同程度的腹腔转移(图3)。
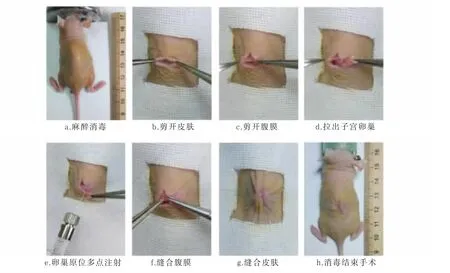
图 2 显微多点注射法构建裸鼠卵巢原位移植瘤模型手术经过Fig.2 Construction of nude mice orthotopic transplanted tumor model by micro multipoint injection
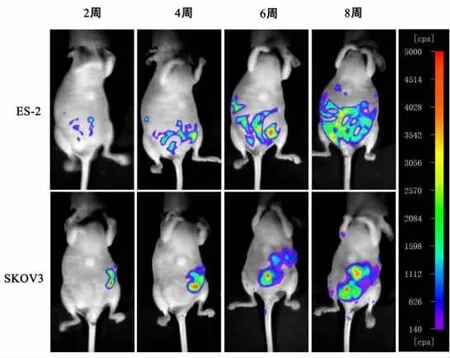
图 3活体成像系统动态观察不同时期两株卵巢癌细胞原位移植瘤模型肿瘤的发展情况Fig.3 In vivo imaging system dynamic observed the development in different stages of two ovarian cancer orthotopic xenograft tumor models
2.3 原位移植瘤组织学检查
解剖卵巢原位移植瘤术后第4-6周裸鼠,可见移植瘤大体外观:左侧卵巢已形成巨大瘤块,外观不规则,质硬,切面见大小不等的灰白色融合性团块。肉眼大体观察可见在SKOV3和ES-2细胞卵巢原位移植瘤裸鼠体内均出现了远处的肠系膜转移。将两株卵巢癌细胞原位移植瘤模型的卵巢原位肿瘤和肠系膜转移瘤行HE染色,显微镜观察可见正常的卵巢上皮细胞已经被肿瘤细胞替代,成片块状弥漫分布或排列成团状,细胞核大且深染,细胞分化程度低。SKOV3细胞模型构建的卵巢和转移瘤组织,HE染色观察病理特征符合人卵巢浆液性腺癌 (图4a);ES-2细胞模型构建的卵巢和转移瘤组织,HE染色观察病理特征符合人卵巢透明细胞癌(图4b)。

图4 原位移植瘤模型的解剖大体观和组织HE染色(×400)Fig.4 Anatomical general observation and tissue HE staining of orthotopic transplanted tumor model
3 讨论
卵巢癌是女性生殖系统三大恶性肿瘤之一,起病隐匿、侵袭转移率高,是导致其死亡率极高的主要原因。因此,深入研究卵巢癌发生发展的机制,从而改善其不良预后是目前临床亟待解决的难题。在卵巢癌组织学类型中,浆液性卵巢癌是最常见的组织学类型,其次是透明细胞卵巢癌,它们分别占上皮性卵巢癌的68%和12%[4]。虽然透明细胞癌在上皮性卵巢癌的总发生率并不高,但与其他组织类型的卵巢癌相比,透明性卵巢癌因具有先天的化疗耐药性,往往在接受手术后容易复发,不仅恶性程度更高,且化疗敏感性更低,即便接受联合铂类化疗药物的综合治疗,其预后一般也都较差[5]。本研究选取常用的人卵巢浆液性腺癌细胞株SKOV3和人卵巢透明细胞癌细胞株ES-2作为研究对象,具有较高的临床代表性;并且SKOV3和ES-2细胞的体外培养较为容易、对数生长周期较短,生物学特性稳定。
目前裸鼠卵巢癌移植瘤模型通常分为3种:皮下移植瘤模型,腹腔移植瘤模型,以及卵巢原位移植瘤模型[6]。皮下移植瘤模型能直观的观察肿瘤的形成情况,可用来检测肿瘤的增殖能力,但并不能模拟卵巢癌在腹腔内极易发生侵袭转移的临床特征。腹腔移植瘤模型较皮下移植瘤模型更接近卵巢癌的体内生长环境,且肿瘤在腹腔的播散以及腹水的形成均与临床上卵巢癌的临床症状相似,然而腹腔移植瘤模型并不能模拟卵巢癌侵袭转移的初始阶段,并不能模拟在此阶段激素微环境对肿瘤播散的影响。肿瘤的发生、发展不仅与基因突变相关,且与肿瘤细胞所在微环境相关。肿瘤细胞和肿瘤微环境、细胞外基质以及肿瘤血管形成等诸多条件的协同进化(co-evolution),促进了肿瘤的发生发展[7]。研究表明,卵巢癌的发生发展与雌激素水平相关[8-10],且卵泡刺激素能诱导卵巢癌发生上皮间质化(EMT)进而促进卵巢癌的远处播散转移[11]。因此在模拟卵巢癌肿瘤微环境和生物学行为等方面,卵巢原位移植瘤模型能够比另外两种模型更客观真实地反映卵巢癌生物学特性。
目前,GFP基因已被广泛应用于肿瘤成像模型[12-14]。本实验将携带GFP基因的卵巢癌细胞移植入雌性裸鼠卵巢内,借助体外活体成像系统的生物荧光成像法(BFI),利用荧光蛋白在外源光源发光照射下被激发产生的荧光作为检测信号,可动态监测肿瘤在体内的形成、生长以及转移情况。相较于荧光素酶报告基因法,该方法无需对实验裸鼠进行荧光底物注射,能减少对实验动物的损伤,同时GFP的荧光信号强度更高[15]。此外,相比于间断解剖以期连续观察肿瘤生长转移情况,本研究可在同一只裸鼠上达到与之相同的效果,能节省动物使用量、实验周期和经费。
目前,卵巢原位移植瘤模型构建方法主要有细胞悬液卵巢原位注射法和瘤块卵巢原位移植法[16-18]。后者方法操作过程较为复杂,对手术技能及手术器械的精度要求较高。且相较两种方法,前者其既能减少皮下移植成瘤所需的裸鼠数量,也能减少相应的建模时间。本研究也对细胞悬液卵巢原位注射法进行了改进,即通过显微注射法对卵巢由单点注射改为多点注射,该方法既可减少单点注射形成的囊泡导致的压力性溢出,亦可减少实验原因导致的种植播散。通过术后观察未发现贯穿、针道漏液等情况。同时实验中对手术部位的腹膜进行缝合关闭,能更大限度的减少误差并避免了人为种植播散等状况的发生。
本研究通过上述实验证实,采用异氟烷吸入麻醉雌性裸鼠、从裸鼠背部正中纵切口进入腹腔、显微多点注射法移植携带GFP的EOC细胞模型,能成功构建裸鼠卵巢原位移植瘤动物模型。该动物模型与人卵巢癌的生物学特征类似、能持续动态观察卵巢癌在裸鼠体内演变进展、节省裸鼠用量、缩短研究时间及科研成本,适宜作为研究卵巢癌的体内模型。该模型的构建,为进一步探索卵巢癌演变进展提供了较为客观可信的模型。
[1]Jayson,Gordon C,Kohn,et al.,Ovarian cancer[J].The Lancet,2014,384(9951):1376-1388.
[2]Davidson B,C G Tropé,R Reich,epithelial–mesenchymal transition in ovarian carcinoma[J].Frontiers in Oncology,2012,3(10):2.
[3]Fu X,R M Hoffman.Human ovarian carcinoma metastatic models constructed in nude mice by orthotopic transplantation of histologically-intact patient specimens[J].Anticancer Res,1993,13(2):283-286.
[4]Ramalingam P,Morphologic.Immunophenotypic molecular features of epithelial ovarian cancer[J].Oncology(Williston Park),2016,30(2):166-176.
[5]LopesCoelho F,Gouveia F S,GoncalvesL G,etal.,HNF1beta drives glutathione (GSH)synthesis underlying intrinsic carboplatin resistance of ovarian clear cell carcinoma(OCCC)[J].Tumour Biol,2016,37(4):4813-4829.
[6]Zhang H,Gao X,Yang Y,et al.New construction of an animal model for the orthotopic transplantation of an ovarian tumor[J].J Ovarian Res,2014,7(3):64.
[7]Junttila M R,F J Sauvage.Influence of tumour microenvironment heterogeneity on therapeutic response[J].Nature,2013,501(7467):346-354.
[8]Stratakis C A,Matyakhina.Endocrine/neuroendocrine glands:adrenal cortical carcinoma[J].Atlas of Genetics and Cytogenetics in Oncology and Haematology,2011,10(2):37.
[9]Konduri S,R E Schwarz.Estrogen receptor beta/alpha ratio predicts response of pancreatic cancer cells to estrogens and phytoestrogens[J].J Surg Res,2007,140(1):55-66.
[10]Setlur S R,Mertz K D,Hoshida Y,et al.,Estrogendependent signaling in a molecularly distinct subclass of aggres-sive prostate cancer[J].J Natl Cancer Inst,2008,100(11):815-825.
[11]Liu L,Zhang J,Fang C,et al.OCT4 mediates F S Hinduced epithelial-mesenchymal transition and invasion through the ERK1/2 signaling pathway in epithelial ovarian cancer[J].Biochem Biophys Res Commun,2015,461(3):525-532.
[12]Hoffman R M.The multiple uses of fluorescent proteins to visualize cancer in vivo[J].Nat Rev Cancer,2005,5(10):796-806.
[13]Hemann M T,Bric A,Teruya Feldstein J,et al.Evasion of the p53 tumour surveillance network by tumourderived MYC mutants[J].Nature,2005,436(7052):807-811.
[14]Mitsiades C S,Mitsiades N S,Bronson R T,et al.Fluorescence imaging of multiple myeloma cells in a clinically relevant SCID/NOD in vivo model:biologic and clinical implications[J].Cancer Res,2003,63(20):6689-6696.
[15]Hoffman R M,M Yang.Wholebody imaging with fluorescent proteins[J].Nature Protocols,2006,1(3):1429-1438.
[16]Yi C,Zhang L,Zhang F,et al.Methodologies for the establishment of an orthotopic transplantation model of ovarian cancer in mice[J].Front Med,2014,8(1):101-105.
[17]Zhang Y,Luo Li,Zheng Xueling,et al.An advanced orthotopic ovarian cancer model in mice for therapeutic trials[J].BioMed Research International,16(20),2016:1-4.
[18]Cordero A B,Kwon Y,Hua X,et al.In vivo imaging and therapeutic treatments in an orthotopic mouse model of ovarian cancer[J].J Vis Exp,2010,4(2):37-39.
Orthotopic construction of human ovarian carcinoma xenograft model in nude mice
Zhan Guangxi1,Peng Shumin1,Meiliguli Mohemaiti1,Guo Xiaoqing2*
(1 School of Medicine,Shihezi University,Shihezi,Xinjiang 832002,China;2 First Maternity and Infant Hospital Affiliated to Tongji University,Shanghai 200040,China)
To build a suitable animal ovarian cancer model in vivo,so as to study the mechanism of its progression.Lentivirus transfection technology was used to build a green fluorescent protein (GFP)marked EOC cells model:SKOV3 (human ovarian serous carcinoma cell lines)and ES-2 (human ovarian clear cell carcinoma cell lines).After isoflurane anesthesia,4-6 week old BALB/C(nu/nu)nude female,back into the abdominal cavity from the median longitudinal incision.Micro multipoint injection method was used to transplant suspension cell model in one side ovary;Night OWL vivo imaging system was used to dynamically observe the growth and metastasis of xenografts in nude mice.Nude mice were dissected at 4-6 weeks after transplantation,the ovarian and metastatic tissues were stained with HE.Both SKOV3 and ES-2 GFP positive cell model was successfully constructed with ovarian orthotopic xenograft.nude mice did not lead to surgical death,the success rate of orthotopic transplanted tumor model in nude mice was 100%.The in vivo imaging system can dynamically monitor the growth of a transplanted tumor in nude mice by detecting the fluorescence intensity and range of GFP.SKOV3 cell model was built-in ovarian canceer and metastatic tissues,HE staining pathological features consistent with human ovarian serous adenocarcinoma;ES-2 cell model was built-in ovarian cancer and metastatic tissues,HE staining pathological features consistent with human ovarian clear cell carcinoma.it can be concluded that inhalation of isoflurane anesthesia,middle of the back vertical incision into the abdominal cavity,micro multipoint injection of GFP-carrying EOC cell model,can be successfully constructed dynamic observation of ovarian orthotopic transplantation tumor in nude mice animal models.This animal model is similar to the biological characteristics of human ovarian cancer and is suitable as an in vivo model to study the development of human ovarian cancer.
ovarian cancer;nude mice;ovarian orthotopic transplanted tumor model;micro multipoint injection method
R711.75
A
10.13880/j.cnki.65-1174/n.2017.05.009
1007-7383(2017)05-0574-06
2017-01-15
国家自然科学基金项目(81372305)
詹光熙(1990-),男,硕士研究生,专业方向为妇产科学。
*通信作者:郭晓青(1966-),女,教授,从事妇科肿瘤研究,e-mail:Xiaoqing_Guo@163.com。

