大鼠体内清金固本胶囊中橙皮苷药代动力学分析
李 娜,李 玎,陈 萍
(1.陕西中医药大学,陕西 咸阳 712046; 2.陕西省中医药研究院,陕西 西安 710003)
研究
大鼠体内清金固本胶囊中橙皮苷药代动力学分析
李 娜1,李 玎1,陈 萍2
(1.陕西中医药大学,陕西 咸阳 712046; 2.陕西省中医药研究院,陕西 西安 710003)
目的建立测定大鼠灌胃清金固本胶囊后血清中橙皮苷含量的高效液相色谱(HPLC)法,并研究其在大鼠体内的药代动力学。方法SD大鼠灌胃给予清金固本胶囊,于不同时间采血,加甲醇沉淀蛋白后分离上清液进行检测,采用HPLC法检测血清中橙皮苷含量,流动相为0.1%磷酸水溶液(A)-70%乙腈(B),梯度洗脱,检测波长为283 nm,运用 DAS 2.1.1软件计算药代动力学参数。结果橙皮苷质量浓度线性范围为 0.1 ~ 1.1 g/m L(r=0.9964),定量下限为 0.1 g/m L,方法回收率为 94.76% ~101.55% ,稳定性试验结果良好;大鼠血清中橙皮苷主要药代动力学参数达峰时间(Tmax)为(1.00 ±0.31)h,药峰浓度(Cmax)为(0.53 ± 0.09)mg/L,0-t药时曲线下面积(AUC0-t)为(1.40 ± 0.03)mg /(L·h),0-∞ 药时曲线下面积(AUC0-∞)为(2.05 ± 0.29)mg/(L·h),消除半衰期(t1/2)为(68.10±13.12)h。结论该方法简便、快速、灵敏,适用于清金固本胶囊的药代动力学研究。
清金固本胶囊;橙皮苷;高效液相色谱法;药代动力学;大鼠
清金固本胶囊源自陕西省中医医院名中医曹丽萍主任的临床经验方,由黄芩、桔梗、茯苓、防风、陈皮、忍冬藤、枳壳、夏枯草、紫苏叶、炒白术、浙贝母、太子参、炒麦芽、甘草共14味中药组方,具有益气、清肺、化痰的功效[1],临床主要用于治疗气虚、痰湿阻肺型非小细胞肺癌等。方中陈皮为臣药,具有理气健脾、燥湿化痰功效[2],其有效成分为橙皮苷。橙皮苷具有抗炎、抑菌、抗病毒、调血脂、提高免疫力、抗肿瘤等多种功效[3-6];对肺癌具有拮抗作用,可诱导人非小细胞肺癌细胞凋亡,抑制非小细胞肺癌细胞生长,减轻转化生长因子-β1(TGF-β1)诱导的非小细胞肺癌细胞的上皮间质转化程度,阻止非小细胞肺癌的转移和扩散。本试验中采用高效液相色谱(HPLC)法对血清中橙皮苷的含量进行测定,研究大鼠灌胃清金固本胶囊后的药代动力学特征,为该复方制剂的临床应用提供依据。
1 仪器、试药与动物
1.1 仪器
Agilent 1260型高效液相色谱仪(包括G1311B型四元泵、G1329B型自动进样器、G1316A型柱温箱、G4212B型二极管阵列检测器和OpenLAB色谱数据工作站,美国安捷伦公司);KHXH-11型旋涡混合器(科华医疗器械有限限公司);TGL-18型台式高速冷冻离心机(长沙英泰仪器有限公司);BP211D型十万分之一电子分析天平(德国赛多利斯天平有限公司);HSC-24A型氮气吹干仪(天津恒奥科技有限公司);Synergy型超纯水系统(美国Millipore公司)。
1.2 试药
橙皮苷对照品(购自中国食品药品检定研究院,批号为110721-201316);清金固本胶囊(陕西省中医医院制剂中心提供,规格为 0.50 g/粒,批号分别为20150926,20151230,20160425);甲醇、乙腈为色谱纯(美国Fisher公司);水为超纯水,其他试剂均为分析纯(天津天力化学试剂有限公司)。
1.3 实验动物
SD 大鼠,SPF 级,雄性,2月龄,体质量(220±20)g,12只,购自西安交通大学医学部实验动物中心,合格证号为 SCXK(陕)2012-003。饲养条件:SPF实验室,室温22~24℃,相对空气湿度45% ~65%,普通饲料喂养,自由饮水,保持整洁。健康状况:活动、饮食、精神状况正常。动物实验均符合动物实验伦理委员会《实验动物福利伦理原则》的要求。
2 方法与结果
2.1 色谱条件
色谱柱:BostonGreenODS-C18柱(250mm ×4.6mm,5 μm);流动相:0.1% 磷酸水溶液(A)-70% 乙腈(B),梯度洗脱(0~10min,15% ~30%B;10~30min,30% ~70%B;30~35min,70% ~25%B;35~43min,25% ~15%B);检测波长:283 nm;流速:1.0mL /min,进样量:10μL;柱温:30℃。
2.2 溶液制备
称取橙皮苷对照品0.82 mg,精密称定,置100 m L容量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得质量浓度为8.20μg/m L的橙皮苷对照品溶液。取清金固本胶囊内容物适量,加纯化水超声溶解,使清金固本胶囊水溶液质量浓度为0.36 g/L,作为大鼠灌胃液。
2.3 血清样品处理
精密吸取大鼠血清200μL,加入甲醇1000μL,涡旋 1min,混匀,以 10000 r/min 的速率离心 10 min,吸取上清液,40℃以下氮气吹干,残渣加入200μL甲醇复溶,经0.45μm微孔滤膜滤过,即得,取续滤液进行测定。
2.4 方法学考察
专属性考察:分别精密吸取200μL空白血清、200μL含橙皮苷血清、200μL给药后血清,按2.3项下方法操作后,按2.1项下色谱条件进行测定,其色谱图见图1。在拟订色谱条件下,基线平稳,血清中橙皮苷的测定不受内源性物质的干扰,橙皮苷的保留时间为(17.66±0.1)min,峰形良好,说明该方法专属性良好。
标准曲线绘制和定量下限确定:取大鼠空白血清200μL,分别精密加入橙皮苷对照品溶液,使血清中橙皮苷含量分别为 0.1,0.3,0.5,0.7,0.9,1.1 μg /m L,按2.3项下方法操作,并按2.1项下色谱条件进行测定,记录峰面积。以橙皮苷峰面积(Y)为纵坐标、橙皮苷质量浓度(X)为横坐标进行线性回归,得回归方程 Y=37.27X+0.5354,r=0.9964(n=6)。结果表明,橙皮苷质量浓度线性范围为 0.1~1.1 μg/m L,定量下限为0.1 μg /m L。

图1 清金固本胶囊给药后血清的HPLC图
精密度试验:取适量橙皮苷对照品,加入空白血清中,按照 2.3项下方法配制低、中、高质量浓度(0.1,0.6,1.1 μg/m L)样品,每个质量浓度平行制备 5 份,按2.1项下色谱条件进行测定,以1 d内5次测定结果计算日内精密度,1周内连续3 d测定结果计算日间精密度。结果表明,日内精密度的 RSD分别为 3.72%,4.65% ,2.25%(n =5),日间精密度的 RSD 分别为5.83% ,4.71% ,2.11%(n = 3)。
稳定性试验:配制低、中、高质量浓度(0.1,0.6,1.1μg/mL)样品,每个质量浓度平行制备 3份样品,检测其在不同处理条件下的稳定性,分别于室温下放置0,2,4,8,12,24 h 时测定,考察样品在室温条件下的稳定性;置-20℃冰箱中反复冻融3次,考察冻融对样品稳定性的影响;于-80℃冰箱放置30 d后,考察样品冷冻放置的稳定性。结果见表1。橙皮苷在上述条件下稳定性良好。
方法回收率试验:取空白血清200μL,分别配制低、中、高质量浓度(0.1,0.6,1.1 μg /mL)样品,每个质量浓度平行制备3份,按2.1项下色谱条件测定峰面积,计算回收率。结果均满足实验要求,详见表2。
表1 稳定性试验结果( ±s,n=3)
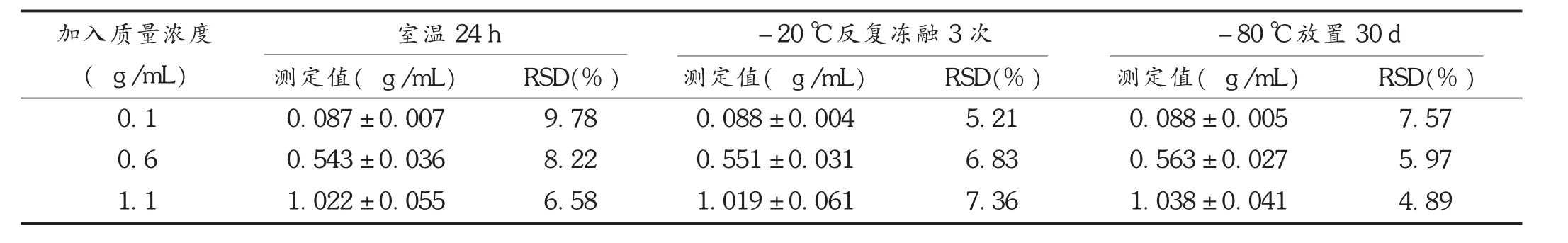
表1 稳定性试验结果( ±s,n=3)
加入质量浓度( g /m L)室温24 h-20℃反复冻融3次-80℃放置30 d 0.10.61.1测定值( g/mL)0.087 ± 0.0070.543 ± 0.0361.022 ± 0.055 RSD(% )9.788.226.58测定值( g/mL)0.088 ± 0.0040.551 ± 0.0311.019 ± 0.061 RSD(% )5.216.837.36测定值( g/m L)0.088 ± 0.0050.563 ± 0.0271.038 ± 0.041 RSD(% )7.575.974.89

表2 回收率试验结果(n=6)
2.5 药代动力学考察
取健康雄性大鼠12只,适应性喂养3 d后,实验前12 h禁食不禁水,大鼠腹腔注射10%乌拉坦麻醉,给药前从颈总动脉处取血0.6mL,给大鼠灌胃清金固本胶囊水溶液,分别于给药后 0.25,0.5,0.75,1,1.5,2,3,4,6 h时取血,由大鼠颈总动脉插管取血0.6mL,静置后,冷冻离心,取血清备用,操作方法同前。使用DAS 2.1.1软件对平均血药浓度-时间曲线进行拟合,大鼠血清中橙皮苷的血药浓度-时间曲线见图2,主要药代动力学参数见表3。

图2 大鼠血清中橙皮苷血药浓度-时间曲线图

表3 橙皮苷在体内的药代动力学参数(n=12)
3 讨论
文献报道,测定橙皮苷含量的方法有胶束毛细管电泳法[6]、高效毛细管电泳法[7-8]、HPLC 法[9-13]等。其中,HPLC法具有成本低和应用广泛的特点,故本试验中选用HPLC法测定清金固本胶囊灌胃后大鼠体内的目标成分。
血清样品预处理方法最常用的是蛋白沉淀法,本试验中选用甲醇和乙腈2种试剂,对各液相色谱峰进行比较,结果以甲醇沉淀蛋白得到的色谱峰响应较高,且采用5倍量甲醇沉淀蛋白效果比较好。
本试验中测定了大鼠灌胃清金固本胶囊后血清中橙皮苷含量,在较短时间内即可测得血清中橙皮苷,说明清金固本胶囊中橙皮苷在大鼠体内吸收较快。该复方制剂活性成分比较复杂,本试验中仅测定了清金固本胶囊中单一活性成分橙皮苷的血药浓度水平,其他活性成分有可能具有拮抗协同作用,因此后期需要进一步研究清金固本胶囊中其他活性成分的药代动力学特征,为该制剂的临床应用提供参考。
[1]李 玎,李 娜,张敏婕,等.清金固本胶囊质量控制方法研究[J].中国药业,2017,26(8):12-16.
[2]吴惠君,欧金龙,池晓玲,等.陈皮药理作用研究概述[J].实用中医内科杂志,2013,27(9):91-92.
[3]Kamaraj S,Ramakrishnan G,Anandakumar P,et al.Antioxidant and anticancer efficacy of hesperidin in benzo(a)pyrene induced lung carcinogenesis in mice[J].Investigational New Drugs,2009,27(3):214-222.
[4]陆红玲,丁学兵,刘达兴,等.橙皮苷诱导人非小细胞肺癌A549/DDP细胞凋亡的实验研究[J].时珍国医国药,2012,23(8):1925-1926.
[5]陆红玲,丁学兵,宋永祥,等.橙皮甙对人非小细胞肺A549/DDP 细胞增殖的影响[J].中国现代医学杂志,2012,22(26):42-46.
[6]任周新,余海滨,李 丽,等.橙皮苷TGF-1诱导的 A549非小细胞肺癌细胞上皮间质转化的影响[J].中国医院药学杂志,2017,37(8):690-693.
[7]杨 瑛,王实强,彭源贵.胶束电动毛细管电泳法测定柑橘属药材中柚皮苷和橙皮苷的含量[J].中草药,1999,30(3):181-184.
[8]韩丽萍,赵 玮,赵树进.高效毛细管电泳法测定藿香正气口服液中橙皮苷含量[J].中药材,2006,29(9):983-984.
[9]霍天凤.高效毛细管电泳法测定金果含片中橙皮苷的含量[J].中国实验方剂学杂志,2012,18(12):117-119.
[10]胡志军,陈建秋.HPLC测定不同基原陈皮药材中橙皮苷含量[J].中国实验方剂学杂志,2012,18(10):95-98.
[11]袁金斌,周志炎.HPLC测定陈皮提取物及制剂中橙皮苷的含量[J].中成药,2006,28(3):455-456.
[12]周 威,郁颖佳,谢美芬,等.微波辅助萃取-高效液相色谱法测定陈皮中橙皮苷含量[J].医药导报,2011,30(5):640-642.
[13]丁爱存,王 强,郎轶咏.痛风饮中橙皮苷、儿茶素和芒果苷在大鼠体内药代动力学实验[J].解放军药学学报,2016,32(4):314-317.
Pharm acokinetic Analysis of Hesperidin from Qingjin Guben Capsules in Rat Serum
Li Na1, Li Ding1, Chen Ping2
(1.Shaanxi University of Chinese Medicine, Xianyang, Shaanxi, China 712046; 2.Shaanxi Chinese Medicine Institute,Xi′an, Shaanxi, China 710003)
Objective To establish an HPLC method for content determination of hesperidin in rat serum after oral administration Qingjin Guben Capsules,and its pharmacokinetics in rats were also studied.Methods SD rats were given the Qingjin Guben Capsules by gavage,the blood was collected at different time,and the supernatant was separated and detected by adding methanol to precipitate protein.HPLC was used to determine hesperidin in rat serum,the mobile phase was 0.1% phosphoric acid aqueous solution(A)-70%acetonitrle(B)for gradient elution,the detection wavelength was 283 nm.DAS 2.1.1 software was used to calculate pharmacokinetic parameters.Results The linear range of hesperidin was 0.1-1.1 μg /m L(r= 0.9964),the quantitative lower limit was 0.1 μg/m L,the recovery rate of the method was 94.76%-101.55% ,and the result of stability test was good.The main pharmacokinetic parameters of hesperidin in rat serum were as follows:Tmaxwas (1.00 ±0.31) h,Cmaxwas (0.53 ±0.09) mg/L,AUC0-twas (1.40 ±0.03) mg/(L·h),AUC0-∞was (2.05 ± 0.29) mg /(L·h) and t1/2βwas (68.10 ± 13.12) h.Conclusion The method is simple,rapid and sensitive,which is suitable for the pharmacokinetic study of Qingjin Guben Capsules.
Qingjin Guben Capsules;hesperidin;HPLC;pharmacokinetics;rat
R284.1;R285.5
A
1006-4931(2017)24-0001-04
10.3969 /j.issn.1006-4931.2017.24.001
陕西省自然科学基础研究计划项目[13-LC128]。
李娜(1989-),女,在读硕士研究生,研究方向为中药质量评价及新药开发,(电子信箱)leetsena@163.com。
陈萍(1964-),女,大学本科,研究员,硕士研究生导师,研究方向为中药质量评价及新药开发,(电话)029-87251787(电子信箱)cp3049033@ 163.com。
2017-09-05)

