浙江省柑橘胶孢炭疽菌遗传多样性的ISSR分析
蒲占湑, 鹿连明, 黄振东, 胡秀荣, 杜丹超, 陈国庆
(浙江省柑橘研究所,浙江 台州 318020)
浙江省柑橘胶孢炭疽菌遗传多样性的ISSR分析
蒲占湑, 鹿连明, 黄振东, 胡秀荣, 杜丹超, 陈国庆
(浙江省柑橘研究所,浙江 台州 318020)
为了解柑橘炭疽病菌的种内遗传多样性,从32条ISSR引物中筛选出多态性好、条带清晰的5条引物,对28株炭疽病菌株进行ISSR-PCR扩增.结果显示:5条引物共扩增出43个条带,多态性条带41个,多态性比例为95.34%,说明柑橘炭疽病菌种内遗传多样性丰富.利用NTSYS软件分析并构建UPGMA聚类图,当相似系数为0.73时,28株菌可以分为5个类群,不同菌株间遗传变异较大,遗传变异与地域来源无显著的相关性.
胶孢炭疽菌; 遗传多样性; 简单重复序列区间
柑橘炭疽病是柑橘生产中普遍发生的具有潜伏侵染特性的真菌性病害,分布在热带、亚热带柑橘产区,如中国、美国、巴西、日本和阿根廷等国.胶孢炭疽菌(Colletotrichumgloeosporioides)是引起我国柑橘炭疽病的主要病原之一,不仅危害柑橘生长期的叶片、枝梢、果柄和果实,还可以引起贮运期果实腐烂[1-2].柑橘炭疽病在我国柑橘产区发生不同程度的危害,其中,广东、湖南、重庆、陕南和浙江等地近年来发病严重,一些地方品种的发病率达20%~60%[3-4].
ISSR(inter-simple sequence repeats,简单重复序列中间区域)标记技术是由Zietkiewicz et al[5]根据SSR(simple sequence repeats,简单重复序列)的特点创建的一种新型的微卫星类分子标记技术,目前广泛应用于许多病原微生物的遗传多样性分析、基因定位、进化及分子生态学的研究[6-8].国内外主要通过肌动蛋白、β-微管蛋白、钙调蛋白、甘油醛-3-磷酸脱氢酶、谷氨酸合成酶等基因序列分析技术进行柑橘炭疽病菌的遗传多样性分析与菌株鉴定[1,9-10].目前,我国尚未见采用ISSR分子标记技术研究柑橘炭疽病菌遗传多样性的报道.本研究采用该技术对浙江省不同来源的炭疽病菌株的遗传多样性进行分析,以期为该病原菌的鉴定和田间防治提供依据.
1 材料与方法
1.1 供试菌株
选择浙江省台州、衢州、丽水、嘉兴和韩国济州岛等柑橘产区具有柑橘炭疽病症状的叶片和果实进行分离,获得炭疽病菌株28株,经形态学和特异性引物的分子生物学方法鉴定为胶孢炭疽菌.具体菌株信息见表1.

表1 供试炭疽病菌株Table 1 Strains of C.gloeosporioides examined
1.2 模板DNA的提取
将胶孢炭疽菌接种在PDA平板上,25 ℃培养7 d后,用无菌牙签刮取菌丝体(约200 mg,带有少量培养基不影响DNA提取)放于高压灭菌后的研钵中,加入少量PVP(0.1 g组织可加0.02 g PVP),用液氮研磨成粉末状.采用改良的CTAB法,提取炭疽菌丝的DNA,提取的DNA经1.5%琼脂糖凝胶电泳检测,并用紫外分光光度计检测其浓度和纯度(λ=260 nm),稀释至50 ng·μL-1后贮存于-20 ℃冰箱中备用.
1.3 ISSR引物筛选及PCR扩增
选择加拿大不列颠哥伦比亚大学(University of British Columbia, Biotechnology Lab)已公布的32条ISSR引物(表2)对LC-02和JJ-4菌株进行ISSR-PCR扩增,最终筛选出稳定性好、条带清晰的ISSR引物,用于28株炭疽病菌的遗传多样性分析.
25 μL PCR反应体系:模板为20 ng,Mg2+浓度为2.0 mmol·L-1,引物浓度为0.4 μmol·L-1,dNTPs浓度为0.2 mmol·L-1,TaqDNA酶量为1 U,2.5 μL 10×Buffer,其余用去离子水补充.
反应条件:94 ℃预变性 5 min;94 ℃ 30 s,各引物最适退火温度下1 min,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min.反应结束后取10 μL扩增产物经1.5%琼脂糖凝胶电泳检测,在凝胶成像系统上拍摄保存.
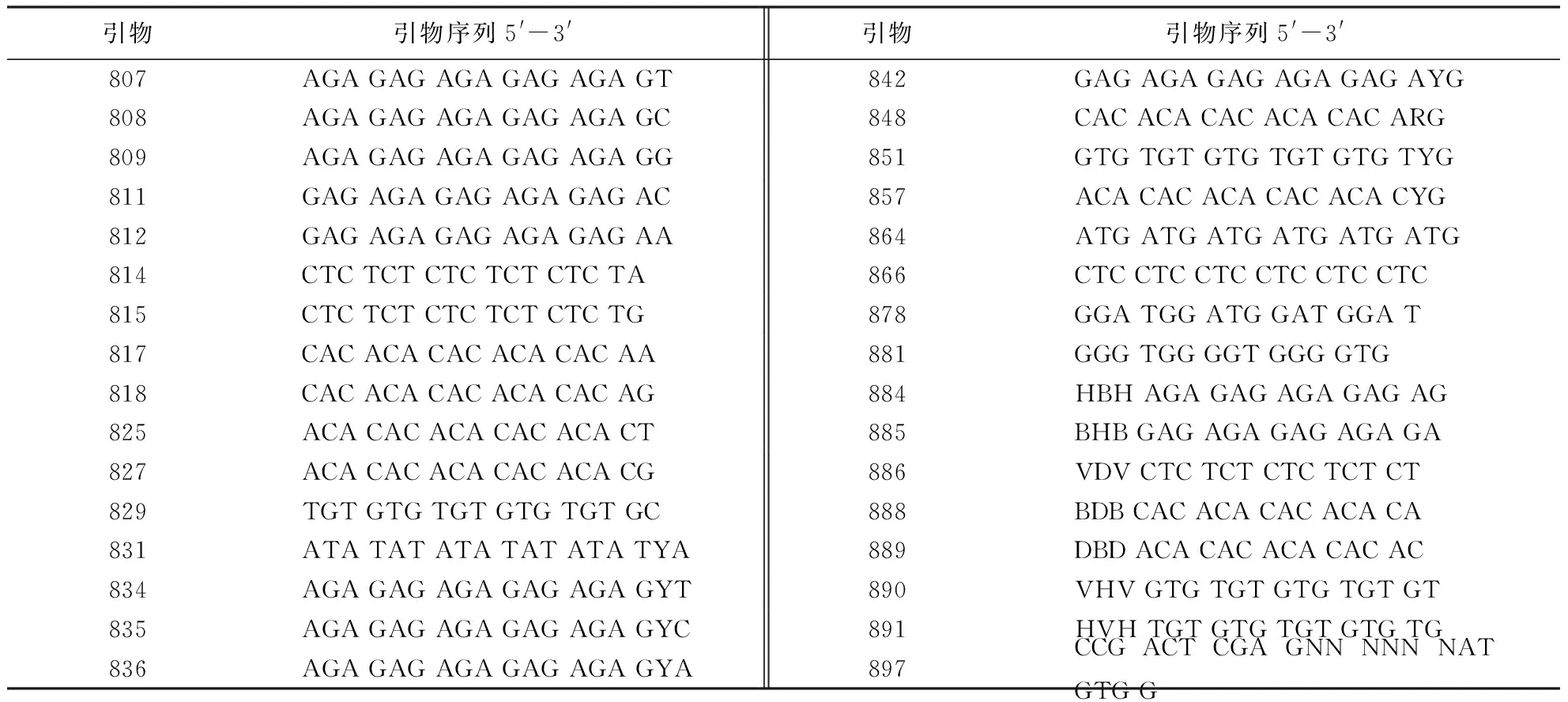
表2 筛选所用的32条ISSR引物Table 2 Primers of ISSR molecular markers
1.4 电泳谱带的记录及数据统计分析
对电泳条带进行统计,在同一位置有清晰条带的记为1,没有条带的记为0,统计为(0,1)-矩阵.利用NTSYS_pc(Rohlf 2000)数据处理软件测定遗传相似性系数,并构建UPGMA聚类树状图,分析遗传多样性与菌株地理来源的相关性.
2 结果与分析
2.1 引物筛选及ISSR-PCR扩增产物的检测
在32条ISSR引物中,筛选出5条稳定性好、条带清晰的引物(表3).应用这5条ISSR引物对28株炭疽病菌进行PCR扩增,可获得清晰的条带(图1A、B),共扩增出43个条带,大小为250~2 000 bp.其中,多态性条带41个,多态性比例平均为95.34%(表3),说明浙江省柑橘炭疽病菌具有丰富的遗传多样性.
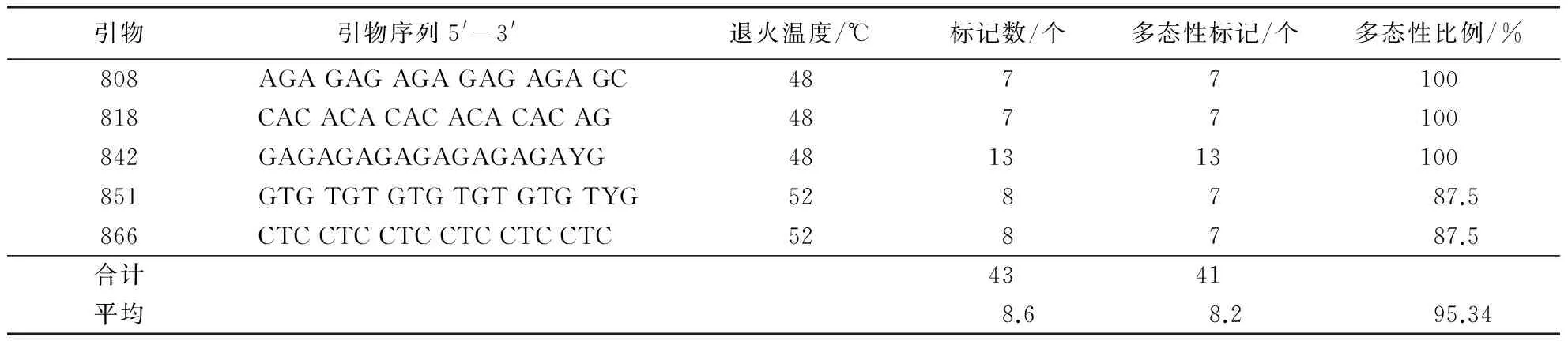
表3 5条引物对胶孢炭疽菌的ISSR-PCR扩增结果Table 3 ISSR-PCR amplification of C.gloeosporioides with 5 primers
2.2 基于ISSR-PCR反应的柑橘炭疽病菌的遗传多样性分析
应用NTSYS (Rohlf 2000)数据处理软件对ISSR-PCR反应的数据进行分析,并构建UPGMA聚类树状图(图2).在相似系数为0.73时,28株炭疽病菌可以分为5个群.类群Ⅰ由3个菌株组成,分别分离自韩国的2个菌株和衢州的1个菌株,占供试菌株总数的10.71%;类群Ⅱ包括衢州和临海的9个菌株,占32.14%;类群Ⅲ包括仙居、黄岩、椒江、衢州、丽水的13个菌株,占46.43%;类群Ⅳ仅为1个菌株;类群Ⅴ包括2个嘉兴的菌株.进一步分析发现,不同来源的菌株在聚类图中既有交叉也有聚类,说明柑橘炭疽病菌基于ISSR的多态性与菌株的地理来源没有显著的相关性.
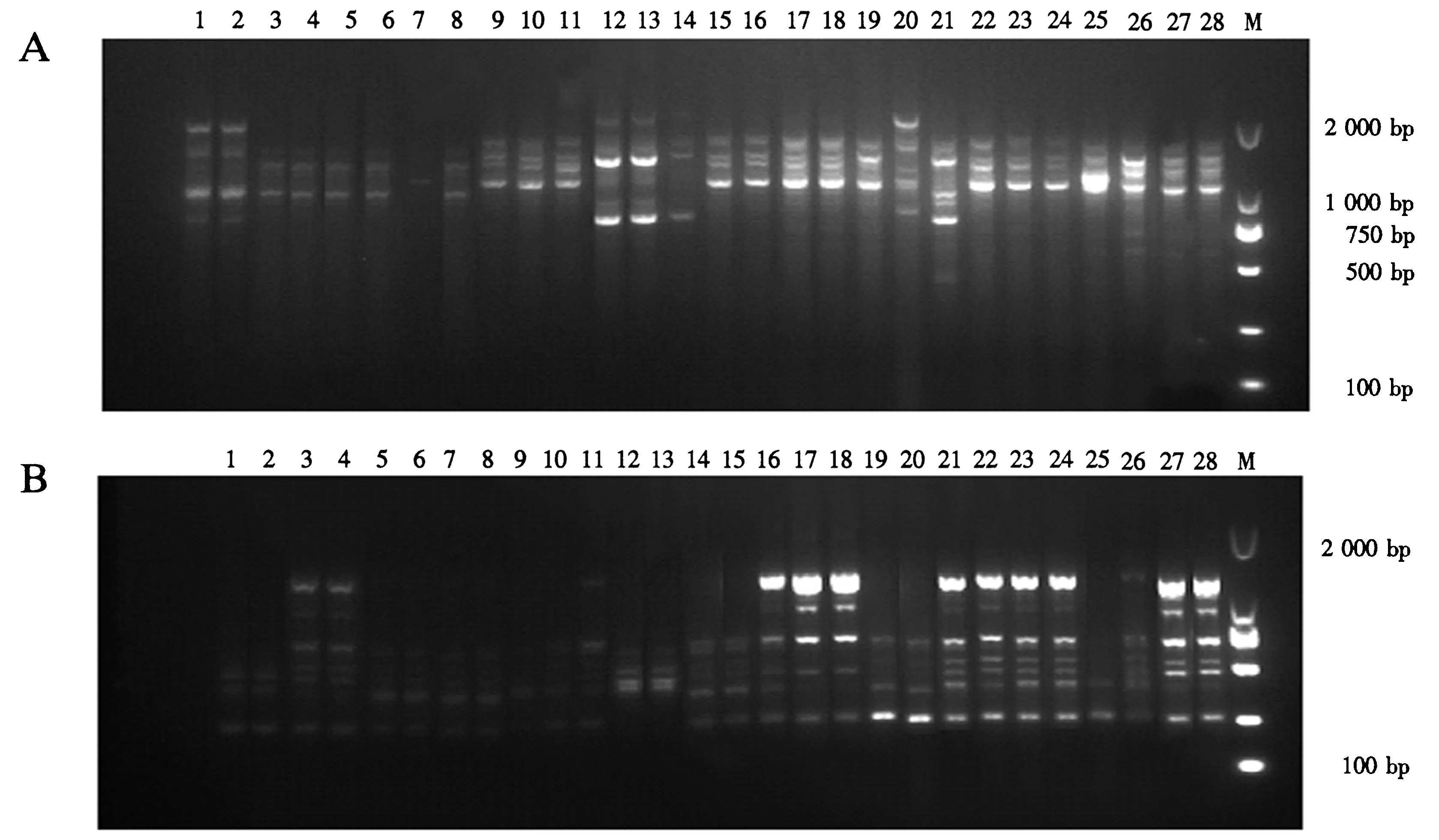
M.DNA Marker DL2000;1~28.菌株编号(见表1).图1 引物866(A)和851(B)对28株炭疽病菌的ISSR-PCR扩增结果Fig.1 ISSR-PCR amplification of 28 isolates of C.gloeosporioides with primer 866 (A) and primer 851 (B)

图2 28株柑橘炭疽病菌基于ISSR的UPGMA聚类分析结果Fig.2 UPGMA cluster analysis of 28 C.gloeosporioides isolates based on ISSR data
3 讨论
本研究采用ISSR分子标记技术分析了28株浙江省柑橘炭疽病菌的遗传多样性,结果表明,浙江省柑橘炭疽病菌种内具有丰富的遗传多样性,不同地理来源的菌株可分为5个类群,不同菌株间变异和分化程度较大,且与地理来源无显著的相关性.这可能是由于柑橘炭疽病具有潜伏侵染的特性,且健康的柑橘组织普遍带菌,可通过苗木、果实和接穗进行远距离传播.本试验结果与陈国庆[11]和徐红梅等[12]的研究结果相似.
地理来源、寄主种类等的差异是导致病原菌遗传多样性分化的重要因素.本研究结果显示,不同寄主种类与病原菌内在遗传多样性没有明显的相关性.然而,由于本试验的寄主种类较少,且大多数来自浙江省,寄主种植的自然环境和气候条件差异较小,研究结果可能不够全面.因此,有关寄主种类与病菌遗传多样性的相关性还需进一步研究.
[1] HUANG F, CHEN G Q, HOU X, et al.Colletotrichumspecies associated with cultivated citrus in China[J]. Fungal Diversity, 2013,61(1):61-74.
[2] 王震,杨媚,杨迎青,等.广东省柑橘炭疽病病原菌的形态与分子鉴定[J].菌物学报,2010,29(4):488-493.
[3] 彭埃天,宋小兵,唐小浪,等.德庆贡柑炭疽病的发生与防治初探[J].广东农业科学,2008(2):190-193.
[4] 刘干生,夏辉源,刘春初,等.柑桔果实炭疽病的危害与防治[J].中国南方果树,2005,34(5):19.
[5] ZIETKIEWICZ E, RAFALSKI A, LABUDA D. Genome fingerprint by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomics, 1994,20:176-183.
[6] 贺小伦,周海峰,袁虹霞,等.河南和河北冬小麦区假禾谷镰孢的遗传多样性[J].中国农业科学,2016,49(2):272-281.
[7] ZHANG X G, HAN T, HE Z G, et al. Genetic diversity ofCentellaasiaticain China analyzed by inter-simple sequence repeat (ISSR) markers: combination analysis with chemical diversity[J]. Journal of Natural Medicines, 2012,66(1):241-247.
[8] RAMPERSAD S N. Genetic structure ofColletotrichumgloeosporioidessensu lato isolates infecting papaya inferred by multilocus ISSR markers[J]. Phytopathology, 2013,103(2):182-189.
[9] PENG L J, YANG Y L, HYDE K D, et al.Colletotrichumspecies onCitrusleaves in Guizhou and Yunnan Provinces, China[J]. Cryptogamie, Mycologie, 2012,33(3):267-283.
[10] SILVA A O, SAVI D C, GOMES F B, et al. Identification ofColletotrichumspecies associated with postbloom fruit drop in Brazil through GAPDH sequencing analysis and multiplex PCR[J]. European Journal of Plant Pathology, 2016,147:1-18.
[11] 陈国庆.中国柑橘炭疽病病原种类及种群遗传多样性研究[D].杭州:浙江大学,2010.
[12] 徐红梅,管兰华,韩正敏.用RAPD标记研究中国木本植物胶孢炭疽菌的群体分化[J].东北林业大学学报,2001,32(6):55-57.
GeneticdiversityofColletotrichumgloeosporioidesfromZhejiangbyISSRmolecularmarkers
PU Zhanxu, LU Lianming, HUANG Zhendong, HU Xiurong, DU Danchao, CHEN Guoqing
(Citrus Research Institute of Zhejiang Province, Taizhou, Zhejiang 318020, China)
In order to understand the genetic diversity ofColletotrichumgloeosporioides, the primary pathogen for citrus anthracnose in tropical and subtropical China, 5 inter-simple sequence repeat (ISSR) primers, which were clearly amplified and highly polymorphic, were screened from 32 primers. Then the 5 primers were used to study the genetic diversity of 28 isolates. The result showed that 43 loci were amplified, which generated 41 polymorphic loci. The percentage of polymorphic loci was 95.34%, indicating an abundant genetic diversity. Referring to UPGMA dendrogram built by NTSYS software, 28 isolates were clustered into 5 clusters when the genetic similar coefficient was 0.73, indicating that the genetic differentiation of isolates was great, and it was not significantly correlated with geographical origin.
Colletotrichumgloeosporioides; genetic diversity; inter-simple sequence repeat
2017-03-08
2017-04-24
国家现代农业柑橘产业技术体系(CARS);浙江省台州市科技计划项目(14ny11).
蒲占湑(1982-),男,助理研究员,硕士.研究方向:植物保护.Email:puzhanxu@139.com.通讯作者黄振东(1969-),男,副研究员.研究方向:植物保护.Email:hyhzd121505@126.com.
S436.66
A
1671-5470(2017)06-0607-05
10.13323/j.cnki.j.fafu(nat.sci.).2017.06.002
(责任编辑:杨郁霞)

