RRM1单核苷酸多态性与非小细胞肺癌患者对吉西他滨化疗敏感性的相关性研究Δ
孟玲利,李晶,王艳娜,程艳芳,王慧,李娜,巩平(石河子大学医学院第一附属医院肿瘤内科,新疆石河子 832000)
·精准医疗·
RRM1单核苷酸多态性与非小细胞肺癌患者对吉西他滨化疗敏感性的相关性研究Δ
孟玲利*,李晶,王艳娜,程艳芳,王慧,李娜,巩平#(石河子大学医学院第一附属医院肿瘤内科,新疆石河子 832000)
目的:探讨核苷酸还原酶M1亚基(RRM1)的单核苷酸多态性(SNPs)与非小细胞肺癌(NSCLC)患者对吉西他滨化疗敏感性的相关性。方法:选取2014年8月-2016年7月我院NSCLC初治患者96例,均接受以吉西他滨为基础的两药联合化疗方案,连续化疗至少2个周期(每28 d为1个周期)。以完全缓解、部分缓解的患者总数与受试患者总数的比值来计算化疗敏感率;采用聚合酶链反应和直接测序法检测其RRM1基因型;分析患者不同基因型与化疗敏感性的相关性。结果:RRM1-37C>A的CC、CA、AA基因型分布频率分别为35.42%、52.08%、12.50%,-524C>T的CC、CT、TT基因型分布频率分别为18.75%、37.50%、43.75%,各基因型分布频率均符合Hardy-Weinberg平衡(P>0.05)。96例NSCLC患者的化疗敏感率为37.50%。患者的年龄、性别、民族、吸烟与否、TNM分期、病理类型、化疗方案和美国东部肿瘤协作组评分与化疗敏感性无关(P>0.05)。RRM1(-37CA)+(-524CT)、(-37CC)+(-524TT)基因型患者的化疗敏感率(57.14%、39.39%)均显著高于其他基因型患者(10.71%),差异均有统计学意义(P<0.05);而RRM1(-37CA)+(-524CT)与(-37CC)+(-524TT)基因型患者的化疗敏感率比较,差异无统计学意义(P>0.05)。结论:NSCLC患者RRM1的SNPs可作为评价吉西他滨化疗敏感性的预测因子,RRM1(-37CA)+(-524CT)和(-37CC)+(-524TT)基因型患者对该类化疗方案具有更高的敏感性。
非小细胞肺癌;核苷酸还原酶M1亚基;单核苷酸多态性;吉西他滨;化疗敏感性
肺癌已成为我国乃至全球发病率及病死率最高的恶性肿瘤。根据全国肿瘤登记中心的数据显示,2012年我国恶性肿瘤发病率及病死率最高的为肺癌,每年新发病例约70.5万,死亡病例约56.9万[1-2]。肺癌分为非小细胞肺癌(Non-small cell lung cancer,NSCLC)和小细胞肺癌(Small cell lung cancer,SCLC),其中NSCLC占肺癌的85%以上,且大部分患者就诊时已为晚期,失去手术机会,而靶向治疗和放疗也仅适用于少部分人群,化疗仍是NSCLC患者的主要治疗手段[3]。随着药物基因组学的发展,人们发现药物相关基因的单核苷酸多态性(Single nucleotide polymorphisms,SNPs)及其表达水平与化疗敏感性之间存在一定的相关性[4]。吉西他滨作为第三代新型化疗药物,可大大提高NSCLC患者的化疗敏感性,但其单药治疗的有效率仍仅为18%~35%;同时在临床工作中还发现,相同病理类型及分期的NSCLC患者可能对以吉西他滨为基础的化疗方案的敏感性存在很大差异[5]。研究证实,吉西他滨作用靶点核苷酸还原酶M1亚基(Ribonucleotide reductase M1,RRM1)编码基因的SNPs与NSCLC患者的化疗敏感性存在相关性[6]。鉴于此,本研究纳入NSCLC患者96例,通过测定RRM1-37C>A和-524C>T的多态性,分析其与患者对以吉西他滨为基础的化疗方案敏感性的相关性,以期为NSCLC患者的个体化治疗提供参考。
1 资料与方法
1.1 研究对象
选取2014年8月-2016年7月我院肿瘤内科收治的NSCLC初治患者96例,年龄18~72岁,平均年龄(59.9±8.4)岁。其中,男性77例,女性19例;维族36例,汉族60例;ⅢB期20例,Ⅳ期76例;鳞癌27例,腺癌69例;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~1分58例,2分38例。
纳入标准:(1)经病理学或细胞学诊断为NSCLC;(2)不适合治疗性手术或放疗;(3)经计算机断层扫描(Computed tomography,CT)或正电子发射计算机断层显像(Positron emission tomography-computed tomography,PET-CT)证实具有可测量的病灶;(4)卡氏评分≥60分,预计生存期≥3个月;(5)血常规、肝肾功能、电解质水平在化疗允许范围内;(6)未经系统性抗癌治疗,无需姑息性放疗,适合于以吉西他滨为基础的化疗。排除标准:(1)曾接受过放化疗者;(2)病理诊断不明者;(3)不能耐受、不愿继续配合化疗或失访者;(4)继发恶性肿瘤、全身性疾病或感染者。本研究方案经医院医学伦理委员会审核通过,所有患者均知情并签署知情同意书。
1.2 基因型检测与分析
所有患者均于化疗前抽取静脉血2 mL,置于乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)抗凝管中,于-80℃低温冰箱中保存,备用。采用DNA抽提试剂盒(北京天根生物科技有限公司)提取患者基因组DNA,使用Gene Amp 9700型聚合酶链反应(Polymerase chain reaction,PCR)仪(美国ABI公司),采用PCR法进行扩增。PCR引物由生工生物工程(上海)股份有限公司设计合成。RRM1-37位点上游引物:5′-CTGGACGGGGCGGCTGGACA-3′,下游引物:5′-TTGGCTACTGAAGACATGCTGG-3′,扩增片段大小为344 bp;RRM1-524位点上游引物:5′-GAGGGCAGTGAGAAACCAACGA-3′,下游引物:5′-CTCCTGCTACCATGTTTTGTGT-3′,扩增片段大小为624 bp。反应体系(50 μL)均含PCR Mix 22.5 μL,上、下游引物各 1 μL,DNA模板3 μL,加无酶水至50 μL。RRM1-37位点的反应条件:94℃预变性5 min,94℃变性10 s,72℃退火10 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸5 min。RRM1-524位点的反应条件:94℃预变性5 min,94℃变性30 s,60 ℃退火10 s,72 ℃延伸30 s,共35个循环;72℃再延伸5 min。所有产物均于-20℃下保存。使用3730 XL型测序仪(美国ABI公司)、采用直接测序法测定各患者的基因型,利用Chromas V1.45软件(http://technelysium.com.au/wp/)进行终点分析。
1.3 化疗方案
每次化疗前,应常规监测患者的血压、呼吸、脉搏、体温和血常规。所有患者均采用注射用盐酸吉西他滨(江苏豪森药业集团有限公司,批准文号:国药准字H20030104,规格:0.2 g)+顺铂注射液(江苏豪森药业集团有限公司,批准文号:国药准字H20010743,规格:20 mL∶20 mg)或注射用盐酸吉西他滨+注射用卡铂(齐鲁制药有限公司,批准文号:国药准字H10920028,规格:0.1 g)方案化疗。具体用法用量为:吉西他滨1 000 mg/m2,持续静脉滴注30 min,d1、d8+顺铂30 mg/m2,2 h内静脉滴注,d2~d4或卡铂[总剂量(mg)=设定药-时曲线下面积×(肌酐清除率+25)[7]],避光条件下静脉滴注,d1。以上方案均以28 d为1个周期,所有患者均连续治疗不少于2个周期。
1.4 疗效评价
疗效评价参照实体瘤疗效评价标准(Response evaluation criteria in solid tumours,RECIST)1.1版[8]——完全缓解(Complete response,CR):所有目标病灶消失,病理性淋巴结短径<10 cm;部分缓解(Partial response,PR):与基线病灶长径总和比较缩小30%;疾病进展(Progressive disease,PD):原靶病灶长径总和增加>20%,且原靶病灶长径总和的绝对值增加>5 mm;稳定(Stable disease,SD):基线病灶长径总和有缩小但未达PR,或有增加但未达PD。化疗敏感率(%)=(CR数量+PR数量)/患者总数×100%。
1.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,组间比较采用方差分析;计数资料以率表示,组间比较采用χ2检验。采用χ2检验考察RRM1各基因型分布是否符合Hardy-Weinberg平衡;采用χ2检验或Fisher确切概率法分析RRM1基因型与患者临床特征(包括年龄、性别、吸烟与否、TNM分期、病例类型、化疗方案和ECOG评分)的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 患者基因型分布
共检出RRM1-37C>A基因型3种,CC、CA、AA基因型的分布频率分别为35.42%、52.08%、12.50%;共检出RRM1-524C>T基因型3种,CC、CT、TT基因型的分布频率分别为18.75%、37.50%、43.75%。上述2个位点各基因型分布频率均符合Hardy-Weinberg平衡(P>0.05),表明受试群体基因遗传平衡,数据来自于同一孟德尔群体,具有较好的群体代表性,详见表1。
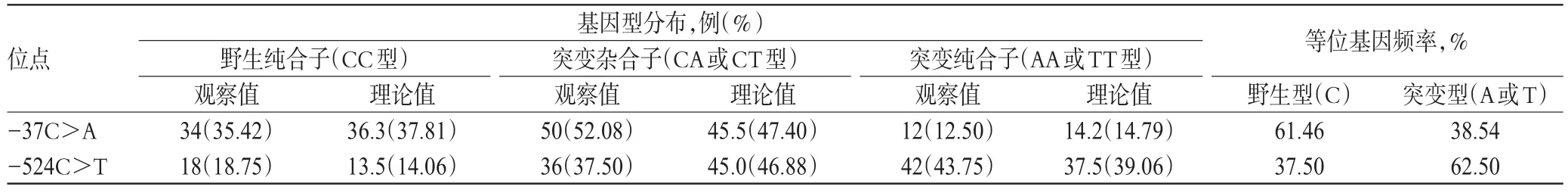
表1 NSCLC患者RRM1基因型分布Tab 1 Distribution of RRM1 genotype in NSCLC patients
2.2 患者临床特征与化疗敏感性
96例NSCLC患者中,CR 12例、PR 24例、SD 44例、PD 16例,对化疗方案敏感的有36例,化疗敏感率为37.50%。患者的年龄、性别、民族、吸烟与否、TNM分期、病理类型、化疗方案、ECOG评分等一般资料比较,差异均无统计学意义(P>0.05),详见表2。
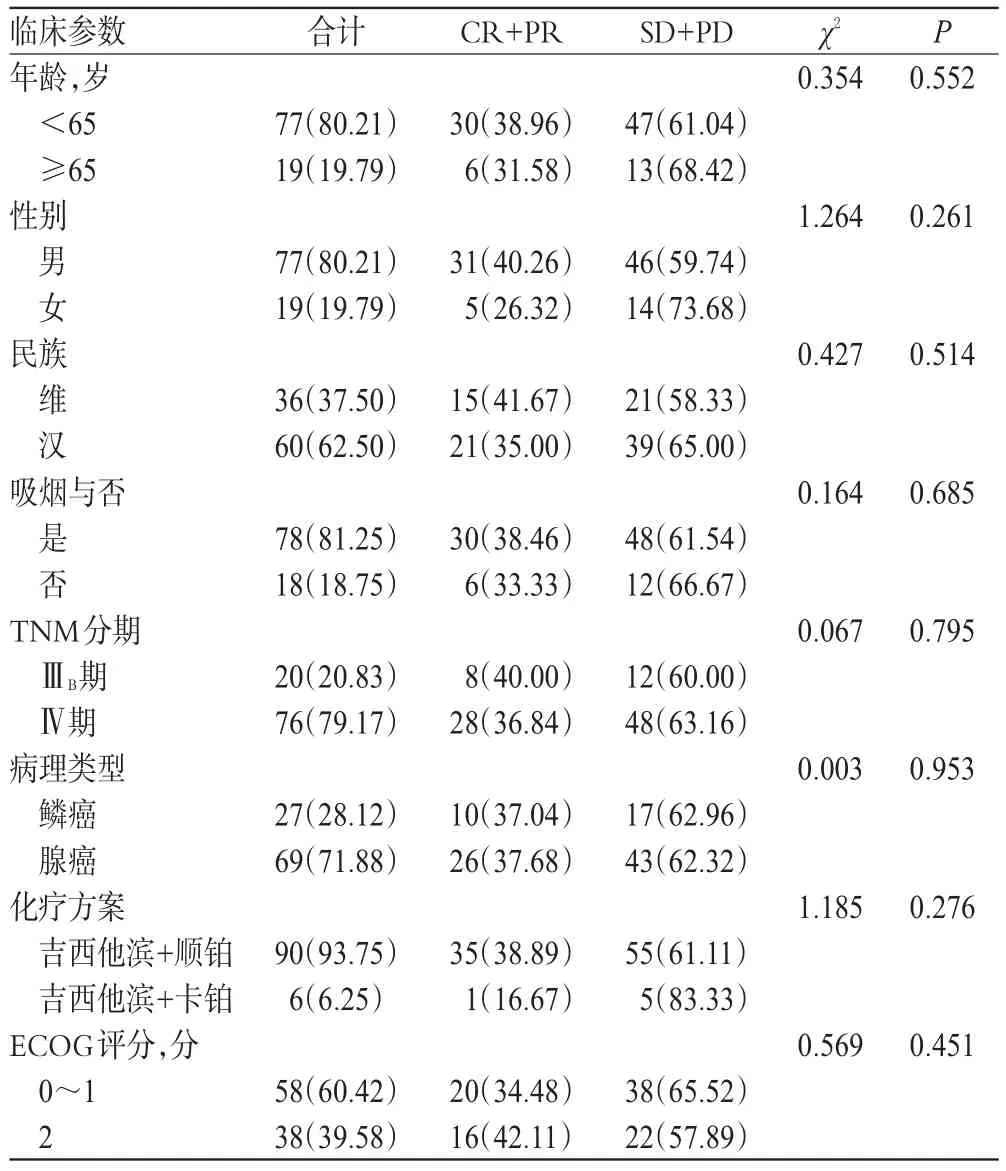
表2 NSCLC患者临床特征与吉西他滨化疗敏感性[例(%%)]Tab 2 The clinical characteristics and the sensitivity of gemcitabine chemotherapy in NSCLC patients[cas(e%%)]
2.3 患者RRM1基因型与化疗方案敏感性的相关性
[6]及受试患者的基因型类型,本研究比较了RRM1(-37CA)+(-524CT)、RRM1(-37CC)+(-524TT)和其他基因型患者的化疗敏感性。结果显示,在35例RRM1(-37CA)+(-524CT)基因型患者中,敏感的有20例,化疗敏感率为57.14%;33例RRM1(-37CC)+(-524TT)基因型患者中,敏感的有13例,化疗敏感率为39.39%;28例其他基因型患者中,敏感的有3例,化疗敏感率为10.71%。3种基因型NSCLC患者的化疗敏感率比较,差异有统计学意义(P<0.05)。两两比较结果显示,RRM1(-37CA)+(-524CT)、(-37CC)+(-524TT)基因型患者的化疗敏感率显著高于其他基因型患者,差异均有统计学意义(P<0.05);而 RRM1(-37CA)+(-524CT)与(-37CC)+(-524TT)基因型患者的化疗敏感率比较,差异无统计学意义(P>0.05),详见表3。
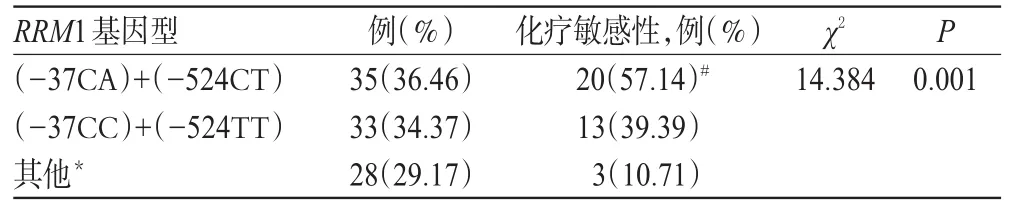
表3 NSCLC患者RRM1基因型与吉西他滨化疗敏感性的相关性Tab 3 The correlation between the genotype of RRM1 and sensitivity of gemcitabine chemotherapy in NSCLC patients
3 讨论
吉西他滨是90年代后期出现的第三代化疗药物,其出现使恶性肿瘤的化疗敏感率得到了很大程度的提升,也为NSCLC患者的化疗提供了新的选择[9]。吉西他滨本质上是一种嘧啶类细胞周期特异性抗代谢药,为胞嘧啶核苷衍生物,可与胞嘧啶竞争参与DNA的合成[10]。RRM1是目前已知的唯一一个使核糖核酸转变为脱氧核糖核苷酸的限速酶,可以调控DNA的聚合和修复[11]。Pereira S等[12]的研究表明,吉西他滨进入人体后所生成的活性代谢产物可抑制RRM1酶的活性,从而使DNA生成所必需的脱氧核苷三磷酸减少,导致DNA链合成终止、DNA断裂,最终诱导细胞死亡。上述研究表明,RRM1酶是吉西他滨的主要作用靶点,也是其发挥抗肿瘤作用的主要作用机制。
吉西他滨作为NSCLC治疗的一线用药,在临床上被广泛应用,但使用吉西他滨不可避免会出现耐药,甚至有些患者在初次使用时就表现出非常低的敏感性,这使得是否该选择吉西他滨成为困扰临床的难题[13]。Bepler G等[14]研究发现,对于仅进行单纯手术治疗的早期NSCLC患者而言,RRM1高表达者的生存期更长;而对于进展期NSCLC患者而言,RRM1低表达者的生存期更长。这使得RRM1表达水平的高低成为预测吉西他滨疗效的指标之一。但测定RRM1表达水平受到取材的限制,寻求更加准确和经济的方法来预测、评估吉西他滨的敏感性尤为重要。
SNPs指基因组DNA序列中频率>1%的单个核苷酸的变异,其差异将直接或间接地影响酶的生物功能[15]。SNPs可通过直接从全血(外周血白细胞、外周血淋巴细胞)标本中提取DNA进行测定,对于肿瘤组织难以获得或不可用的NSCLC患者,更加便捷、经济;除此之外,采用SNPs作为预测因子还具有结果恒定的优点[16]。相关研究表明,RRM1-37、-524位点的SNPs调控了启动子的活性,从而调控了RRM1的表达,影响了NSCLC患者对吉西他滨的敏感性,但具体的转录机制尚缺乏充分研究[17]。张璇等[11]的研究发现,RRM1-37位点AC基因型患者对以吉西他滨为基础的化疗方案具有更高的敏感性和更长的生存期。Mazzoni F等[16]进行了一项前瞻性的临床研究,检测首次确诊为NSCLC患者的RRM1基因型,并基于SNPs的情况将患者分为吉西他滨敏感[RRM1(-37AA)+(-524CC)以外的基因型]组和吉西他滨不敏感[RRM1(-37AA)+(-524CC)基因型]组,前者给予吉西他滨治疗,后者改用多西他赛。结果表明,患者的无进展生存期(Progression-free-survival,PFS)和总生存时间(Overall survival,OS)得到了明显延长,且鳞癌患者相比于腺癌患者更加受益于个体化治疗。Bepler G等[14]的研究表明,与其他基因型患者相比,RRM1(-37CC)+(-524TT)基因型患者具有更好的化疗缓解率和更长的PFS。而林莉等[18]则发现40例使用吉西他滨化疗的NSCLC患者的疗效及生存时间与RRM1-37位点的多态性无关(P分别为0.267、0.057)。因此,目前关于何种基因型携带者对吉西他滨化疗敏感性更高尚存有争议,这可能与研究样本量、研究地点、种族和试验方法的差异有关。
由于各基因型组合的患者数量差异较大,本研究在已有文献的基础上,初步比较了RRM1(-37CA)+(-524CT)、(-37CC)+(-524TT)和其他基因型患者对以吉西他滨为基础的化疗方案敏感性之间的差异。结果表明,在96例NSCLC患者中,RRM1(-37CA)+(-524CT)基因型患者的化疗敏感性最高,其次为RRM1(-37CA)+(-524TT)基因型患者,而RRM1(-37AC)+(-524CC)等其他4种基因型患者对吉西他滨的化疗敏感性最低,提示RRM1(-37CA)+(-524CT)和(-37CC)+(-524TT)两种基因型患者对以吉西他滨为基础的化疗方案具有较高敏感性,该种基因型组合可能通过调控RRM1的表达,使患者的化疗敏感性明显提高;同时,也提示RRM1的SNPs可作为评价以吉西他滨为基础的化疗方案敏感性的预测因子,且不同基因型患者对应的敏感性也有所差异。但本研究结果有异于Bepler G等[17]的研究,这可能与种族、样本量以及基因型测定方法不同有关。
综上所述,NSCLC患者RRM1的SNPs对使用以吉西他滨为基础的化疗方案的敏感性评价具有一定的预测价值,RRM1(-37CA)+(-524CT)和(-37CC)+(-524TT)基因型患者对该化疗方案具有更高的敏感性。通过测定NSCLC患者的RRM1基因型,对患者进行初筛,可在一定程度上提高使用以吉西他滨为基础的化疗方案的敏感率。但本研究仅能显示特定基因型组合患者对以吉西他滨为基础的化疗方案的敏感性,并未提示野生型和突变型对化疗敏感性的影响;其次,本研究并未发现NSCLC患者的性别、年龄、吸烟与否、TNM分期、病理类型、化疗方案及ECOG评分与吉西他滨化疗敏感性的相关性,这可能受到样本量的限制;再次,本研究由于周期尚短,并未对不同基因型NSCLC患者的预后进行分析,也并未对维吾尔族和汉族患者RRM1基因型分布的差异进行探讨,再加之入选的多为进展期NSCLC患者,故仍需大样本量、长时间的后续研究予以进一步证实。
参考文献
[1]World Health Organization.GLOBOCAN 2012:estimated cancerincidence,mortality and prevalence worldwide in 2012[EB/OL].(2014-01-09)[2014-07-01].http://globocan.iarc.fr/Pages/fact_sheets_population.aspx.
[2]陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[3]Maione P,Rossi A,Sacco PC,et al.Advances in chemotherapy in advanced non-small-cell lung cancer[J].Expert Opin Pharmacother,2010,11(18):2997-3007.
[4]周帆,辛华雯.药物基因组学与个体化治疗[J].中国药师,2011,14(11):1673-1677.
[5]于世英.吉西他滨用于非小细胞肺癌治疗的研究进展[J].中国癌症杂志,2001,11(4):367-370.
[6]Kim SO,Jeong JY,Kim MR,et al.Efficacy of gemcitabine in patients with non-small cell lung cancer according to promoter polymorphisms of the ribonucleotide reductase M1 gene[J].Clin Cancer Res,2008,14(10):3083-3088.
[7]杜春双,焦建杰,包乐纹,等.卡铂按不同AUC给药对晚期卵巢上皮癌患者药动学参数的影响[J].中国药房,2013,24(28):2637-2641.
[8]Jang GS,Kim MJ,Ha HI,et al.Comparison of RECIST version 1.0 and 1.1 in assessment of tumor response by computed tomography in advanced gastric cancer[J].Chin J Cancer Res,2013 ,25(6):689-694.
[9]梁会营.吉西他滨联合铂类与其它三代含铂双药方案治疗晚期非小细胞肺癌的疗效和毒性反应比较[D].沈阳:中国医科大学,2010.
[10]Li L,Schaid DJ,Fridley BL,et al.Gemcitabine metabolic pathway genetic polymorphisms and response in patients with non-small cell lung cancer[J].Pharmacogenet Genomics,2012,22(2):105-116.
[11]张璇.核糖核苷酸还原酶(RRM1)37位点基因多态性与晚期非小细胞肺癌患者GP化疗敏感性关系的研究[D].
锦州:辽宁医学院,2012.
[12]Pereira S,Fernandes PA,Ramos MJ.Mechanism for ribonucleotide reductase in activation by the anticancer drug gemcitabine[J].J Comput Chem,2004,25(10):1286-1294.
[13]信文.RRM1基因多态性与进展期胰腺癌患者吉西他滨化疗敏感性及毒副作用的研究[D].天津:天津医科大学,2014.
[14]Bepler G,Sharm S,Cantor A,et al.RRM1 and PTEN as prognostic parameters for overall and disease-free survival in patients with non-small cell lung cancer[J].Clin Oncol,2004,22(10):1878-1885.
[15]张静.DNA损伤修复基因多态与苯作业工人遗传损伤易感性关系的研究[D].乌鲁木齐:新疆医科大学,2012.
[16]Mazzoni F,Cecere FL,Meoni G,et al.PhaseⅡtrial of customized first line chemotherapy according to ERCC1 and RRM1 SNPs in patients with advanced non-small cell lung cancer[J].Lung Cancer,2013,82(2):288-293.
[17]Bepler G,Zheng Z,Gautam A,et al.Ribonucleotide reductase M1 gene promoter activity,polymorphisms,population frequencies,and clinical relevance[J].Lung Cancer,2005,47(2):183-192.
[18]林莉,刘晓晴,宋三泰,等.肺癌患者RRM1(-37)位点基因多态性及其与临床相关性的研究[J].中国肺癌杂志,2008,11(6):784-788.
Study on the Correlation between RRM1 Single Nucleotide Polymorphisms and Chemotherapy Sensitivity of NSCLC Patients for Gemcitabine
MENG Lingli,LI Jing,WANG Yanna,CHENG Yanfang,WANG Hui,LI Na,GONG Ping(Dept.of Oncology,the First Affiliated Hospital,Shihezi University School of Medicine,Xinjiang Shihezi 832000,China)
OBJECTIVE:To investigate the correlation between ribonucleotide reductase M1 subunit(RRM1)single nucleotide polymorphisms(SNPs)and chemotherapy sensitivity of patients with non-small cell lung cancer(NSCLC)for gemcitabine.METHODS:A total of 96 NSCLC patients receiving primary treatment selected from our hospital during Aug.2014-Jul.2016 were all accepted gemcitabine-based two-drug chemotherapy plan,with continuous treatment for at least 2 cycles(28 d as a cycle).Chemotherapy sensitivity rate was calculated by using the ratio of the sum of patients with complete response and partial response to the sum of test patients.RRM1 genotype was tested by PCR and direct sequencing.The correlation between different genotypes and chemotherapy sensitivity was analyzed.RESULTS:Distribution frequency of RRM1-37C>A CC,CA,AA genotype were 35.42%,52.08%,12.50%,respectively;distribution frequency of-524C>T CC,CT,TT genotype were 18.75%,37.50%,43.75%,respectively.The frequency of each genotype was in the line with Hardy-Weinberg equilibrium(P>0.05).Chemotherapy sensitivity rate of 96 NSCLC patients was 37.50%.The patient’s age,sex,ethnicity,smoking or not,TNM stage,pathological type,chemotherapy plan,and the Eastern American Oncology Collaboration score were not associated with chemotherapy sensitivity(P>0.05).Chemotherapy sensitivity rates of RRM1(-37CA)+(-524CT)genotype and(-37CC)+(-524TT)genotype patients(57.14%,39.39%)were significantly higher than those of other genotype patients(10.71%),with statistical significance(P<0.05).There was no statistical significance in chemotherapy sensitivity rate between RRM1(-37CA)+(-524CT)and(-37CC)+(-524TT)genotype patients.CONCLUSIONS:In NSCLC patients,the SNPs of RRM1 can be used as predictive factor for the sensitivity of gemcitabine chemotherapy,and RRM1(-37CA)+(-524CT)and(-37CC)+(-524TT)genotype patients have higher sensitivity to this type of chemotherapy.
Non-small cell lung cancer;Ribonucleotide reductase M1 subunit;Single nucleotide polymorphisms;Gemcitabine;Chemotherapy sensitivity
R734.2
A
1001-0408(2017)35-4897-05
DOI10.6039/j.issn.1001-0408.2017.35.01
国家自然科学基金资助项目(No.81560381)
*硕士研究生。研究方向:肿瘤化疗、生物免疫治疗。电话:0993-2812389。E-mail:786415618@qq.com
#通信作者:主任医师,教授,博士。研究方向:肿瘤综合治疗、药物敏感性评价。电话:0993-2812389。E-mail:18999536479@163.com
2017-01-04
2017-10-15)
(编辑:张元媛)

