英夫利西单抗治疗克罗恩病的疗效、安全性观察及影响因素分析Δ
陈禾凤,杨婉花,姚玮艳(1.上海交通大学医学院附属瑞金医院药剂科,上海0005;.上海交通大学医学院附属瑞金医院消化内科,上海 0005)
英夫利西单抗治疗克罗恩病的疗效、安全性观察及影响因素分析Δ
陈禾凤1*,杨婉花1#,姚玮艳2(1.上海交通大学医学院附属瑞金医院药剂科,上海200025;2.上海交通大学医学院附属瑞金医院消化内科,上海 200025)
目的:观察英夫利西单抗(IFX)治疗克罗恩病(CD)的疗效和安全性,探讨其影响因素。方法:采用回顾性研究法,选择2015年1-12月于我院住院行IFX治疗的CD患者120例作为研究对象。所有患者均给予注射用IFX 5 mg/kg静脉滴注,分别于0、2、6周及以后每隔8周给予相同剂量,持续用药。比较患者用药前后的体质量、C反应蛋白(CRP)、红细胞沉降率(ESR)、白细胞计数(WBC)、内镜下黏膜愈合情况等疗效指标,丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(AKP)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(TB)、直接胆红素(DB)、尿肌酐(Cr)等肝肾功能指标,以及ADR发生时间、累及器官/系统、临床表现和转归;分析其影响因素。结果:与用药前比较,患者用药后的体质量显著增加,ESR显著下降,差异均有统计学意义(P<0.05);且二者变化值呈显著正相关(r=0.275,P=0.016)。78.57%的患者经肠镜评估示黏膜愈合。患者用药前后的AST、AKP和Cr比较,虽然差异均有统计学意义(P<0.05),但升高幅度较小,AST均未超过正常值上限2倍,AKP仅1例超过正常值上限2倍,Cr均未超过正常值上限。患者用药前后的CRP、WBC及其余肝肾功能指标比较,差异均无统计学意义(P>0.05)。24例患者有ADR记录,发生率为20.00%,累及呼吸、消化、皮肤黏膜、机体防御等器官/系统,多表现为上呼吸道感染、肝功能指标异常等;其中10例(41.67%)因ADR延迟给药,6例(25.00%)停药。规律/首次用药患者的ESR达标率(78.21%)高于有间歇用药史者(57.14%),但差异无统计学意义(P>0.05);合用美沙拉嗪对患者AST、AKP水平是否上升有显著影响(P=0.002)。结论:IFX可显著增加CD患者体质量、降低ESR、改善黏膜愈合情况,疗效明确。建议CD患者规律使用IFX。IFX总体安全性良好,但可能引起输液反应、肝功能指标短暂升高,故输液期间应严密监测患者情况,尤其是对有合并用药(美沙拉嗪等)的患者应监测肝功能。
英夫利西单抗;克罗恩病;疗效;安全性;影响因素
克罗恩病(CD)是一种慢性非特异性疾病,与溃疡性结肠炎统称为炎症性肠病(IBD)。该病好发于青壮年,可累及消化道各部位,临床表现常见腹痛、腹泻、肠梗阻,并发症多,且反复发作、迁延不愈,严重影响患者的生存质量。英夫利西单抗(IFX)是首个用于治疗CD的生物制剂[1],适用于传统治疗效果不佳的中重度活动性CD和瘘管型CD[2]。自2007年IFX于我国上市,已积累了一部分治疗风湿性疾病的临床观察报道[3-4],但治疗IBD的相关报道有限[5],且以CD患者为研究对象的临床观察例数通常较少。本研究回顾性分析了120例IFX治疗CD的临床疗效及药品不良反应(ADR),以期为临床合理用药提供依据。
1 资料与方法
1.1 纳入与排除标准
纳入标准:临床诊断和用药方案符合《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[6]、《英夫利西治疗克罗恩病的推荐方案(2011年)》[7]、《建立我国炎症性肠病诊治中心质量控制指标的共识》[8]。
排除标准:有活动性感染、肠道CD合并纤维狭窄性梗阻且不伴有炎性反应活动证据的患者。
1.2 研究对象
按照上述标准,纳入2015年1-12月(设为“观察期”)于我院住院行IFX治疗的120例CD患者的病历。其中,男性79例(65.83%),女性41例(34.17%);年龄≤16岁者11例,17~40岁者99例,>40岁者10例,平均年龄(27.93±8.96)岁;病变部位:回肠末段47例,结肠15例,回结肠58例;25例合并瘘管;2例累及上消化道;31例有IBD相关手术史;2例合并强直性脊柱炎;94例为观察期内启用IFX,17例为观察期前已开始规律应用IFX,9例有间歇给药史(即观察期前有IFX用药史,停药半年以上,重新按0、2、6周开始给药);IFX给药次数为1~8次/人,共计(576±1.46)次,平均(4.81±1.46)次/人;有52例患者同时联用美沙拉嗪、硫唑嘌呤、甲氨蝶呤或糖皮质激素等其他IBD治疗药物,其中43例联合1种药物、7例联合2种药物、2例联合3种药物。
1.3 治疗方法
所有患者均给予注射用IFX(商品名:类克,荷兰Janssen Biologics B.V.,注册证号:S20120012,规格:100 mg/支)5 mg/kg静脉滴注,分别于0、2、6周及以后每隔8周给予相同剂量,持续用药。每支药品用10 mL无菌注射用水溶解,再用0.9%氯化钠注射液稀释至250 mL;滴注时间不得少于2 h。
1.4 观察指标
通过医院信息系统查阅患者病历,结合国家《药品不良反应/事件报告表》,使用Excel 2007软件记录患者的性别、年龄、诊断、过敏史、IFX用药史、合并用药、IFX给药次数及每次给药剂量等一般资料,体质量、C反应蛋白(CRP)、红细胞沉降率(ESR)、白细胞计数(WBC)、内镜下黏膜愈合情况等疗效指标,丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(AKP)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(TB)、直接胆红素(DB)、尿肌酐(Cr)等肝肾功能指标,以及ADR发生时间、临床表现和转归。其中,若所测指标值高于正常值上限则标为“异常”,异常率=用药后指标异常例数/总例数×100%。ADR按现行的《药品不良反应报告和监测管理办法》[9]进行相关性及严重程度评估。因患者持续用药,本研究中“用药后”指的是观察期内最后一次用药后。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以x±s表示,根据是否符合正态分布采用t检验或非参数秩和检验;计数资料以例数或百分比表示,采用χ2检验或Fisher确切概率检验;相关性分析采用Pearson和Spearman分析。P<0.05为差异有统计学意义。
2 结果
2.1 疗效指标
与用药前比较,患者用药后的体质量显著增加(P<0.001),ESR显著下降(P=0.018),差异均有统计学意义;用药前后的CRP和WBC比较,差异均无统计学意义(P>0.05)。相关性分析结果表明,ESR变化值与体质量变化值呈显著正相关(r=0.275,P=0.016)。CRP、ESR、WBC的异常率从用药前的25.00%~38.61%下降至用药后的3.26%~23.53%。14例患者于6次用药后再次行肠镜评估,有11例(78.57%)示黏膜愈合。患者用药前后疗效指标比较见表1。
2.2 肝肾功能指标
用药前,患者肝肾功能指标的异常率仅为0~3.96%;用药后,除Cr外所有肝肾功能指标的异常率均有上升,为3.03%~9.59%。患者用药前后的AST(P=0.029)和AKP(P=0.006)比较,差异均有统计学意义;用药前后的Cr比较,差异虽然也有统计学意义(P=0.010),但均未超过正常值上限(97 μmol/L),故异常率为0;其余肝肾功能指标比较,差异均无统计学意义(P>0.05),详见表2。
2.3 ADR
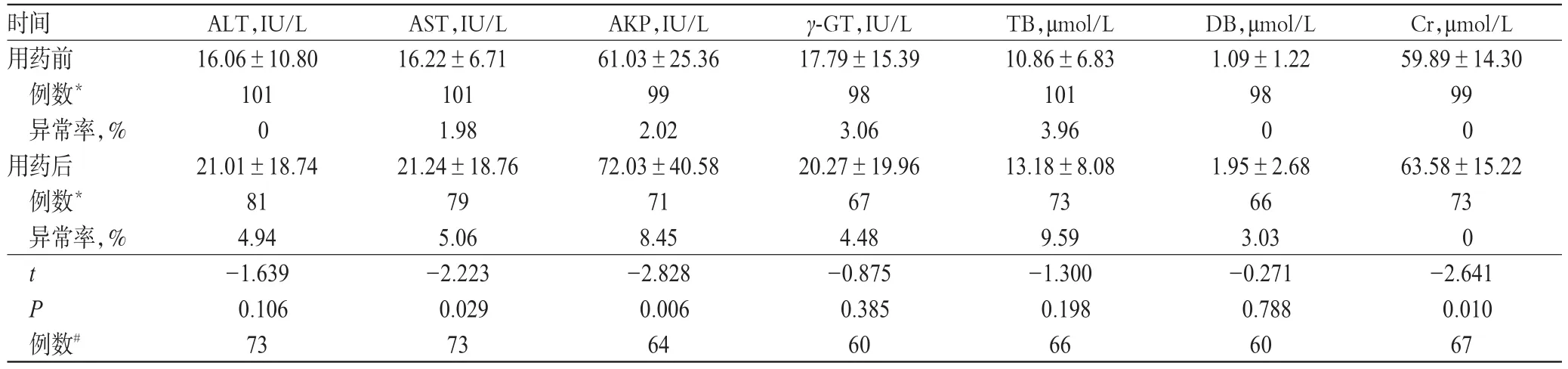
表2 患者用药前后肝肾功能指标比较(x±s)Tab 2Comparison of liver and renal function indexes before and after medication(x±s)
2.3.1 基本情况 24例患者的病历中有ADR记录,发生率为20.00%(24/120)。其中,在第2、3次用药后有10例(41.67%)患者发生ADR,在第1、5次用药后各有4例(16.67%)患者发生ADR,其他ADR发生时间分别为第4次(3例,12.50%)、第6次(2例,8.33%)、第9次(1例,4.17%)用药后;有7例(29.17%)ADR在用药后1 d内发生。ADR临床表现涉及呼吸、消化、皮肤黏膜、机体防御等器官/系统,详见表3。
2.3.2 临床转归 24例发生ADR的患者中,10例(41.67%)因ADR而延迟给药,6例(25.00%)停药[其中5例为皮肤黏膜及心血管系统相关ADR(20.83%)]。5例(20.83%)未作处理自行好转;19例(79.17%)使用药物对症处理,其中5例(20.83%)因ADR住院检查、治疗或留院观察,延长住院时间1~18 d。经处理后,患者ADR症状均较前有所改善,复查指标基本恢复正常;仅有1例存在反复血压波动,出院后经门诊随访治疗后病情稳定。
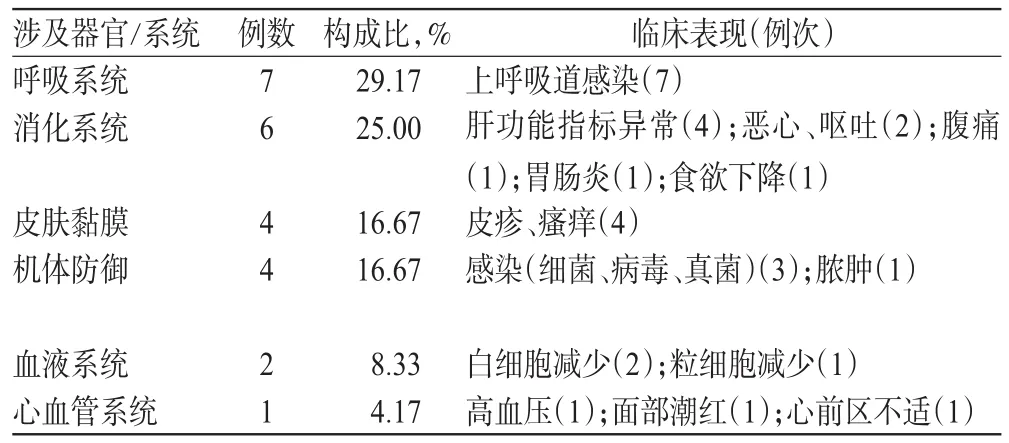
表3 IFX致ADR累及器官/系统及临床表现Tab 3 Organs/systems involved in IFX-induced ADR and clinical manifestations
2.4 影响因素分析
ESR、体质量及肝肾功能影响因素分析结果分别见表4、表5。由表4可知,虽然差异无统计学意义(P>0.05),但规律/首次用药患者的ESR达标率为78.21%(61/78),高于有间歇用药史者(57.14%,4/7);规律/首次用药患者的体质量增加率也较有间歇用药史者更高[72.73%(80/110)vs.44.44%(4/9)]。由表5可知,合用美沙拉嗪对患者AST、AKP水平是否上升有显著影响(P=0.002),其他因素对患者肝肾功能的影响不显著。
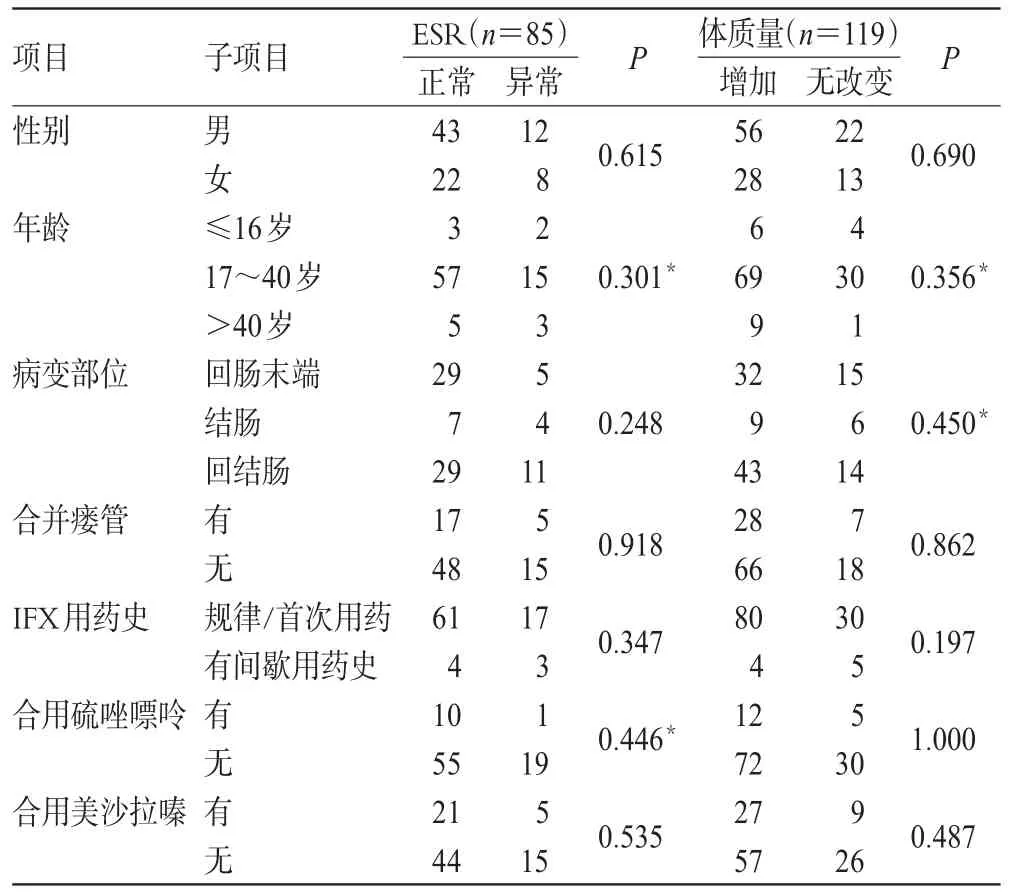
表4 ESR、体质量影响因素分析结果Tab 4 Analysis results of influential factors of ESR and body weight
3 讨论
ACCENTⅠ、ACCENTⅡ、REACH等多个大型临床试验及国内外多项临床研究已证实IFX对CD的缓解率可达36%~88%[10-11]。CRP、ESR、WBC等炎症指标作为评估CD活动度的重要参数[6],被临床广泛应用。本研究结果显示,患者应用IFX后,CRP、ESR、WBC的异常率从用药前的25.00%~38.61%下降至用药后的3.26%~23.53%,与既往研究[10]结果基本一致。营养不良是CD常见的全身症状,本研究中患者应用IFX后,体质量明显增加,且与ESR下降呈显著正相关,进一步证明了IFX的疗效。此外,内镜下黏膜是否愈合是CD治疗效果的客观评价指标[12],本研究中78.57%的患者可达到黏膜愈合,充分证实了IFX可促进肠道黏膜愈合、改善临床症状。
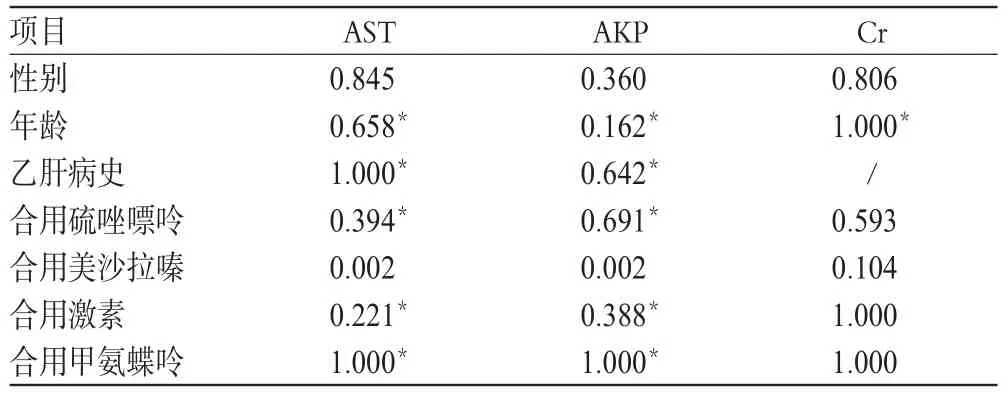
表5 肝肾功能影响因素分析结果(P)Tab 5 Analysis result of influential factors for liver and renal function(P)
IFX是人鼠嵌合免疫球蛋白(Ig)G1分子,可引发免疫原性,形成抗体,中和IFX的生物学效应。国外研究显示,经IFX规律治疗的患者肠道较有间歇用药史者的黏膜愈合率更高、手术率更低且生存质量更高[13-14]。因本研究中有间歇用药史者的样本量有限,故未进一步分析其与内镜下肠道黏膜愈合的相关性。但据报道,约8%~60%的IBD患者在用药过程中(尤其是间断按需给药时)会产生抗体[15],而当抗IFX抗体(ATI)存在时,IFX的清除率将提高2.7倍[16]。因此,有间歇用药史者可能因产生更多的抗体而影响疗效。本研究结果显示,虽然差异无统计学意义,但规律/首次用药患者的ESR达标率和体质量增加率均较有间歇用药史者更高。然而IFX作为生物制剂,价格昂贵,考虑到患者的经济负担,按疗程间歇给药在国内并不少见,临床在权衡利弊时应充分考虑药物疗效、产生抗体风险及患者的经济水平。
输液反应、感染、肝毒性等是IFX常见的ADR,甚至可导致停药[17]。本研究观察期间发生24例ADR,主要包括感染、肝功能指标异常及皮肤黏膜的输液反应,ADR构成比及表现与既往研究[3-5]结果类似。其中,皮肤黏膜及心血管系统相关ADR均为给药后速发型输液反应,占所发生ADR的20.83%,与国内外约20%的总体发生率[18]相近。虽然例数仅为5例,但均导致患者停用IFX,对疾病治疗造成影响。因此,输液期间及输液后均需对患者进行监护,如有异常,及时处理。
单抗药物可使免疫调节细胞和肝细胞因子功能表达异常,引起细胞因子释放综合征,导致肝功能指标暂时升高[19]。本研究中,患者用药前后的AST、AKP和Cr比较,虽然差异均有统计学意义,但升高幅度较小,AST均未超过正常值上限的2倍,AKP仅1例超过正常值上限2倍,Cr均未超过正常值上限,肝损伤分级属于1级(轻度肝损伤)[20],经口服保肝药治疗后转归较好,未影响IFX给药。影响因素分析结果显示,合用美沙拉嗪对患者AST、AKP水平是否上升有显著影响。肝功能指标异常是IFX常见的ADR之一,美沙拉嗪、硫唑嘌呤等CD治疗药物也可能引起转氨酶升高[18],因此对于同时使用IFX及美沙拉嗪等的患者,尤其是长期用药患者,应加强肝功能监测,以保障用药安全。
IFX可抑制机体体液免疫、细胞免疫和天然免疫,增加CD患者感染风险,主要为严重细菌感染、机会性感染。本研究中所有患者用药前均已经过详细体检、X光片、T-Spot检查及乙/丙型肝炎病毒检查,期间未发现结核及肝炎复发,主要发生的感染事件为上呼吸道感染,治疗后均恢复正常。有研究表明,年龄(≥65岁)是IBD患者使用生物制剂发生严重感染的高危因素[21],提示治疗期间应密切监测患者情况,严格把握给药指征。
综上所述,IFX可显著增加CD患者的体质量、降低ESR、改善黏膜愈合情况,疗效明确。建议CD患者应规律使用IFX,以保证疗效。为保障用药安全,给药前应对患者进行活动性感染筛查,输液过程中严密监测患者情况;除了少见且严重的输液反应外,每次用药前需监测患者的血常规、肝肾功能;对有合并用药(美沙拉嗪等)的患者更应密切跟踪肝功能指标变化。下一步研究可完善疗效评估指标、扩大样本量,对IFX长期疗效及安全性的影响因素及相关性进行深入探讨。
[1]Brynskov J,Nielsen OH,Ahnfelt-Ronne I,et al.Cytokines(immunoinflammatory hormones)and their natural regulation in inflammatory bowel disease(Crohn’s disease and ulcerative colitis):a review[J].Dig Dis,1994,12(5):290-304.
[2]Derkx B,Taminiau J,Radema S,et al.Tumour-necrosisfactor antibody treatment in Crohn’s disease[J].Lancet,1993,342(8864):173-174.
[3]李峰,晋红中.119例英夫利西单抗不良反应的文献分析[J].中国药物警戒,2016,13(4):229-232.
[4]冯莉霞,朱剑,张江林,等.英夫利西单抗治疗风湿性疾病的安全性评价[J].中国药房,2015,26(17):2356-2358.
[5]范如英,盛剑秋,陆晓娟,等.英夫利西单抗对炎症性肠病的疗效及安全性分析[J].胃肠病学和肝病学杂志,2013,22(9):898-900.
[6]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见:2012年·广州[J].中华内科杂志,2012,51(10):818-831.
[7]中华医学会消化病学分会炎症性肠病学组.英夫利西治疗克罗恩病的推荐方案:2011年[J].中华消化杂志,2011,31(12):822-824.
[8]中华医学会消化病学分会炎症性肠病学组.建立我国炎症性肠病诊治中心质量控制指标的共识[J].中华内科杂志,2016,55(7):568-571.
[9]卫生部.药品不良反应报告和监测管理办法[S].2011-05-04.
[10]Nanda KS,Cheifetz AS,Moss AC.Impact of antibodies to infliximab on clinical outcomes and serum infliximab levelsin patientswith inflammatory boweldisease(IBD):a meta-analysis[J].Am J Gastroenterol,2013,108(1):40-47.
[11]宓林,于晓峰,邹健.英夫利昔治疗炎症性肠病的国内研究系统回顾[J].国际消化病杂志,2013,33(4):279-282.
[12]Baert F,Moortgat L,Van Assche G,et al.Mucosal healing predicts sustained clinical remission in patients with early-stage Crohn’s disease[J].Gastroenterology,2010,138(2):463-468.
[13]Rutgeerts P,Diamond RH,Bala M,et al.Scheduled maintenance treatment with infliximab is superior to episodic treatment for the healing of mucosal ulceration associated with Crohn’s disease[J].Gastrointest Endosc,2006,63(3):433-442.
[14]Lichtenstein GR,Yan S,Bala M,et al.Remission in patients with Crohn’s disease is associated with improvement in employment and quality of life and a decrease in hospitalizations and surgeries[J].Am J Gastroenterol,2004,99(1):91-96.
[15]Ben-Horin S,Mazor Y,Yanai H,et al.The decline of anti-drug antibody titres after discontinuation of anti-TNFs:implications for predicting re-induction outcome in IBD[J].Aliment Pharmacol Ther,2012,35(6):714-722.
[16]Ternant D,Aubourg A,Magdelaine-Beuzelin C,et al.Infliximab pharmacokinetics in inflammatory bowel disease patients[J].Ther Drug Monit,2008,30(4):523-529.
[17]周有连,陈烨.英夫利昔单抗治疗炎症性肠病的疗效及影响因素分析[J].南方医科大学学报,2013,33(12):1833-1838.
[18]周笑甜,冉志华.英夫利昔单抗治疗炎症性肠病的研究进展[J].胃肠病学,2009,14(11):691-694.
[19]黄奇,缪应雷.炎症性肠病中药物性肝损伤的研究进展[J].胃肠病学和肝病学杂志,2014,23(7):727-730.
[20]于乐成,茅益民,陈成伟.药物性肝损伤诊治指南[J].临床肝胆病杂志,2015,31(11):1752-1769.
[21]Cottone M,Kohn A,Daperno M,et al.Advanced age is an independent risk factor for severe infections and mortality in patients given anti-tumor necrosis factor therapy for inflammatory bowel disease[J].Clin Gastroenterol Hepatol,2011,9(1):30-35.
Efficacy and Safety Observation of Infliximab in the Treatment of Crohn’s Disease and Analysis of Influential Factors
CHEN Hefeng1,YANG Wanhua1,YAO Weiyan2(1.Dept.of Pharmacy,Ruijin Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200025,China;2.Dept.of Gastroenterology,Ruijin Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200025,China)
OBJECTIVE:To observe therapeutic efficacy and safety of infliximab(IFX)in the treatment of Crohn’s disease(CD),and to investigate its influential factors.METHODS:In retrospective study,a total of 120 CD patients
IFX treatment in our hospital during Jan.-Dec.2015 were selected as research objects.All patients were given IFX for injection 5 mg/kg intravenously at 0,2nd,6th week and later every 8 weeks continously.Therapeutic efficacy indexes(body weight,CRP,ESR,WBC,mucosal healing under endoscope),liver and renal indexes(ALT,AST,AKP,γ-GT,TB,DB,Cr),the occurrence time of ADR,organs/systems involved,clinical manifestations and outcomes were compared before and after treatment.Influential factors were analyzed.RESULTS:Compared with before medication,body weight of patients were increased significantly,while ESR were decreased significantly,with statistical significance(P<0.05).There was positively correlation between above two indexes(r=0.275,P=0.016).Mucosal healing was found in 78.57%of patients by colonoscopy.There was statistical significance in the levels of AST,AKP and Cr before and after treatment(P<0.05),but those indexes were increased slightly.AKP exceeded 2 times the upper limit of normal value in only 1 case,but AST did not exceed 2 times the upper limit of normal limit,Cr did not exceed the upper limit of normal value.There was no statistical significance in CRP,WBC or other liver and renal function indexes before and after treatment(P>0.05).There were 24 cases of ADR with incidence of 20.00%.Respiratory system,digestive system,skin mucous membrane,body defense and other organs/systems were involved,mainly manifestating as uper respiratory tract infetion,liver function indexes order etc.Ten patients(41.67%)delayed the treatment,and 6 cases(25.00%)discontinued.Standard rate of ESR in patients with regular/primary medication(78.21%)was higher than those with intermittent medication history(57.14%),but without statistical significance(P>0.05).Combined use of mesalazine had no significant effect on the increase of AST and AKP(P=0.002).CONCLUSIONS:IFX significantly increases body weight of CD patients,decreases ESR and improves mucosal healing.It shows definite therapeutic efficacy.It is suggested that CD patients should use IFX regularly.The overall safety of IFX is good,but it may cause transfusion reaction and transient increase of liver function index.So,the patient’s condition should be closely monitored during the infusion.[especially for liver function of those with drug combination(mesalazine,etc.)]
Infliximab;Crohn’s disease;Therapeutic efficacy;Safety;Influential factor
R969.3
A
1001-0408(2017)35-4947-05
DOI10.6039/j.issn.1001-0408.2017.35.14
上海市临床药学重点专科建设项目
*主管药师,硕士研究生。研究方向:临床药学。电话:021-64370045。E-mail:chf40626@rjh.com.cn
#通信作者:主任药师,硕士生导师,硕士。研究方向:临床药学。电话:021-64370045。E-mail:yangwanhuaxy@163.com
2017-02-09
2017-05-10)
(编辑:胡晓霖)

