酸奶中高抗氧化活性乳酸菌的筛选及性能研究*
孙志华
(山西省分析科学研究院, 山西 太原 030006)
酸奶中高抗氧化活性乳酸菌的筛选及性能研究*
孙志华
(山西省分析科学研究院, 山西 太原 030006)
从三元酸牛奶和伊利全脂调味酸牛乳样品中分别分离筛选出乳酸菌菌株B2和C12, 采用革兰氏染色法观察其形态, 并用过氧化氢酶对其鉴定, 考察了两菌株的自由基清除能力、 抗脂质过氧化性能和亚铁离子螯合能力. 实验结果表明, 浓度为108mL-1的菌悬液清除羟自由基能力强于同体积的浓度为1 mmo1/L抗坏血酸; B2和C12对二苯基苦基苯肼自由基清除率分别为21.51%和22.35%, 对超氧阴离子自由基清除率分别为24.86%和27.07%; 抗脂质过氧化力分别为20.11%和19.8%, 对亚铁离子的螯合能力强于蒙牛原味酸牛奶对照普通菌株A4.
乳酸菌; 抗氧化活性; 自由基清除; 抗脂质过氧化性; 亚铁离子螯合; 酸奶
生命有机体活动中生物氧化是一个至关重要的过程, 氧化过程会产生自由基, 但是过多的自由基会与磷脂结合攻击生物膜, 会使氨基酸残基突变引起蛋白质变性, 会使核酸被修饰从而引起DNA破坏, 最终将导致肿瘤、 动脉粥样硬化、 关节炎、 肺气肿、 肝硬化等疾病的发生[1-3]. 为了减少氧化损伤, 各种合成的抗氧化剂如叔丁基羟基茴香醚、 2, 6-二叔丁基对甲酚、 特丁基对苯二酚和丁羟甲苯被广泛使用[4], 然而, 这些合成的抗氧化剂会造成肝损害, 并有致癌特性[5], 因此需要寻找低廉、 安全无毒的天然抗氧化剂[6], 从而保护人体自由基, 这对延缓多种慢性疾病具有非常重要的意义.
乳酸菌因其抗氧化活性近几年被人们广泛接受, 它具有降低胆固醇、 抗癌、 增强免疫力、 延缓衰老等作用[7-8]. 乳酸菌的来源广泛, 如乳制品、 泡菜、 发酵豆制品等[9-11], 其中, 从酸奶中获得乳酸菌最廉价易得. 乳酸菌抗氧化机理的研究是其作为新型抗氧化剂工业化应用的基础.
本研究对从酸奶中分离、 筛选出活性较强的乳酸菌进行抗脂质过氧化率、 二苯基苦基苯肼自由基清除率、 超氧阴离子自由基清除率、 羟自由基清除率、 亚铁离子鳌合率的测定, 以确定分离得到乳酸菌的抗氧化活性, 以期为乳酸菌在抗氧化性方面的应用提供理论基础.
1 材料与方法
1.1 材料和仪器
蒙牛原味酸牛奶(A), 三元酸牛奶(B), 伊利全脂调味酸牛乳(C)均从超市购得.
过氧化氢, 二苯基苦基苯肼自由基, 三氯乙酸, 硫代巴比妥酸, 丁基化羟基甲苯, 二乙三胺五乙酸, 三羟甲基氨基甲烷, 抗坏血酸(Vc), 均为分析纯, 国药集团化学试剂有限公司.
溴甲酚绿(BCG)牛乳营养培养基, MRS液体培养基, 半固体MRS培养基.
洁净工作台: VD-B20, 哈尔滨市东联电子技术开发有限公司, 智能生化培养箱: SHX, 上海华连医疗器械有限公司, 光学显微镜: XSZ-3GB, 北京格拉威尔科技有限公司.
1.2 实验方法
1.2.1 抗氧化乳酸菌的筛选
1) 分离
将用无菌PBS缓冲液逐级稀释的3种酸奶样品涂布在BCG牛乳培养基平板上, 30 ℃厌氧培养48 h后, 将颜色变化明显的典型菌落挑选出来, 采用划线分离纯化, 革兰氏染色, 镜检, 将G+菌株再次接种于半固体MRS培养基上, 于4 ℃保藏备用.
2) 筛选
按1%的接种量分别接入含不同浓度(0.4%, 0.7%, 1.0%)过氧化氢的MRS液体培养基, 置于30 ℃恒温培养箱中培养, 取菌液时间间隔为2 h, 取液后用分光光度计测其光密度(OD)值, 得到在不同起始过氧化氢浓度下每个菌株的生长趋势, 以筛选得到高过氧化氢耐受性的乳酸菌.
3) 富集
将筛选所得菌株体积分数为10%的接种量接于MRS液体培养基中, 恒温30 ℃培养.
1.2.2 高抗氧化活性乳酸菌的鉴定
1) 乳酸菌细胞形态鉴定
将菌种接种到MRS培养基中生长到对数期, 革兰氏染色, 光学显微镜观察细胞的形态、 大小.
2) 过氧化氢酶实验
在生长于平板上的菌落上加一滴双氧水(3%), 观察有无气泡产生, 若有气泡产生, 表明过氧化氢酶为阳性.
1.2.3 乳酸菌活细胞(IC)的制备
将培养液用离心机(4 000 r/min)离心 15 min, 收集菌体并洗涤, 用无菌PBS缓冲液配制混悬液, 使其菌数为108mL-1.
1.2.4 抗氧化活性的测定
1) 羟自由基(HO·)清除能力的测定
取2.6 mmol/L邻-菲罗琳1 mL, 依次加入pH 7.4的PBS 1 mL, 蒸馏水1 mL, 充分混匀后, 加入2.5 mmol/L FeSO41 mL, 混匀后加20 mmol/L H2O21 mL, 混合液中分别加入 0.5, 1, 1.5, 2.0, 2.5 mL乳酸菌IC和1 mmo1/L的抗坏血酸, 在37 ℃水浴 1.5 h 后于536 nm处测定其吸光度A, 以PBS为对照, 按式(1)计算羟自由基清除率.

式中:As为样品的吸光值;Ap为水浴后样品的吸光值;Ab为PBS的吸光值.
2) 二苯基苦基苯肼自由基(DPPH)清除能力的测定
将1 mL乳酸菌IC加入至 1 mL的0.2 mmol/L DPPH自由基甲醇溶液, 无光室温下反应0.5 h, 离心, 上清液于517 nm处测吸光度A, 按式(2)计算得DPPH自由基清除率.

式中:As为样品的吸光值;Ab为PBS的吸光值.


式中:A00为溶液中不加样品和邻苯三酚的吸光度;A01为溶液中加入了邻苯三酚的吸光度;A10为溶液中不含邻苯三酚的吸光度;A11为溶液中加入了样品和邻苯三酚的吸光度.
4) 抗脂质过氧化作用的测定
在1 mL乳酸菌中加入1 mL亚油酸和0.5 mL pH=7.4 PBS缓冲液的混合液, 再加入一定量硫酸和过氧化氢进行催化氧化, 于37 ℃反应12 h. 再将0.2 mL的4%三氯乙酸, 2 mL的0.8% 硫代巴比妥酸, 0.2 mL的0.4%丁基化羟基甲苯加入至混合液中, 100 ℃反应30 min, 冷却后离心收集上清液, 在532 nm下测吸光值A, 以PBS为对照, 按照式(4)计算抗脂质过氧化率.

式中:As为样品的吸光值;Ab为PBS的吸光值.
5) 亚铁离子(Fe2+)鳌合能力的测定
将1 mL乳酸菌IC加入至由0.1mL硫酸亚铁(0.4%)、 0.1 mL抗坏血酸(1%)和1 mL氢氧化钠(0.2 moL/L)组成的混合液中, 37 ℃水浴20 min. 三氯乙酸沉淀蛋白, 3 000 r/min离心10 min, 吸取0.2 mL上清液, 加入2 mL邻-菲罗琳(0.1%)静置10 min, 于510 nm处测定吸光值.
2 结果与讨论
2.1 抗氧化乳酸菌的分离、 筛选、 富集及鉴定
将10-2浓度的三元酸牛奶(B)和伊利全脂调味酸牛乳(C)涂布在分离培养基上, 颜色由蓝紫色变成了绿色, 挑选疏密有致的菌落接种于斜面培养, 经过反复划线分离, 并通过过氧化氢筛选与革兰氏染色得到2株具有抗过氧化氢的菌株, 编号B2和C12, 其在显微镜下的形态见图 1. 从图中可以看出, 这两种菌株的菌体形态基本一致. 后将这两菌株进行富集培养. 另外, 从蒙牛原味酸牛奶中获得A4菌株.
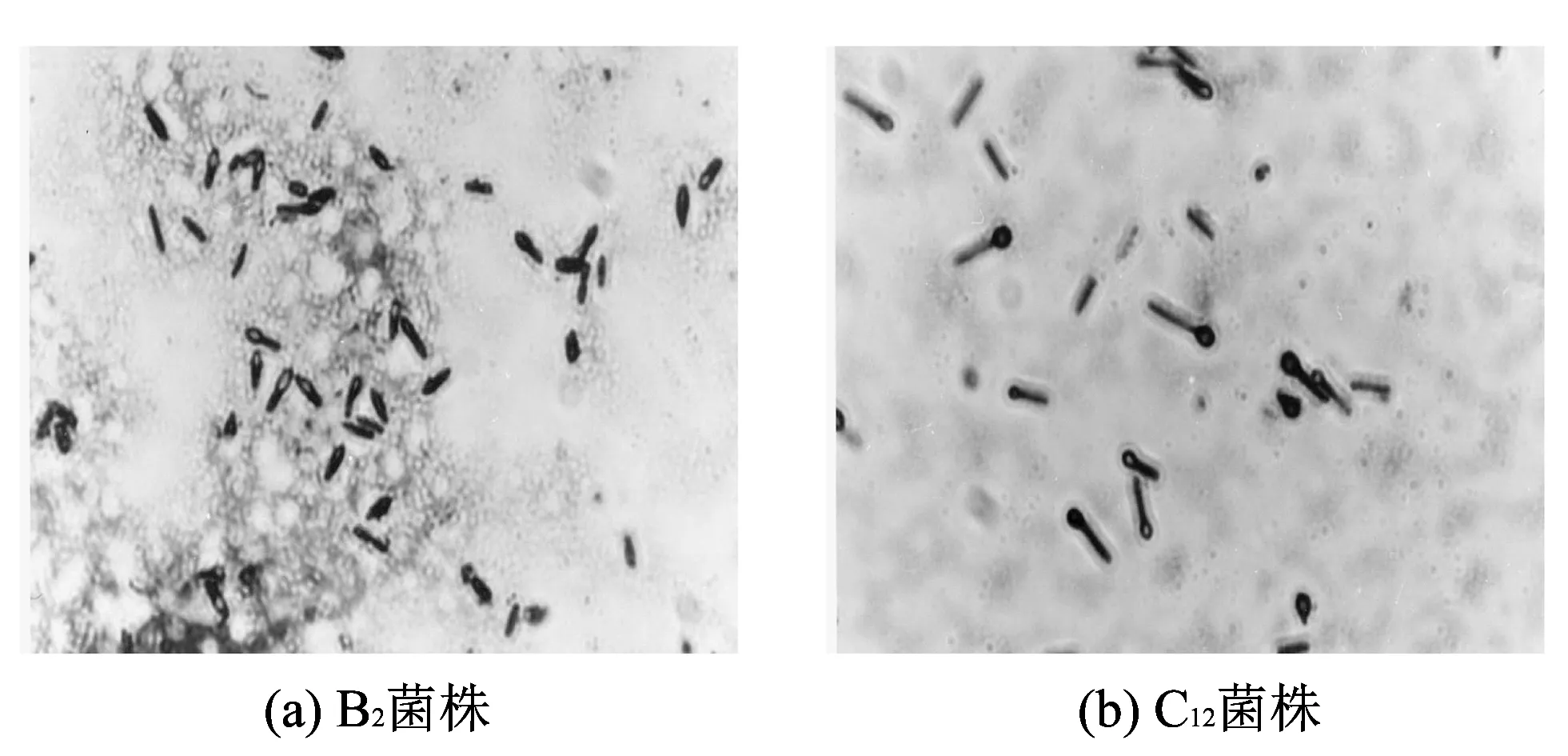
图 1 两株乳酸菌在显微镜下的菌体形貌(30×100倍)Fig.1 Microscope morphology of the two lactic acid bacteria (30×100)
由图 1 可以看出, 经革兰氏染色后, 两株菌均成革兰氏阳性, 短棒状. 将一滴3%的H2O2分别滴加至B2和C12菌落上, 结果显示, 两个菌落均无气泡产生, 表明其都属过氧化氢酶阴性. 由以上的鉴定结果可以初步断定菌株B2和C12为乳酸菌.
2.2 乳酸菌的抗氧化性能
2.2.1 羟自由基(HO·)的清除能力
羟自由基是一种氧化性很强的自由基, 能够降解DNA、 损伤生物膜和糖类分子, 是导致脂质过氧化和人体多种细胞损伤的最主要的自由基[12]. 因此, 对羟基自由基的清除能力是抗氧化性能的一个主要指标. 图2显示了抗氧化活性较强的不同浓度的活细胞B2和C12菌株以及抗坏血酸(阳性对照)对HO·的清除作用.
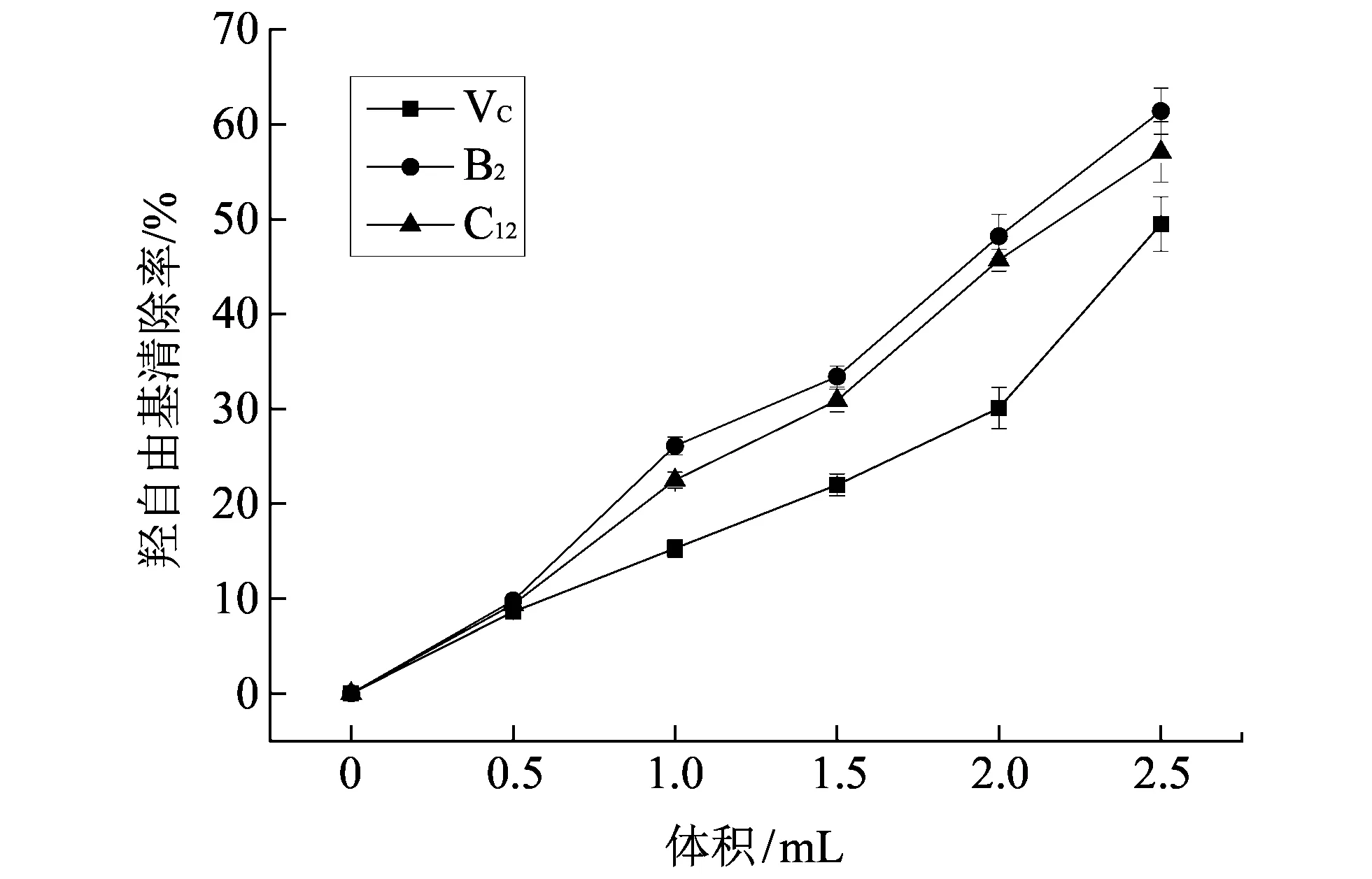
图 2 菌体加入量对羟自由基的清除能力曲线Fig.2 Scavenging capacity curves of lactic acid bacteria to hydroxyl free radicals
从图 2 中可以看出, 在相同浓度下, 随着加入菌体体积的增加, 乳酸菌对羟自由基的清除率也在相应的增大. 在加入菌体体积为2.5 mL时, B2菌株的羟自由基清除率为61.4%, 高于Vc(49.5%). 这主要是由于在乳酸菌细胞内存在着针对Cu2+和Fe2+的天然螯合物质, 这些物质能够螯合Cu2+和Fe2+, 从而减少羟自由基的产生[13].
2.2.2 二苯基苦基苯肼自由基(DPPH)清除能力
B2和C12菌株对DPPH自由基的清除率见图 3.

图 3 B2和C12乳酸菌对DPPH的清除率Fig.3 DPHH scavenging ratio of B2 and C12 lactic acid bacteria
DPPH分光测定法用来评价某种物质的抗氧化能力, 是筛选和评价抗氧化效果的一种常用的有效方法. 由图 3 可以看出, B2和C12两菌株对DPPH自由基都有很高的清除能力, 其中菌株C12清除率较高, 为22.35%, 这可能是因为乳酸菌产生的胞外多糖具有DPPH自由基的清除活性[14].

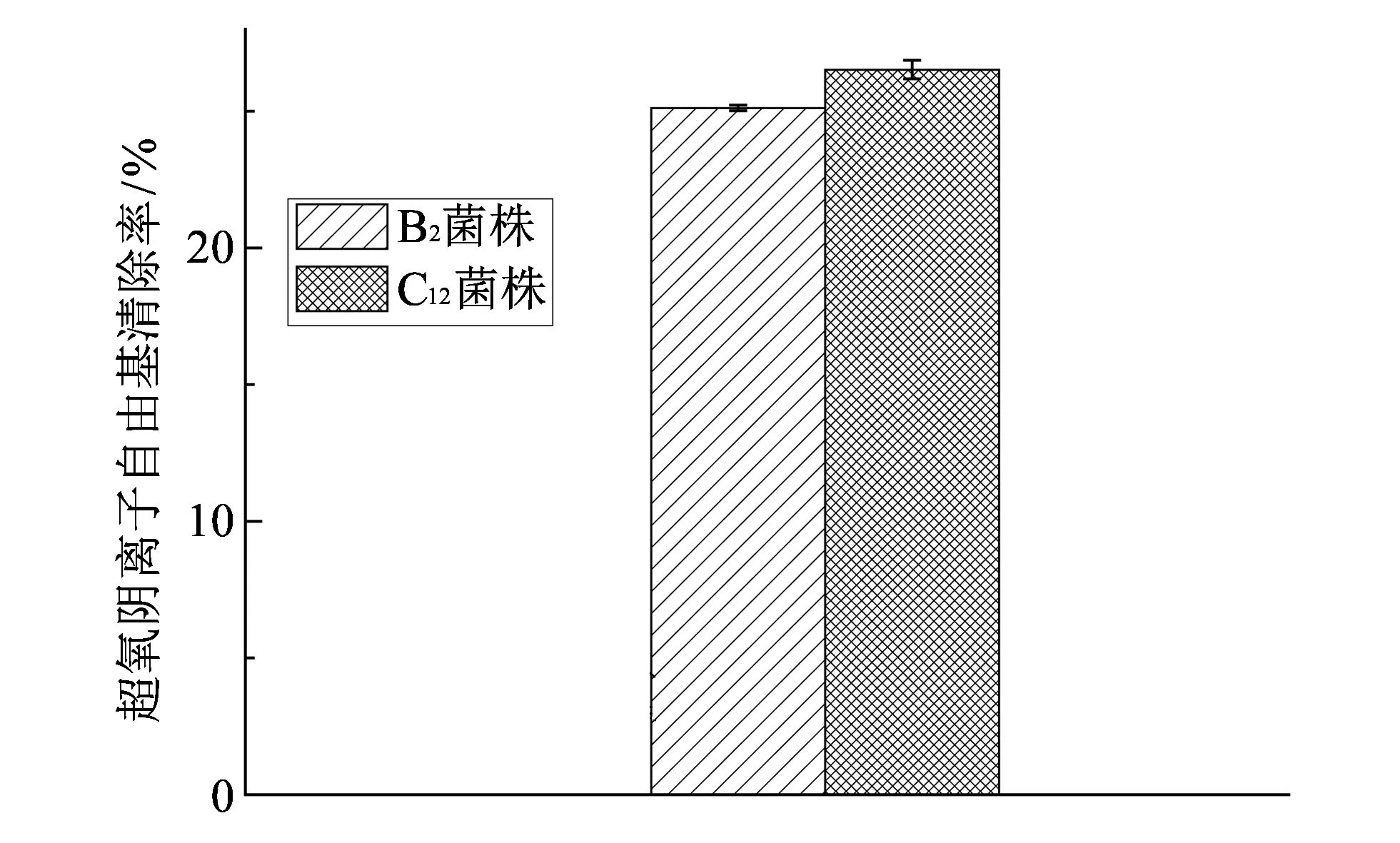
图 4 B2和C12菌株对超氧阴离子自由基的清除率Fig.4 Scavenging ratio of B2 and C12 bacteria to superoxide anion free radicals

2.2.4 抗脂质过氧化能力
丙二醛(MDA)是脂质过氧化反应的最终产物, 它能够破坏机体的生物大分子蛋白质、 核酸等, 造成机体老化以及诱发多种疾病. 因此, MDA含量的测定, 能够在一定程度上反映抗脂质过氧化的能力, 是常用的一种脂质过氧化的指标. B2和C12菌株的活细胞体抗脂质过氧化的清除率如图 5 所示.

图 5 B2和C12菌株抗脂质过氧化能力Fig.5 Anti-lipid peroxidation of B2 and C12 bacteria
本实验对两株抗氧化活性较强菌株B2和C12的抗脂质过氧化率进行3次测定, 得到B2和C12的抗脂质过氧化清除率分别为20.11%和19.8%.
2.2.5 亚铁离子(Fe2+)鳌合能力
Fe2+是在金属离子中最典型的促氧化剂, 它促进脂质过氧化反应的进行, 进一步损害机体生物膜. 将菌株B2和C12以及对照普通菌株A4对Fe2+的螯合率分析以了解其抗氧化水平, 结果如图 6 所示.

图 6 三株菌对亚铁离子的螯合能力Fig.6 Chelating capacity of three strain to ferrous ion
从实验结果中可以看出, 这3种菌株均对Fe2+有螯合能力, 但B2和C12菌株的螯合能力为52%和55%, 明显高于普通对照菌株A4的螯合能力(30%).
3 结 论
从酸奶样品中分离、 筛选, 并用革兰氏染色和过氧化氢酶活性鉴定获得2株具有高抗氧化活性的B2和C12乳酸菌菌株. 对B2和C12菌株进行抗氧化活性测定得出, 这两株乳酸菌活性细胞对羟自由基的抗氧化活性强于同体积的Vc; 对DPPH自由基的清除率性能较好, 都高于20%; C12菌株超氧阴离子自由基的清除能力高于B2; 两株菌的抗脂质过氧化能力都较高, 对亚铁离子的螯合能力较高, 高于50%, 强于普通菌株A4. 本文研究结果希望对推动绿色抗氧化剂研究提供一定理论基础.
[1] Pham-Huy L A, He H, Pham-Huy C. Free radicals, antioxidants in disease and health[J]. Journal of Biomedical Science, 2008, 4(2): 89-96.
[2] Lobo V, Patil A, Phatak A, et al. Free radicals, antioxidants and functional foods: impact on human health[J]. Pharmacognosy Reviews, 2010, 4(8): 118-126.
[3] Kin J E, Kim J, Lee K W, et al. Cancer chemopreventive effects of Lactic acied bacteria[J]. Journal of Microbiology and Biotechnology, 2007, 17(8): 1227-1235.
[4] 李浩峰, 李忠海, 王利兵, 等. 包装材料中三种抗氧化剂的快速检测[J]. 食品与机械, 2013, 29(1): 88-91.
Li Haofeng, Li Zhonghai, Wang Libing, et al. Determination of three antioxidants existed in food and drug packaging materials using gas chromatography[J]. Food & Machinery, 2013, 29(1): 88-91. (in Chinese)
[5] 徐琴, 汤志旭, 林洪, 等. 反相高效液相色谱-荧光法同时测定食品中叔丁基对苯二酚和叔丁基羟基茴香醚的含量[J]. 分析化学, 2008, 36(2): 274.
Xu Qin, Tang Zhixu, Lin Hong, et al. Simultaneous determination of tert-butyl hydroquinone and butylated hydroxyanisole in foods by high performance liquid chromatography with fluorimetric detection[J]. Chinese Journal of Analytical Chemistry, 2008, 36(2): 274. (in Chinese)
[6] Ahire J J, Mokashe N U, Patil H J, et a1. Antioxidative potential of folate producing probiotic lactobacillus helveticus CD6[J]. Journal of Food Science and Technology, 2013, 50(1): 26-34.
[7] 王瑞君. 降解胆固醇乳酸菌的筛选及中草药与乳酸菌的协同作用[J]. 食品科学, 2013, 34(1): 210-214.
Wang Ruijun. Sceening of cholesterol-lowering lactic acid bacteria and synergic effect with Chinese herbal medicines[J].Food Science, 2013, 34(1): 210-214. (in Chinese)
[8] Chen Q, Kong B H, Sun Q X, et al. Antioxidant potential of a unique LAB culture isolated from Harbin dry sausage: In vitro and in a sausage model[J]. Meat Science, 2015, 110: 180-188.
[9] Luang-In V, Deeseenthum S. Exopolysaccharide-producing isolates from Thai milk kefir and their antioxidant activities[J]. Food Science and Technology, 2016, 73: 592-601.
[11] 张艳芳, 郭焱, 李昌任, 等. 发酵豆制品中乳酸菌分离及其鉴定和功能研究[J]. 农产品加工, 2016(2): 38-42.
Zhang Yanfang, Guo Yan, Li Changren, et al. Isolation of lactic acid bacteria showing probiotic activities from chinese traditional fermented foods[J]. Farm Products Processing, 2016(2): 38-42. (in Chinese)
[12] Nimse S B, Pal D. Free radicals, natural antioxidants, and their reaction mechanisms[J]. RSC Advances, 2015, 5(35): 27986-28006.
[13] Kullisaar T, Zilmer M, Mikelsaar M, et a1. Two antioxidative lactobacilli strains promising probiodcs[J]. Intemational Journal of Food Microbiology, 2002, 72(3): 215-224.
[14] Xu R, Shang N, Li P. In vitro and in vivo antioxidant activity of exopolysaccharide Fractions from Bifidobacterium animalis RH[J]. Anaerobe, 2011, 17(5): 226-231.
[15] Lee B J, Kim J S, Kang Y M, et a1. Antioxidant activity andγ-aminobutyric acid(GABA)content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chemistry, 2010, 122(1): 271-276.
ScreeningandPerformanceStudyofLacticAcidBacteriaPossessingHighAntioxidantActivityfromYogurt
SUN Zhi-hua
(Shanxi Academy of Analytical Sciences, Taiyuan 030006, China)
The Lactic acid bacteria were isolated and screened from sanyuan yogurt and yili whole milk yogurt, and strains of B2and C12were obtained respectively. The morphology was observed with gram staining method and the identification was performed by hydrogen peroxide enzyme. Free radical scavenging ability, anti-lipid peroxidation and the ferrous ion chelating power of the two strains were explored respectively. The experimental results indicate that the same volume of 108mL-1bacterial suspension shows higher hydroxyl radical scavenging ability than 1mmo1/L Vc. For B2and C12, 1,1-diphenyl-2-picryhydrazyl(DPPH) radical scavenging rate are 21.51% and 22.35%, superoxide anion radical scavenging rate are 24.86% and 27.07% respectively, and superoxide anion radical scavenging rate are 24.86% and 27.07%, anti-lipid peroxidation ability are 20.11% and 19.8%. The chelating power of strains of B2and C12for ferrous ion is stronger than contrasted strain A4, which comes from mengniu pure yogurt.
lactic acid bacteria; antioxidant activity; radicals scavenging; anti-lipid peroxidation; ferrous ion chelating; yogurt
1673-3193(2017)03-0302-05
2016-10-15
孙志华(1975-), 女, 助理研究员, 硕士, 主要从事分析检测技术的研究 .
Q93-3
A
10.3969/j.issn.1673-3193.2017.03.010

