黄芩甙对新城疫病毒感染鸡胚成纤维细胞Toll样受体2、3、4、7 mRNA表达的影响
许锐光,贾 艳,胡力文,翁嘉华,邓俊良,胡延春,*
(1.四川农业大学 动物医学院/动物疫病与人类健康四川省重点实验室,四川 成都 611130; 2.嘉兴职业技术学院 农业与环境分院,浙江 嘉兴 314036)
黄芩甙对新城疫病毒感染鸡胚成纤维细胞Toll样受体2、3、4、7 mRNA表达的影响
许锐光1,贾 艳2,胡力文1,翁嘉华1,邓俊良1,胡延春1,*
(1.四川农业大学 动物医学院/动物疫病与人类健康四川省重点实验室,四川 成都 611130; 2.嘉兴职业技术学院 农业与环境分院,浙江 嘉兴 314036)
旨在探讨黄芩甙对新城疫病毒感染鸡胚成纤维细胞Toll样受体2、3、4、7 mRNA表达的影响。新城疫病毒(NDV)感染鸡胚成纤维细胞,使用MTT法检测黄芩甙对鸡胚成纤维细胞的最大安全浓度,使用荧光定量PCR方法检测不同浓度黄芩甙对染毒细胞Toll样受体2、3、4、7 mRNA在不同时间表达的影响。结果表明,黄芩甙组和病毒对照组细胞TLR2、TLR4和TLR7 mRNA的表达水平起初受到抑制,TLR2和TLR4 mRNA在24 h内呈上升趋势,TLR7 mRNA在16 h内呈上升趋势,TLR3 mRNA的表达水平呈波动性变化。黄芩甙在24 h时能够促进NDV感染细胞TLR2和TLR4 mRNA的表达,且呈剂量依赖性,从而发挥免疫调节作用,具有抗NDV的功能。
黄芩甙;新城疫病毒;Toll样受体;实时荧光定量PCR
新城疫病毒(Newcastlediseasevirus, NDV)也被称为亚洲鸡瘟病毒、伪鸡瘟病毒或禽肺脑炎病毒,属于副黏病毒科,禽腮腺炎病毒属(Avulavirus),禽副黏病毒I型(APMV-1)[1]。最急性NDV感染鸡群,死亡率高达90%,其每年对全球养禽业都造成巨大的损失[2]。接种疫苗是目前本病主要的防治措施[3],因大量抗病毒西药被禁止应用于畜禽临床中,故选择一种天然化合物作为替代十分有应用前景[4]。许多中药本身具有调节免疫功能、抑制病毒增殖和感染[5]等作用,以及副作用小、毒性低等优良特性。但目前中药在动物医学领域的应用并不广泛。中药抗病毒不只单纯着眼于直接的抗病毒作用,更重视“病毒-机体-药物”的关系,不仅直接杀灭病毒,阻止病毒的复制、转染,更重要的是能够增强机体的免疫力,激发调动一切的免疫防御系统发挥抗病毒作用[5]。黄芩甙(C21H18O11,图1)是提取自中药黄芩的干燥根中的一种主要活性成分,它具有抗炎[6]、抗病毒[7]、抗菌[8]和调节免疫[9]等生物活性。Jia等[10]的研究表明,黄芩甙具有体外直接抗NDV作用。
通过模式识别受体来识别病原微生物的特异性成分是机体发挥免疫应答抵御病原微生物侵入的前提和基础。Toll样受体(TLRs)是一类重要模式识别受体,在脊椎动物中具有显著的保守性,能够识别细菌、病毒等微生物的各种组分[11]。当TLRs被配体激活后,信号通过相关分子的传导,激发一系列的免疫应答反应,产生炎症细胞因子,抵御包括病毒在内的病原微生物的侵入[12]。目前,在禽体内已发现的TLRs为TLR1、TLR2、TLR3、TLR4、TLR5、TLR7、TLR15和TLR21[13]。其中,TLR2、TLR3、TLR4、TLR7在NDV感染机体时发挥作用。本文通过研究黄芩甙对新城疫病毒感染鸡胚成纤维细胞Toll样受体2、3、4、7 mRNA表达的影响,旨在揭示黄芩甙能够通过调节机体的免疫力,激发调动免疫防御系统发挥抗NDV作用的机理,以期为临床抗NDV新药的研发提供理论和试验依据。

图1 黄芩甙的化学结构式Fig.1 Chemical structure of Baicalin
1 材料与方法
1.1 试验材料
药物:黄芩甙,购自上海金穗生物科技有限公司,纯度≥98%。
病毒:新城疫病毒(La Sota株)由四川农业大学预防兽医系黄勇教授提供。
试验试剂:DMEM培养基购自Hyclone;噻唑蓝(MTT)和二甲基亚砜(DMSO)购自Sigma;胎牛血清购自杭州四季青生物工程材料有限公司;TRIpure总RNA快速提取试剂盒购自成都百菲特科技有限公司;TUREscript 1st Strand cDNA Synthesis Kit和BestarSybrGreen qPCR mastermix购自北京艾德莱生物科技有限公司。
仪器设备:37XC009312型倒置显微镜,上海江南光学仪器厂;Thermo311型二氧化碳培养箱,Thermo Fisher Scientific;YXQ-LS-50S11型高压灭菌锅,上海博迅实业有限公司医疗责任设备厂;1645050型电泳仪,iMark型酶标仪,CFX96荧光定量PCR仪和GelDoc XR+型凝胶成像系统,BIO-RAD公司。
1.2 方法
1.2.1 细胞和病毒
按文献[4]方法制备鸡胚成纤维细胞(CEF)。
将NDV La Sota株(病毒含量为100 EID50·mL-1)接种于9日龄鸡胚尿囊腔,每胚接种0.2 mL,24 h内死亡鸡胚弃之。收集24 h后死亡鸡胚尿囊液,0.22 μm滤膜过滤除菌、加双抗(青霉素G和硫酸链霉素各100单位·mL-1)、分装,-80 ℃保存。
1.2.2 NDV病毒对CEF细胞TCID50的测定
将病毒液用DMEM培养基对数稀释成10-1,10-2,…,10-8。吸取每一稀释度的病毒液100 μL加入吸去培养基的单层CEF 96孔板的相应孔中,每个稀释度重复4孔,在37 ℃、5% CO2培养箱中吸附1.5 h。吸弃病毒液,每孔加入200 μL维持液,培养72 h,在倒置显微镜下观察致细胞病变效应(CPE),并记录结果。用Reed-Muench方法计算病毒的TCID50。
1.2.3 黄芩甙对CEF细胞安全浓度的测定
用含2%胎牛血清的DMEM培养基,即维持液稀释Baicalin 至2 mg·mL-1,过滤除菌。倍比稀释8个梯度加至吸去培养基的单层CEF 96孔板的相应孔中,100 μL·孔-1,每个稀释度重复4孔,同时设细胞对照孔和空白对照孔, 37 ℃、5%CO2培养。加药后每12 h 观察1次细胞单层完好程度, 培养72 h 后, 按MTT法[14]用酶标仪测定570 nm 波长处D570值。选择细胞D570值不显著小于细胞对照组的单体最大质量浓度作为该单体最大安全浓度[15]。
1.2.4 荧光定量PCR引物合成
根据文献[16]提供的序列合成特异性引物,如表1。
1.2.5 黄芩甙对NDV感染的CEF细胞TLR2、TLR3、TLR4、TLR7 mRNA的调控试验
(1)样品准备
取处于对数期CEF细胞,用细胞生长液调整细胞密度为 5×105个·孔-1接种到 6 孔细胞培养板。待CEF细胞长至单层时,弃旧培养液,加入
100TCID50的NDV,37 ℃吸附 1.5 h,弃去病毒液,黄芩甙由最大安全浓度倍比稀释5个浓度梯度加入6孔板,并设置细胞对照和病毒对照,每组重复4次。分别于4、8、16、24、48、72 h后终止试验,冰上吸出培养液,PBS 洗3次,每孔中加入1 mL Trizol,用细胞刮刮净细胞,储存于-80 ℃冰箱,用于 RNA 提取。
(2)细胞总 RNA 的提取
根据TRIpure总RNA提取试剂盒说明书进行操作,提取细胞总RNA。运用变性琼脂糖凝胶电泳检测提取的总RNA的完整性,130 V稳压,1×TBE Buffer 1%变性琼脂糖凝胶电泳20~30 min。
(3)总 RNA 的反转录反应
根据TUREscript 1st Strand cDNA Synthesis Kit说明书进行反转录反应合成cDNA。所得产物-20 ℃冰箱长期保存。
(4)实时荧光定量 PCR 反应
取合成的cDNA作为DNA模板,每组设3个平行重复孔,按照BestarSybrGreen qPCR mastermix试剂盒说明书进行PCR扩增。反应程序为:95 ℃ 2 min;94 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。
1.2.6 数据分析
由 SPSS 20.0软件进行数据统计分析和差异显著性分析。黄芩甙对CEF细胞安全浓度的测定数据用Mean±SE表示。在进行相对荧光定量时以18sRNA内参基因作为标准。基因相对表达量的计算用2-ΔΔCt法。
2 结果与分析
2.1 NDV的TCID50测定结果
表1引物序列及扩增片段长度
Table1The primers sequences and amplification fragments sizes

目的基因TargetmRNA上游引物Forwardprimers(5′-3′)下游引物Reverseprimers(5′-3′)产物大小Productsize/bpTLR2GATTGTGGACAACATCATTGACTCAGAGCTGCTTTCAAGTTTTCCC294TLR3TCAGTACATTTGTAACACCCCGCCGGCGTCATAATCAAACACTCC256TLR4AGTCTGAAATTGCTGAGCTCAAATGCGACGTTAAGCCATGGAAG190TLR7TTCTGGCCACAGATGTGACCCCTTCAACTTGGCAGTGCAG21918SrRNATCAGATACCGTCGTAGTTCCTTCCGTCAATTCCTTTAAGTT154
根据CPE情况计算NDV的TCID50,结果得出TCID50=10-5.5·mL-1,本试验使用的病毒浓度为100TCID50,故本试验使用的病毒浓度为10-3.5·mL-1。
2.2 黄芩甙对CEF细胞的安全浓度
根据MTT试验结果,选择合适的植物单体作用于CEF细胞的药物浓度。黄芩甙对CEF细胞的安全浓度测定结果图 2。黄芩甙对CEF细胞的最大安全浓度为0.25 mg·mL-1。
2.3 总RNA的完整性
结果如图3所示,总RNA的18S RNA和28S RNA条带比较清晰、明亮、规则,并且18S RNA和28S RNA之间无拖带,说明所提总RNA完整性较高,可用来合成cDNA。

A,黄芩甙组; B,病毒对照组; C,细胞对照组A, Baicalin group; B, NDV control group; C, cell control group图3 总RNA变性琼脂糖凝胶电泳Fig.3 Denatured agarose gel electrophoresis test of total RNA extracted from CEFs
2.4 黄芩甙对染毒细胞TLR2、TLR3、TLR4、TLR7 mRNA表达作用的影响
2.4.1 黄芩甙对染毒细胞TLR2 mRNA表达作用的影响
黄芩甙组和病毒对照组细胞TLR2 mRNA的表达水平起初受到抑制,极显著低于细胞对照组(P<0.01),在24 h内呈上升趋势,于24 h时极显著高于细胞对照组(P<0.01),最大相对表达量分别提高了149%(黄芩甙组)和67%(病毒对照组),并在24 h后呈下降趋势。在24 h时黄芩甙组的TLR2 mRNA的表达水平与浓度成正相关,并在浓度为1×2-2~1×2-4mg·mL-1时极显著高于病毒对照组(P<0.01),在浓度为1×2-5mg·mL-1时显著高于病毒对照组(P<0.05),在浓度为1×2-5mg·mL-1时与病毒对照组无显著差异。故黄芩甙能够促进NDV感染细胞TLR2 mRNA的表达且促进能力与浓度呈正相关,从而能够通过免疫调节发挥抗病毒作用(图4-A)。
2.4.2 黄芩甙对染毒细胞TLR3 mRNA表达作用的影响
黄芩甙组和病毒对照组细胞TLR3 mRNA的表达水平呈波动性变化,无明显规律。而不同浓度的黄芩甙组的TLR3 mRNA表达水平与病毒对照组无显著差异(P>0.05)。故黄芩甙对NDV感染细胞TLR3 mRNA的表达无显著影响(图4-B)。
2.4.3 黄芩甙对染毒细胞TLR4 mRNA表达作用的影响
黄芩甙组和病毒对照组细胞TLR4 mRNA的表达水平起初受到抑制,极显著低于细胞对照组(P<0.01),在24 h内呈上升趋势,于24 h时极显著高于细胞对照组(P<0.01),最大相对表达量分别提高了93%(黄芩甙组)和52%(病毒对照组)并在24 h后呈下降趋势。在24 h时黄芩甙组的TLR4 mRNA的表达水平与浓度成正相关,并在浓度为1×2-2~1×2-4mg·mL-1时极显著高于病毒对照组(P<0.01),在浓度为1×2-5mg·mL-1时显著高于病毒对照组(P<0.05),在浓度为1×2-6mg·mL-1时与病毒对照组无显著差异。故黄芩甙能够促进NDV感染细胞TLR4 mRNA的表达且促进能力与浓度呈正相关,从而能够通过免疫调节发挥抗病毒作用(图4-C)。
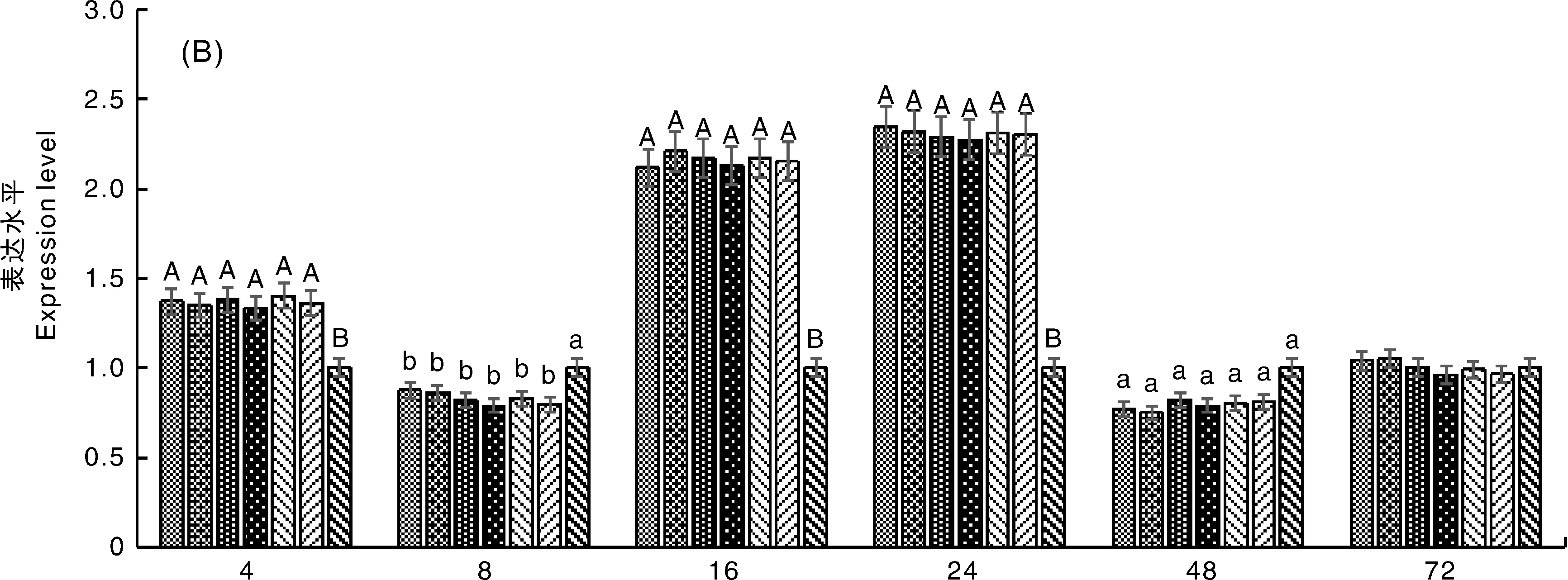


在同一时间,无相同大写字母表示差异极显著(P<0.01),无相同小写字母表示差异显著(P<0.05)At the same time, the difference between data with different capital letter is very significant(P<0.01), and the difference between data with different small letters is significant (P<0.05)图4 不同处理组CEF细胞内TLR2(A)、TLR3(B)、TLR4(C)、TLR7(D) mRNA的表达水平Fig.4 Expression levels of TLR2(A)、TLR3(B)、TLR4(C)、TLR7(D) in NDV-infected CEFs of different treatment groups
2.4.4 黄芩甙对染毒细胞TLR7 mRNA表达作用的影响
黄芩甙组和病毒对照组细胞TLR7 mRNA的表达水平起初受到抑制,极显著低于细胞对照组(P<0.01),在16 h内呈上升趋势,于16 h时极显著高于细胞对照组(P<0.01),相对表达量提高了约120%,并在16 h后呈下降趋势。不同浓度黄芩甙组的TLR7 mRNA表达水平与病毒对照组无显著差异。故黄芩甙对NDV感染细胞TLR7 mRNA的表达无显著影响(图4-D)。
3 讨论
了解NDV感染和免疫系统的相互作用对于理解新城疫的发病机制是十分重要的。TLRs是细胞对抗病原入侵的首道防线,能够作为模式识别受体识别病原。到目前为止,已经有13种TLRs被发现,它们可以调节产生各种炎性细胞因子、化学增活素和干扰素[17]。其中,TLR2、TLR3、TLR4和TLR7在因病毒感染产生的天然免疫反应中发挥重要的作用。
TLR2可以激活MyD88信号通路,激活NF-κB和AP-1转录因子和干扰素调节因子(IRFs),从而协调调节宿主对微生物感染的防御[18]。越来越多的证据表明,TLR/MyD88信号转导通路在机体对微生物病原体的先天免疫和适应性免疫应答的激活发挥着核心作用[19-20]。本试验结果表明,在NDV感染早期,TLR2 mRNA的表达被NDV抑制,但随着NDV的增殖,TLR2 mRNA的表达量增加并于24 h达峰值。故NDV能够激活TLR2的复制,从而激活MyD88信号转导通路协同调节宿主防御病毒。本研究中,黄芩甙能增加TLR2 mRNA在NDV感染细胞的表达并增强上述免疫作用。
TLR3属于I型跨膜蛋白,是存在于细胞内的富含亮氨酸的重复序列(LRR),并且是一个Toll-IL-1受体(TIR)的同源信号域[21]。TLR3受体可以识别体外转录的dsRNA[22]。Cheng等[23]的研究结果表明,TLR3能够积极参与NDV感染时的前期炎症反应,并且导致抗病毒细胞因子分泌。本研究结果表明,NDV感染可引起TLR3 mRNA表达的变化,但它没有规律,并且黄芩甙对TLR3 mRNA在NDV感染的细胞中的表达无明显影响。
和TLR2一样,TLR4也能够激活MyD88信号转导通路[24]。一些TRIF相关的接头分子(TRAM)只能被TLR4所利用,MyD88适配器是一个连接适配器,联通TLR4和TRAM[25]。受体复合物的形成激活信号转导通路,产生 NF-κB、IRF3、IRF5 和IRF7转录因子,导致特异性免疫途径基因表达从而调节机体的免疫机能[17]。本试验结果表明,在NDV感染早期,TLR4 mRNA的表达被NDV抑制。但随着NDV的增殖,TLR4 mRNA的表达量增加并于24 h达峰值。故NDV能够激活TLR4的复制。TLR4可以激活MyD88信号转导通路协同调节宿主防御病毒。本研究中,黄芩甙能增加TLR4 mRNA在NDV感染细胞的表达,并增强上述免疫作用。
TLR7能够识别病毒的ssRNA,并且是机体对ssRNA病毒外周免疫反应的重要媒介[26]。它主要参与促炎性细胞因子的产生,但具体机制尚不清楚[27]。本研究结果表明,在NDV感染早期,TLR7 mRNA的表达被NDV抑制,但随着NDV的增殖,TLR7 mRNA的表达量增加并于16 h达峰值。故NDV能够激活TLR7的复制从而调节宿主防御病毒。本研究中,黄芩甙对TLR7基因在病毒感染细胞的表达无明显影响。
众所周知,TLR2和TLR4均可以参与机体对病毒糖蛋白诱导产生促炎症反应[17]。在机体中,TLR2是TLR4的辅助受体,TLR2和TLR4基因的表达呈正相关关系[28]。在本研究中,TLR2和TLR4的mRNA具有相似的表达变化趋势,在NDV感染早期,其mRNA的表达均被NDV抑制。但随着NDV的增殖其mRNA表达量均增加并于24 h达峰值。这是与前人的研究结果一致。
本研究结果表明,NDV感染影响了TLR2、TLR3、TLR4、TLR7 mRNA的表达,黄芩甙可以极显著地促进NDV感染细胞TLR2和TLR4 mRNA的表达,发挥免疫调节作用,具有抗NDV的功能。
[1] 蔡宝祥. 家畜传染病学[M]. 北京:中国农业出版社, 2001.
[2] PALYA V, KISS I, TATR-KIS T, et al. Advancement in vaccination against Newcastle disease: recombinant HVT NDV provides high clinical protection and reduces challenge virus shedding with the absence of vaccine reactions[J].AvianDiseases, 2017, 56(2):282-287.
[3] 罗玉均,陈建红,张济培. 鸡新城疫的诊断与防制[J]. 养禽与禽病防治, 2004 (12):7.
LUO Y J, CHEN J H, ZHANG J P. Diagnosis and control of Newcastle disease[J].PoultryHusbandryandDiseaseControl, 2004 (12):7.(in Chinese)
[4] ZHANG Y Q, SUN Z A, LIU J G, et al. Flavone ingredients can synergistically inhibit NDV infecting cell and improve ND vaccine’s protective rate[J].InternationalJournalofBiologicalMacromolecules, 2012, 51(3):201-208.
[5] CHEN Y, ZHU J. Anti-HBV effect of individual traditional Chinese herbal medicineinvitroandinvivo: an analytic review[J].JournalofViralHepatitis, 2013, 20(7):445-452.
[6] GUO M, ZHANG N, LI D, et al. Baicalin plays an anti-inflammatory role through reducing nuclear factor-κB and p38 phosphorylation inS.aureus-induced mastitis[J].InternationalImmunopharmacology, 2013, 16(2):125-130.
[7] NAYAK M K, AGRAWAL A S, BOSE S, et al. Antiviral activity of baicalin against influenza virus H1N1-pdm09 is due to modulation of NS1-mediated cellular innate immune responses[J].JournalofAntimicrobialChemotherapy, 2014, 69(5):1298-1310.
[8] ZHU J L, WANG J F, SHENG Y, et al. Baicalin improves survival in a murine model of polymicrobial sepsis via suppressing inflammatory response and lymphocyte apoptosis[J].PLoSOne, 2012, 7(5):e35523.
[9] 刘晓婷. 黄芩苷对流感病毒H1N1感染A549细胞的作用及免疫调控机制的研究[D]. 北京:北京中医药大学, 2016.
LIU X T. Effect of Baicalin on influenza virus H1N1 infection in A549 cells and its immunoregulation mechanism[D]. Beijing: Beijing University of Chinese Medicine, 2016.(in Chinese with English abstract)
[10] JIA Y, XU R G, HU Y C, et al. Anti-NDV activity of baicalin from a traditional Chinese medicineinvitro[J].JournalofVeterinaryMedicalScience, 2016, 78(5):819-824.
[11] KUMAR H, KAWAI T, AKIRA S. Biochemical and biophysical research communications toll-like receptors and innate immunity[J].BiochemicalandBiophysicalResearchCommunications, 2009, 388(4):621-625.
[12] 何晓霞, 白海. Toll样受体的研究进展[J]. 西北国防医学杂志,2010,31(6):445-446.
HE X X, BAI H. Advances in toll like receptors[J].MedicalJournalofNationalDefendingForcesinNorthwestChina, 2010,31(6):445-446.(in Chinese)
[13] 丁娜, 孙英杰, 丁铲. 禽Toll样受体研究进展[J]. 中国动物传染病学报,2011,19(6):77-83.
DING N, SUN Y J, DING C. Research progress in avian toll-like receotors[J].ChineseJournalofVeterinaryParasitology, 2011, 19(6):77-83.(in Chinese with English abstract)
[14] VERMA A, PRASAD K N, SINGH A K, et al. Evaluation of the MTT lymphocyte proliferation assay for the diagnosis of neurocysticercosis[J].JournalofMicrobiologicalMethods, 2010, 81(2):175-178.
[15] CHEN M Z, XIE H G, YANG L W, et al.Invitroanti-influenza virus activities of sulfated polysaccharide fractions fromGracilarialemaneiformis[J].VirologicaSinica, 2010, 25(5):341-351.
[16] 张婷婷. 两种不同来源新城疫病毒的感染对鸡免疫作用的分子机制[D]. 哈尔滨:东北农业大学, 2015.
ZHANG T T. The molecular mechanism of infection ofNewcastleDiseaseVirusfrom different hosts on theimmune function of chickens[D]. Harbin: Northeast Agricultural University, 2015.(in Chinese with English abstract)
[17] AKIRA S, UEMATSU S, TAKEUCHI O. Pathogen recognition and innate immunity[J].Cell, 2006, 124(4):783-801.
[18] KURTJONES E A, BELKO J, YU C, et al. The role of toll-like receptors in herpes simplex infection in neonates[J].JournalofInfectiousDiseases, 2005, 191(5):746-748.
[19] ZHOU S, HALLE A, KURTJONES E A, et al.Lymphocyticchoriomeningitisvirus(LCMV) infection of CNS glial cells results in TLR2-MyD88/Mal-dependent inflammatory responses[J].JournalofNeuroimmunology, 2008, 194(1/2):70.
[20] SEGOVIA J, SABBAH A, MGBMENA V, et al. TLR2/MyD88/NF-κB pathway, reactive oxygen species, potassium efflux activates NLRP3/ASC inflammasome during respiratory syncytial virus infection[J].PLoSOne, 2012, 7(1):e29695.
[21] PAULINE MENAGER P R F M. Toll-like receptor 3 (TLR3) plays a major role in the formation of rabies virus Negri Bodies[J].PLoSPathogens, 2009, 5(2):e1000315.
[22] ALEXOPOULOU L, HOLT A C, MEDZHITOV R, et al. Recognition of double-stranded RNA and activation of NF-kappaB by toll-like receptor 3[J].Nature, 2001, 413(6857):732-738.
[23] CHENG J, SUN Y, ZHANG X, et al. Toll-like receptor 3 inhibitsNewcastlediseasevirusreplication through activation of pro-inflammatory cytokines and the type-1 interferon pathway[J].ArchivesofVirology, 2014, 159(11):2937-2948.
[24] TAKEUCHI O, AKIRA S. MyD88 as a bottle neck in Toll/IL-1 signaling[J].CurrentTopicsinMicrobiology&Immunology, 2002, 270:155-167.
[25] YAMAMOTO M, SATO S, HEMMI H, et al. TRAM is specifically involved in the toll-like receptor 4-mediated MyD88-independent signaling pathway[J].NatureImmunology, 2003, 4(11):1144-1150.
[26] TOWN T, BAI F W, WANG T, et al. Toll-like receptor 7 mitigates lethal West Nile encephalitis via interleukin 23-dependent immune cell infiltration and homing[J].Immunity, 2009, 30(2):242-253.
[27] BAKER D G, WOODS T A, BUTCHI N B, et al. Toll-like
receptor 7 suppresses virus replication in neurons but does not affect viral pathogenesis in a mouse model of Langat virus infection[J].JournalofGeneralVirology, 2013,94(Pt 2):336-347.
[28] KLEIN K P, TAN L, WERKMAN W, et al. The role of toll-like receptors in regulating the immune response against respiratory syncytial virus[J].CriticalReviewsinImmunology, 2009, 29(6):531-550.
EffectofBaicalinonexpressionofToll-likereceptor2,3,4,7inNewcastlediseasevirus-infectedCEFs
XU Ruiguang1, JIA Yan2, HU Liwen1, WENG Jiahua1, DENG Junliang1, HU Yanchun1,*
(1.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China; 2.AgriculturalandEnvironmentalBranch,JiaxingVocationalTechnicalCollege,Jiaxing314036,China)
The purpose of this study was to investigate the changes of the expression ofTLR2,TLR3,TLR4 andTLR7 gene in NDV-infected cells and the effect of Baicalin on them. NDV infection of chicken embryo fibroblasts (CEFs) was performed. Cytotoxicity of Baicalin was tested by the MTT method. Quantitative expressions ofTLR2,TLR3,TLR4 andTLR7 gene were analyzed by real-time fluorescence quantitative PCR (RTFQ PCR). The results showed that the expressions ofTLR2,TLR4 andTLR7 genes were suppressed by NDV in the early infection stage, while their expression were enhanced with the replication of NDV and the expression ofTLR2 andTLR4 gene reached the peak level at 24 h. As well as the expression ofTLR7 gene reached the peak level at 16 h. The infection of NDV could change the expression ofTLR3 gene, but it was not regular. Besides, Baicalin could increase the expression ofTLR2 andTLR4 genes in NDV-infected cells and show the dosage-dependence, which enhanced immune function and possessed anti-NDV activity.
Baicalin;Newcastlediseasevirus(NDV); Toll-like receptors (TLRs);real-time fluorescence quantitative PCR (RTFQ PCR)
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(12): 1986-1993
http://www.zjnyxb.cn
许锐光,贾艳,胡力文,等. 黄芩甙对新城疫病毒感染鸡胚成纤维细胞Toll样受体2、3、4、7 mRNA表达的影响[J].浙江农业学报, 2017,29(12): 1986-1993.
10.3969/j.issn.1004-1524.2017.12.05
2017-05-22
四川省科技支撑项目(2015SZ0201);教育部创新团队项目(IRT0848);四川省学术和技术带头人培养基金项目(2014,2016)
许锐光(1993—),女,河北沧州人,硕士研究生,研究方向为动物环境公害性疾病。E-mail: 597033704@qq.com
*通信作者,胡延春,E-mail: hychun114@163.com
S831.7
A
1004-1524(2017)12-1986-08
(责任编辑卢福庄)

