抵抗素基因多态性与伴或不伴阻塞性睡眠呼吸暂停低通气综合征的高血压患者的相关性
陈 成 ,王先梅 ,杨丽霞 ,曹现宝,孙景豫 ,秦 鼐 ,徐梦云,唐仁春 ,王一交 ,张利军 ,万秋华 ,段亚南
(1.成都军区昆明总医院心血管内科,昆明650032;2.昆明医科大学研究生部,昆明650500;3.成都军区昆明总医院耳鼻咽喉颌面外科,昆明650032)
抵抗素基因多态性与伴或不伴阻塞性睡眠呼吸暂停低通气综合征的高血压患者的相关性
陈 成1,2,王先梅1,杨丽霞1,曹现宝3,孙景豫3,秦 鼐1,徐梦云1,唐仁春1,王一交1,张利军1,万秋华1,段亚南1
(1.成都军区昆明总医院心血管内科,昆明650032;2.昆明医科大学研究生部,昆明650500;3.成都军区昆明总医院耳鼻咽喉颌面外科,昆明650032)
目的探讨抵抗素-420C/G位点基因多态性与原发性高血压(essential hypertension,EH)、阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)相关性EH患者的相关性。方法选取OSAHS并发EH的患者50例,设为EH+OSAHS组;选择同期成都军区昆明总医院就诊的单纯EH患者60例、OSAHS患者35例,同期体检中心健康体检者31名,分别设为EH组、OSAHS组、N组。监测并记录入选患者血压、睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)、身高、体质量以及血常规、生化常规结果;采用聚合酶连反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RELP)方法测定抵抗素单核苷酸多态性(single nucleotide polymorphism,SNP)-420C/G(rs1862513)的基因型,酶联免疫吸附试验(ELISA)法测定各组血清抵抗素浓度;彩色超声诊断仪测定入选者颈动脉内膜-中层厚度(carotid intima-middle thickness,CIMT)。Logistic回归分析EH+OSAHS组抵抗素基因型多态性与体质量指数(body mass index,BMI)、血压及CIMT的关系。结果(1)血清抵抗素浓度在N组[(0.5883±0.0070)pg/mL]、OSAHS组[(0.5989±0.0010)pg/mL]、EH组[(0.6007±0.0055)pg/mL]、EH+OSAHS组[(0.6035±0.0085)pg/mL]逐渐升高,3个病例组与N组比较,差异均有统计学意义(P<0.05)。(2)抵抗素基因SNP-420C/G(rs1862513)基因型频率和等位基因频率在EH+OSAHS组和N组之间分布比较,差异有统计学意义(P<0.05)。(3)EH组和OSAHS相关性EH组的CIMT与N组、OSAHS组比较,差异有统计学意义(P<0.01)。(4)Logistic回归分析显示,EH+OSAHS组中抵抗素SNP-420C/G位点携带G1等位基因者有着更高的BMI(OR=1.310,P<0.05)、舒张压(OR=1.145,P<0.05)及CIMT(OR=3.054,P<0.05)。结论高血清抵抗素浓度与EH、OSAHS相关性EH密切相关。抵抗素基因SNP-420C/G与OSAHS相关性EH相关,G等位基因可能是肥胖和舒张压升高的危险因素。OSAHS相关性EH患者中携带G等位基因者更易发生动脉粥样硬化。
原发性高血压;阻塞性睡眠呼吸暂停低通气综合征;抵抗素;基因多态性
人体血压的高低与睡眠觉醒周期密切相关。阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrom,OSAHS)是各种原因导致睡眠状态下反复出现呼吸暂停和(或)低通气,引起一系列病理学、病理生理学改变的临床综合征[1]。50%的OSAHS患者伴有原发性高血压(essential hypertension,EH),30%以上的EH患者并发OSAHS,OSAHS是独立于年龄、性别、吸烟、肥胖、生活压力以及心、肾疾病等以外的EH发病的独立危险因素[2-3]。OSAHS相关性EH患者不仅很常见,且其与EH的临床诊治有很大差异。对于0SAHS相关性EH的患者,常规的降压药物往往不能明显改善24 h血压,且睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)越高,降压药物的效果越差[4-5]。采用持续气道正压通气(CPAP)或行悬雍垂-腭-咽成形术(UPPP)和口腔矫治器等方式治疗者,上述难治性血压常可获得较为满意的效果。但亦有研究表明持续气道正压通气或行悬雍垂-腭-咽成形术等治疗并不能降低OSAHS并发EH且正在服用降压药治疗的患者的血压[6-7]。EH的发生、发展和内皮功能紊乱关系密切[8],OSAHS引起的低氧血症和高碳酸血症通过各种机制进一步加重血管内皮功能异常;内皮功能下降促进斑块形成,颈动脉内膜中层厚度(carotid intima-middle thickness,CIMT)增厚与动脉硬化密切相关。CIMT与晚间血压变化之间存在相关性[9],目前在人类的动脉粥样硬化斑块中找到了抵抗素mRNA及其蛋白质的表达[10]。抵抗素是脂肪源性的分泌型多肽,在人白色脂肪的基质血管部及外周血中可检出[11-12]。单核苷酸多态性(single nucleotide polymorphism,SNPs)是决定不同人群疾病易感性和药物治疗敏感性的标记。在抵抗素的多个多态性位点中以SNP-420C>G被认为是影响抵抗素基因表达的主要的多态性位点[13]。研究显示,血清抵抗素与原发性EH、OSAHS有相关关系[14-17]。本研究试图阐明血清抵抗素浓度及其420C/G位点基因多态性与原发性EH、OSAHS相关性EH的关系,探索其临床意义及应用前景,报道如下。
1 资料和方法
1.1 一般资料
收集2014年8月至2015年9月在成都军区昆明总医院院心内科、耳鼻喉科、睡眠监测室、体检中心就诊的中青年患者及体检者,结合病史、血压及多导睡眠图(polysomnography,PSG)监测结果,选择无EH的OSAHS患者35例为OSAHS组,男28例,女7例,年龄(41.00±6.87)岁;单纯EH无OSAHS的患者60例为EH组,男45例,女15例,年龄(43.20±5.32)岁;并发EH的OSAHS患者50例为EH+OSAHS组,男38例,女12例,年龄(43.36±7.33)岁;无OSAHS也无EH的体检健康者31名为对照组,男23名,女8名,年龄(44.70±9.75)岁。EH诊断参照文献[18]标准,入选者为初次诊断EH,或既往明确诊断EH而入选时血压控制未达标,且标本采集时已停服降压药≥2周者。OSAHS诊断参照文献[1]标准。排除标准:(1)其他继发性高血压的患者;(2)并发严重心、肺、消化系统疾病、肝及肾功能不全的患者;(3)有感染性疾病、内分泌疾病、结缔组织病、恶性肿瘤等慢性疾病及滥用酒精或药物者;(4)有精神病史或不能理解、不能签署知情同意书及配合实验的患者。4组入选者性别、年龄比较,差异无统计学意义(P>0.05),具可比性。
1.2 研究方法
1.2.1一般情况测量入选者在我院心内科超声心动图室由同一名超声医生进行CIMT测量;据睡眠呼吸监测结果计算AHI(每小时睡眠中呼吸暂停次数+低通气次数);病例组在睡眠呼吸监测当晚睡前、次日晨清醒时及日间测量静息血压、取平均值;监测当晚测量身高(m)、体质量(kg),计算体质量指数(body mass index,BMI)。
1.2.2标本采集及贮存监测次日晨采集空腹静脉血6 mL,对照组由门诊体检中心采集同类型标本:4 mL空腹静脉血置于非抗凝试管中,室温放置2 h后离心(1 000 r/min,20 min)分离血清分装标记;另外2 mL置于乙二胺四乙酸(EDTA)管,低温离心机4℃离心(1 500 r/min,20 min)收集血浆及血细胞,置-8O℃超低温冰箱保存待用。
1.2.3血清抵抗素浓度及临床指标测定采用酶联免疫吸附试验(ELISA)法测定所有标本的血清抵抗素浓度,操作过程严格按照试剂盒(武汉Cloud-Clone-Corp试剂公司)说明书进行;常规检测入选者血常规(血红蛋白)、生化[空腹血糖、三酰甘油(triacylglycerol,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)]等指标。
1.2.4抵抗素单核苷酸多态性-420C/G的基因型分析血液DNA提取试剂盒(TIANGEN公司)提取外周血DNA后采用聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)法测定。PCR引物设计参照文献应用primer5.0软件得出,由上海生物工程有限公司合成及纯化:-420上游引物为5′-GTTTGCATCAGCCACCCT-3′,下游引物为5′-GCACCGCAGCTCTTTCTT-3′。PCR反应体系为25 μL,条件为94℃预变性3 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,循环35次,末次循环后72℃额外延伸3 min。取6μL的PCR产物经2%琼脂糖凝胶电泳确认,扩增片段长度286 bp。然后用Bpi I限制性内切酶37℃酶切14 h,再以2%琼脂糖凝胶电泳分离酶切产物,紫外灯下观察。
1.3 统计学分析
按Hardy-Weinberg平衡法计算各样本基因型频率分布,具有群体代表性。应用SPSS 17.0统计软件进行统计学处理。计量资料以()表示,多组间比较采用方差分析(F检验),多个样本均数两两比较采用S-N-K、LSD-t检验。计数资料以[n(%)]表示,采用χ2检验。Logistic回归法评价各变量与OSAHS并发EH之间的相关关系,相对风险度以比值比(OR)和95%的置信区间(CI)表示。以P<0.05为差异有统计学意义。
2 结果
2.1 各组基线资料比较
EH+OSAHS组吸烟患者(32例)较对照组(11例)、OSAHS组(19例)、EH组(27例)高,差异有统计学意义(P<0.05)。4组的基线资料比较,详见表1。抵抗素水平:对照组<OSAHS组<EH组<EH+OSAHS组,OSAHS组、EH组、EH+OSAHS组与N组比较差异均有统计学意义,P值分别为0.001、0.000、0.000,其余组间两两比较差异无统计学意义(P>0.05)。
2.2 抵抗素基因位点-420C/G分型结果
抵抗素-420C/G位点有3种基因型:抵抗素-420(GG),酶切后仅有286 bp一条带;抵抗素-420(CG),酶切后有286 bp、179 bp和107 bp三条带;抵抗素-420(CC),酶切后有179 bp和107 bp两条带。3种基因型样本的PCR产物测序结果与国内张凌云、付景云等[28-29]的研究资料一致。
2.3 抵抗素基因位点-420C/G多态性分布特点
(1)病例组和对照组各基因型及等位基因分布见表2。抵抗素基因-420C/G位点等位基因频率在4组人群分布与预期频率基本一致(P>0.05),符合Hardy-weinberg平衡,具有群体代表性。(2)抵抗素-420C/G位点GG、CG、CC基因型频率在对照组分别为0.097、0.194、0.71;在OSAHS组分别为0.2、0.343、0.457;在EH组分别为0.133、0.4、0.467;在EH+OSAHS组分别为0.3、0.34、0.36。基因型频率在EH+OSAHS组和对照组之间分布有显著统计学意义(P<0.01),其余组间两两比较差异无统计学意义(P>0.05)。G等位基因在3个病例组均明显高于对照组,差异有统计学意义(P<0.05)。
表14 组基线资料比较 [±s]

表14 组基线资料比较 [±s]
注:1 mmHg=0.133 kPa;与对照组比较,*P<0.05,**P<0.01;与OSAHS组比较,1)*P<0.05,1)**P<0.01;与EH组比较,2)*P<0.05,2)**P<0.01
项目n BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)TC(mmol/L)TG(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)空腹血糖(mmol/L)血红蛋白(g/L)AHI(次/h)CIMT(mm)抵抗素(pg/mL)对照组31 21.87±2.15 115.20±10.84 69.40±7.60 4.75±1.34 1.68±0.33 1.70±0.25 2.06±0.77 4.96±0.53 140.20±13.72 2.90±1.20 0.81±0.19 0.5883±0.0070 OSAHS组35 28.54±2.11*124.11±22.50 83.33±16.00*5.99±0.90*3.01±1.14*1.23±0.51*2.62±0.63 5.38±0.69 151.00±11.10 20.22±5.52*0.86±0.29 0.5989±0.0010*EH组60 24.07±2.47*,1)*167.00±14.04*,1)*98.53±9.64*,1)*5.39±0.93 1.79±0.901)*1.34±0.55*3.20±0.72*5.31±0.78 140.93±14.39 3.20±1.321)*1.16±0.13*,1)*0.6007±0.0055*,1)*EH+OSAHS组50 29.31±5.79*,1)*179.14±19.32*109.00±9.53*,1)*,2)*7.58±1.47*,1)*,2)*2.76±1.87*,2)*1.09±0.31*,2)*3.99±0.84*,1)*,2)*6.46±2.02*,1)*,2)*157.07±16.15*,2)*30.14±9.24*,1)*,2)*1.39±0.26*,1)*,2)*0.6035±0.0085*,1)*,2)*

表24 组抵抗素-420C/G基因型频率和等位基因频率比较 [n(%)]
2.4 EH+OSAHS组抵抗素-420C/G不同基因型的一般临床资料比较
抵抗素-420C/G各基因型频率与临床资料比较:携带G等位基因的OSAHS相关性EH人群有着更高的血清抵抗素浓度、更高的AHI、BMI、收缩压、舒张压和CIMT,差异有统计学意义(P>0.05),详见表3。
2.5 Logistic回归分析结果
以EH+OSAHS组BMI、舒张压及CIMT分别为因变量,以抵抗素-420C/G基因型为自变量进行分析后显示,抵抗素-420C/G位点携带G等位基因者高BMI危险度是不携带G等位基因者的1.31倍(95%CI:0.890~1.929;P=0.049);携带G等位基因者高舒张压是不携带者的1.145倍(95%CI:1.008~1.300;P=0.037);携带G等位基因者高CIMT是不携带者的3.054倍(95%CI:0.105~1.552;P=0.046),详见表4。EH+OSAHS组人群中抵抗素-420C/G位点携带G等位基因者有着更高的BMI、舒张压及CIMT。
表3 EH+OSAHS组抵抗素-420C/G基因多态性与一般临床资料比较 [±s]
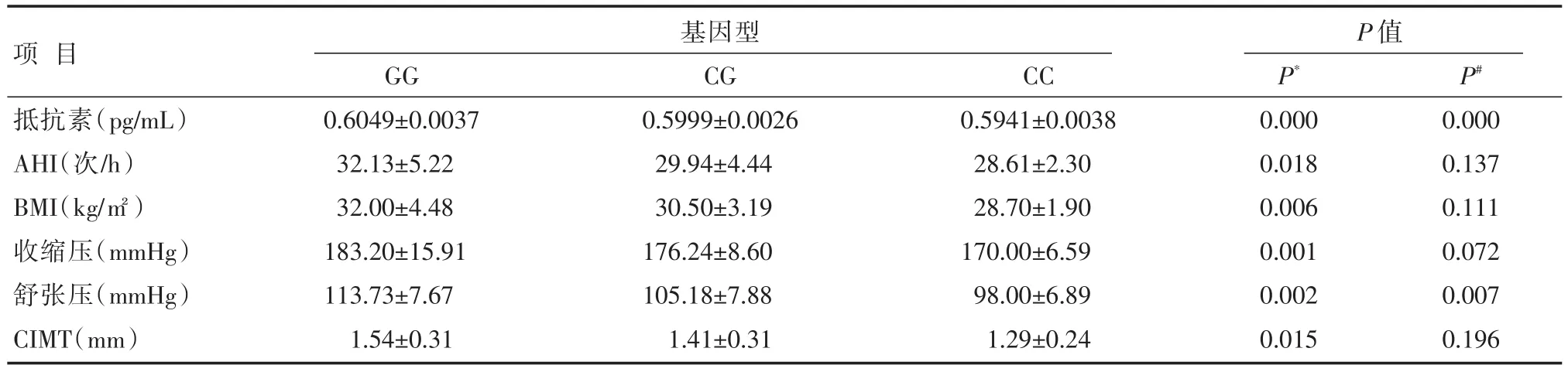
表3 EH+OSAHS组抵抗素-420C/G基因多态性与一般临床资料比较 [±s]
注:P*为基因型GG组与CC组比较;P#为基因型CG组与CC组比较
项目抵抗素(pg/mL)AHI(次/h)BMI(kg/㎡)收缩压(mmHg)舒张压(mmHg)CIMT(mm)基因型P值GG 0.6049±0.0037 32.13±5.22 32.00±4.48 183.20±15.91 113.73±7.67 1.54±0.31 CG 0.5999±0.0026 29.94±4.44 30.50±3.19 176.24±8.60 105.18±7.88 1.41±0.31 CC 0.5941±0.0038 28.61±2.30 28.70±1.90 170.00±6.59 98.00±6.89 1.29±0.24 P*P#0.000 0.018 0.006 0.001 0.002 0.015 0.000 0.137 0.111 0.072 0.007 0.196
表4 EH+OSAHS组抵抗素-420C/G基因型多态性与BMI、血压及CIMT的回归分析 [±s]
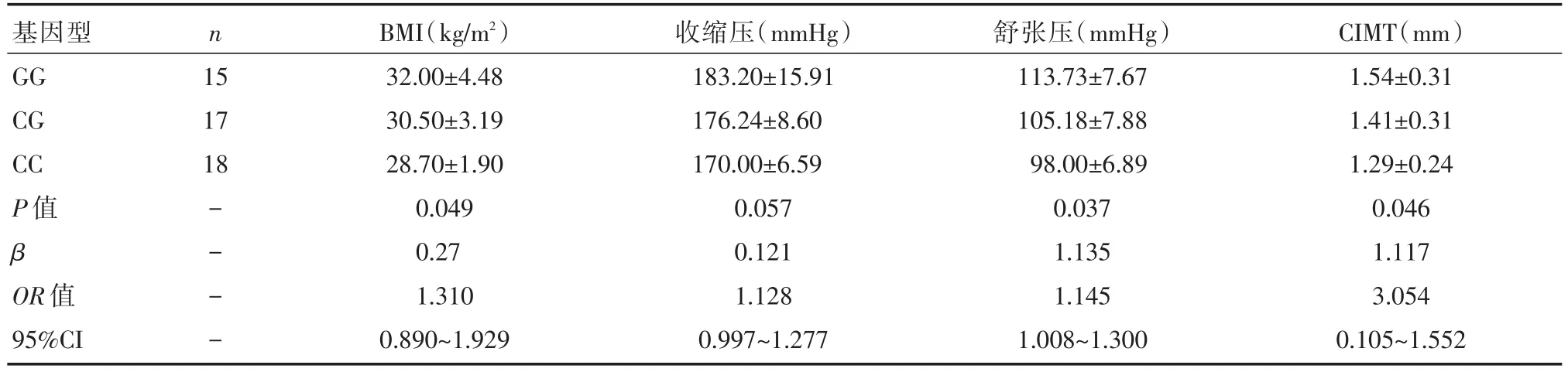
表4 EH+OSAHS组抵抗素-420C/G基因型多态性与BMI、血压及CIMT的回归分析 [±s]
注:β为回归系数;OR为危险度;95%CI为95%置信区间
基因型GG CG CC P值β OR值95%CI n 15 17 18----BMI(kg/m2)32.00±4.48 30.50±3.19 28.70±1.90 0.049 0.27 1.310 0.890~1.929收缩压(mmHg)183.20±15.91 176.24±8.60 170.00±6.59 0.057 0.121 1.128 0.997~1.277舒张压(mmHg)113.73±7.67 105.18±7.88 98.00±6.89 0.037 1.135 1.145 1.008~1.300 CIMT(mm)1.54±0.31 1.41±0.31 1.29±0.24 0.046 1.117 3.054 0.105~1.552
3 讨论
阻塞性睡眠呼吸暂停是反复缺氧再复氧的过程,可引起氧化应激和炎症损伤,成为慢性间歇低氧(CIH)与血压相关性损害的细胞和分子基础[19]。OSAHS相关性EH患者在长期慢性缺氧或再复氧的氧化应激状态下引起夜间以副交感神经张力为主转为以交感神经张力为主的调节机制,患者的生理性“勺状”血压变化趋势减弱甚或消失[20-22]。研究显示,OSAHS已成为顽固性EH的最主要病因,本文收集的85例OSAHS患者中50例并发EH,占58.82%,与目前的研究基本一致[6,23]。但目前OSAHS相关性EH的发病机制尚未完全明确,且并非所有OSAHS相关性EH患者均愿意接受或能耐受持续气道正压通气(CPAP)治疗。因此,发现新的、更便捷有效的细胞因子或分子遗传学方面的探索,将有望为OSAHS相关性EH等顽固性EH患者的诊治提供新思路。
抵抗素是Steppan等于2001年在研究噻唑烷二酮类药物作用机制的动物实验中发现的源于白色脂肪组织的分泌型多肽,具调节代谢、介导血管炎症等作用。人抵抗素mRNA在白色脂肪的基质血管部及外周血能检出[9-11]。抵抗素基因SNP的系统调查及遗传学研究发现了抵抗素的多个多态性位点,其中-420C>G被认为是影响抵抗素基因表达的主要位点[12,14]。研究表明,SNP-420C/G 与血清抵抗素浓度升高有关,并证实SNP-420与抵抗素浓度的关系为G/G >C/G >C/C[13,24]。目前已在鼠和人的动脉粥样硬化斑块中发现了抵抗素mRNA及其蛋白质的表达,而动脉粥样硬化斑块形成是EH的基本病理基础[13,25]。研究显示,血清抵抗素与EH、OSAHS及胰岛素抵抗关联的促红细胞生成素反应是相关的,与炎性介质如白细胞介素-6(IL-6)、超敏C-反应蛋白等也具有相关性,而慢性炎症在OSAHS相关性EH的发病过程中起重要作用[17,26]。但抵抗素基因非编码区的SNP与BMI、EH等是否相关尚有争议。
云南是我国EH的高发区,我们对该地区汉族OSAHS及EH患者进行了血清抵抗素浓度测定,并对抵抗素-420C/G位点进行了基因检测,探讨抵抗素-420C/G基因多态性与OSAHS相关性EH患者动脉粥样硬化的关系。
本研究结果显示:(1)血清抵抗素浓度在对照组、OSAHS组、EH组、EH+OSAHS组逐渐升高,3个病例组与正常对照组比较,有着更高的BMI、舒张压及血清抵抗素浓度,表明肥胖、舒张压及高抵抗素浓度与EH、OSAHS、OSAHS相关性EH密切相关。(2)抵抗素基因SNP-420C/G(rs1862513)基因型频率及等位基因频率在EH+OSAHS组和对照组之间比较有显著性差异(P<0.01),G等位基因可能为OSAHS相关性EH患者发病的危险因素,但亦有研究认为抵抗素基因多态性与EH无明显相关关系[27]。(3)EH组和OSAHS相关性EH组CIMT与对照组、OSAHS组比较,差异均有统计学意义(P<0.01),表明CIMT与EH、OSAHS相关性EH的发生密切相关;抵抗素-420C/G基因变异与CIMT相关,携带G等位基因者有着更高的CIMT。CIMT是反映动脉粥样硬化程度的重要指标,可见抵抗素-420C/G位点G等位基因可能是动脉粥样硬化发生、发展的重要因素,因EH组和对照组中血脂浓度无明显差异,提示抵抗素-420C/G位点G等位基因可能有独立于血脂以外的促动脉粥样硬化作用。这与现有部分研究一致[28-29]。(4)Logistic回归分析表明,EH+OSAHS患者组中抵抗素-420C/G位点携带G等位基因者有着更高的BMI、舒张压及CIMT。
本研究中,血清抵抗素浓度在对照组、OSAHS组、EH组、EH+OSAHS组逐渐升高,3个病例组与对照组比较,差异均有统计学意义(P<0.01),表明OSAHS及EH患者存在高抵抗素血症。原因可能:抵抗素是一种具有促炎作用的多肽,会受OSAHS调控的炎症因子白细胞介素-6、肿瘤坏死因子-α等的影响,进而上调其mRNA的表达[30-31]。已知肥胖是OSAHS的危险因素之一,而OSAHS也是导致肥胖的原因之一。有研究认为,抵抗素通过促进血糖升高、刺激脂肪细胞增殖等途径引起肥胖[32],提示抵抗素在OSAHS及肥胖的关联中起到一定作用。抵抗素作为脂肪源性的分泌型多肽,其血清浓度在OSAHS、OSAHS相关性EH患者中升高可能与抑制前体脂肪细胞向成熟脂肪细胞分化有关[33-34]。该研究还发现:在EH+OSAHS组患者中,抵抗素-420C/G位点基因型频率及等位基因频率和对照组之间比较,差异有统计学意义(P<0.01)。G等位基因在3个病例组均明显高于对照组,相关及回归分析表明携带G等位基因的OSAHS相关性EH人群有着更高的血清抵抗素浓度、更高的 AHI、BMI、舒张压和 CIMT(P<0.05)。提示SNP-420C/G位点基因变异可能是OSAHS相关性EH的危险因素之一。
OSAHS相关性EH的发病机制尚未完全明确,治疗效果欠佳。综上所述,抵抗素作为脂肪源性的分泌型多肽,其高血清浓度与OSAHS、EH、OSAHS相关性EH有相关关系,且其SNP-420C/G位点基因变异与OSAHS相关性EH也有相关关系。进一步的研究有望为OSAHS相关性EH等难治性EH患者的治疗提供新的诊疗思路。但由于本研究是单中心、小样本的横断面设计,研究结论存在一定的局限性,还需大样本、多中心的随机对照研究加以阐述。
[1]中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)[J].中华结核和呼吸杂志,2012,35(1):9-12.
[2]DRAGER L F,GENTA P R,PEDROSA R P,et al.Characteristtics and predictors of obstructive sleep apnea in patients with systemic hypertension[J].Am J Cardiol,2010,105(8):1135-1139.
[3]LEVYP,TAMISIER R,ARNAUD C,et al.Sleep deprivation,sleep apnea and cardiovascular diseases[J].Front Biosci(EliteEd),2012,1(4):2007-2021.
[4]GOODSON B L,WUNG S F,ARCHBOLD K H.Obstructive sleep apnea hypopnea syndrome and metabolic syndrome:a synergistic cardiovascular risk factor[J].J Am Acad Nurse Pract,2012,24(12):695-703.
[5]PHILLIPS C L,ODRISCOLL D M.Hypertension and obstructive sleep apnea[J].Nat Sci Sleep,20l3,10(5):43-52.
[6]SOVA M,SOVOVA E,HOBZOVA M,et al.Research of relations among sleep disorders,obstructive sleep apnoea,hypertension onset and hypertensive treatment-current or long-term trend[J].Vnitr Lek,2015,61(1):50-55.
[7]GARCIA J M,SHARAFKHANEH H,HIRSHKOWITZ M,et al.Weight and metabolic effects of CPAP in obstructive sleep apnea patients with obesity[J].Epub,2012,8(14):7745-7599.
[8]陈懿宇,张京春,陈静,等.伴及不伴睡眠呼吸暂停的高血压患者内皮功能[J].中国老年学杂志,2013,33(2):262-265.
[9]李国标,张卫.老年高血压患者脉压与颈动脉内膜中层厚度关系[J].岭南心血管病杂志,2007,l3(3):195-196.
[10] PATEL L,BUCKELS A C,KINGHORN I J,et a1.Resistinis expressed in human macrophages and directlyregulatedby PPARg activators[J].Biochem Biophys Res Commun,2003,300(2):472-476.
[11] STCJSKAL D,PROSKOVD J,ADAMOVSKA S,et a1.Preliminary experience with resistin assessment in common population[J].Biomed Pap Med Fac Univ Palaeky Olomouc Czech Repub,2002,146(2):47-49.
[12] SADASHIV,TIWARI S,PAUL B N,et al.Over expression of resistin in adipose tissue of the obese induces insulin resistance[J].World J Diabetes,2012,3(7):135-141.
[13] OSAWA H,TABARA Y,KAWAMOTO R,et a1.Plasma resistin,associated with single nucleotide polymorphism-420,is correlated with insulin resistance,lower HDL cholesterol,and hish-sensitivity C-reactive protein in the Japanese general population[J].Diabetes Care,2007,30(6):1501-1506.
[14]孙亚东,马彦,杨乐.抵抗素基因多态性与中国东北地区汉族老年人群2型糖尿病患病的相关性[J].中国老年学杂志,2011,31(23):4515-4516.
[15] 李劲然,张桂珍,陈琰,等.抵抗素基因rs34861182多态性与东北汉族人群2型糖尿病相关性研究[J].中国实验诊断学,2014,18(3):456-458.
[16] TANAKA N,KUSUNOKI N,KUSUNOKI Y,et a1.Resistin is associated with the inflammation process in patients with systemic autoimmune diseases undergoing glucocorticoid therapy:comparison with leptin and adiponectin[J].Mod Rheumatol,2013,23(1):8-18.
[17]迟玉梅.阻塞性睡眠呼吸暂停综合征与血清抵抗素水平相关性的分析[J].中国现代医生,2013,51(11):141-142.
[18]中国高血压防治指南修订委员会.中国高血压防治指南3版[M].北京:人民卫生出版社,2010:18-20.
[19] JULIAN C G,VARGAS E,GONZALES M,et al.Sleep disordered breathing and oxidative stress in preclinical chronic mountain sickness(excessive erythrocytosis)[J].Respir Physiol Neurobiol,2013,186(2):188-196.
[20] PRIOU P,LE VAILLANT M,MESLIER N,et al.Cumulative association of obstructive sleep apnea severity and short sleep duration with the risk for hypertension[J].PLoS One,2014,9(12):22-26.
[21] LI L,GUO LZ,LI J,et al.White coat hypertension and obstructive sleep apnea[J].Sleep Breath,2015,14(5):45-50.
[22] SNCHEZ-DE-LA-TORRE M,BARCEL A,PIROLA J,et al.Impact of obstructive sleep apnea on the 24-h metabolic hormone profile[J].Sleep Med.2014,15(6):625-630.
[23]中国医师协会高血压专业委员会,中华医学会呼吸病学分会睡眠呼吸障碍学组.阻塞性睡眠呼吸暂停相关性高血压临床诊断和治疗专家共识[J].中国呼吸与危重监护杂志,2013,12(5):435-441
[24] ONUMA H,OCHI M,MURAKAMI A,et a1.Resistin SNP-420 determines its monocyte mRNA and serum levels inducing type 2 diabetes[J].Biochem Biophys Res Comrnun,2005,335(2):596-602.
[25]刘跃辉,张致丹,丁华,等.高血压病患者颈动脉斑块与内皮细胞功能相关性的研究[J].中国卫生标准管理,2015,6(22):87-88.
[26] FU C,JIANG L,ZHU F,et a1.Chronic intermittent hypoxia leads to insulin resistance and impaired glucose tolerance through dysregulation of adipokines in non-obese rats[J].Sleep Breath,2015,19(4):1467-1473.
[27]赵红,张娜,袁仕善,等.抵抗素基因多态性与原发性高血压及血脂的相关性研究[J].湖南师范大学自然科学学报,2008,31(1):95-99.
[28] OSAWA H,DOI Y,MAKINO H,et a1.Diabetes and hypertension markedly increased the risk of ischemic stroke associated with high serum resistin concentration in a general Japanese population: the Hisayama Study[J].Cardiovasc Diabetol,2009,8(60):1-8.
[29]张凌云,金勇君,安新荣,等.抵抗素基因420C/G基因型与高血压发病年龄相关[J].中国动脉硬化杂志,2009,17(12):1027-1029.
[30]张娜,李伟红,林宇涵.抵抗素通过内质网应激致血管内皮细胞产生胰岛素抵抗[J].军事医学,2015,39(8):607-609,625.
[31] WANG H,SUN R Q,ZENG X Y,et al.Restoration of autophagy alleviates hepatic ER stress and impaired insulin signalling transductionin high fructose-fed male mic[J].Endocrinology.2015,1(1):169-181.
[32] SONG R,WANG X,MAO Y,et al.Resistin disrupts glycogen synthesis under high insulin and high glucose levels by down-regulating the hepatic levels of GSK3β[J].Gene,2013,529(1):50-56.
[33] SHENG C H,DU Z W,SONG Y,et al.Human resistin inhibits myogenic differentiation and induces insulin resistance in myocytes[J].Biomed Res Int,2013,2013(1):125-125.
[34] 张卫,曾卓,王蔚,等.高血压患者抵抗素与左室肥厚的相关性[J].实用医学杂志,2015,31(4):550-552.
Correlation analysis between resistin gene polymorphism and the hypertension patients with or without obstructive sleep apnea hypopnea syndrome
CHEN Cheng1,2,WANG Xian-mei1,YANG Li-xia1,CAO Xian-bao3,SUN Jing-yu3,QIN Nai1,XU Mengyun1,TANG Ren-chun1,WANG Yi-jiao1,ZHANG Li-jun,WAN Qiu-hua1,DUAN Ya-nan1
(1.Department of Cardiovascular Medicine,Kunming General Hospital of Chengdu Military Command,Kunming 650032,China;2.Kunming Medical University Graduate Department,Kunming 650500,China;3.Department of ENT & Maxillofacial Surgery,Kunming General Hospital of Chengdu Military Command,Kunming 650032,China)
ObjectivesTo investigate the correlation between resistin site-420C/G gene polymorphism and patients with essential hypertension(EH),obstructive sleep apnea hypopnea syndrome(OSAHS)related EH.MethodsTotally 50 patients with OSAHS combined EH were selected for EH+OSAHS group,60 patients with simple EH hospital-ized in the same period were selected as EH group,35 patients with OSAHS were selected as OSAHS group,31 cases of healthy check-up were selected as N group.Blood pressure,apnea hypopnea index(AHI),height,weight and routine biochemical results were detected and recorded.Using polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP)method to determin resistin single nucleotide polymorphism(SNP)-420C/G(rs1862513)genotype and serum concentrations of resistin in each group were detected by enzyme linked immunosorbent assay method.Carotid intima-middle thickness(CIMT)was determined by color ultrasonic diagnostic instrument.Multivariate Logistic regression analysis was used to evaluate the correlation of resistin gene polymorphism with body mass index(BMI),blood pressure and CIMT in patients with OSAHS related EH.Results(1)Serum concentrations of resistin in N group[(0.5883±0.0070)pg/mL],OSAHS group[(0.5989±0.0010)pg/mL],EH group[(0.6007±0.0055)pg/mL],EH+OSAHS group[(0.6035±0.0085)pg/mL]gradually increased,differences among the three groups group were statistically significant(P<0.05).(2)Difference of resistin gene SNP-420C/G(rs1862513)genotypes and allele frequencies distribution between EH+OSAHS group and N group was statistically significant(P<0.05).(3)CIMT in EH group and EH+OSAHS group compared with that in N group,OSAHS group had significant difference(P<0.01).(4)Logistic regression analysis showed that,resistin SNP-420C/G carrying G allelic in EH+OSAHS group have a higher BMI(OR=1.310,P<0.05),diastolic blood pressure(OR=1.145,P<0.05)and CIMT(OR=3.054,P<0.05).ConclusionsHigh serum concentration of resistin is closely related to EH and OSAHS associated EH.Resistin gene SNP-420C/G is related to OSAHS associated EH,and G allele may be a risk factor for obesity and diastolic blood pressure.Patients of OSAHS associated EH carrying G allele are more likely to develop atherosclerosis.
essential hypertension;obstructive sleep apnea hypopnea syndrome;resistin;genetic polymorphism
R544.1
A
1007-9688(2017)06-0738-06
10.3969/j.issn.1007-9688.2017.06.24
陈成(1989-),女,在读硕士研究生,研究方向为高血压动脉粥样硬化的防治。
王先梅,E-mail:wangxianmei89@tom.com
2016-07-12)

