尖吻鲈鱼鳞和鱼皮胶原蛋白的提取及其理化特性分析
廖 伟,夏光华,李 川,仇昶旭,李永成,申铉日*
(海南大学食品学院,海南 海口 570228)
尖吻鲈鱼鳞和鱼皮胶原蛋白的提取及其理化特性分析
廖 伟,夏光华,李 川,仇昶旭,李永成,申铉日*
(海南大学食品学院,海南 海口 570228)
以尖吻鲈鱼鳞和鱼皮为原料,提取并分离纯化酶溶性胶原蛋白,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)、氨基酸组成分析、差示扫描量热(differential scanning calorimetry,DSC)、傅里叶变换红外光谱、X射线衍射和Zeta电位以及溶解度研究,分析和比较了其主要理化性质。冷冻干燥后鱼鳞和鱼皮胶原蛋白得率(干质量)分别为2.3 g/100 g和47.3 g/100 g;SDS-PAGE结果显示两种胶原蛋白构型均为[α1(Ⅰ)]2α2(Ⅰ),初步判断属于Ⅰ型胶原蛋白;DSC结果显示鱼鳞和鱼皮胶原蛋白热变性温度(Td)分别为37.54 ℃和36.74 ℃;傅里叶变换红外光谱和X射线衍射结果显示胶原蛋白经胃蛋白酶处理后仍能保持其完整的三股螺旋结构;Zeta电位结果显示鱼鳞和鱼皮胶原蛋白等电点分别为pH 6.40和pH 6.64;溶解度研究结果显示两种胶原蛋白在酸性条件和低NaCl质量浓度下均表现出良好的溶解性。
尖吻鲈;鱼鳞;鱼皮;胶原蛋白;氨基酸
胶原蛋白是脊椎动物中最主要的结构蛋白之一,约占蛋白总量的30%[1]。目前,研究已经发现至少29 种不同类型的胶原蛋白,每种胶原蛋白都有其独特的氨基酸序列与分子结构,其中Ⅰ型胶原蛋白在日常生活中最为常见[2]。Ⅰ型胶原蛋白在食品、生物材料、药制品和化妆品工业中已有广泛应用[3]。目前,牛、羊和猪畜等加工下脚料仍是提取胶原蛋白的主要原料。但是禽流感、疯牛病、口蹄疫和一些宗教的相关问题对陆地生物提取胶原蛋白造成了一定的影响[4]。因此,研究者开始寻找新的胶原蛋白来源,特别是鱼类胶原蛋白已经被纳入天然胶原蛋白的提取来源之中。
尖吻鲈(Lates calcarifer),又名盲曹鱼,在沿海水域栖息和觅食,是我国南方人民最喜食的鱼类之一。尖吻鲈肉质鲜美、营养价值高,由于具有生长快、养殖周期短、广盐性等优点,吸引了东南亚、澳大利亚等地的广泛养殖。伴随着养殖产量增大,尖吻鲈深加工后产生大量的副产物——鱼鳞和鱼皮,其富含胶原蛋白,可作为提取胶原蛋白的新原料。尖吻鲈深加工后的副产物得到充分利用后不仅可以增加鱼制品的附加值,还可以减少其对环境的污染。目前,胶原蛋白提取自条纹鲶鱼[5]、鲤鱼[3]、乌鳢和草鱼[6]等已有相关报道。然而,系统比较鱼鳞和鱼皮胶原蛋白性质特征的研究较少。因此,本实验旨在通过酶法提取尖吻鲈鱼鳞和鱼皮胶原蛋白并系统比较它们主要的性质特征。
1 材料与方法
1.1 材料与试剂
尖吻鲈购买于海口市中心农贸市场;胃蛋白酶美国Sigma公司;其余试剂均为国产分析纯;实验用水为去离子水。
1.2 仪器与设备
DSC131EV差示扫描量热(differential scanning calorimetry,DSC)仪 法国塞塔拉姆仪器公司;DYCZ-24DN垂直电泳系统 北京市六一仪器厂;TV-1900双光束紫外-可见光分光光度计 北京普析通用仪器公司;EYEL4冷冻干燥机 日本Rikakikai公司;TENSOR27傅里叶变换红外光谱仪、X射线粉末衍射仪 德国Bruker公司;Zetasizer Nano S90激光粒度分析仪 英国马尔文公司;Stratos高速冷冻离心机美国赛默飞世尔公司。
1.3 方法
1.3.1 鱼皮和鱼鳞胶原蛋白的提取、纯化
酸辅酶法提取酶溶性胶原蛋白(pepsin-soluble collagen,PSC)参考Nagai等[7]的方法并略作修改。具体方法如下:用剪刀将解冻后的鱼皮和鱼鳞剪成0.5 cm×0.5 cm的小块,随后浸泡在0.1 mol/L的NaOH溶液(1∶20,m/V)中36 h,以除去杂蛋白和色素。碱处理后的鱼鳞和鱼皮用去离子水冲洗至中性。鱼皮浸泡在10%的正丁醇溶液(1∶10,m/V)中脱脂24 h;鱼鳞浸泡在0.5 mol/L乙二胺四乙酸溶液(1∶10,m/V)中处理72 h,以除去羟磷灰石。
处理后的鱼鳞和鱼皮残留物浸泡在含有1 g/100 mL胃蛋白酶的0.5 mol/L乙酸溶液(1∶20,m/V)中48 h以提取胶原蛋白,随后溶解液在20 000×g,4 ℃的条件下离心20 min,收集上清液后盐析至终浓度0.9 mol/L。盐析后的样品液在12 000×g,4 ℃的条件下离心15 min,收集沉淀;收集的沉淀完全溶于0.5 mol/L的乙酸溶液,在0.1 mol/L的乙酸溶液(1∶50,V/V)中透析24 h,随后在相同体积的去离子水中透析24 h。透析后的样品冻干后即为PSC。胶原蛋白的得率是指提取所得胶原蛋白样品质量(干质量)与冻干鱼皮的质量比。胶原蛋白的提取重复3次,得率取其平均值,所有的操作均在4 ℃条件下进行。
1.3.2 胶原蛋白理化性质研究
1.3.2.1 SDS-PAGE
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)根据Laemmli[8]的方法,采用不连续的Tris-甘氨酸电泳系统。胶原蛋白样品溶解于去离子水中,配制成质量浓度为2.5 mg/mL的胶原蛋白溶解液。7.5%的分离胶和4%的浓缩胶,以80 V的稳流电压进行电泳分析。
1.3.2.2 氨基酸组成测定
胶原蛋白样品经盐酸水解后密封在消化管中,110 ℃减压处理。随后采用高效液相色谱法进行测定。结果以每1 000 个氨基酸残基中的特定氨基酸残基数来表示。
1.3.2.3 DSC测定
胶原蛋白样品溶于去离子水中(1∶40,m/V),在4 ℃静置24 h。称取溶解后的样品9~15 mg于铝锅中,加盖密封,置于仪器样品槽中进行测定。空的密封铝锅作为对照。样品扫描温度为15~50 ℃,扫描速率为2 ℃/min。
1.3.2.4 傅里叶变换红外光谱测定
取5 mg胶原蛋白样品与150 mg KBr粉末在干燥条件下充分研磨,压片。研磨压片后的药片状样品置于样品室内待测定。红外光谱扫描范围为4 000~500 cm-1,分辨率2 cm-1。扫描结果使用Origin 8.0 软件分析。
1.3.2.5 X射线衍射分析
胶原蛋白样品的晶体结构用X射线衍射仪记录分析,X射线源为Cu靶Ka辐射,电压为40 kV,电流为40 mA。扫描角度2θ为10°~50°,扫描速率为0.06°/s。
1.3.2.6 Zeta电位测定
Zeta电位分析根据Singh等[5]的方法进行测定。胶原蛋白样品溶解于0.5 mol/L的乙酸溶液中至终质量浓度5 mg/mL,用1 mol/L KOH和1mol/L HNO3溶液将胶原蛋白样品液调至不同的pH值(2~10),随后用Zeta电位仪测定不同pH值的Zeta电位。
1.3.2.7 溶解度测定
参考Liu Dasong等[9]的方法探索pH值和NaCl质量浓度对胶原蛋白样品溶解度的影响。
pH值对胶原蛋白溶解度的影响:胶原蛋白样品在4 ℃条件下溶于0.5 mol/L的乙酸溶液,终质量浓度为3 mg/mL,磁力搅拌直至完全溶解。取8 mL的胶原蛋白样品液用6 mol/L HCl或6 mol/L NaOH溶液调节至不同的pH值(1~10)。样品液调至要求的pH值后,用0.5 mol/L的乙酸溶液将其补足至10 mL。随后,混合液在20 000×g、4 ℃的条件下离心30 min,收集上清液。根据Lowry法[10]测定其蛋白质含量,牛血清白蛋白作为对照。相对溶解度的计算是某一特定pH值胶原蛋白的溶解度比上胶原蛋白最大的溶解度。
NaCl质量浓度对胶原蛋白溶解度的影响:胶原蛋白样品在4 ℃条件下溶于0.5 mol/L的乙酸溶液(终质量浓度为6 mg/mL),磁力搅拌直至完全溶解。取5 mL的胶原蛋白溶解液与5 mL含有不同质量浓度NaCl(0、1、2、3、4、5 g/100 mL和6 g/100 mL)的0.5 mol/L乙酸溶液混合均匀。随后混合液在20 000×g、4 ℃条件下离心30 min。采用上述Lowry法测定其蛋白质含量。NaCl溶液质量浓度为0 g/100 mL时作为参比计算相对溶解度。
2 结果与分析
2.1 PSC提取率
尖吻鲈鱼鳞和鱼皮PSC的提取率分别为2.3 g/100 g和47.3 g/100 g(干质量,下同)。尖吻鲈鱼鳞PSC的提取率低于鳙鱼鱼鳞PSC的(2.7 g/100 g),而高于红点海鲱鲤PSC(1.2 g/100 g)和酸法提取胶原蛋白(acid soluble collagen,ASC)(0.46 g/100 g)[2,11]。尖吻鲈鱼皮PSC提取率低于鳙鱼鱼皮PSC(60.3 g/100 g)和史氏鲟鱼皮PSC(52.8 g/100 g),而远高于大鳍鳠ASC(16.8 g/100 g)和罗非鱼ASC(27.2 g/100 g)[1,12]。胶原蛋白提取率的差异可能是由不同物种胶原蛋白结构的差异和胶原蛋白制备方法的差异造成的。另外,相比PSC,ASC得率较低是因为胶原蛋白端肽链的交联使其在酸性条件下溶解度降低[13]。而PSC经胃蛋白酶处理后裂解了端肽结构,从而提高胶原蛋白在酸性条件下的溶解度,所以用酸法有助于提高胶原蛋白的提取率[14]。
2.2 SDS-PAGE结果
尖吻鲈鱼鳞和鱼皮胶原蛋白SDS-PAGE结果如图1所示,两种胶原蛋白都含有两条不同的α链(α1和α2)和一条β链,其中α1条带浓度明显高于α2且接近于α2条带浓度的两倍,提示该胶原蛋白是由两个单位α1链和一个单位α2链组成([α1(Ⅰ)]2α2(Ⅰ)),这与杨玲等[15]的结果相似,可初步判定尖吻鲈鱼鳞和鱼皮胶原蛋白属于典型的Ⅰ型胶原蛋白。分析可知,鱼鳞胶原蛋白在电泳条带上分子质量分布(α1120 kDa和α2114 kDa)与鱼皮胶原蛋白(α1122 kDa和α2116 kDa)基本一致。另外,图中条带清晰、杂带少,说明胶原蛋白纯度较高。
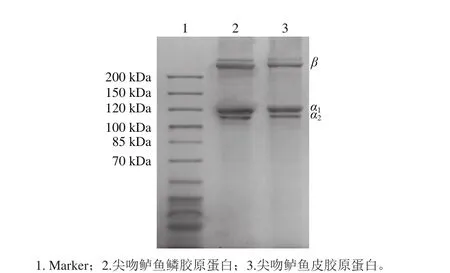
图1 尖吻鲈鱼鳞和鱼皮胶原蛋白SDS-PAGE图Fig. 1 SDS-PAGE of collagen from scales and skin of Asian seabass
2.3 氨基酸组成分析结果

表1 尖吻鲈鱼鳞和鱼皮胶原蛋白氨基酸组成分析Table 1 Amino acid composition of collagen from scales and skin of Asian seabass
尖吻鲈鱼鳞和鱼皮胶原蛋白氨基酸组成分析如表1所示。两种胶原蛋白都含有丰富的甘氨酸(约占总氨基酸含量的1/3)、丙氨酸、脯氨酸和羟脯氨酸,也都含有少量的组氨酸、酪氨酸和半胱氨酸。
亚氨酸(脯氨酸+羟脯氨酸)含量通常被用来判断胶原蛋白的热稳定性,因为脯氨酸和羟脯氨酸的吡咯烷环可加强多肽链的构象限制,并有助于增强三股螺旋的稳定性[16]。尖吻鲈鱼鳞胶原蛋白亚氨酸含量(207.6/1 000 个残基)高于鱼皮胶原蛋白的(195.5/1 000 个残基)。相比之前已经报道的鱼类ASC或PSC[3,9,17],尖吻鲈鱼鳞和鱼皮PSC具有较强的热稳定性。另外,已经报道的文献显示尖吻鲈鱼鳞ASC亚氨酸含量(193/1 000 个残基)[18]低于本实验的鱼鳞PSC(207.6/1 000 个残基),这可能是由于胶原蛋白制备方法的不同或鱼类栖息环境的不同所造成。另外,食品中胶原蛋白水解物具有抗氧化性是由于疏水性氨基酸作用而产生的,这些疏水性氨基酸包括胶原蛋白N端上的亮氨酸和缬氨酸,或蛋白序列中的组氨酸、酪氨酸和脯氨酸。另外蛋白肽链上的疏水氨基酸,诸如胶原蛋白C端上的丙氨酸、苏氨酸、缬氨酸、脯氨酸、异亮氨酸、亮氨酸、甲硫氨酸和苯丙氨酸可以增强ACE抑制剂活性[19]。而尖吻鲈鱼鳞和鱼皮胶原蛋白中含有大量的疏水性氨基酸,这意味着尖吻鲈鱼鳞和鱼皮胶原蛋白具有潜在的抗氧化和降血压活性。
2.4 DSC分析结果

图2 尖吻鲈鱼鳞和鱼皮胶原蛋白DSC测定结果Fig. 2 DSC curves of collagen from scales and skin of Asian seabass
图2为两种胶原蛋白热变性温度(Td)曲线,尖吻鲈鱼鳞胶原蛋白的变性温度比鱼皮胶原蛋白的稍高,分别出现在37.54 ℃和36.74 ℃处。鱼鳞胶原蛋白热焓值(0.937 J/g)也比鱼皮胶原蛋白(0.827 J/g)高,所以鱼鳞胶原蛋白比鱼皮胶原蛋白拥有更好的热稳定性。尖吻鲈鱼鳞和鱼皮胶原蛋白具有较高的热稳定性,高于已经报道过的草鱼鱼皮PSC(Td=35.81 ℃)和乌鳢鱼皮PSC(Td=34.06 ℃),大黄鱼鱼鳞PSC(Td=27.5 ℃)和鲢鱼鱼鳞PSC(Td=29 ℃)[20-21],略低于牛皮ASC(Td=40.8 ℃)和小鸡胸骨PSC(Td=43.8 ℃)[3,22]。Ikoma等[23]曾报道脯氨酸和羟脯氨酸中的吡啶环状结构有助于增强胶原蛋白三股螺旋结构的稳定性,所以亚氨酸含量和热稳定性呈正相关。尖吻鲈鱼鳞胶原蛋白(207.6/1 000 个残基)亚氨酸含量高于鱼皮胶原蛋白(195.5/1 000 个残基),与DSC结果相符。另一方面,Nagai等[7]曾报道胶原蛋白热稳定性与脯氨酸羟基化率呈正相关[24]。而计算得尖吻鲈鱼鳞羟基化率为40.55%,低于鱼皮胶原蛋白的40.77%,与DSC结果不符。所以胶原蛋白的热稳定性与氨基酸组成具体关系还需要进一步研究证明。
2.5 傅里叶变换红外光谱分析
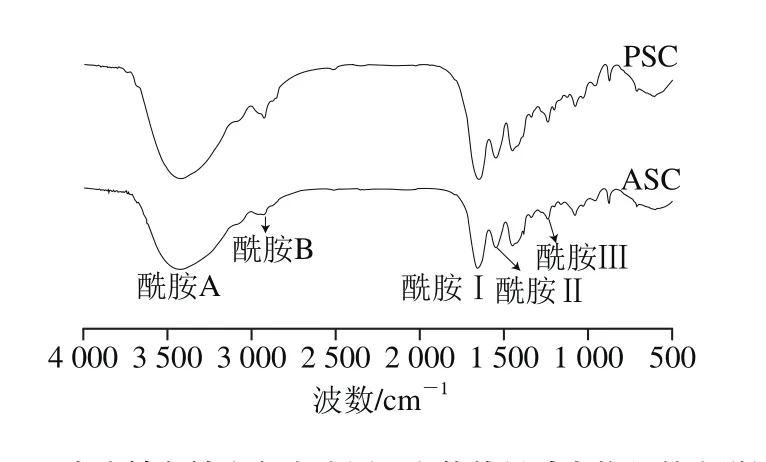
图3 尖吻鲈鱼鳞和鱼皮胶原蛋白的傅里叶变换红外光谱图Fig. 3 FTIR spectra of collagen from scales and skin of Asian seabass
从图3中可以清晰观察到胶原蛋白傅里叶变换红外光谱图中酰胺A、酰胺B、酰胺Ⅰ、Ⅱ和Ⅲ的吸收峰,这些峰的位置有细微差别,此结果与条纹鲶鱼[5]、罗非鱼[25]的报道较为类似。归属于N—H的伸缩振动的酰胺A带分别出现在尖吻鲈鱼鳞和鱼皮胶原蛋白红外光谱3 442.07 cm-1和3 424.25 cm-1处。根据Doyle等[26]的报道,酰胺A带出现的位置与肽链N—H基团的氢键键合程度有关,当N—H的氢键键合程度较高时,则吸收峰会蓝移。归属于—CH2非对称拉伸的酰胺B带,出现在尖吻鲈鱼鳞和鱼皮胶原蛋白傅里叶变换红外光谱的2 933.63 cm-1和2 929.46 cm-1处。胶原蛋白的酰胺Ⅰ、Ⅱ和Ⅲ带与胶原蛋白的三股螺旋结构紧密相关,其中C=O伸缩振动归属于酰胺Ⅰ;N—H和C—H扭转振动归属为酰胺Ⅱ;甘氨酸和脯氨酸残基上的—CH2特征振动归属为酰胺Ⅲ[1]。鱼鳞胶原蛋白的酰胺Ⅰ、Ⅱ和Ⅲ带分别出现在1 658.18、1 549.38 cm-1和1 241.37 cm-1处,而鱼皮胶原蛋白出现在相对稍低的1 652.41、1 548.99 cm-1和1 240.42 cm-1的位置,这意味着鱼皮胶原蛋白比鱼鳞胶原蛋白拥有更多或更强的氢键,更多的氢键则意味着蛋白分子规整度更低,所以鱼皮胶原蛋白规整度不如鱼鳞胶原蛋白。
2.6 X射线衍射分析
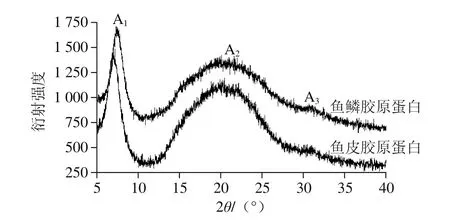
图4 尖吻鲈鱼鳞和鱼皮胶原蛋白的X射线衍射图Fig. 4 X-ray diffraction patterns of collagen from scales and skin of Asian seabass
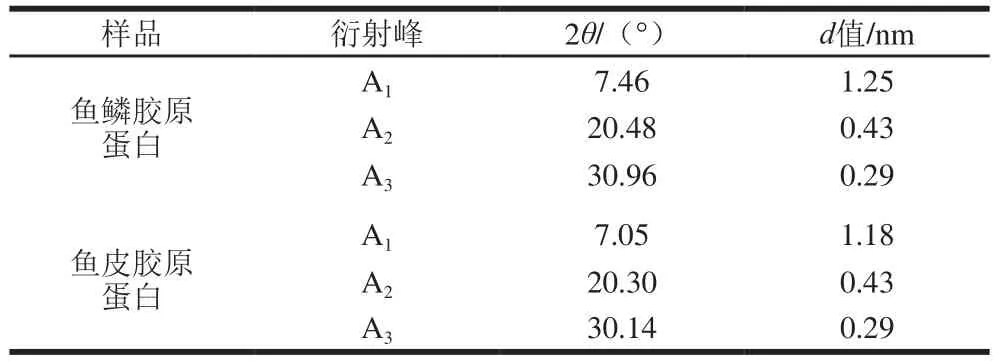
表2 尖吻鲈鱼鳞和鱼皮胶原蛋白X射线衍射峰对应的d值Table 2 d values of X-ray diffraction peaks of collagen from scales and skin of Asian seabass
两种胶原蛋白X射线衍射分析结果如图4、表2所示。采用布拉格二维方程2dsin θ=λ(λ=0.154)描述X射线衍射结果。鱼鳞和鱼皮胶原蛋白均有3 个不同的衍射峰,第1个衍射峰(标记为A1)在7°~8°之间出现,峰型相对比较尖锐。A1峰的d值可反映了胶原蛋白纤维中分子链间的距离[27],计算可得鱼鳞和鱼皮胶原蛋白纤维中分子链的距离分别是1.25 nm和1.18 nm,说明了鱼鳞胶原蛋白比鱼皮胶原蛋白更适合药物传输方面的应用[28]。在20°~25°之间出现了一个宽且大的峰(标记为A2),A2峰代表了胶原蛋白纤维内部的众多结构层次所引起的漫散射。在30°~35°之间出现了第3个峰,(标记为A3),A3峰的d值代表代表了三股螺旋结构上沿螺旋中心轴相邻氨基酸残基之间的距离。Eyre[29]曾报道胶原蛋白的三股螺旋结构中每圈螺旋含有3.3 个氨基酸残基(n=3.3),螺距为0.96 nm;沿着螺旋中心轴,相邻氨基酸残基之间的距离为0.29 nm。尖吻鲈鱼鳞和鱼皮胶原蛋白A3峰的d值均为0.29 nm,说明酶法提取的两种胶原蛋白均保持了完整的三股螺旋结构。
2.7 Zeta电位测定结果
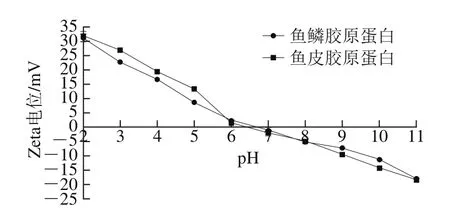
图5 尖吻鲈鱼鳞和鱼皮胶原蛋白在不同pH值条件下的Zeta电位Fig. 5 Zeta potential of collagen from scales and skin of Asian seabass at different pH levels
不同pH值的Zeta电位测定结果如图5所示。两种胶原蛋白的正电位在pH 2~6之间,负电位在pH 7~11之间。尖吻鲈鱼鳞和鱼皮胶原蛋白表面静电荷均随着pH值的增加而降低,分别在pH 6.40和pH 6.64处静电荷为0,即等电点。当pH值高于或低于蛋白质的等电点时,蛋白质分子链之间斥力增加,产生较高的静电荷并使得蛋白分子溶解度增加。当静电荷为0时,疏水基之间的相互作用增强而引起蛋白质沉淀或聚集[5]。不同鱼类的胶原蛋白有着不同的等电点。例如,黑鳍鲨鱼皮PSC等电点为7.02,红点海鲱鲤鱼鳞PSC等电点为4.96[11,30]。这些鱼类胶原蛋白具有不同的等电点可能是因为氨基酸的序列不同和氨基酸残基的分布不同所致。
2.8 溶解度测定结果
2.8.1 pH值对胶原蛋白溶解度的影响

图6 尖吻鲈鱼鳞和鱼皮胶原蛋白在不同pH值条件下的相对溶解度Fig. 6 Relative solubility of collagen from scales and skin of Asian seabass as affected by different pH
不同pH值对尖吻鲈鱼鳞和鱼皮胶原蛋白溶解度的影响如图6所示。尖吻鲈鱼鳞和鱼皮胶原蛋白溶解度受pH值的影响有着相近的趋势。在酸性条件下,鱼鳞和鱼皮胶原蛋白溶解度较大,在pH 4处取得最大值,继续增大溶液pH值,则溶解度下降。两种胶原蛋白均在中性或碱性条件下溶解度较低,并在pH 7处取得最小值,与之前报道的罗非鱼的结果相似[28]。不同pH值胶原蛋白溶解度差异可能是因为胶原蛋白不同的分子特征和结构构象所造成的。
2.8.2 NaCl质量浓度对胶原蛋白溶解度的影响

图7 尖吻鲈鱼鳞和鱼皮胶原蛋白在不同NaCl质量浓度条件下的相对溶解度Fig. 7 Relative solubility of collagen from scales and skin of Asian seabass as affected by NaCl concentrations
NaCl对胶原蛋白溶解度的影响如图7所示,不同NaCl质量浓度对尖吻鲈两种胶原蛋白溶解度影响相近。胶原蛋白溶解度随着NaCl质量浓度的增大而逐渐降低,在NaCl质量浓度为1~3 g/100 mL时,胶原蛋白具有较高且稳定的溶解度。然而当NaCl质量浓度超过3 g/100 mL时,胶原蛋白溶解度明显下降,这样的趋势与鳙鱼相似[9]。盐离子通常以两种不同的方式影响蛋白质的稳定性。在低质量浓度条件下,Na+可以与胶原蛋白稳定结合,使胶原蛋白表面正电荷增加,蛋白质分子之间相互排斥,分散性好,使三股螺旋结构更加稳定,所以溶解度较大;然而在NaCl质量浓度较高时,盐离子与周围水分子可结合形成水化膜,使蛋白质脱水发生盐析效应而析出,导致溶解度急剧下降[31]。
通过对尖吻鲈鱼鳞和鱼皮胶原蛋白溶解度的分析发现该胶原蛋白在酸性条件和低NaCl质量浓度条件下溶解性良好。
3 结 论
本实验采用酶法提取尖吻鲈鱼鳞和鱼皮的胶原蛋白并比较其理化性质。尖吻鲈鱼皮胶原蛋白提取率(47.3 g/100 g)远高于尖吻鲈鱼鳞胶原蛋白(2.3 g/100 g);两种胶原蛋白初步判断均为Ⅰ型胶原蛋白,经胃蛋白酶处理后仍保持了其完整的三股螺旋结构;DSC分析结果表明鱼鳞胶原蛋白相比鱼皮具有更好的热稳定性。另外,尖吻鲈鱼鳞和鱼皮胶原蛋白在酸性和低盐浓度下均具有良好的溶解性。综上数据表明,尖吻鲈鱼鳞和鱼皮是工业中胶原蛋白提取潜在的新资源。
[1] ZHANG M, LIU W T, LI G Y. Isolation and characterisation of collagens from the skin of largefin longbarbel catfish (Mystus macropterus)[J]. Food Chemistry, 2009, 115(3): 826-831.DOI:10.1016/j.foodchem.2009.01.006.
[2] LIAO W, LIU Y F, XIA G H, et al. Characterization of three-spot seahorse (Hippocampus trimaculatus) skin collagen and its fibrillar gel reinforced by EDC: a comparative study[J]. Journal of Food Biochemistry, 2017(1): e12391. DOI:10.1111/jfbc.12391.
[3] DUAN R, ZHANG J J, DU X Q, et al. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio)[J]. Food Chemistry,2009, 112(3): 702-706. DOI:10.1016/j.foodchem.2008.06.020.
[4] AHMAD M, BENJAKUL S. Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket(Aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824.DOI:10.1016/j.foodchem.2009.11.019.
[5] SINGH P, BENJAKUL S, MAQSOOD S, et al. Isolation and characterisation of collagen extracted from the skin of striped catf i sh(Pangasianodon hypophthalmus)[J]. Food Chemistry, 2011, 124(1):97-105. DOI:10.1016/j.foodchem.2010.05.111.
[6] 王忠稳, 汪海波, 梁艳萍, 等. 乌鳢和草鱼鱼皮胶原蛋白蛋白的提取与理化性能分析[J]. 食品科学, 2013, 34(17): 23-27. DOI:10.7506/spkx1002-6630-201317006.
[7] NAGAI T, SUZUKI N. Isolation of collagen from fi sh waste materialzskin, bone and fins[J]. Food Chemistry, 2000, 68(3): 277-281.DOI:10.1016/S0308-8146(99)00188-0.
[8] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[9] LIU Dasong, LIANG Li, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales,skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133(4): 1441-1448. DOI:10.1016/j.foodchem.2012.02.032.
[10] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[11] MATMAROH K, BENJAKUL S, PRODPRAN T, et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatf i sh (Parupeneus heptacanthus)[J]. Food Chemistry,2011, 129(3): 1179-1186. DOI:10.1016/j.foodchem.2011.05.099.
[12] WANG L, LIANG Q F, CHEN T T, et al. Characterization of collagen from the skin of Amur sturgeon (Acipenser schrenckii)[J].Food Hydrocolloids, 2014, 38: 104-109. DOI:10.1016/j.foodhyd.2013.12.002.
[13] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al.Isolation and characterization of collagen from bigeye snapper(Priacanthus macracanthus) skin[J]. Journal of the Science of Food and Agriculture, 2005, 85(7): 1203-1210. DOI:10.1002/jsfa.2072.
[14] ZHANG X, OOKAWA M, TAN Y, et al. Biochemical characterisation and assessment of fibril-forming ability of collagens extracted from Bester sturgeon Huso huso × Acipenser ruthenus[J]. Food Chemistry,2014, 160: 305-312. DOI:10.1016/j.foodchem.2014.03.075.
[15] 杨玲, 赵燕, 鲁亮, 等. 鲟鱼鱼皮胶原蛋白蛋白的提取及其理化性能分析[J]. 食品科学, 2013, 34(23): 41-46. DOI:10.7506/spkx1002-6630-201323010.
[16] NALINANON S, BENJAKUL S, KISHIMURA H, et al. Type I collagen from the skin of ornate threadf i n bream (Nemipterus hexodon):characteristics and effect of pepsin hydrolysis[J]. Food Chemistry,2011, 125(2): 500-507. DOI:10.1016/j.foodchem.2010.09.040.
[17] 万琼红, 党美珠, 曾建成, 等. 几种淡水鱼鱼鳞酶溶性胶原蛋白蛋白的比较研究[J]. 食品科学, 2009, 30(19): 28-31. DOI:10.3321/j.issn:1002-6630.2009.19.004.
[18] CHUAYCHAN S, BENJAKUL S, KISHIMURA H. Characteristics of acid- and pepsin-soluble collagens from scale of seabass (Lates calcarifer)[J]. LWT-Food Science and Technology, 2015, 63(1): 71-76.DOI:10.1016/j.lwt.2015.03.002.
[19] CHEUNG H S, WANG F L, ONDETTI M A, et al. Binding of peptide substrates and inhibitors of angiotensin-converting enzyme.Importance of the COOH-terminal dipeptide sequence[J]. Journal of Biological Chemistry, 1980, 255(2): 401-407.
[20] ZHANG J J, RUI D, CHAO Y E, et al. Isolation and characterization of collagens from scale of silver carp (Hypophthalmichthys molitrix)[J].Journal of Food Biochemistry, 2010, 34(6): 1343-1354. DOI:10.1111/j.1745-4514.2010.00439.x.
[21] WU Q Q, LI T, WANG B, et al. Preparation and characterization of acid and pepsin-soluble collagens from scales of croceine and redlip croakers[J]. Food Science & Biotechnology, 2015, 24(6): 2003-2010.DOI:10.1007/s10068-015-0264-z.
[22] CAO H, XU S Y, CAO H, et al. Purif i cation and characterization of type Ⅱ collagen from chick sternal cartilage[J]. Food Chemistry, 2008,108(2): 439-445. DOI:10.1016/j.foodchem.2007.09.022.
[23] IKOMA T K H, TANAKA J, WALSH D, et al. Physical properties of type Ⅰ collagen extracted from fish scales of Pagrus major and Oreochromis niloticas[J]. International Journal of Biological Macromolecules, 2003, 32(3/4/5): 199-204. DOI:10.1016/S0141-8130(03)00054-0.
[24] NAGAI T, SUZUKI N, NAGASHIMA T. Collagen from common minke whale (Balaenoptera acutorostrata) unesu[J]. Food Chemistry,2008, 111(2): 296-301. DOI:10.1016/j.foodchem.2008.03.087.
[25] 郝淑贤, 林婉玲, 李来好, 等. 不同提取方法对罗非鱼皮胶原蛋白蛋白理化特性的影响[J]. 食品科学, 2014, 35(15): 59-62. DOI:10.7506/spkx1002-6630-201415012.
[26] DOYLE B B, BENDIT E G, BLOUT E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers, 1975, 14(5):937-957.
[27] GIRAUD G M, BESSEAU L C, DURAND P, et al. Structural aspects of fi sh skin collagen which forms ordered arrays via liquid crystalline states[J]. Biomaterials, 2000, 21(9): 899-906.
[28] CHEN J D, LI L, YI R Z, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT-Food Science and Technology, 2016, 66:453-459.DOI:10.1016/j.lwt.2015.10.070.
[29] EYRE D R. Collagen: molecular diversity in the body’s protein scaffold[J]. Science, 1980, 207: 1315-1322.
[30] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Isolation and properties of acid- and pepsin-soluble collagen from the skin of blacktip shark (Carcharhinus limbatus)[J]. European Food Research and Technology, 2009, 230(3): 475-483. DOI:10.1007/s00217-009-1191-0.
[31] NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of bigeye snapper(Priacanthus tayenus)[J]. Food Chemistry, 2007, 104(2): 593-601.DOI:10.1016/j.foodchem.2006.12.035.
Extraction and Characterization of Collagen from Scales and Skin of Asian Seabass
LIAO Wei, XIA Guanghua, LI Chuan, QIU Changxu, LI Yongcheng, SHEN Xuanri*
(College of Food Science and Technology, Hainan University, Haikou 570228, China)
Pepsin-soluble collagen was extracted from the scales and skin of Asian seabass, and their physicochemical properties were characterized by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), amino acid composition analysis, differential scanning calorimetry (DSC), Fourier transform infrared (FT-IR) spectroscopy, X-ray diffraction, zeta potential and solubility measurement. The yields of scale collagen and skin collagen were 2.3 and 47.3 g/100 g (dry weight), respectively. The SDS-PAGE profile showed that both collagens contained [α1(I)]2α2(I) and were characterized as type I collagen. DSC indicated that denaturation temperatures (Td) of scale and skin collagen were 37.54 and 36.74 ℃, respectively. Based on FT-IR spectra and X-ray diffraction spectra, after pepsin treatment, the triple-helical structure of the collagens was still intact. Zeta potential studies indicated that scale and skin collagen had a net charge of zero at pH 6.40 and 6.64,respectively. Both collagens exhibited high solubility under acidic and low salt concentration conditions.
Asian seabass; scale; skin; collagen; amino acid
10.7506/spkx1002-6630-201801005
TS254.1
A
1002-6630(2018)01-0036-06
廖伟, 夏光华, 李川, 等. 尖吻鲈鱼鳞和鱼皮胶原蛋白的提取及其理化特性分析[J]. 食品科学, 2018, 39(1): 36-41.
DOI:10.7506/spkx1002-6630-201801005. http://www.spkx.net.cn
LIAO Wei, XIA Guanghua, LI Chuan, et al. Extraction and characterization of collagen from scales and skin of Asian seabass[J]. Food Science, 2018, 39(1): 36-41. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801005.http://www.spkx.net.cn
2016-10-02
国家自然科学基金地区科学基金项目(31260376)
廖伟(1993—),男,硕士研究生,研究方向为农产品加工及贮藏。E-mail:wei_food@163.com
*通信作者简介:申铉日(1968—),男,教授,博士,研究方向为食品科学和水产品精深加工。E-mail:shenxuanri2009@163.com

