CYP3A4、CYP3A5和MDR1基因多态性与肾移植受者他克莫司血药浓度的关系
朱 琳 常 水 曲振华 宋洪涛
CYP3A4、CYP3A5和MDR1基因多态性与肾移植受者他克莫司血药浓度的关系
朱 琳1常 水1曲振华1宋洪涛2
目的:研究CYP3A4*18B、CYP3A5*3及MDR1基因突变对他克莫司血药浓度/(剂量×体重)(C/D)的影响。 方法:采用PCR-RFLP方法检测227例肾移植受者CYP3A4*18B、CYP3A5*3及MDR1 C1236T、G2677T/A及C3435T基因型,比较不同基因型受者之间他克莫司的C/D值的差异。 结果:CYP3A4*18B和CYP3A5*3基因多态性与肾移植受者他克莫司C/D值具有相关性(P<0.01)。但是消除CYP3A5*3等位基因影响后,CYP3A4*18B各基因型间他克莫司的C/D值无显著性差异(P>0.05);而消除CYP3A4*18B等位基因影响后,CYP3A5*1/*1型和*1/*3型受者型受者他克莫司的C/D值显著性低于*3/*3(P<0.01)。MDR1各基因型组间他克莫司的C/D值均无显著性差异。 结论:消除CYP3A5*3等位基因影响后,CYP3A4*18B和MDR1基因多态性对他克莫司血药浓度无影响。
肾移植 他克莫司 基因多态性 血药浓度
他克莫司属钙调磷酸酶抑制剂,广泛用于预防器官移植后排斥反应的发生,但其治疗窗窄,药动学个体差异大(半衰期t1/2为3.5~40.5 h,口服生物利用度为4%~89%[1]),给予相同体重剂量的他克莫司后血药浓度相差>10倍[2]。一般情况下需要通过数周甚至数月才能调整至他克莫司维持剂量,急性排斥反应和不良反应发生率较高,直接影响肾移植受者的生存率和生存质量,甚至致使器官移植失败。
研究表明药物反应和处置个体差异的20%~95%是由遗传因素引起的[3]。他克莫司是细胞色素P450(cytochrome P450)3A酶和P-糖蛋白(P-glycoprotein,P-gp)的作用底物[4],它们的生物活性及表达水平会直接影响到他克莫司的吸收、分布及其代谢,而这些酶表达量及活性与编码这些酶的基因多态性有一定关系。近年来,研究较多的基因主要有CYP3A4、CYP3A5和多药耐药基因1(multi-drug resistance gene l,MDR1),仅CYP3A5*3(rs776746)基因多态性与他克莫司血药浓度密切相关[5-8],国内外研究结论较为一致外,其他基因多态性的影响还有待进一步进行研究[9-11]。本研究通过对肾移植受者进行回顾性研究,进一步探讨CYP3A4*18B、CYP3A5*3及MDR1 C1236T、G2677T/A 和C3435T基因多态性与他克莫司血药浓度、疗效及不良反应之间的关系,从而为临床他克莫司的个体化用药提供理论依据。
材料与方法
试剂与仪器引物由宝生物工程(大连)有限公司(TaKaRa)合成;Taq DNA聚合酶(TaKaRa),限制性内切酶(上海生工生物工程限公司);琼脂糖(BIO BASIC INC),溴化乙锭(申能博彩biocolors);化学试剂均为分析纯(国药集团化学试剂有限公司)。
GeneAmp PCR system 9700(美国基因公司);蛋白核酸测定仪(德国Eppendorf公司);FX-DY-252型电泳仪(上海复兴高科技(集团)有限公司);WD-9413B凝胶成像分析系统(北京六一仪器制造厂)等。
研究对象选择在南京军区福州总医院首次接受异体肾移植手术且术后定期随访的受者为试验对象,共入选227例(均为汉族),其中男性170例,女性57例,年龄39±11岁;体重56.7±11.8 kg;身高166.4±7.4 cm。试验排除术前肝功能异常、合并使用肾毒性药物(如两性霉素B、氨基糖苷类抗生素等)及给药前两周内服用过CYP3A酶诱导剂或抑制剂(如利福平、大环内酯类药物等)的受者。
免疫抑制剂给药方案免疫抑制治疗方案采用他克莫司+吗替麦考酚酯+糖皮质激素三联用药,并服用地尔硫卓提高他克莫司血药浓度。他克莫司剂量为0.1~0.12 mg/(kg·d),早晚两次服用,饭前1 h或饭后2 h口服给药,首次剂量在肾移植术后第二天晚上给予,根据血药浓度监测结果调整剂量,使其谷浓度C0达到目标浓度范围5~10 ng/mL。吗替麦考酚酯剂量为0.5~2 g/d,自术后第l天开始口服。激素为术后0~3d,常规给予甲泼尼龙琥珀酸钠500 mg/d静滴,于第4天改口服醋酸泼尼松20 mg/d。
全血DNA提取采集受者外周静脉血2~3 ml置于EDTA抗凝管中低温(4 ℃)保存,全血3 000 r/min离心5 min,弃上层血浆,在一周内用改良碘化钾法提取DNA。用紫外分光光度法测定所提取DNA的OD260、OD280,计算OD260/OD280,1.6 基因型分析采用聚合酶链反应(PCR)和限制性内切片段长度多态性(RFLP)方法分析CYP3A4*18B、CYP3A5*3、MDR1 C1236T、MDR1 G2677T/A及MDR1 C3435T基因型。各位点PCR引物设计见表1,各位点的酶切图谱详见图1。 表1 PCR扩增引物及限制性内切酶 图1 PCR-RFLP琼脂糖凝胶电泳图谱 临床资料记录查阅受者住院病历,记录人口学资料(年龄、性别、身高与体重);受者用药情况(他克莫司、吗替麦考酚酯、泼尼松、地尔硫卓及其他合并用药情况);他克莫司维持剂量(他克莫司的维持剂量是指在服用相同剂量下,受者连续两次测定谷浓度的值在其治疗窗之间,两次相隔时间至少14d以上)及此时的谷浓度及生化检查指标肌酐、尿素、谷丙转氨酶、总胆红素、白蛋白、血红蛋白及红细胞压积。 全血谷浓度的测定早晨服用药物前处于稳定状态时抽取肾移植受者静脉血3 ml,用酶联免疫吸附法(ELISA)测定全血谷浓度。为便于比较,一般对他克莫司的血药浓度进行剂量校正,即血药浓度/(剂量×体重)(C/D)作为评价指标。 基因分型227例肾移植受者DNA标本经PCR-RFLP基因分型的结果见表2。经Hardy-Weinberg 检验分析,结果显示P>0.05,各基因频率达到遗传平衡,研究资料具有群体代表性。 表2 CYP3A4、CYP3A5和多耐药基因1(MDR1)基因多态性在227例肾移植受者中的突变频率 基因多态性对他克莫司C/D的影响本研究的结果显示,CYP3A4*1/*18B和*18B/*18B基因型受者他克莫司维持剂量显著性高于*1/*1型受者(P<0.01);CYP3A4*1/*1型受者他克莫司C/D值明显高于*1/*18B和*18B/*18B型受者,具有统计学意义(P<0.01)(图2A);CYP3A4*1/*18B和*18B/*18B间他克莫司维持剂量及C/D值差异无统计学意义。CYP3A5*3/*3基因型受者他克莫司维持剂量明显低于*1/*1型和*1/*3型受者(P<0.01),组间他克莫司C/D具有显著性差异(P<0.01)(图2B),*1/*1型和*1/*3型间维持剂量及C/D值差异无统计学意义。MDR1 C1236T、G2677T/A和C3435T各基因型组他克莫司维持剂量及其C/D值差异无显著性(P>0.05)(图2C~E)。 图2 基因多态性对肾移植受者他克莫司C/D值影响的箱式分布图C/D:血药浓度/剂量×体重比值 CYP3A4*18B和CYP3A5*3基因多态性对他克莫司C/D的影响CYP3A5*3与CYP3A4*18B存在连锁不平衡[13],为避免研究结果的混淆,进行分层分析。表4显示消除掉CYP3A5*3的影响,在维持剂量时,CYP3A4*18B各基因组间的C/D的差异无统计学意义(P>0.05)(表3)。消除CYP3A4*18B影响因素后,在维持剂量时,CYP3A5*3/*3与CYP3A5*1/*1型和*1/*3型组间的C/D仍存在显著性差异(P<0.01)(表4)。 表3 以CYP3A5分组后CYP3A4基因多态性对他克莫司C/D的影响 C/D:血药浓度/(剂量×体重)比值 表4 以CYP3A4分组后CYP3A5基因多态性对他克莫司C/D的影响 C/D:血药浓度/(剂量×体重)比值;#:与*3/*3组比较,P<0.01 他克莫司在肾移植受者中被广泛应用,目前临床上常规给予相同体重剂量的药物,然后根据治疗药物监测(TDM)结果对这一初始剂量进行调整,但由于其治疗窗窄、药动学差异大,使得移植术后受者需要较大剂量范围和较长时间的进行剂量调整,急性排斥反应和不良反应的发生率较高,严重影响移植手术的治疗效果以及移植术后受者的生存质量。 个体间遗传背景的差异可能是导致他克莫司用药个体差异的原因之一,明确相关基因多态性对他克莫司血药浓度、疗效及不良反应的影响,能为肾移植受者他克莫司的个体化给药提供依据。我们的研究发现CYP3A4*18B、CYP3A5*3、MDR1 C1236T、MDR1G2677T/A以及MDR1C3435T五个位点的突变频率,分别为30.8%、74.2%、65.6%、38.8%(G2677T)、10.3%(G2677A)和38.3%,各基因频率均达到遗传平衡,与文献报道的中国汉族人群各位点突变频率基本一致[10-12]。 CYP3A4和CYP3A5是他克莫司的代谢酶,他们的遗传多态性可能是造成他克莫司药动学个体差异的主要原因。研究结果显示,肾移植受者获得维持剂量时,CYP3A4*18B和CYP3A5*3基因多态性与他克莫司的C/D值显著相关(P<0.01),但考虑到CYP3A5*3与CYP3A4 *18B存在一定的连锁不平衡(D=0.43)[13],我们对其进行了分层分析。结果表明,消除CYP3A5*3的影响后则CYP3A4*18B各基因型组间他克莫司C/D值没有统计学差异(P>0.05);但是以CYP3A4*18B分层后,CYP3A5*3基因多态性与他克莫司C/D之间仍有显著相关性(P<0.01)。因此推测CYP3A4*18B对他克莫司C/D的影响还是来自于与CYP3A5*3的连锁不平衡,其单独对他克莫司血药浓度没有影响,起作用的主要还是CYP3A5*3。CYP3A5*3基因多态性对他克莫司的血药浓度的影响,与国内外的研究结果相一致[5-8]。 MDR1编码的P-gp在他克莫司的吸收过程中起很大的作用,近年的许多研究证实遗传因素在个体间P-gp表达和功能的差异中扮演了重要角色。在已发现的48个SNPs中,外显子12、21和26的C1236T、G2677T/A和C3435T SNP具有重要的功能意义,此类突变的发生将明显降低基因编码蛋白的表达或改变蛋白的分子结构,从而影响蛋白功效的充分发挥。国内外对有许多报道研究了MDR1基因多态性对他克莫司药代动力学的影响作用,但结论不甚一致,甚至完全相反[9,14-17]。造成不同的研究所产生的结论并不完全一致的原因包括:不同的研究其研究人群的种族背景、饮食习惯等环境因素不同;不同的研究研究的时间点不同,在研究过程中受者同时服用了不同种类的其他药物(如激素、钙拮抗剂)等。本研究结果表明在维持剂量时,MDR1 C1236T、G2677T/A和C3435T不同基因型组间受者C/D差异均无统计学意义(P>0.05)。 1 Venkataramanan R,Swaminathan A,Prasad T,et al.Clinical pharmacokinetics of tacrolimus.Clin Pharmacolanet,1995,29(6):404-430. 2 朱琳,宋洪涛,王庆华,等.肾移植受者他克莫司的血药浓度与CYP3A5*3基因多态性的关系.中国临床药学杂志,2012,21(4):201-204. 3 Evans WE,McLeod HL.Pharmacogenomics-drug disposition,drug targets,and side effects.N Engl J Med,2003,348(20):538-549. 4 Staatz CE,Goodman LK,Tett SE.Effect of CYP3A and ABCB1 single nucleotide polymorphisms on the pharmacokinetics and pharmacodynamics of calcineurin inhibitors:part I.Clin Pharmacokinet,2010,49(3):141-175 5 Chen P,Li J,Li J,et al.Dynamic effects of CYP3A5 polymorphism on dose requirement and trough concentration of tacrolimus in renal transplant recipients.J Clin Pharm Ther,2017,42(1):93-97. 6 Asada A,Bamba S,Morita Y,et al.The effect of CYP 3A5 genetic polymorphisms on adverse eventfs in patients with ulcerative colitis treated with tacrolimus.Dig Liver Dis,2017,49(1):24-28. 7 Debette-Gratien M,Woillard JB,Picard N,et al.Influence of Donor and Recipient CYP3A4,CYP3A5,and ABCB1 Genotypes on Clinical Outcomes and Nephrotoxicity in Liver Transplant Recipients.Transplantation,2016,100(10):2129-2137 8 Yousef AM,Qosa H,Bulatova N,et al.Effects of Genetic Polymorphism in CYP3A4 and CYP3A5 Genes on Tacrolimus Dose Among Kidney Transplant Recipients.Iran J Kidney Dis,2016,10(3):156-163. 9 Riegersperger M,Plischke M,Steinhauser C,et al.The Effect of ABCB1 Polymorphisms on Serial Tacrolimus Concentrations in Stable Austrian Long-Term Kidney Transplant Recipients.Clin Lab,2016,62(10):1965-1972. 10 朱立勤,章袁,王楠,等.肝移植受者CYP3A5和MDR1基因多态性与他克莫司浓度/剂量比的关系.中国新药杂志,2015,24(5):545-549. 11 张燕青,陈锦珊,李金雨,等.MDR1基因多态性和单倍体对肾移植术后稳定期受者他克莫司浓度/剂量比值的影响.药学实践杂志,2015,33(5):415-418. 12 侯明明,侯颖,宋洪涛,等.肾移植受者CYP3A4基因多态性对他克莫司疗效和不良反应的影响.中国药房,2010,21(26):2427-2429. 13 胡永芳,翟所迪,邱雯.CYP3A5*3和CYP3A4*18B基因多态性对肾移植患者环孢素药代动力学的影响.中国药理学通报,2009,25(3):378-382. 14 Genvigir FD,Salgado PC,Felipe CR,et al.Influence of the CYP3A4/5 genetic score and ABCB1 polymorphisms on tacrolimus exposure and renal function in Brazilian kidney transplant patients.Pharmacogenet Genomics,2016,6(10):462-72. 15 Yan L,Li Y,Tang JT,et al.Donor ABCB1 3435 C>T genetic polymorphisms influence early renal function in kidney transplant recipients treated with tacrolimus.Pharmacogenomics,2016,17(3):249-257. 17 Buendía JA,Otamendi E,Kravetz MC,et al.Combinational Effect of CYP3A5 and MDR-1 Polymorphisms on Tacrolimus Pharmacokinetics in Liver Transplant Patients.Exp Clin Transplant,2015,13(5):441-448. AssociationofCYP3A4,CYP3A5andMDR1polymorphismswithindividualtacrolimusdosageregimeninrenaltransplantrecipients ZHULin1,CHANGShui1,QUZhenhua1,SONGHongtao2 1DepartmentofPharmacy,YantaiAffiliatedHospitalofBinzhouMedicalUniversity,Yantai264000,China2DepartmentofPharmacy,FuzhouGeneralHospitalofNanjingMilitaryRegion,Fuzhou350025,China SONGHongtao(E-mail:sohoto@vip.163.com) Objective:To investigate the effect of CYP3A4*18B, CYP3A5*3 and MDR1 on concentration/dosage×body body weight ratios (C/D) of tacrolimus in renal transplant patients.MethodologyThe CYP3A4*18B, CYP3A5*3, MDR1 C1236T, G2677T/A and C3435T genotypes of 227 renal transplant patients were determined by PCR-RFLP method. The differences of C/D ratios were compared among all of the genotype groups treated with tacrolimus.ResultsCYP3A4*18B and CYP3A 5*3 gene polymorphisms were associated with the C/D ratios of patients (P<0.01). No significant association was found between C/D of tacrolimus and CYP3A4*18B genotypes when they were classified by two CYP3A5 genotypes (P>0.05), While after the effects of CYP3A4*18B genotype was eliminated, the C/D ratio of tacrolimus in patients with CYP3A5*1/*1 and *1/*3 genotype group were significantly lower than those with CYP3A5*3/*3 genotype groups (P<0.01). There was no significant difference in the C/D ratio of tacrolimus among MDR1 C1236T,MDR1 G2677T/A and MDR1 C3435T genotype groups.ConclusionCYP3A4*18B and MDR 1 gene polymorphisms do not affect blood concentration of tacrolimus. renal transplantation tacrolimus polymorphism Blood drug concentration 10.3969/cndt.j.issn.1006-298X.2017.06.005 1滨州医学院烟台附属医院药学部(烟台,264000);2南京军区福州总医院药学科 宋洪涛(E-mail:sohoto@vip.163.com) ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有 2017-06-15 (本文编辑 逸 沐)
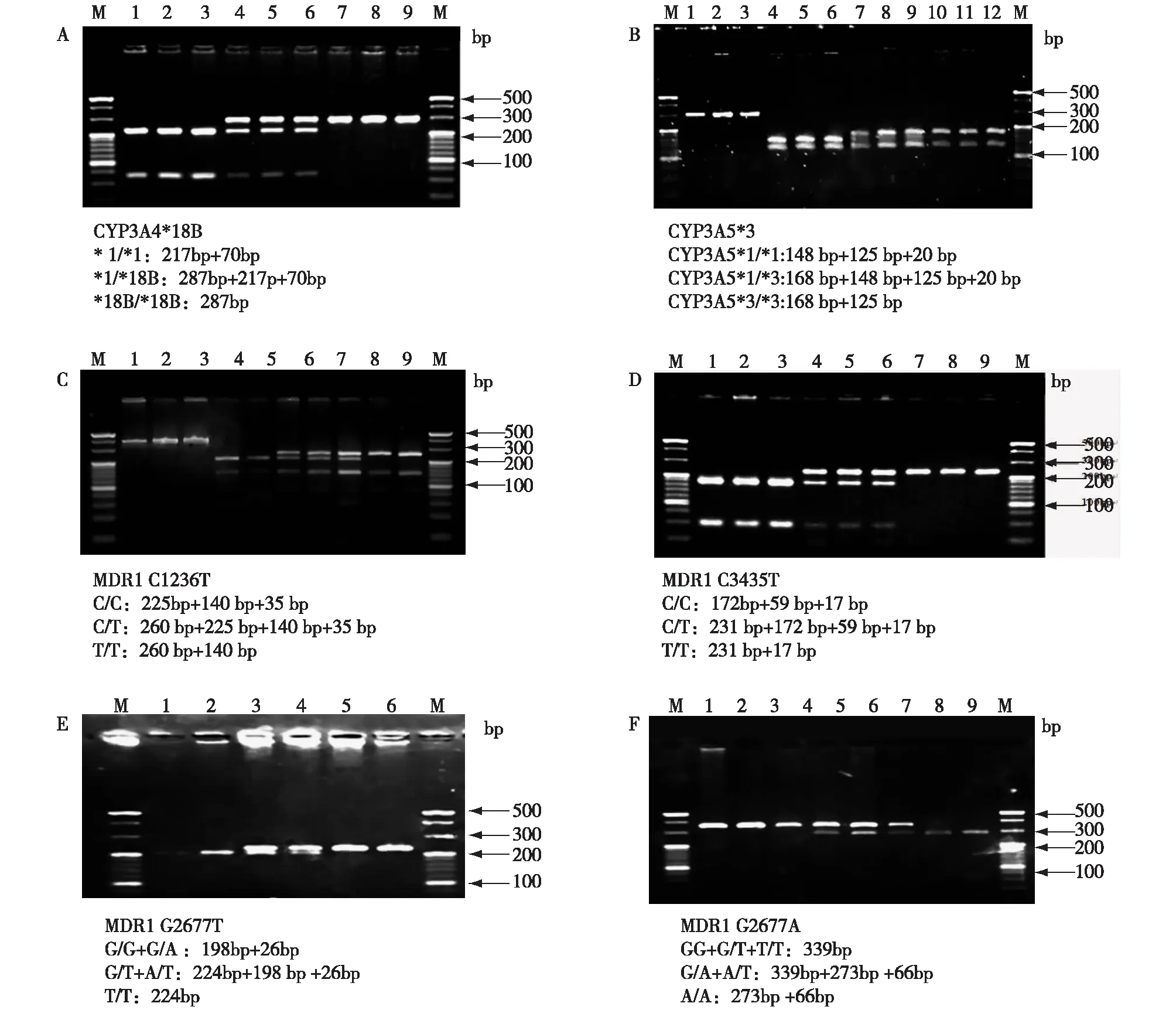
结 果




讨 论

