小鼠颌下腺上皮细胞的体外培养及鉴定
张晓娟,段梦园,李 娟,郭 磊,鞠 瑞,朱 蕾,叶菜英
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 药理系, 北京 100005)
唾液腺是人体重要的腺体之一,包括腮腺、颌下腺和舌下腺3对大唾液腺以及散在分布口腔各壁的众多小唾液腺,其主要功能是分泌唾液,参与咀嚼、吞咽、消化、发音和言语等[1]。唾液腺功能减退可导致相关疾病,典型代表是干燥综合征(Sjögren’s syndrome, SS),该病由于唾液腺受累导致口腔干燥[2]。鉴于唾液腺是SS中的重要受损靶器官,建立唾液腺细胞体外培养方法对于研究其功能,进一步探讨SS的发病机制以及评价SS的治疗药物具有重要意义。
本研究采用胶原酶消化法培养小鼠颌下腺上皮细胞,探究颌下腺上皮细胞分离、培养的最佳方法和条件,为进一步的实验研究提供技术基础。
1 材料与方法
1.1 动物与材料
SPF级C57BL/6小鼠,4周龄左右,体质量17~22 g,雌雄不拘[北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014- 0004];IV型胶原酶(Sigma公司);DMEM高糖培养基、F- 12培养基(中国医学科学院基础医学研究所细胞资源中心);胎牛血清(Gibco公司);表皮生长因子(epidermal growth factor,EGF)(R&D公司);细胞角蛋白8(cytokeratin 8, CK- 8)抗体、波形蛋白(vimentin)抗体和山羊抗兔IgG/Alexa Fluor 488标记(Abcam公司);锥虫蓝染液(碧云天生物技术有限公司);CCK- 8试剂盒(日本东仁化学科技有限公司)。
1.2 方法
1.2.1 颌下腺上皮细胞的分离与培养[3- 6]:断颈处死小鼠,75%乙醇浸泡消毒后,超净台内无菌摘取双侧颌下腺,冰PBS漂洗,去除附带的脂肪、包膜等,剪碎,加入Ⅳ型胶原酶(0.25 g/L,PBS配置),37 ℃消化3 h,期间每隔30 min轻轻振荡以促进消化。消化后的液体经100目筛网过滤后,1 000 r/min离心5 min,弃上清,加红细胞裂解液5 mL,轻轻吹打充分裂解红细胞后,PBS清洗,用少量培养基(F- 12∶DMEM=3∶1,2.5% FBS,10 μg/L EGF,2 mmol/L L-谷氨酰胺,100 U/mL青霉素,100 mg/L链霉素)重悬细胞,调整浓度后接种于大培养皿中,37 ℃、5% CO2培养。每隔2~3 d换1次培养基,细胞铺满单层后进行传代培养。
1.2.2 细胞形态学的观察:从培养的第1天开始,每隔1 d光学显微镜下观察细胞形态,记录细胞增殖状态并拍照。
1.2.3 颌下腺细胞的纯化[7]:最初分离的细胞中混有成纤维细胞,根据成纤维细胞与目的细胞贴壁能力和时间的差别,采用差速贴壁法去除成纤维细胞。成纤维细胞的贴壁能力强,在接种30~60 min左右基本完全贴壁,目的细胞约24 h贴壁。接种细胞约1 h后,将含有目的细胞的上清收集继续培养,反复多次即得到纯度较高的目的细胞。
1.2.4 细胞存活率的测定:接种前采用锥虫蓝染色法测定细胞存活率。取适量细胞悬液与锥虫蓝染液混匀,滴入细胞计数板。3 min内,在显微镜下计数300个细胞。未着色的为活细胞,呈蓝色的为死细胞。计算公式:存活率(%)=(活细胞数/300)×100%。
1.2.5 免疫荧光染色鉴定细胞:取对数期细胞,爬片后4%多聚甲醛固定20 min,0.3% Triton X- 100通透,牛血清白蛋白封闭后,一抗(CK- 8 抗体或vimentin抗体)4 ℃孵育过夜。PBS清洗后,山羊抗兔IgG/ Alexa Fluor 488标记的二抗37 ℃孵育1 h,避光操作,最后DAPI染核,封片,荧光显微镜下观察并拍照。
1.2.6 细胞增殖曲线检测[7- 8]:细胞消化计数后,调整细胞浓度至5×106个/L,接种至10块96孔板,每孔200 μL细胞悬液,接种24 h后每天用CCK- 8法检测,具体为:每孔加入20 μL CCK- 8试剂,孵育4 h后450 nm处测定吸光度值。以时间为横轴,吸光度值为纵轴,绘制细胞增殖曲线。
2 结果
2.1 细胞存活率
接种前用锥虫蓝染色法测定细胞存活率,大约为97.5%。
2.2 颌下腺细胞的形态学特征
体外培养的原代细胞24 h左右贴壁,此时细胞为圆形,之后细胞慢慢伸展,呈现多边形。第2天细胞开始形成集落,增殖的细胞呈形态一致的立方体,第7~8天见部分细胞表现为铺路石样排列,未见导管或腺泡样结构(图1)。传代细胞与原代形态基本一致,接种后7~9 d可进行传代培养,一般能传3代,至第4代细胞活性变差,死亡的细胞变多,镜下观察发现培养基中漂浮大量细胞碎片,且细胞形态转变为星形,表面出现突起,已不适合做进一步实验研究。

图1 原代培养的颌下腺细胞Fig 1 Primary culture of the submandibular gland cells (×100)
2.3 免疫荧光染色结果
体外培养的颌下腺细胞CK 8表达阳性,胞质呈现绿色荧光(图2A),细胞核呈蓝色荧光,阳性率约为85%;vimentin表达为阴性(图2B),提示培养的细胞为颌下腺上皮细胞。

A.culture cells were positively stained by CK 8 antibody; B.culture cells were negatively stained by vimentin antibody图2 免疫荧光染色法鉴定颌下腺细胞Fig 2 Identification of the submandibular gland cells by immunofluorescence staining (×200)
2.4 细胞增殖特点
根据吸光度值绘制细胞增殖曲线。细胞于第1~2天处于滞留期,完成贴壁并有部分增殖,第3天开始进入对数期,细胞增殖迅速,第7天达到顶峰,随后细胞增殖趋势缓慢下降(图3)。
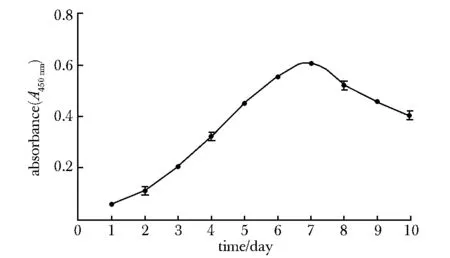
图3 颌下腺上皮细胞的增殖曲线Fig 3 Proliferation curve of the submandibular gland
3 讨论
SS是一种常见的慢性炎症性的自身免疫性疾病,发病率逐年增高[2]。唾液腺破坏是其重要表现,80%患者有口腔干燥症,唾液分泌明显减少,严重者影响说话,甚至出现“猖獗齿”[9]。目前SS的发病机制尚未阐明,现有治疗方法非常有限,且收效甚微。因此建立体外细胞培养模型,有助于为SS以及其他唾液腺相关疾病的研究和药物评价提供体外实验模型。
唾液腺细胞是一种终末分化细胞,培养相对困难,一直是众多学者研究的难题。目前唾液腺细胞培养大多取材于大鼠腮腺,或者在培养液中添加糖皮质激素、胰岛素等以促进细胞增殖[7, 10- 11]。然而,唾液的70%由颌下腺分泌,且有研究报道SS患者的颌下腺功能损害较腮腺常见,SS患者早期颌下腺唾液流量减少亦比腮腺更显著[12]。而且,SS作为一种自身免疫性疾病,培养液中添加糖皮质激素等药物不利于细胞保持原有的功能,干扰对SS发病机制的探讨以及治疗药物的评价。
目前已知颌下腺上皮细胞的培养方法包括组织块法和胶原酶消化法,与前者相比,胶原酶消化法能缩短获取大量细胞的时间[11]。本研究采用作用温和的Ⅳ型胶原酶消化细胞以减轻对细胞的损伤,锥虫蓝染色法显示细胞存活率达97.5%。随后采用差速贴壁法除去混杂的成纤维细胞,获得较为纯化的目的细胞。颌下腺细胞是一种需复杂营养的、在一般合成培养基中不易增殖的细胞,我们用含10 μg/L EGF的F- 12/DMEM培养液进行培养获得成功,简化了实验,且颌下腺是产生EGF的主要器官,体外培养的颌下腺上皮细胞本身可合成并分泌EGF[13],因此添加低浓度的EGF有利于细胞增殖并保持功能,且不会影响后续实验研究。经过上述方法得到的原代和传代培养细胞,形态呈上皮样,镜下观察为多边形,铺路石样排列。根据增殖曲线,细胞增殖能力良好,一般能传3代,到第4代时,增殖能力明显降低。在细胞鉴定方面,CK- 8表达阳性,而vimentin表达阴性,符合唾液腺细胞的表型特征,证实了所培养的细胞为上皮来源的可靠性。
综上所述,本研究采用胶原酶消化法获得了增殖良好的小鼠颌下腺上皮细胞,方法简便易行,这为进一步研究提供了良好的实验模型。
[1] Atkinson JC, Grisius M, Massey W. Salivary hypofunc-tion and xerostomia: diagnosis and treatment [J]. Dent Clin North Am, 2005, 49: 309- 326.
[2] Shashikala K, Subash BV, Sandhya V. Salivary gland disorders: A comprehensive review [J]. World J Stomatol, 2015, 4: 56- 71.
[3] Park YJ, Koh J, Gauna AE,etal. Identification of regulatory factors for mesenchymal stem cell-derived salivary epithelial cells in a co-culture system [J]. PLoS One, 2014, 9: e112158, doi: 10.1371/journal.pone.0112158.
[4] Sisto M, Barca A, Lofrumento DD,etal. Downstream activation of NF-kappaB in the EDA-A1/EDAR signalling in Sjögren’s syndrome and its regulation by the ubiquitin-editing enzyme A20 [J]. Clin Exp Immunol, 2016, 184: 183- 196.
[5] Sisto M, Lorusso L, Lisi S. TLR2 signals via NF-kappaB to drive IL- 15 production in salivary gland epithelial cells derived from patients with primary Sjögren’s syndrome [J]. Clin Exp Med, 2017, 17: 341- 350.
[6] Dimitriou ID, Kapsogeorgou EK, Abu-Helu RF,etal. Establishment of a convenient system for the long-term culture and study of non-neoplastic human salivary gland epithelial cells [J]. Eur J Oral Sci, 2002, 110: 21- 30.
[7] 黄巍巍, 谭学新, 李波, 等. 组织块法培养大鼠颌下腺细胞的实验研究 [J]. 中国医科大学报, 2010, 39: 194- 196.
[8] 刑红艳, 刘彦普, 刘斌, 等. 体外培养小鼠下颌下腺细胞生长特性的实验研究 [J]. 现代生物医学进展, 2013, 13: 5409- 5412.
[9] Pilar BZ, Chiara B, Hendrika B,etal. Sjögren’s Syndrome [J]. Nat Rev Did Primers, 2016, 2: 1- 20.
[10] Oliver C. Isolation and maintenance of differentiated exocrine gland acinar cells in vitro [J]. In Vitro, 1980, 16: 297- 305.
[11] 王蕾, 王雪红, 张华炎, 等. 组织块法和酶消化法培养大鼠颌下腺细胞的比较研究 [J]. 大连大学学报, 2014, 35: 103- 106.
[12] Pijpe J, Kalk WW, Bootsma H,etal. Progression of salivary gland dysfunction in patients with Sjogren’s syndrome [J]. Ann Rheum Dis, 2007, 66: 107- 112.
[13] Barka T. Biologically active polypeptides in submandibular gland [J]. J Histochem Cytochem, 1980, 28: 836- 859.

